2. 中国建筑设计研究院, 北京 100044
2. China Architecture Design & Research Group, Beijing 100044, China
城镇供水末端水质安全是饮用水安全保障的重要环节,二次供水系统已成为城镇供水最重要的终端[1].市政供水管网输配到建筑时多需要进行二次加压,以保障整个建筑的水量和水压要求.给水管网系统中有很多微生物能够存活[2-3],其中至少有95%的微生物附着在管壁生长,会加快余氯消耗速度,造成二次供水系统中余氯量过低,严重威胁终端用户的用水安全.一方面,给水管网中的微生物有较高的抗氯性,如有荚膜和无荚膜的肺炎克雷伯式菌株等在贫营养条件下对自由氯的抗性分别增加2~3倍,一些菌种甚至会增加9倍[4];另一方面,生物膜在水力冲刷下会脱落,可能为水中微生物的再生长提供营养物质,增加水中悬浮菌的数目[5-6].在建筑供水系统中,也会出现微生物大量繁殖与孳生等二次污染,使得终端用户的水质恶化[7].研究表明[8],即使管道中保持较高质量浓度的余氯,用户端的水质还会出现微生物指标超标的问题.二次供水系统作为供水终端,比市政管网的问题更加严重.为充分保障建筑供水终端用户的龙头水水质,不仅要考虑二次供水中余氯含量,还必须对二次供水管壁生物膜进行有效地控制.
在二次供水系统中二次投加氯或氯胺是常用的消毒方法.苏欢欢等[9]的研究结果表明,氯胺对管壁上附着细菌和水中悬浮细菌都有一定的控制作用,氯胺投量在0.5~0.75 mg/L时,可以将管壁上生物量降低近50%.张永吉等[10]的研究结果表明,水中悬浮菌的灭活程度与CT值和氯质量浓度都有关;在相同CT值下,较高质量浓度的氯对悬浮态和生物膜中大肠杆菌的灭活效果要高于低质量浓度的氯.朱永娟等[11]的研究结果表明,短时高质量浓度加氯后挂片上异养菌数量迅速下降,对管道生物膜造成很大损伤.可见,采用高质量浓度消毒剂对二次供水管壁生物膜进行灭活是一种有效的手段.
本文采用BAR反应器模拟建筑二次供水管网系统,考察二次供水管道生物膜的形成特性,以及生物膜中的优势菌属;研究氯和氯胺质量浓度及CT值对管壁生物膜中细菌总数、大肠杆菌以及HPC的灭活效果以及对生物膜结构的影响,对比氯和氯胺对管壁生物膜的灭活效果,为建筑二次供水管道系统的冲击消毒技术提供支持.
1 试验 1.1 试验装置与过程试验采用BAR反应器模拟实际建筑二次供水管道条件.BAR反应器的圆柱形外壁及内部转筒均采用聚氯乙烯(PVC)制作,上部采用减速电机控制反应器转子的转速,转速设置为50 r/min,每个BAR反应器的转子上可放置18个挂片;本研究采用PVC挂片,每个挂片的有效挂膜面积为18 cm2;BAR顶部设有加药口和进水口,侧面上部设有出水口,采用蠕动泵控制进水流量;BAR的有效容积为800 mL,水力停留时间为4 h.
试验前,先使用10 mg/L的NaOCl溶液对BAR反应器、挂片、进水管、出水管等进行灭菌,然后依次用自来水和超纯水将BAR反应器冲洗干净.BAR反应器运行时,使用1台蠕动泵控制进水流量,另一台蠕动泵控制消毒剂的质量浓度,BAR反应器示意图如图 1所示.
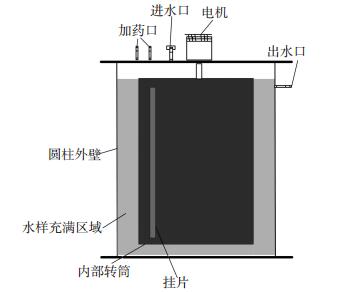
|
图 1 BAR反应器装置示意 Figure 1 BAR experimental apparatus |
氯的配制:利用市售的NaOCl溶液稀释制得.将市售的NaOCl溶液用超纯水稀释至大约200 mg/L,放于4 ℃的冰箱,保质期为两周.
氯胺的配制:氯胺储备液采用次氯酸钠溶液和氯化铵溶液以4:1的质量浓度比在pH为8.0的磷酸缓冲液中配制,现用现配;配制过程中,先加氯化铵后,缓慢将次氯酸钠溶液滴入氯化铵溶液中,同时采用磁力搅拌器不断混匀溶液,将混合物置于避光处反应30 min后,检测生成的一氯胺的质量浓度.
1.2.2 常规指标检测浊度值采用浊度仪(2100N, HACH, 美国)测定,测量范围为0.01~4 000.0 NTU,精度为0.01 NTU.利用总有机碳测定仪(Vario TOC,Elementar,德国)测定DOC.测定前先经0.45 μm的醋酸纤维膜滤除水中的颗粒物质,然后用盐酸对水样酸化并曝气去除水样中的无机碳.氯和氯胺质量浓度的测定采用便携式余氯快速测定仪(S-CL501,清时捷,中国),测量范围为0.01~5.00 mg/L.
1.2.3 微生物检测用无菌水冲洗掉挂片表面附着的菌落后,用2~4根已灭菌的棉签由挂片上部到底部进行擦拭,擦拭5次后将棉签放入10 mL已灭菌的超纯水中,使棉签浸没水中,然后置于超声波清洗仪中作用20 min,超声温度为20 ℃,频率为40 kHz,使棉签上的生物膜充分溶于已灭菌的超纯水中.
细菌总数测定方法.将水样按一定的比例进行稀释,以无菌操作方法用灭菌吸管吸取1 mL充分混匀的水样,注入灭菌的培养皿中,倾注约15 mL已融化并冷却到45 ℃左右的营养琼脂培养基,并立即摇匀培养皿,使水样与培养基充分混匀.冷却后放入37 ℃的培养箱培养24 h.
大肠杆菌测定方法.采用滤膜法,将水样通过过滤器过滤,使其中的大肠杆菌截留在滤膜上,然后将滤膜放在品红亚硫酸钠培养基上并放入37 ℃的培养箱培养24 h.
HPC测定方法.采用R2A培养基,将水样按一定的比例稀释,取100 μL水样进行平板涂布,在培养温度为22 ℃下培养7 d.
微生物灭活率采用式(1) 计算:
| $ 微生物灭活率 =-\lg \left( {{N_1}/{N_0}} \right) $ | (1) |
式中:N0为消毒前微生物的数量,N1为消毒后微生物数量.
1.2.4 生物膜形态检测利用扫描电子显微镜(scanning electron microscope, SEM) (FEI nova nano450,荷兰)对挂片的生物膜表面结构进行观察.生物膜的预处理如下:1) 在BAR反应器中取出挂片,用去离子水清洗数次,加入4%、pH为6.8的戊二醛溶液进行固定,并淹没挂片,置于4 ℃冰箱中固定12 h;2) 用0.1 mol/L、pH为6.8的磷酸缓冲溶液冲洗3次,每次10 min;依次用体积分数为50%、70%、80%和90%的乙醇溶液对挂片生物膜进行脱水处理,每次10~15 min,再用100%的乙醇溶液脱水3次,每次10~15 min;3) 用乙醇与乙酸异戊酯体积比为1:1配制的溶液,以及纯乙酸异戊酯溶液各置换一次挂片生物膜,每次15 min;将挂片置于干燥器干燥8 h;将处理好的待检生物膜挂片置于扫描电镜下观察,选择合适的放大倍数,拍摄并储存照片.
1.2.5 宏基因组分析流程首先采集挂片生物膜,方法同1.2.3,将采集的生物膜提取并载体连接后转化到宿主细胞内,通过构建宏基因组文库,收集样本中全部微生物的DNA信息,运用序列筛选或功能筛选从文库中获得活性物质并加以分析.
1.3 试验水质试验用水为实验室自来水,具体水质见表 1.
| 表 1 试验用水水质 Table 1 Water quality of tap water in laboratory |
图 2为BAR反应器中生物膜上细菌总数、大肠杆菌以及HPC的变化.BAR反应器运行0~40 d期间,挂片生物量一直维持在较低水平,生物膜中细菌总数小于60 CFU/mL,大肠杆菌未检出,HPC数量为500~800 CFU/mL,出水满足《生活饮用水卫生标准》(GB5749—2006),可见管壁生膜物的生长需要较长的时间.运行40~60 d期间时,挂片生物量变化不明显,其中细菌总数、大肠杆菌和HPC的平均数分别为(1.1~4.1)×103、0~70和(1.2~5.1)×103 CFU/cm2.运行第70天后,挂片生物量随时间的延续显著增加.在运行第80天左右时达到最大值,此时细菌总数、大肠杆菌及HPC分别为7.6×104、1.2×103和7.5×105 CFU/cm2.在第80天后,挂片的生物量呈现逐渐下降和波动的趋势,可能是由于生物膜的老化以及水流剪切力导致生物膜脱落,使得挂片的生物量减少并趋于稳定.在运行第90~120天期间,挂片的细菌总数、大肠杆菌及HPC的平均值分别为(3.0~4.4)×104、(3.5~6.5)×102和(2.5~3.5)×105 CFU/cm2;此时,BAR反应器出水中细菌总数为80~150 CFU/mL,大肠杆菌检出数为1~3 CFU/mL,HPC数为800~1 200 CFU/mL,微生物指标超标.可见,即使余氯质量浓度为0.03~0.20 mg/L的自来水中,长期运行后管壁也会生成生物膜,生物膜老化、脱落会造成饮用水的生物安全性受到严重影响.
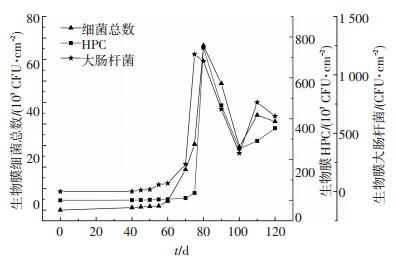
|
图 2 挂片生物膜中生物量变化 Figure 2 Biofilm bacteria in RAB with the coupon |
BAR反应器中生物膜成熟稳定后,对挂片生物膜的细菌菌群进行宏基因组16S测序分析,测序结果如图 3所示.该样本的覆盖率为0.95,Shannon指数为4.07,Simpson指数为0.08,表明生物膜中群落多样性高.由图 3可以看出,其中厚壁菌门、变形菌门和拟杆菌所占的比例较大,分别为43.25%、21.60%和18.19%.厚壁菌门可产生芽孢,对不良环境具有较强的抗性[12],这是在低有机物质量浓度以及存在余氯情况下,形成优势菌属的原因.变形菌门包括许多病原菌,如大肠杆菌、沙门氏菌等,与2.1中BAR反应器的生物膜中大肠杆菌的检出具有一致性,拟杆菌是化能有机营养菌,对有机物有较强的适应性,能够代谢碳水化合物,降解许多复杂有机物[13].古菌门(Thaumarchaeota)、放线菌门(Actinobacteria)、浮霉菌(Planctomycetes)、泉古菌门(Crenarchaeota)所占的比例较少,分别为6.84%、5.30%、1.17%、1.10%,其余各种群所占的比例均小于1.0%;其中浮霉菌能够将NO2-氧化成NH4+来获得能量,是水处理工艺系统中具有重要作用的菌种.在小于1.0%的种群中存在一种硝化螺旋菌门(Nitrospirae),属于亚硝酸盐氧化菌(NOB)[14-15],具有脱氮功能.上述结果表明,二次供水系统中具有大量抗氯性菌种,可对供水生物安全性产生一定的威胁;同时,仍可存在一定的硝化和反硝化作用,对水中NH4+、NO3-、NO2-含量转化产生一定影响,也会造成饮用水化学安全性的潜在风险.
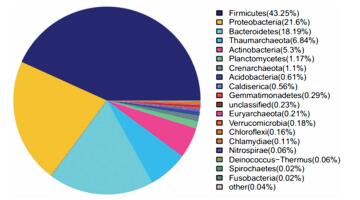
|
图 3 生物膜菌种分布 Figure 3 Pie plot of Bacterial Genus on biofilm |
图 4、5分别是氯和氯胺对生物膜中细菌总数的灭活效果.可以看出,细菌总数的灭活效果与氯或氯胺的质量浓度以及CT值有关.由图 4可知,在氯质量浓度为1.0 mg/L、CT值为100 mg·min/L时,细菌总数的灭活效果很低,灭活率仅为0.03lg,随着消毒时间的增加,CT值分别增加到200、300和400 mg·min/L时,灭活率分别增加到0.13lg、0.72lg和1.11lg,细菌总数的灭活效果仍处于较低水平.随着氯质量浓度的增加,细菌总数灭活效率不断提高,当氯质量浓度为2.0 mg/L时,CT值分别为100、200、300和400 mg·min/L时,细菌总数灭活率分别为0.86lg、0.93lg、1.73lg和1.74lg,可见在一定的氯质量浓度下,随着消毒时间的增加,细菌总数灭活率呈现先增大后趋于稳定的趋势.当氯质量浓度为3.0 mg/L时,细菌总数灭活效果显著,CT值在100、200、300和400 mg·min/L时,灭活率均可达到2.00lg,细菌总数灭活率达99.9%以上.可见,采用高质量浓度氯消毒时,在很短消毒时间内细菌总数即可以达到完全灭活的程度.由图 5可知,当氯胺质量浓度为1.0 mg/L时,对生物膜中总细菌的灭活效果不明显,随着消毒时间的增大,灭活效果仍然没有明显变化,对细菌总数的灭活率维持在0.14lg左右.当氯胺质量浓度为2.0 mg/L时,随着消毒时间的延长,对生物膜细菌总数的灭活率增加;当氯胺质量浓度为3.0 mg/L、CT值大于300 mg·min/L时,灭活效果趋于稳定,氯胺对生物膜中细菌总数的灭活率稳定在2.00lg,细菌总数灭活率也达99.9%以上.

|
图 4 氯对细菌总数的灭活 Figure 4 Effect of chlorine on biofilm total bacteria inactivation |
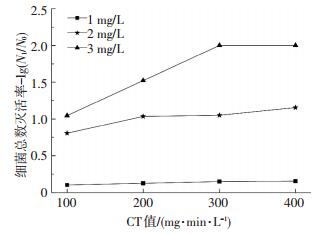
|
图 5 氯胺对细菌总数的灭活 Figure 5 Effect of chloramines on biofilm total bacteria inactivation |
对比图 4、5可知,在较低氯和氯胺质量浓度下,随着消毒时间的增大,氯消毒效果增大,而氯胺消毒效果与消毒时间的相关性不大,氯消毒效果优于氯胺;当氯和氯胺质量浓度为3.0 mg/L时,氯消毒可以在较短时间内完全灭活细菌,而氯胺消毒则需要更长的时间.从整体来看,氯对生物膜细菌总数的灭活效果优于氯胺.有研究认为[16-17]消毒效果仅取决于CT值,而与消毒剂的质量浓度无关;本文研究结果表明,生物膜中细菌总数的灭活效果与CT值和消毒剂质量浓度均有关,提高消毒剂质量浓度更有利于生物膜中细菌总数的灭活.
2.4 大肠菌群灭活效果由图 6可知,在氯质量浓度为1.0 mg/L条件下,CT值为100 mg·min/L时生物膜中大肠杆菌灭活率仅为0.26lg,CT值增加到400 mg·min/L时的大肠杆菌灭活率为0.64lg,不能对大肠杆菌进行有效灭活;当氯质量浓度为2.0和3.0 mg/L、CT值为400 mg·min/L时,生物膜中大肠杆菌的灭活率提高到0.74lg和1.38lg.由图 7可知,在氯胺质量浓度为1.0 mg/L条件下,CT值为100 mg·min/L时大肠杆菌的灭活率为0.19lg;CT值为400 mg·min/L时的大肠杆菌灭活率为0.23lg,灭活率仅升高了0.04lg,其原因可能是生物膜中的大肠杆菌被有机物包裹,低质量浓度氯胺与大肠杆菌作用时,会与生物膜中的物质发生反应,造成氯胺被消耗,因而对大肠杆菌的灭活效率降低[18-19].在氯胺质量浓度为2.0和3.0 mg/L条件下,CT值为400 mg·min/L时的大肠杆菌灭活率为0.97lg和1.28lg,灭活效果显著提高.对比图 6、7可以看出,氯和氯胺对生物膜中大肠杆菌的灭活与对生物膜中细菌总数的灭活具有相似的规律,其灭活效果不仅取决于CT值,同时与氯和氯胺的质量浓度有关;随着氯和氯胺质量浓度的提高,生物膜中大肠杆菌的灭活率增大.氯胺对大肠杆菌的灭活效果略低于氯,在氯和氯胺质量浓度为3.0 mg/L、CT值为400 mg·min/L时,氯和氯胺对大肠杆菌的灭活效率分别为1.38lg和1.28lg,二者相差0.10lg.可见,在杀灭生物膜中大肠杆菌方面,氯的灭活效果比氯胺更好.
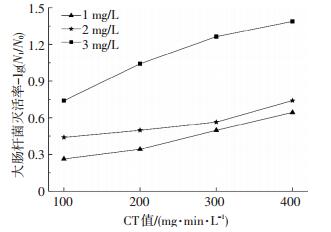
|
图 6 氯对大肠杆菌的灭活 Figure 6 Effect of chlorine on biofilm E.coli inactivation |
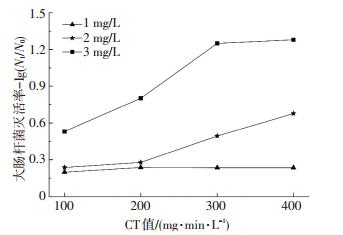
|
图 7 氯胺对大肠杆菌的灭活 Figure 7 Effect of chloramines on biofilm E.coli inactivation |
图 8、9分别为氯和氯胺对生物膜中HPC的灭活效果,可以看出,氯和氯胺对HPC均有显著的灭活效果,随着CT值的增加,HPC灭活率总体呈增大的趋势;在相同CT值的情况下,高质量浓度氯和氯胺对HPC的灭活率更高;对比图 8、9可以看出,在氯和氯胺质量浓度均为1.0 mg/L条件下,CT值为100 mg·min/L时氯和氯胺的HPC灭活率分别为0.11lg和0.58lg,氯胺的灭活效果远好于氯.随着消毒时间增大,氯和氯胺的灭活率均呈现增大的趋势,但氯的灭活率增长速率大于氯胺.当CT值达400 mg·min/L时,氯胺对HPC的灭活效果总体仍好于氯;已有的研究发现[20-21]氯胺氧化能力比氯弱,但氯胺可以进入到生物膜内部,因此,对生物膜中HPC的作用更有效.当氯和氯胺质量浓度为3.0 mg/L、CT值为400 mg·min/L时,氯和氯胺的HPC灭活率分别达2.37lg和2.19lg,对HPC均有很好的灭活效果.

|
图 8 氯对HPC的灭活效果 Figure 8 Effect of chlorine on biofilm HPC inactivation |

|
图 9 氯胺对HPC的灭活效果 Figure 9 Effect of chloramines on biofilm HPC inactivation |
图 10为氯和氯胺质量浓度为3.0 mg/L、CT值为300~400 mg·min/L时,冲击消毒前后生物膜的SEM照片,(放大倍数为10 000倍).由图 10可以看出,冲击消毒前的生物膜为厚实且致密的块状结构,挂片表面有结垢现象,为生物膜的进一步附着生长提供了条件.氯冲击消毒后生物膜的块状结构变小,部分生物膜脱落,挂片表面大部分面积裸露.氯胺冲击消毒后,生物膜结构仍较密实,只有一小部分挂片表面裸露,生物膜块状结构变小.可以看出,氯冲击消毒对生物膜的破坏程度更大.

|
图 10 消毒前后生物膜SEM图 Figure 10 Effect of disinfection on SEM of biofilm |
图 11为生物膜扫描电镜图通过软件处理所得的生物膜三维结构图,可以更直观地表示生物膜垂直挂片方向的结构,其中绿色、黄色和红色部分依次表示从挂片表面至生物膜表面的纵向厚度分布情况.
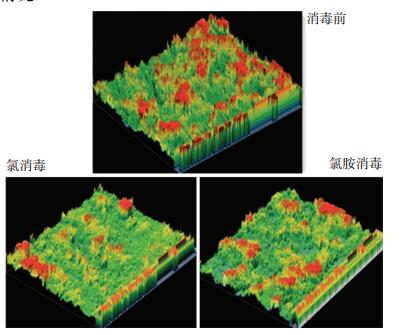
|
图 11 消毒前后生物膜结构 Figure 11 Effect of disinfection on biofilm structure |
由图 11可以看出,冲击消毒前的生物膜厚度三维分布图以红色和黄色为主.与冲击消毒前相比,氯冲击消毒后生物膜的红色和黄色部分面积分别减少了53.3%和32.7%,三维分布图以绿色为主;氯胺冲击消毒后,生物膜的红色部位的面积减少了21.1%,黄色部位面积增加了7.4%,三维分布图以绿色和黄色面积为主.氯冲击消毒后生物膜的红色部分面积相对于氯胺冲击消毒后减少了25.8%,黄色部位面积减少了26.9%.可以看出,氯和氯胺冲击消毒后生物膜的平均厚度小于氯胺冲击消毒,且两者均小于冲击消毒前的生物膜厚度.氯和氯胺冲击消毒后明显破坏了生物膜结构,造成生物膜脱落,生物膜得到了非常有效的削减和控制.
3 结论1) 二次供水管道连续运行80 d时,管壁生物膜中的生物量达到最大值,且生物量始终维持在较高水平,厚壁菌门(43.25%)、变形菌门(21.60%)和拟杆菌门(18.19%)成为优势菌属,对饮用水生物安全性造成很大威胁,有必要对二次供水管道系统进行定期冲击消毒.
2) 氯和氯胺对管壁生物膜均有较好的灭活效果,随着CT值增大,生物膜的微生物灭活率呈增加的趋势;在相同CT值下,高质量浓度氯和氯胺的灭活率更高.最佳冲击消毒条件为氯或氯胺投加质量浓度3.0 mg/L,CT值300~400 mg·min/L.考虑到高质量浓度氯产生的消毒副产物以及刺激气味可能对终端用户产生的感官影响,在对二次供水管道进行定期消毒时,可以根据管壁生物膜实际情况选择高质量浓度氯或氯胺进行冲击消毒.
3) 在最佳冲击消毒条件下,生物膜中总细菌数、大肠杆菌和HPC的最佳灭活率均达95%以上.氯冲击消毒对细菌总数和大肠杆菌的灭活效果优于氯胺,但氯和氯胺的HPC灭活效果无明显差异.
4) 氯和氯胺冲击消毒均可破坏生物膜的结构,造成生物膜脱落,生物膜的平均厚度得到显著的削减,生物膜得到了有效的控制,其中氯冲击消毒对生物膜的结构破坏、生物膜厚度的削减和控制更有效.
| [1] |
赵锂. 城镇供水末端水质保障技术的现状与需求[J].
给水排水, 2013, 39(1): 1-3.
ZHAO Li. The present situation and the development demand of technical supports for urban water supply water quality[J]. Water & Wastewater Engineering, 2013, 39(1): 1-3. |
| [2] |
SIMÕES L C, SIMÕES M, OLIVEIRA R, et al. Potential of the adhesion of bacteria isolated from drinking water to materials[J].
Journal of Basic Microbiology, 2007, 47(2): 174-183.
DOI: 10.1002/(ISSN)1521-4028 |
| [3] |
方华, 吕锡武, 吴今明. 管网水细菌再生长限制因子的特性与比较[J].
给水排水, 2004, 30(12): 32-36.
FANG Hua, LU Xiwu, WU Jinming. Comparison and feature of bacterial regrowth and inhibition in water distribution system[J]. Water & Wastewater Engineering, 2004, 30(12): 32-36. DOI: 10.3969/j.issn.1002-8471.2004.12.010 |
| [4] |
余国忠, 王根凤, 龙小庆, 等. 给水管网的细菌生长可能机制与防治对策[J].
中国给水排水, 2000, 16(8): 18-20.
YU Guozhong, WANG Genfeng, LONG Xiaoqing, et al. The mechanisms and prevention countermeasures of possible bacterial growth in the water supply pipe network[J]. China Water & Wastewater, 2000, 16(8): 18-20. |
| [5] |
CHANDY J P, ML A. Determination of nutrients limiting biofilm formation and the subsequent impact on disinfectant decay[J].
Water Research, 2001, 35(11): 2677-2682.
DOI: 10.1016/S0043-1354(00)00572-8 |
| [6] |
NDIONGUE S, HUCK P M, SLAWSON R M. Effects of temperature and biodegradable organic matter on control of biofilms by free chlorine in a model drinking water distribution system[J].
Water Research, 2005, 39(6): 953-964.
DOI: 10.1016/j.watres.2004.12.019 |
| [7] |
王启山, 任福燕. 二次供水系统中UV消毒装置的开发[J].
中国给水排水, 2001, 17(9): 75-76.
WANG Qishan, REN Fuyan. The development of UV disinfection device in the secondary water supply[J]. China Water & Wastewater, 2001, 17(9): 75-76. |
| [8] |
周玲玲, 张永吉, 黄飞, 等. 给水管壁生物膜特性与控制方法[J].
净水技术, 2008, 27(4): 5-8.
ZHOU Lingling, ZHANG Yongji, HUANG Fei, et al. The characteristics and control methods of biofilm in drinking water distribution system[J]. Water Purification Technology, 2008, 27(4): 5-8. |
| [9] |
李星, 苏欢欢, 周玲玲, 等. 氯胺消毒对管壁生物膜形成的影响[J].
中国给水排水, 2008, 24(13): 23-26, 30.
LI Xing, SU Huanhuan, ZHOU Lingling, et al. Effect of chloramine disinfection on biofilm formation in water distribution system[J]. China Water & Wastewater, 2008, 24(13): 23-26, 30. DOI: 10.3321/j.issn:1000-4602.2008.13.006 |
| [10] |
张永吉, 周玲玲, 李伟英, 等. 氯对模拟管壁生物膜的氧化特性研究[J].
环境科学, 2009, 30(5): 1381-1385.
ZHANG Yongji, ZHOU Lingling, LI Weiying, et al. Oxidization characteristic of chlorine on the biofilm in simulated drinking water distribution system[J]. Environmental Science, 2009, 30(5): 1381-1385. |
| [11] |
朱永娟, 杨艳玲, 李星, 等. 预氯化对管道生物膜净水效能影响及性能恢复[J].
中国环境科学, 2013, 33(5): 843-847.
ZHU Yongjuan, YANG Yanling, LI Xing, et al. Influence of pre-chlorination on pipeline biofilm water purification efficiency and recovery process[J]. China Environment Science, 2013, 33(5): 843-847. |
| [12] |
祝泽兵. 供水管网中的耐氯菌群及其耐氯机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2015.
ZHU Zebing. Research on chlorine-resistant bacterial community and chlorine resisitance mechanism in drinking water distribution system[D]. Harbin: Harbin Institute of Technology, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10213-1015957407.htm |
| [13] |
HILL V R, KAHLER A M, JOTHIKUMAR N, et al. Multistate evaluation of an ultrafiltration-based procedure for simultaneous recovery of enteric microbes in 100-liter tap water samples[J].
Applied & Environmental Microbiology, 2007, 73(13): 4218-4225.
|
| [14] |
BURRELL P, KELLER J, BLACKALL L L. Characterisation of the bacterial consortium involved in nitrite oxidation in activated sludge[J].
Water Science & Technology, 1999, 39(6): 45-52.
|
| [15] |
LEE H W, LEE S Y, LEE J W, et al. Molecular characterization of microbial community in nitrate-removing activated sludge[J].
Fems Microbiology Ecology, 2002, 41(2): 85-94.
DOI: 10.1111/fem.2002.41.issue-2 |
| [16] |
HAAS C N, JOFFE J, ANMANGANDLA U, et al. Water quality and disinfection kinetics[J].
Journal-American Water Works Association, 1996, 88(3): 95-103.
|
| [17] |
HELBLING D E, JM V. Free chlorine demand and cell survival of microbial suspensions[J].
Water Research, 2007, 41(19): 4424-4434.
DOI: 10.1016/j.watres.2007.06.006 |
| [18] |
TACHIKAWA M, TEZUKA M, MORITA M, et al. Evaluation of some halogen biocides using a microbial biofilm system[J].
Water Research, 2005, 39(17): 4126-4132.
DOI: 10.1016/j.watres.2005.07.039 |
| [19] |
GOERES D M, PALYS T, SANDEL B B, et al. Evaluation of disinfectant efficacy against biofilm and suspended bacteria in a laboratory swimming pool model[J].
Water Research, 2004, 38(38): 3103-3109.
|
| [20] |
AL-JASSER A O. Chlorine decay in drinking-water transmission and distribution systems: Pipe service age effect[J].
Water Research, 2007, 41(2): 387-396.
DOI: 10.1016/j.watres.2006.08.032 |
| [21] |
LEHTOLA M J, MIETTINEN I T, LAMPOLA T, et al. Pipeline materials modify the effectiveness of disinfectants in drinking water distribution systems[J].
Water Research, 2005, 39(10): 1962-1971.
DOI: 10.1016/j.watres.2005.03.009 |
 2017, Vol. 49
2017, Vol. 49


