好氧颗粒污泥是在好氧废水处理系统中培养出来的颗粒状微生物自固定形成的特殊活性污泥.与传统活性污泥相比,颗粒污泥结构更为密实紧凑、沉降性更好、生物量较高且耐冲击负荷能力更强[1],近年来受到广泛关注.然而,较长的培养周期在一定程度上限制了好氧颗粒污泥技术的发展与应用[2].
研究者发现了一些可以加速污泥颗粒化进程的方法.在SBAR(sequencing batch airlift reactor)中投加10 mL/L的絮凝细菌,可以将颗粒污泥的形成时间由42 d缩短至35 d[3].通过人工添加颗粒活性炭作为载体,可以促使细菌更容易地吸附在其表面形成核心,从而减少颗粒化时间[4].另一方面,研究者发现,Ca2+、Mg2+等金属离子的投加对微生物凝聚体的自固定有积极的作用,可以有效地加速好氧颗粒污泥的颗粒化[5].同样,Al3+对好氧污泥颗粒化的进程也有直接影响.Shi等[6]在好氧颗粒污泥的培养过程中投加A13+,使污泥完全颗粒化时间缩短了33 d.作为常用的铝盐混凝剂,聚合氯化铝(poly aluminum chloride,PAC)和硫酸铝已被广泛地用于水处理领域[7].它们在一般条件下可以促进水中微小悬浮物质和胶体物质脱稳、聚集、成长,所以,将PAC和硫酸铝用于加速初期好氧污泥的颗粒化是可行途径[8].但是不同混凝剂在强化造粒过程中所起到的作用是否存在差异仍有待进一步研究与验证.本研究通过在好氧颗粒污泥培养初期投加PAC和硫酸铝,考察不同铝盐强化造粒效能,并分阶段检测铝元素在颗粒内部的质量分数及分布,分析成熟颗粒中EPS的组分和分布,以探究不同铝盐混凝剂在颗粒污泥形成过程中的作用.
1 实验 1.1 实验废水和接种污泥实验原始污泥来自西安市第五污水处理厂(A2/O工艺)好氧池的内回流污泥,MLVSS(mixed liquor volatile suspended solids)为5.9 g/L,污泥容积指数为110 mL/g.
实验用水为人工模拟废水,采用混合碳源[9],其主要成分为:CH3CH2OH 298 mg/L,CH3COONa 390 mg/L,NH4Cl 167 mg/L,MgSO4·7H2O 25 mg/L,FeSO4·7H2O 20 mg/L,CaCl2·2H2O 30 mg/L,KH2PO4·3H2O 37.5 mg/L,H3BO30.15 μg/L,Na2Mo7O24·2H2O 0.06 μg/L,CuSO4·5H2O 0.03 μg/L,MnCl2·2H2O 0.12 μg/L,ZnSO4·7H2O 0.12 μg/L,CoCl2·6H2O 0.15 μg/L,KI 0.03 μg/L.
在反应器运行的10~16 d,每天的前两个周期(每个运行周期288 min)分别向两个反应器一次性投加PAC和硫酸铝,PAC投加量为75 mL(质量浓度10.00 g/L),加药后反应器中PAC的质量浓度为0.312 5 g/L.硫酸铝投加量为75 mL(质量浓度19.65 g/L),加药后反应器中硫酸铝的质量浓度为0.614 0 g/L.两个反应器内有效铝的当量相同.手动曝气使污泥与铝盐混合均匀,用NaHCO3溶液将反应器中的pH调至7.0~7.5.
1.2 实验装置及运行条件实验装置为3个双层有机玻璃制成的圆柱形SBR(sequencing batch reactor),分别为R1(对照组,不加混凝剂)、R2(投加PAC)和R3(投加硫酸铝),其结构相同.高径比(H/D)为30,其中,高度为1.5 m,直径为0.05 m,有效体积为2.4 L,排水比为50%,曝气量为2 L/min.运行周期为288 min,其中进水,曝气、排水、沉淀、闲置时间分别为3,252,3,15和15 min.在实验运行的1~10 d,将沉淀时间由15 min逐渐调整至5 min.
1.3 分析方法 1.3.1 颗粒污泥的特性好氧颗粒污泥的MLVSS和SVI均按标准方法测定[10];污泥的微观形态采用BX51奥林巴斯显微镜进行观察;粒径分布采用LS230激光粒径分布仪.
1.3.2 EPS分析TOC表征污泥中EPS的总量,采用岛津TOC-V分析仪进行测定.EPS的提取采用超声+加热法[11-12];采用F-7000荧光分光光度计对EPS进行分析;采用傅里叶红外光谱仪(FTIR IS50) 测定样品,提取的EPS样品于冷冻干燥机处理后,置于样品台进行测定.
1.3.3 铝元素分析取50 mL污泥混合液经真空泵抽滤后,在105 ℃烘箱内烘5 h.烘干后研碎成均匀粉末,在X荧光光谱(SPECTRO MIDEX)下测量铝元素的质量分数.好氧颗粒污泥剖面中铝的分布测定采用扫描电镜(QUINITA-600F)和能量弥散X射线光谱仪(Inca-IE350) 联用的方法.
2 结果与讨论 2.1 铝盐强化造粒条件下好氧颗粒污泥的污泥特性反应器运行的第1天,污泥均为结构松散的絮体,颜色呈深棕色,其中有大量的丝状菌.在运行的第10天分别向R2、R3投加PAC和硫酸铝进行强化造粒,R1作为对照组(不加混凝剂).在此过程中反应器内污泥形态发生明显变化,颜色逐渐由深褐色变为浅黄色.污泥外观形态的变化如图 1所示.强化造粒一周后,R1的结构比较松散,颗粒透光性好,周围有少许丝状菌.而投加PAC和硫酸铝的污泥均比较密实,透光性较差,且颗粒污泥周围基本没有丝状菌,说明铝盐的添加会抑制丝状菌的生长.对比32天的颗粒污泥,此时投加混凝剂的污泥已经基本成熟,且粒径大于对照组.此时R1、R2、R3的MLVSS分别为5.2、6.2、7.8 g/L,SVI分别为60、45、32 mL/g.说明混凝剂的投加使微生物聚集,促使污泥具有良好的沉淀性能.

|
图 1 颗粒污泥形成过程的形态变化 Figure 1 Morphological changes in the formation of granular sludge |
胞外聚合物(extracellular polymeric substances,EPS)是附着于细胞表面的复杂高分子不溶性有机物的总称,这些有机物可以促进细胞间的凝聚和结构的稳定,对好氧污泥颗粒化起到重要作用.根据EPS存在形式,可以分为溶解性EPS(soluble EPS,S-EPS)和结合型EPS(bound EPS),结合型EPS又可分为紧密黏附EPS(tightly bound EPS,TB-EPS)和松散附着的EPS(loosely bound EPS,LB-EPS).表 1为颗粒污泥生长过程中EPS总量的变化.
| 表 1 不同培养阶段颗粒污泥EPS的总量变化 Table 1 Changes of EPS content in granular sludge at the different stages |
由于S-EPS总量的变化幅度不大,只分析结合型EPS.不难发现,在污泥的成长过程中LB-EPS和TB-EPS的质量分数都呈增加趋势,其中LB-EPS的增幅较大.这是因为TB-EPS与细胞表面结合较紧,而LB-EPS位于EPS的外围,比较松散,更容易向周围扩散[13].此外,PAC和硫酸铝的投加对此有促进作用.这是由于投加铝盐后,微生物为保护自身细胞免受阳离子渗透压的影响而分泌EPS[14].随着污泥的颗粒化,成熟颗粒中LB-EPS和TB-EPS质量分数均有所降低.R1、R2和R3颗粒中单位MLVSS LB-EPS质量分数降至66.8、69.3和89.7 mg/g,分别是颗粒形成初期污泥中LB-EPS质量分数的1.4、1.6和1.8倍.而成熟污泥中TB-EPS质量分数和颗粒形成初期污泥中质量分数相差不多.有研究者指出LB-EPS对污泥聚集产生积极影响[15],而混凝剂的投加使成熟颗粒污泥的LB-EPS质量分数增幅较大,进而加速了颗粒污泥的形成.
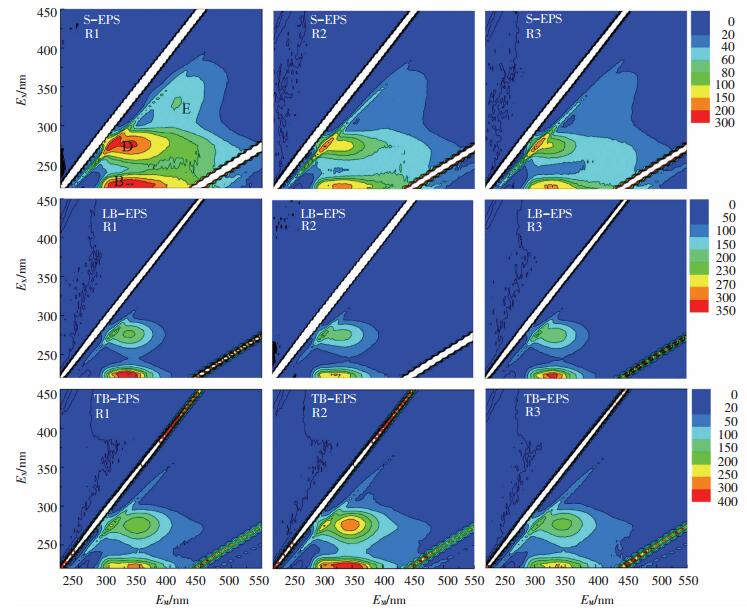
2.2.2 三维荧光图谱分析EPS的分布规律FRI(荧光区域积分法)方法把激发、发射波长所形成的荧光区域分为5个区域,A: EX为220~250 nm,EM为280~330 nm;B: EX为220~250 nm,EM为330~380 nm;C: EX为220~250 nm,EM为380~500 nm;D: EX为250~280 nm,EM为280~380 nm;E: EX为280~400 nm,EM为380~500 nm.其中A、B类分别为芳香类蛋白物质Ⅰ、Ⅱ,C为富里酸类物质,D为溶解性微生物代谢产物,E为腐殖酸类物质[16-17].成熟颗粒污泥的三维荧光光谱可以作为半定量手段进行相对分析.图 2显示,R2和R3污泥中S-EPS的峰E消失,说明混凝剂的投加导致污泥S-EPS中峰E的荧光强度明显降低.对比R1、R2和R3污泥中LB-EPS和TB-EPS,发现峰B、D均被检测到,且只有这两类峰的存在.说明虽然LB-EPS和TB-EPS是分别位于污泥外层和内层的胞外聚合物,但其组分和物质结构基本相同,同时也说明混凝剂的投加未改变结合型EPS的基本组分.从表 2可以看出,与R1污泥中LB-EPS和TB-EPS荧光峰位相比,R2污泥的LB-EPS中荧光峰B沿EM方向发生2 nm的红移,这种变化与荧光基团中羰基、羧基、羟基和胺基的增加有关[18],R3污泥中LB-EPS的荧光峰B沿EM方向发生2 nm的蓝移,TB-EPS中荧光峰B沿EX和EM方向分别发生5和6 nm蓝移.这种蓝移猜测是R3污泥内部存在硫酸铝的水解产物,吸附了部分芳香环等物质[19],导致芳香环或共轭集团数量减少[20].三维图谱中荧光峰位置发生了转移,说明PAC和硫酸铝的投加使好氧颗粒污泥EPS的化学结构改变,且对其结构的影响不同.
|
图 2 成熟颗粒污泥中EPS三维荧光图 Figure 2 3D-EEM spectra of EPS from granular sludge |
| 表 2 成熟颗粒污泥三维荧光光谱分析结果 Table 2 Fluorescence spectra parameters of EPS from granular sludge |
为进一步分析R1、R2、R3中好氧颗粒污泥EPS各组分的官能团,采用傅里叶红外光谱图(FTIR)分析各形态EPS,以期明确混凝剂的投加对官能团的影响.
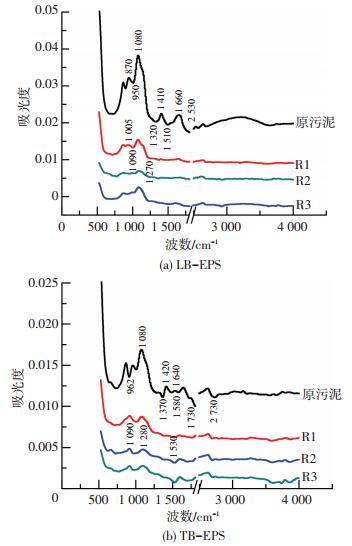
测试结果如图 3所示.通过对不同波段各形态EPS成分的FTIR图谱分析认为吸收波段1 000~1 200 cm-1是C—O与O—H的伸缩振动[21],指向的是糖类最常见的功能基团,糖类物质对好氧颗粒污泥的形成及稳定起一定作用[22].波段为1 200~1 350 cm-1所表征的是蛋白质二级结构Amide Ⅲ[23].图 3中R1、R2和R3中颗粒污泥的LB-EPS、TB-EPS官能团均大致相同,成熟颗粒污泥中LB-EPS在1 005、1 090 cm-1以及1 270 cm-1处均有吸收峰的存在,且TB-EPS在吸收波段1 090和1 280 cm-1处有吸收峰.蛋白类和糖类化合物在成熟颗粒污泥的EPS中均存在,说明EPS中这两类物质对好氧颗粒污泥的形成有一定的促进作用,且混凝剂的投加对EPS的官能团无明显影响.
|
图 3 成熟颗粒污泥中EPS红外光谱图 Figure 3 FTIR spectra of EPS from granular sludge |
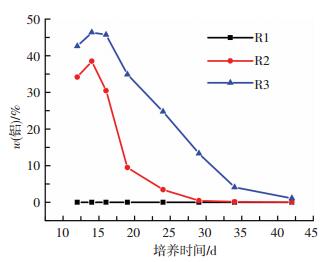
用X荧光光谱仪测得铝元素的质量(测定范围为元素周期表中10号以后的元素,包括铝、钙、磷、硫、铁等), 其中,以铝元素在这5种元素的质量分数表征其质量分数.反应器运行的第10~16天,分别向反应器R2和R3投加相同铝当量的PAC和硫酸铝进行强化造粒.在好氧污泥颗粒化过程中,污泥中铝元素的质量分数如图 4所示.
|
图 4 好氧污泥颗粒化过程中铝元素的质量分数 Figure 4 Changes of aluminum content during aerobic sludge granulation |
在加药阶段,R2和R3污泥内的铝元素质量分数均呈线性增加.停止加药后,R2和R3污泥内的铝元素质量分数均下降.P和S元素的质量分数逐渐回升,这是因为EPS中蛋白类物质增多,生物自絮凝在之后的过程中占据主导地位.污泥中Fe元素也逐渐增多,这可能是好氧污泥吸收了原水中的Fe2+,将一部分Al释放出来[24].而在第29天时,R2污泥中铝元素的质量分数仅为0.43%,R3铝元素的质量分数为13.29%.停止加药后,R2的铝质量分数立即下降,这是因为在本次实验条件下,加药结束后部分絮体的结构比较松散,曝气过程中被水流剪切力冲散,成为沉降性较差的悬浮物,在排出期间大量排出,致使铝质量分数大幅下降.而R3污泥中铝元素质量分数缓慢下降,猜测是有部分铝元素很好地与污泥结合在一起.且形成的絮体在相同的水力剪切力下较密实、沉降性好,在生物选择过程中排出较少.随着颗粒污泥的成长,铝的质量分数逐渐线性下降.
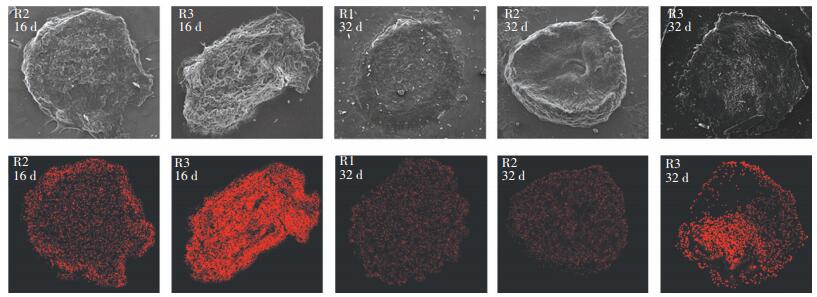
2.3.2 强化造粒条件下铝元素的空间分布通过扫描电镜图可以发现,投加混凝剂的污泥剖面凹凸不平.对比16 d污泥的扫描电镜图,投加PAC的(R2) 污泥只有外围有白色沉积物,投加硫酸铝(R3) 的污泥整个颗粒几乎布满了结构紧凑的白色沉积物.而32 d电镜图,R2中颗粒污泥的剖面比较平滑,R3中颗粒的中心有部分白色沉积物.这些白色的物质经能谱分析发现其中含有大量的铝元素(图中红色部分).
图 5表明,R2的污泥在投加PAC期间(16 d),颗粒污泥的内部铝分布较少,外围有部分铝.这是因为PAC聚集结合的絮体比较松散,在排水期间排出,导致铝元素质量分数的大量降低.且污泥聚集体手工切片容易破碎,选择完整切片的污泥可能是已经在加药前初步形成的小颗粒.由于PAC水解产生的高价聚合物直接扩散迁移到固液界面,在小颗粒表面发生络合沉淀反应,形成表面覆盖层[25],所以铝元素大多只分布在颗粒外围.而硫酸铝水解后转化为单体和低聚物与污泥结合,污泥小絮体聚集形成较小的密实颗粒,因此,颗粒的整个剖面都有铝元素.随着污泥的颗粒化,R2的成熟颗粒(32 d)中铝元素的分布和未加混凝剂的污泥(R1) 铝的分布基本相同,红色部分基本低于检测下限.结合EPS质量分数的变化说明本次实验条件下,PAC的投加可能主要是促进微生物大量分泌EPS,通过EPS和微生物之间的桥连作用,从而促进了污泥的颗粒化[26].而R3中成熟颗粒污泥的铝元素主要分布在中心,猜测此微晶核是由铝盐沉淀构成.两种铝盐的作用机理可能并不相同.有学者指出Ca2+的加入可作为诱导核加速微生物凝聚,同时在颗粒表面形成胞外多聚物,通过架桥作用促进细菌凝聚形成颗粒,并且颗粒内部的钙盐沉淀为CaCO3[27].投加硫酸铝也具有相似的功能,在强化造粒过程中,由于絮凝作用使污泥内部形成了一个富含铝元素的核心,且强化污泥中微生物产生了大量的EPS,促进快速形成好氧颗粒污泥.但是R3的颗粒污泥中铝盐沉淀的组成部分还有待研究.
|
图 5 各时期颗粒污泥剖面铝元素的空间分布 Figure 5 The different spatial distribution of aluminum during the stages of sludge |
1) 投加PAC和硫酸铝均加速了好氧污泥颗粒化进程,且投加硫酸铝的效果优于PAC.
2) 混凝剂的投加促进了成熟期LB-EPS总量的增长,并使污泥中EPS的化学结构发生变化.
3) 在16~29 d的阶段内,投加PAC的污泥中铝元素的质量分数由30.46%降至0.43%.而在同时期,投加硫酸铝的污泥中铝元素的质量分数由45.69%降至13.29%.反应器运行至第42天时,投加硫酸铝的污泥中铝元素质量分数为1.09%,明显高于经PAC强化的污泥(0.02%).
4) 不同铝盐在颗粒污泥形成过程中的作用机理可能有所差别.其中,PAC的投加主要是促进EPS分泌,使微生物聚集.硫酸铝的投加使生物聚集体内部形成了一个富含铝元素的核心,并促使EPS质量分数增多,从而快速形成好氧颗粒污泥.
| [1] |
LIU Xianwei, SHENG Guoping, YU Hanqing, et al. Physicochemical characteristics of microbial granules[J].
Biotechnology Advances, 2009, 27(6): 1061-1070.
DOI: 10.1016/j.biotechadv.2009.05.020 |
| [2] |
PIJUAN M, WERNER U, YUAN Zhiguo. Reducing the startup time of aerobic granular sludge reactors through seeding floccular sludge with crushed aerobic granules[J].
Water Research, 2011, 45: 5075-5083.
DOI: 10.1016/j.watres.2011.07.009 |
| [3] |
宋志伟, 童龙燕, 潘月军, 等. 絮凝细菌投加量对好氧颗粒污泥性能影响的研究[J].
环境科学, 2010, 31(5): 1263-1268.
SONG Zhiwei, TONG Longyan, PAN Yuejun, et al. Influence of flocculant bacterium on characteristics of aerobic granular sludge[J]. Environmental Science, 2010, 31(5): 1263-1268. |
| [4] |
ZHOU Jiaheng, ZHAO Hang, HUA Miao, et al. Granular activated carbon as nucleating agent for aerobic sludge granulation: Effect of GAC size on velocity field differences (GAC versus flocs) and aggregation behavior[J].
Bioresource Technology, 2015, 198: 358-363.
DOI: 10.1016/j.biortech.2015.08.155 |
| [5] |
CAO Xiaolei, SHENG Yuxing, CAO Hongbin, et al. Comparison of Mg2+ and Ca2+ enhancing anaerobic granulation in an expanded granular sludge-bed reactor[J].
Science China Chemistry, 2014, 57(11): 1596-1601.
DOI: 10.1007/s11426-014-5197-5 |
| [6] |
时文歆, 王硕, 于水利, 等. 铝离子对低温好氧颗粒污泥颗粒化的强化作用[J].
同济大学学报(自然科学版), 2012, 40(11): 253-374.
SHI Wenxin, WANG Shuo, YU Shuili, et al. Enhanced granulation of aerobic granular sludge by Al3+ augmentation at low temperature[J]. Journal of Tongji University (Natural Science), 2012, 40(11): 253-374. |
| [7] |
LIN Jrlin, HUANG Chipin, CHIN C J M, et al. The origin of Al(OH)3-rich and Al13 aggregate flocs composition in PACl coagulation[J].
Water Research, 2009, 43(17): 4285-4295.
DOI: 10.1016/j.watres.2009.06.023 |
| [8] |
LIU Zhe, LIU Yongjun, ZHANG Aining, et al. Study on the process of aerobic granule sludge rapid formation by using the poly aluminum chloride (PAC)[J].
Chemical Engineering Journal, 2014, 250: 319-325.
DOI: 10.1016/j.cej.2014.04.025 |
| [9] |
JIANG Helong, TAY J H, LIU Yu, et al. Ca2+ augmentation for enhancement of aerobically grown microbial granules in sludge blanket reactors[J].
Biotechnology Letter, 2003, 25: 95-99.
DOI: 10.1023/A:1021967914544 |
| [10] |
Editorial Board of China Environmental Protection Agency for Monitoring and Analyzing Methods of Water & Waste Water.
Monitoring and analyzing methods of water & waste water[M]. 4th ed. Beijing: China Environmental Science Press, 2002.
|
| [11] |
LIU Yongjun, LIU Zhe, WANG Fukun, et al. Regulation of aerobic granular sludge reformulation after granular sludge broken: Effect of poly aluminum chloride (PAC)[J].
Bioresource Technology, 2014, 158: 201-208.
DOI: 10.1016/j.biortech.2014.02.002 |
| [12] |
蒋勗欣, 李军, 马挺. 好氧污泥颗粒化中胞外聚合物(EPS)的动态变化[J].
环境科学学报, 2014, 34(5): 1192-1198.
JIANG Xuxin, LI Jun, MA Ting. Dynamic changes of EPS in aerobic sludge granulation[J]. Acta Scientiae Circumstantiae, 2014, 34(5): 1192-1198. |
| [13] |
SHENG Guoping, YU Hanqing, LI Xiaoyan. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review[J].
Biotechnology Advance, 2010, 28: 882-894.
DOI: 10.1016/j.biotechadv.2010.08.001 |
| [14] |
MEHRNIA M R, AZAMI H, SARRAFZDEH M H. Fouling mitigation in membrane bioreactors using multivalent cautions[J].
Colloids and Surfaces B: Biointerfaces, 2013, 109: 90-96.
DOI: 10.1016/j.colsurfb.2013.03.009 |
| [15] |
LIU Xiaomeng, SHENG Guoping, LUO Hongwei, et al. Contribution of extracellular polymeric substances (EPS) to the sludge aggregation[J].
Environmental Science & Technology, 2010, 44: 4355-4360.
DOI: 10.1021/es9016766 |
| [16] |
YU Guanghui, WU Minjie, LUO Yihong, et al. Fluorescence excitation emission spectroscopy with regional integration analysis for assessment of compost maturity[J].
Waste Management, 2011, 31: 1729-1736.
DOI: 10.1016/j.wasman.2010.10.031 |
| [17] |
CHAI Xiaoli, LIU Guixian, ZHAO Xin, et al. Fluorescence excitation-emission matrix combined with regional integration analysis to characterize the composition and transformation of humic and fulvic from landfill at different stabilization stages[J].
Waste Management, 2012, 32(3): 438-447.
DOI: 10.1016/j.wasman.2011.10.011 |
| [18] |
ZHU Liang, QI Hanying, LV Meile, et al. Component analysis of extracellular polymeric substances (EPS) during aerobic sludge granulation using FTIR and 3D-EEM technologies[J].
Bioresource Technology, 2012, 124: 455-459.
DOI: 10.1016/j.biortech.2012.08.059 |
| [19] |
周玲玲, 张永吉, 孙丽华, 等. 铁盐和铝盐混凝对水中天然有机物的去除特性研究[J].
环境科学, 2008, 29(5): 1187-1191.
HOU Lingling, ZHANG Yongji, SUN Lihua, et al. Characteristic of Natural organic matter removal by ferric and aluminum coagulation[J]. Environmental Science, 2008, 29(5): 1187-1191. |
| [20] |
SWIETLIK J, DABROWSKA A, RACZYK-STANISLAWIAK U. Reactivity of natural organic matter fractions with chlorine dioxide and ozone[J].
Water Research, 2004, 38(3): 547-558.
DOI: 10.1016/j.watres.2003.10.034 |
| [21] |
TU Liang, SONG Yonghui, YU Huibin, et al. Fractionation and characterization of dissolved extracellular and intracellular products derived from floccular sludge and aerobic granules[J].
Bioresource Technology, 2012, 123: 55-61.
DOI: 10.1016/j.biortech.2012.07.075 |
| [22] |
ADAV S S, LEE D J, TAY J H. Extracellular polymeric substances and structural stability of aerobic granule[J].
Water Research, 2008, 42(6/7): 1644-1650.
|
| [23] |
BADIREDDY A, RCHELLAM S, GASSMAN P L, et al. Role of extracellular polymeric substances in bioflocculation of activated sludge microorganisms under glucose-controlled conditions[J].
Water Research, 2010, 44: 4505-4516.
DOI: 10.1016/j.watres.2010.06.024 |
| [24] |
GAI Lihong, WANG Shuguang, GONG Wenxin, et al. Influence of pH and ionic strength on Cu(Ⅱ) biosorption by aerobic granular sludge and biosorption mechanism[J].
Journal of Chemical Technology and Biotechnology, 2008, 83: 806-813.
DOI: 10.1002/(ISSN)1097-4660 |
| [25] |
黄磊, 方红卫, 王靖宇, 等. 天然石英砂的表面络合模型研究[J].
环境科学学报, 2014, 34: 1141-1149.
HUANG Lei, FANG Hongwei, WANG Jingyu, et al. Surface complexation model for quartz sand particles[J]. Acta Scientiae Circumstantiae, 2014, 34: 1141-1149. |
| [26] |
LIU Zhe, LIU Yongjun, KUSCHK P, et al. Poly aluminum chloride (PAC) enhanced formation of aerobic granules: Coupling process between physicochemical-biochemical effects[J].
Chemical Engineering Journal, 2016, 284: 1127-1135.
DOI: 10.1016/j.cej.2015.09.061 |
| [27] |
REN Tingting, LIU Li, SHENG Guoping, et al. Calcium spatial distribution in aerobic granules and its effects on granule structure, strength and bioactivity[J].
Water Research, 2008, 42: 3343-3352.
DOI: 10.1016/j.watres.2008.04.015 |
 2017, Vol. 49
2017, Vol. 49


