2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090
2. State Key Laboratory of Urban Water Resources and Water Environment(Harbin Institute of Technology), Harbin 150090, China
印染、化工、纺织等工业的发展带来许多环境污染问题,其中工业废水对水体的污染尤为严重[1-2].这些工业废水中往往包含许多有害物质,例如有机烃类、苯酚、酚的衍生物、有机染料等[3].传统处理这些污染的方法主要有生物法、物理法和化学法.其中,物理法往往无法完全处理这些污染物,生物法也常存在一些无法降解的有机物,因此,化学处理方法逐渐成为当前处理这些污染的首选.化学法中高级氧化技术(AOPs)因具有反应迅速、反应完全、产物无污染等优点受到了越来越多的关注.AOPs主要包括TiO2/UV、O3、H2O2、Fenton和类Fenton体系等[4-6].在这些方法中,Fenton法具有其所特有的(Fe2+/ Fe3+/ H2O2)体系,相比其他方法能够更快速地产生大量HO·,且Fe2+与Fe3+之间的转化能够使催化剂更加稳定,重复利用率更高[7-8].Fenton法主要利用Fe2+与H2O2进行反应生成大量HO·,Fe2+被氧化为Fe3+,之后Fe3+与H2O2再一次反应继续产生HO·,Fe3+被还原Fe2+.在Fe2+与Fe3+的转化过程中大量HO·不断产生,从而达到处理有机污染物的目的[9-10].Fenton试剂主要包括铁、铁的各种氧化物和其他含铁元素的复杂化合物.其中,Fe3O4具有优于其他Fenton类试剂的磁性,在使用中能够利用磁场将其分离,因此,Fe3O4作为Fenton试剂能够赋予催化剂更高的回收率,大大减少了催化剂的二次污染.此外,由于Fe3O4同时具有Fe2+与Fe3+,也优于其他只含一种化合态的Fenton试剂[11].
Fe3O4微球合成目前主要有溶胶-凝胶法[12]、水热法[13-15]、溶剂热法[16-17]、微波法[18-19]等.其中溶剂热法由于具有较稳定反应环境、容易控制粒子粒径、反应不需在超高温度下进行等优点,逐渐取代以上合成方法成为Fe3O4微球合成的主要手段.先前的研究中仅仅探究了乙二胺的用量对样品的影响,并未进一步探究不同原料投料比对样品photo-Fenton降解的影响及最佳的photo-Fenton反应条件.因此,本文通过控制不同投料比优化Fe3O4微球溶剂热法的合成,合成出粒径为(200±0.5) nm的Fe3O4微球,通过XRD、SEM、TEM、FT-IR等手段对合成的样品进行分析.通过对样品晶型分析、表面修饰、比表面积的分析得出亲水性较强、结构稳定的Fe3O4微球.通过对优化的Fe3O4微球进行photo-Fenton性能优化得到该样品photo-Fenton反应的最佳条件.
1 实验 1.1 实验原料六水合三氯化铁(FeCl3·6H2O, AR), 天津市光复科技有限公司;无水乙酸钠(CH3COONa, AR),二甲酚橙(XO, AR);过氧化氢(H2O2, 30%, AR), 天津市科密欧化学试剂有限公司;乙二醇(HOCH2CH2OH, AR)、乙二胺(H2NCH2CH2NH2, AR)、无水乙醇(C2H5OH),天津市富宇精细化工有限公司.本实验用水为实验室自制蒸馏水.
1.2 实验仪器日本理学株式会社D/MAX2200型X-射线衍射仪(XRD);日本HITACHI公司H-7650型透射电子显微镜(TEM);美国Nicolet公司Magna-IR560型傅里叶变换红外光谱(FTIR);日本电子株式会社SM-6700F扫描电子显微镜(SEM);上海岩征实验仪器有限公司YZ-GHX-A型光化学反应仪;精微高博公司JW-BK132F型比表面及孔径分析仪;北京普析通用仪器有限公司TU-1901型双光束紫外可见光分光光度计.
1.3 Fe3O4微球的制备以表 1投料比将原料分别置于烧杯中,量取48 mL乙二醇分别加入上述烧杯中,利用超声波清洗仪超声30 min.将烧杯置于水浴恒温锅中恒温至50 ℃,加入预热至50 ℃的乙二胺强烈搅拌至溶液澄清.将混合溶液分别倒入高压反应釜中于200 ℃反应6 h,反应结束后利用磁场将样品分离,分别用无水乙醇和蒸馏水反复清洗3~5次.然后置于真空干燥箱干燥.
| 表 1 反应物加入量配比 Table 1 Ratio for the amount of reactants |
取制备好的5种不同比例的Fe3O4微球20 mg分别置于烧杯中,加入亚甲基蓝溶液(200 mL,20 mg/L)中,迅速加入过氧化氢溶液(15 mL)并混合均匀后,超声15 min,将超声后混合溶液置于光化学反应仪中进行photo-Fenton降解反应.反应每进行10 min取10 mL溶液,直到反应进行至60 min,利用紫外光谱分析其降解率.
取最优投料比一组的Fe3O4微球20 mg加入到200 mL 20 mg/L的亚甲基蓝溶液中.分别加入30%过氧化氢溶液13、14、15、16、17 mL并混合均匀后,超声15 min,将超声后混合溶液置于光化学反应仪中进行photo-Fenton降解反应.反应每进行10 min取10 mL溶液,直到反应进行至60 min,利用紫外光谱分析其降解率.
取5组200 mL 20 mg/L亚甲基蓝溶液于烧杯中,滴加HCl溶液分别调节溶液pH为1、2、3、4、5,取20 mg Fe3O4微球分别加入其中.加入30%过氧化氢溶液15 mL(最优用量)并混合均匀后,超声15 min,将超声后混合溶液置于光化学反应仪中进行photo-Fenton降解反应.反应每进行10 min取10 mL溶液,直到反应进行至60 min,利用紫外光谱分析其降解率.
1.5 回收再生磁性Fe3O4微球光芬顿降解亚甲基蓝取200 mL的20 mg/L亚甲基蓝溶液于烧杯中,用浓度为0.1 mol/L的HCl和NaOH溶液分别调节溶液pH至上述实验最优pH下,取20 mg磁性Fe3O4微球分别加入其中.加入过氧化氢溶液(以性能优化实验最佳用量为准)并混合均匀后,超声15 min, 将超声后混合溶液置于光反应仪中进行photo-Fenton降解反应.每进行10 min取10 mL溶液,直到反应进行至60 min,利用紫外光谱分析其降解率.反应结束后,利用磁场将磁性Fe3O4分离,将分离后固体用去离子水和乙醇各超声洗涤3遍后, 于70 ℃真空度为-0.07 MPa的真空干燥箱中干燥.利用回收后催化剂重复上述实验9次.
2 结果与讨论 2.1 晶体结构利用X射线衍射对样品进行分析,结果如图 1所示,不同投料比所合成样品的XRD图谱基本相同,不同原料投料比对生成样品的晶体结构无较大影响.其特征峰分别为30.10°,35.32°,42.86°,53.48°,56.96°,62.44°,其对应样品晶面分别为(220),(311),(400),(422),(511),(440).其中(311) 晶面对应的衍射峰最强.以图 1(c)图谱为例利用徳拜-谢乐公式以(311) 晶面为基准进行结构基元计算,得到所制备Fe3O4微球结构基元为7.72 nm.此外,在XRD图谱中未发现杂质峰,这也表明所制备的Fe3O4微球较为纯净.

|
(a)m(FeCl3·6H2O)∶m(CH3COONa)∶m(NH2CH2CH2NH2)=1∶3∶10; (b)m(FeCl3·6H2O)∶m(CH3COONa)∶m(NH2CH2CH2NH2)=1∶4∶5; (c)m(FeCl3·6H2O)∶m(CH3COONa)∶m(NH2CH2CH2NH2)=1∶4∶10; d)m(FeCl3·6H2O)∶m(CH3COONa)∶m(NH2CH2CH2NH2)=1∶5∶5 图 1 Fe3O4微球的XRD谱图 Figure 1 XRD spectrum of as-synthesis Fe3O4 nanospheres |
如图 2所示,最优条件下(投料比为m(FeCl3·6H2O):m(CH3COONa):m(NH2CH2CH2NH2)=1:4:10) 制备出的Fe3O4微球粒子粒径分布比较均匀,其粒径基本分布于200 nm以内,表面结构以准球形居多,无明显团聚现象.除此之外,如图 2(c)所示,两个晶面的晶面间距经过测量分别为2.540和2.976 nm,与立方Fe3O4的311晶面和220晶面的晶面间距相符,这与XRD计算结构相符,因此, 证明了XRD结果的准确性.

|
(a)平均粒径(200±0.5)nm的Fe3O4微球的TEM图像;(b)Fe3O4微球的TEM图像;(c)Fe3O4微球的高分辨TEM图像 图 2 Fe3O4微球的TEM图像及粒径分析 Figure 2 TEM picture of as-synthesized Fe3O4 nanospheres and particle size analysis |
图 3为Fe3O4微球表面修饰情况.其中,可以明显地发现598,710,1 210 cm-1伯胺N-H,C-N的特征振动峰.此外,在3 500 cm-1有强而宽的-OH振动峰,580 cm-1为Fe3O4特征吸收峰.可以证明所合成催化剂被-NH2,-OH成功修饰.因此,本文所制备的催化剂表面的亲水性、抗氧化性大大提高,从而增加了溶液中亚甲基蓝分子与Fe3O4微球的接触概率.
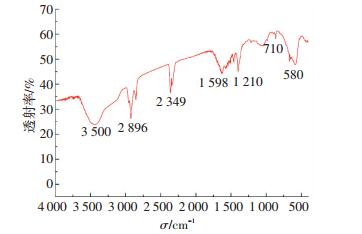
|
图 3 Fe3O4微球的红外谱图 Figure 3 FTIR of as-synthesis Fe3O4 nanospheres |
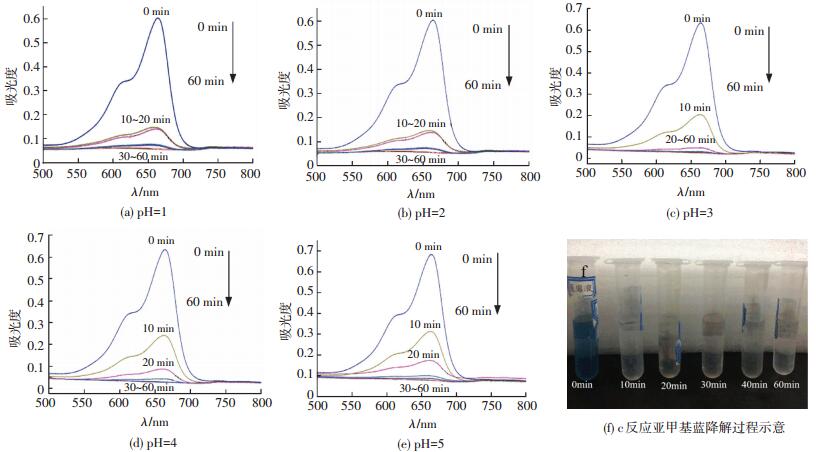
利用紫外-可见光分光光度计测试不同比例制备的磁性Fe3O4微球作催化剂降解前后亚甲基蓝的紫外光谱.由紫外光谱可以发现,在反应开始至反应20 min亚甲基蓝特征峰强度明显减弱,反应进行40 min特征峰基本消失.为了方便分析各个投料比之间的差异,图 4、5对各组不同降解时间下亚甲基蓝紫外光谱和每10 min的降解率进行分析比较.如图 5所示,反应开始后,前30 min的反应速率较大,随着反应进行开始接近反应平衡状态(反应大约进行至40 min).更重要的是,当反应结束时(反应进行60 min)每组样品的降解率约为90%.由图 5可以明显看出,m(FeCl3):m(CHCOONa)=1:4且加入乙二胺10 mL时效率最高,其反应至40 min时降解率100%.
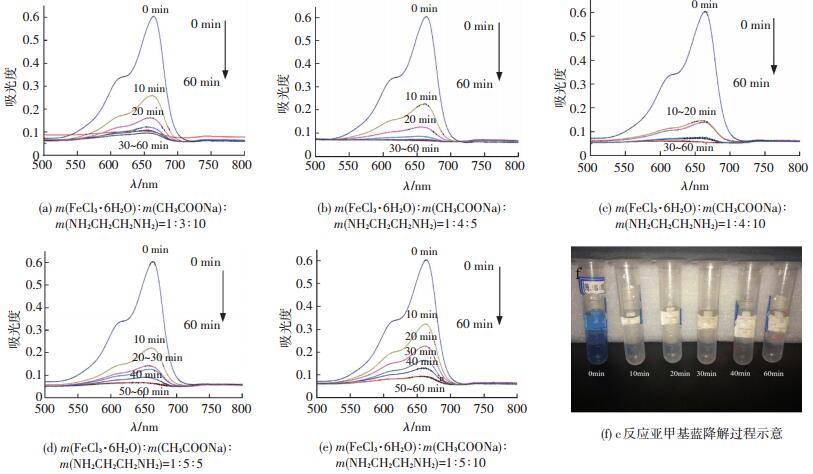
|
图 4 不同反应物配比所合成磁性Fe3O4微球降解亚甲基蓝紫外-可见光谱及c反应亚甲基蓝降解过程实物 Figure 4 UV-vis spectrum of MB during photo-Fenton process by Fe3O4 nanospheres synthesized with different initial ratio of reactants and the picture of real products of "c" degradation reaction |
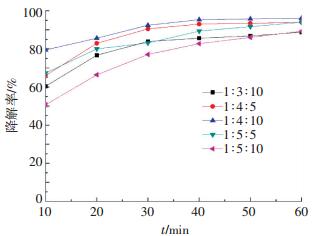
|
图 5 不同反应物配比时亚甲基蓝降解率 Figure 5 Degradation rate of MB with reacted time by as-synthesis Fe3O4 nanospheres with different initial ratio of reactants |
如图 6所示,m(FeCl3):m(CHCOONa)=1:4、乙二胺加入量为10 mL时,粒径分布较均匀,样品的分散性较好.此外,如表 2所示,最优投料比(m(FeCl3·6H2O):m(CH3COONa):m(NH2CH2CH2NH2)=1:4:10) 制备的样品比表面积相对于其他条件下所制备的样品大,这也解释了其降解效率优于其他组样品的原因.

|
图 6 不同反应物配比所合成Fe3O4微球SEM图像 Figure 6 SEM picture of as-synthesized Fe3O4 nanospheres with different initial ratio of reactants |
| 表 2 不同投料比合成的样品BET比表面积 Table 2 BET specific surface area of samples with different initial ratio of reactants |
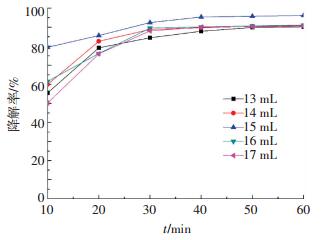
为了研究不同H2O2的量作反应物之间的差异,对各组不同降解时间下亚甲基蓝紫外光谱和降解率进行对比分析,结果如图 7、8所示.每组样品反应至60 min时降解率均为(92±0.5)%,如图 8所示.其中效果最好为H2O2加入量为15 mL时,其反应至60 min降解率为95%.分析表明,当H2O2加入量为13~15 mL时,由于H2O2浓度增大反应体系中的·OH大量增加,亚甲基蓝的降解率在90%~100%范围内依次增加.然而,随着H2O2 浓度的进一步提高,亚甲基蓝降解率由100%至90%逐渐下降.这种趋势可以解释H2O2反应液增加产生更多·OH羟基自由基·OH耦合终止自由基发生时所用的H2O2.因此,当H2O2添加量大于15 mL,导致降解速率的降低.此外,H2O2在高浓度时,清除了高度有效的·OH,并产生了反活性物质,如·OOH自由基,使得此反应降低了攻击亚甲基蓝分子的概率.
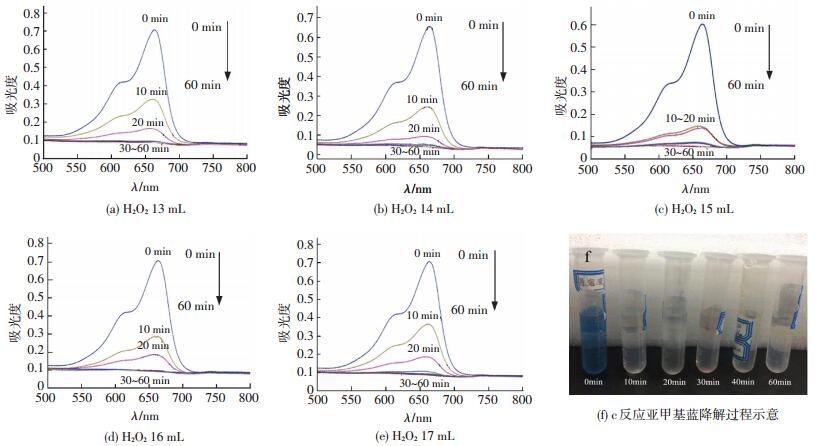
|
图 7 不同过氧化氢用量所合成磁性Fe3O4微球降解亚甲基蓝紫外-可见光谱及c反应亚甲基蓝降解过程示意 Figure 7 UV-vis spectrum of MB during photo-Fenton by Fe3O4 nanospheres synthesized with different initial amount of H2O2 and the picture of real products of "c" degradation reaction |
|
图 8 加入不同过氧化氢时亚甲基蓝降解率 Figure 8 Degradation rate of MB with reacted time with different initial amount of H2O2 |
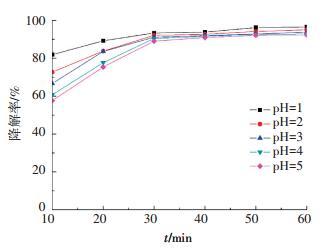
为了研究不同pH条件下光芬顿反应的差异,对各组不同降解时间亚甲基蓝紫外光谱和降解率进行分析比较, 结果如图 9、10所示.每组样品在反应开始至反应进行30 min反应速率较快,至40 min时反应接近平衡状态,反应结束(反应进行60 min)后每组样品降解率均在95%以上.如图 10所示,在pH=1时,降解速率最强,随着pH增加,降解速率依次减弱.这表明,当pH低于3时,形成的H3O2+将提高H2O2的活性.同时,pH为3以上时,形成的·OH和Fe2+水解对降解的亚甲基蓝进行了阻碍.pH显著影响反应过程中的降解,较低的pH可以导致更短的时间达到平衡反应.如图 10所示,在pH=1~5内降解速率虽然有差异,但是反应进行至60 min时亚甲基蓝的降解率都达90%.Fe3O4纳米催化剂可以克服只能作用在狭窄pH范围的光芬顿反应,使得Fe3O4纳米催化剂成为降解废水中亚甲基蓝的良好催化剂.
|
图 9 不同pH所合成磁性Fe3O4微球降解亚甲基蓝紫外-可见光谱及a反应亚甲基蓝降解过程实物 Figure 9 UV-vis spectrum of MB during photo-Fenton degradation by as-synthesized Fe3O4 with different pH value and the picture of real products of "a" degradation reaction |
|
图 10 不同pH亚甲基蓝降解率 Figure 10 Degradation rate of MB with reacted time at different pH value |
经过反复试验发现由于合成的Fe3O4具有较强磁性,利用磁场可以容易地将催化剂从反应体系中分离.表 3列举了10组催化剂回收稳定性试验数据,可以看出催化剂回收率有7组超过了90%,除了其中一组回收率为83.00%,其余9组回收率都超过了85.00%.由此可见,本研究合成的催化剂具有较好的回收率,大大降低了应用成本.
| 表 3 催化剂的回收率稳定性分析 Table 3 Stability analysis of recovery rate of catalyst |
对合成的photo-Fenton催化剂进行再生利用,结果如表 4所示,循环10次以后催化剂的效率与第一次无较大差别.在循环过程中虽然降解率随循环次数的增多有下降的趋势,但是当催化剂第10次循环的过程中降解率也仅从96.83%降至94.75%,并无较大的下降趋势.因此,合成的photo-Fenton催化剂具有较好的循环利用效率.
| 表 4 催化剂再生循环利用率 Table 4 Recycle efficiency of catalyst |
本研究所合成样品经过回收再生后使用,催化降解效率并未随使用次数有明显的下降.然而,在一些文献中,其催化降解效率随使用次数的增多有明显的下降(见表 5).由此可得,本研究所合成的样品具有较高的重复利用率,这也赋予了该样品具有较高的经济价值.
| 表 5 样品再生后降解率与文献数据对比 Table 5 Degradation rates after regeneration compared with reported results |
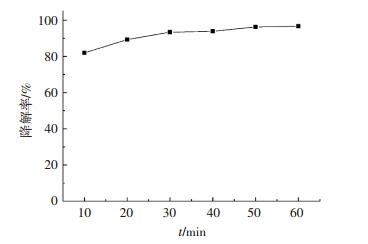
如图 11所示,在最优环境下反应开始10 min后,亚甲基蓝的降解率达80%以上,反应开始30 min后亚甲基蓝降解率接近95%.本部分将进一步分析催化剂高效率的原因.
|
图 11 最优条件下亚甲基蓝降解率与时间关系 Figure 11 Variation of photo-Fenton degradation rate of MB with reacted time |
利用溶剂热法制备样品为样品生成提供了一个稳定的反应环境,如图 2所示,样品的粒径分布均一、分散性好、团聚较少,从微观结构上解释了催化剂高效率的原因;在反应物中加入了乙二胺作为添加剂,如图 3样品红外光谱所示,分析得出乙二胺在样品表面上成功修饰,由于-NH2的存在提高了样品的亲水性,从而提高了样品对溶液中染料分子的吸附,从表面基团上解释了催化剂高效率的原因;如图 1所示样品的XRD图无杂质峰,且峰强而尖,由此说明所制备样品晶化程度较好,从结构的角度解释了催化剂高效率的原因;在上述优化反应条件的过程中,由于H+、·OH等对反应过程的影响已在上部分论述,此部分不再过多赘述.
3 结论1) 利用控制变量法对样品合成的原料进行对比,得到最佳样品配比,并成功利用溶剂热法制备出直径在200 nm以内的单分散Fe3O4微球.
2) 当反应物初始比值m(FeCl3·6H2O):m(CH3COONa):m(NH2CH2CH2NH2)=1:4:10,所制备样品形貌较好,粒径分布均匀且BET比表面积优于其他配比样品.
3) 不同条件下样品对亚甲基蓝的降解都能达90%以上.
4) 过氧化氢添加量为15 mL且在pH=1的环境下,降解率达到最大,此条件为最优反应条件.
5) 催化剂易回收,仅磁场便可分离,并且回收率超过85%,重复利用时降解效率未随着使用次数的增大而下降.
6) Fe3O4微球在整个酸性条件下不被腐蚀并且可以稳定存在及使用,且在较大的过氧化氢范围内具有较高的催化效率,利用此条件合成的样品其原料价格低廉.Fe3O4微球作为photo-Fenton催化剂具有较高的经济效益和广阔的应用前景.
| [1] |
NGUYEN T D, PHAN N H, Do M H, et al. Magnetic Fe2MO4 activated carbons: fabrication, characterization and heterogeneous Fenton oxidation of methyl orange[J].
Journal of Hazardous Materials, 2011, 185(2/3): 653-61.
DOI: 10.1016/j.jhazmat.2010.09.068 |
| [2] |
DAUD N K, AHMAND M A, HAMEED B H. Decolorization of Acid Red 1 dye solution by Fenton-like process using Fe-Montmorillonite K10 catalyst[J].
Chemical Engineering Journal, 2010, 165(1): 111-116.
DOI: 10.1016/j.cej.2010.08.072 |
| [3] |
JING J, LIU M, COLVIN V L, et al. Photocatalytic degradation of nitrogen-containing organic compounds over TiO2[J].
Journal of Molecular Catalysis A Chemical, 2011, 351(61): 17-28.
|
| [4] |
RAY M B, CHEN J P, WANG L K, et al. Advanced oxidation processes[J].
Treatise on Water Science, 2006, 4(2): 377-408.
|
| [5] |
RODRIGUEZ A, ROSAL R, PERDIGON-MELON J A, et al. Ozone-based technologies in water and wastewater treatment[J].
Handbook of Environmental Chemistry, 2008(5): 127-175.
|
| [6] |
TAI C, PENG J F, LIU J F, et al. Determination of hydroxyl radicals in advanced oxidation processes with dimethyl sulfoxide trapping and liquid chromatography[J].
Analytica Chimica Acta, 2004, 527(1): 73-80.
DOI: 10.1016/j.aca.2004.08.019 |
| [7] |
PIGNATELLO J J, OLIVEROS E, MACKAY A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J].
Critical Reviews in Environmental Science and Technology, 2006, 36(1): 1-84.
DOI: 10.1080/10643380500326564 |
| [8] |
TORRADE F, GARCIA J. Using central composite experimental design to optimize the degradation of real dye wastewater by Fenton and photo-Fenton reactions[J].
Dyes and Pigments, 2014, 100: 184-189.
DOI: 10.1016/j.dyepig.2013.09.004 |
| [9] |
MALATO S, FERNANDEZ P, MALDONADO M I, et al. Decontamination and disinfection of water by solar photocatalysis: Recent overview and trends[J].
Catalysis Today, 2009, 147(1): 1-59.
DOI: 10.1016/j.cattod.2009.06.018 |
| [10] |
LIPCZYNSKA-KOCHANY E, KOCHANY J. Effect of humic substances on the Fenton treatment of wastewater at acidic and neutral pH[J].
Chemosphere, 2008, 73(5): 745-750.
DOI: 10.1016/j.chemosphere.2008.06.028 |
| [11] |
GE Y, XIANG Y, HE Y, et al. Preparation of Zn-TiO2/RH/Fe3O4 composite material and its photocatalytic degradation for the dyes in wastewater[J].
Desalination and Water Treatment, 2015, 57(21): 9837-9844.
|
| [12] |
SUN G, DONG B, CAO M, et al. Hierarchical dendrite-like magnetic materials of Fe3O4, γ-Fe2O3, and Fe with high performance of microwave absorption[J].
Chemistry of Materials, 2011, 23(6): 1587-1593.
DOI: 10.1021/cm103441u |
| [13] |
ZHANG H, ZHU G. One-step hydrothermal synthesis of magnetic Fe3O4 nanoparticles immobilized on polyamide fabric[J].
Applied Surface Science, 2012, 258(11): 4952-4959.
DOI: 10.1021/cm103441u |
| [14] |
MUKHOPADHYAY A, JOSHI N, CHATTOPADHYAY K, et al. A facile synthesis of PEG-coated magnetite (Fe3O4) nanoparticles and their prevention of the reduction of cytochromec[J].
ACS Applied Materials & Interfaces, 2012, 4(1): 142-149.
DOI: 10.1021/am201166m |
| [15] |
HU A, CHEN X, TANG Q, et al. Hydrothermal controlled synthesis of Fe3O4 nanorods/graphene nanocomposite for high-performance lithium ion batteries[J].
Ceramics International, 2014, 40(9): 14713-14725.
DOI: 10.1016/j.ceramint.2014.06.060 |
| [16] |
HUANG Y, ZHANG L, HUAN W, et al. A study on synthesis and properties of Fe3O4 nanoparticles by solvothermal method[J].
Glass Physics and Chemistry, 2010, 36(3): 325-331.
DOI: 10.1134/s1087659610030090 |
| [17] |
ZHANG J, YAO Y, HUANG T, et al. Uniform hollow Fe3O4 spheres prepared by template-free solvothermal method as anode material for lithium-ion batteries[J].
Electrochimica Acta, 2012, 78: 502-507.
DOI: 10.1016/j.electacta.2012.06.045 |
| [18] |
NI S, LIN S, PAN Q, et al. Hydrothermal synthesis and microwave absorption properties of Fe3O4 nanocrystals[J].
Journal of Physics D: Applied Physics, 2009, 42(5): 055004.
DOI: 10.1088/0022-3727/42/5/055004 |
| [19] |
HOJATI-TALEMI P, AZADMANJIRI J, SIMON G P. A simple microwave-based method for preparation of Fe3O4/carbon composite nanoparticles[J].
Materials Letters, 2010, 64(15): 1684-1687.
DOI: 10.1016/j.matlet.2010.04.040 |
| [20] |
BORUAH P K, SHARMA B, KARBHAL I, et al. Ammonia-modified graphene sheets decorated with magnetic Fe3O4 nanoparticles for the photocatalytic and photo-Fenton degradation of phenolic compounds under sunlight irradiation[J].
Journal of Hazardous Materials, 2017, 325: 90-100.
DOI: 10.1016/j.jhazmat.2016.11.023 |
| [21] |
MA J, GUO S, GUO X, et al. A mild synthetic route to Fe3O4@TiO2-Au composites: Preparation, characterization and photocatalytic activity[J].
Applied Surface Science, 2015, 353: 1117-1125.
DOI: 10.1016/j.apsusc.2015.07.040 |
| [22] |
XIA J, WANG A, LIU X, et al. Preparation and characterization of bifunctional, Fe3O4/ZnO nanocomposites and their use as photocatalysts[J].
Applied Surface Science, 2011, 257(23): 9724-9732.
DOI: 10.1016/j.apsusc.2011.05.114 |
 2017, Vol. 49
2017, Vol. 49


