bovine and buffalo MFGMPs
乳脂肪球由乳腺上皮分泌细胞形成,先在细胞内质网形成乳脂肪球前体,并从细胞质基质中穿过形成小的脂肪液滴,然后由极性脂质和蛋白质组成的非双分子层物质包裹起来,最终形成乳脂肪球[1],这层非双分子层物质,即为乳脂肪球膜(MFGM).MFGM由磷脂、鞘脂类、糖脂、胆固醇和蛋白质组成[2],具有抑制癌细胞[3]、治疗孤独症[4]、抗菌[5]、抗黏附性[6]等功能.目前已分离并纯化出的奶牛MFGMPs主要有黏蛋白、黄嘌呤氧化酶、嗜乳脂蛋白、脂肪分化相关蛋白、脂肪酸结合蛋白等40多种蛋白质[7].随着蛋白质组学技术的发展,人们对MFGM蛋白的组成和特性有了新的认识.近年来对奶牛MFGM蛋白的研究较多,但是关于水牛MFGM蛋白的组成和特性的研究鲜有报道.
同位素相对和绝对定量标记(iTRAQ)技术是一种在同位素亲和标记(iCAT)技术的基础上发展起来的,可同时标记8种蛋白质样品.该技术对样品的氨基基团进行标记,经串联质谱分离后,通过查询数据库对结果蛋白进行定性定量分析.iTRAQ技术能鉴定任何类型的蛋白,灵敏度高,对结果蛋白可定性定量并分析其功能特性[8].
近年来,iTRAQ技术在蛋白质组学领域获得了广泛的应用.Shi等[9]用iTRAQ结合LC-MS/MS的方法,比较了非油性酿酒酵母和产油白色隐球酵母、圆红冬孢酵母的不同脂质积累阶段的蛋白质组,生长初期分离出132个蛋白,中、后期分别分离出122个和116个.Wu等[10]对DIGE(荧光差异凝胶电泳)、iCAT和iTRAQ技术进行了比较.结果表明,iTRAQ技术可以鉴定出iCAT技术不能表达的蛋白和超出DIGE技术使用范围的蛋白,且iTRAQ技术具有分离鉴定的蛋白质种类更广、数量更多、灵敏度更高、误差更小等优点[11].
本文采用iTRAQ联合液相色谱串联质谱技术对奶牛和水牛MFGM蛋白质组进行混标、分离及精确定量蛋白质组分,并通过数据库和分析软件,查询、分析蛋白质组的详细信息,进一步讨论差异性蛋白的生物学特性,目的是对奶牛和水牛MFGMPs组成和特性进行深入了解,为MFGMPs的开发、利用奠定基础.
1 材料与方法 1.1 主要仪器和试剂仪器:TrippleTOFTM5600质谱仪(AB SCIEX)、AKTA Purifier 100纯化仪(GE Healthcare)、600 V电泳仪(GE Healthcare EPS601).
药品:iTRAQ 8标试剂盒(AB SCIEX)、BCA蛋白定量试剂盒(Pierce)、乙腈(Acetonitrile),丙烯腈(默克)、C18 Cartridge(66872-U sigma).
1.2 样品采集奶牛乳取自黑龙江省哈尔滨市牧场,水牛乳取自广西壮族自治区水牛研究所.本实验奶样为50~80头不同泌乳期的牛乳混合样.样品取出后12 h内送入实验室进行分离实验.
1.3 MFGMPs的分离和蛋白含量的测定参照Pisanu等[12]方法用酸沉将酪乳中的MFGMPs沉淀,高速离心分离出来,冻干备用.用BCA蛋白质定量试剂盒测定样品中的蛋白质浓度.
1.4 SDS-PAGE电泳分离MFGM样品取过滤后的样品,加入上样缓冲液(样品:缓冲液=5:1 (v/v)),沸水浴后高速短时离心,取上清进行SDS-PAGE电泳分离(14 mA×90 min),分离胶片进行考马斯亮蓝染色.
1.5 联合纳升液相色谱和串联质谱分析 1.5.1 酶解、肽段定量及标记样品加入DTT,沸水浴.冷却后依次加入尿素缓冲液、UA缓冲液和IAA溶液,离心.依次加入尿素缓冲液和溶解缓冲液,离心后振荡.静置过夜后离心,OD280肽段定量[13].根据iTRAQ 8标试剂盒说明书对样品进行标记,奶牛和水牛样品分别被标记为113和115.
1.5.2 毛细管高效液相色谱和质谱分析采用纳升流速HPLC液相系统Easy Nano-LC分离.色谱柱以95%的缓冲液A(0.1%甲酸水溶液)平衡,样品富集到上样柱(2 cm×100 μm,5 μm-C18),再经过分析柱(75 μm×100 mm,3 μm-C18) 分离肽段.在质荷比为300~1800 m/z进行1次全扫描的质谱分析,检测正离子,时长240 min.
1.5.3 数据分析采用Proteome Discoverer 1.4和Mascot 2.2对肽段报告离子峰强度值进行定量分析.用数据库uniprot_cetartiodactyla.fasta查询蛋白质组的信息.
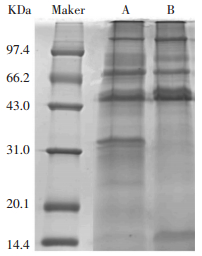
2 结果与讨论 2.1 蛋白质定量及SDS-PAGE电泳分离采用BCA试剂盒测定奶牛和水牛MFGMPs浓度分别为10.8 μg/μL和3.13 μg/μL.MFGMPs样品的SDS-PAGE分离如图 1所示.图 1中A为奶牛MFGM蛋白, B为水牛MFGM蛋白.
|
图 1 奶牛和水牛MFGM蛋白样品的SDS-PAGE分离 Figure 1 SDS-PAGE of MFGMPs from bovine and buffalo |
由图 1可见,奶牛和水牛MFGMPs在97.4-66.2 kDa和35.0-20.1 kDa两个区段条带数目有明显的差异,在66.2-43.0 kDa和15.0-14.4 kDa两个区段条带深浅有明显差异.说明两组样品的蛋白质在种类和含量上均存在差异, 在进一步研究中,采用二维色谱和质谱联用技术对MFGMPs的组成及相对含量进行分离和鉴定的进一步分析.
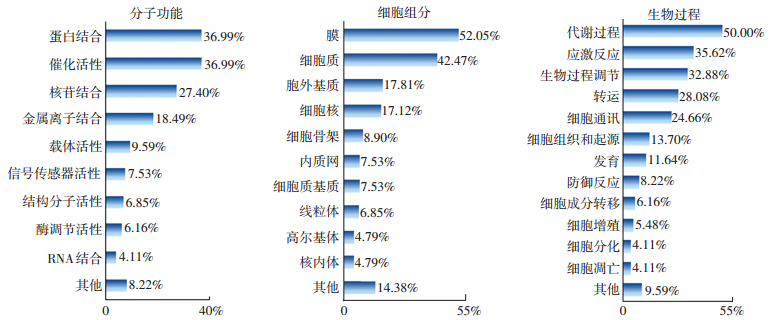
2.2 奶牛和水牛乳脂肪球膜蛋白质组的生物信息奶牛和水牛MFGMPs经质谱分析和数据分析共定量鉴定出奶牛MFGMPs为424个,水牛为422个.Ma[14]采用无标记法定量测定出奶牛MFGMPs为460个,水牛为330个.本研究测定出的蛋白质有407个具有功能性.对于蛋白质功能性的分类参照基因本体(gene ontology,GO)的方法进行[15](图 2),涵盖生物学的3个方面:即分子功能、细胞组分和生物过程.

|
图 2 奶牛和水牛MFGMPs的GO功能分类 Figure 2 The classifications of GO for MFGMPs of bovine and buffalo |
从图 2的结果可以看出,具有催化活性和蛋白质结合功能的蛋白最多,其次为核苷酸结合域;46.46%的蛋白质参与了生物代谢过程,其次是应激反应和生物过程调节;分别有43.40%和42.69%的蛋白质处在细胞膜和细胞质中.
在水牛MFGMPs中未检出开创性核糖核酸酶和Uncharacterized protein(AC:F1ML83).前者处在胞外基质,具有酶催化活性,参与生物体代谢过程;后者在细胞膜上.核糖核酸酶作为一种核酸水解酶模型蛋白常被应用在分子生物学中[16],与生物的器官生成、宿主防御机制、控制肿瘤血管生成、杀灭肿瘤细胞和抑制病毒复制等[17]有关.牛乳开创性核糖核酸酶是RNaseA的同系物,具有特异性抗肿瘤、无精子生成和免疫抑制力活性[18].
2.3 奶牛和水牛乳脂肪球膜蛋白质显著差异蛋白功能活性分析对奶牛和水牛MFGM蛋白质组中146个蛋白含量差异极显著蛋白质的GO功能进行分析归类,结果如图 3所示.
|
图 3 奶牛和水牛MFGM差异显著蛋白GO功能分类 Figure 3 The classifications of GO for significant difference MFGMPs of bovine and buffalo |
具有蛋白质结合和催化活性的蛋白质最多;大部分的蛋白质处在膜上;参与的生物过程最多为代谢过程.图 3的结果与图 2几乎完全一致,说明差异显著性蛋白表现出的功能特性和生物功能可以代表已鉴定蛋白的功能特性.
2.4 奶牛和水牛乳脂肪球膜蛋白显著差异蛋白的比较为表征奶牛和水牛MFGMPs之间的差异表达,以奶牛MFGMPs为内参对鉴定出的蛋白质分析比对,得到差异极显著(p≤0.01) 蛋白146个.在这些蛋白中以2倍(水牛/奶牛)蛋白质相对含量的比值为限定标准,确定上调和下调蛋白质的组成,统计结果见表 1.
| 表 1 奶牛和水牛MFGMPs中的差异蛋白 Table 1 The differential proteins of MFGMPs from bovine and buffalo |
由表 1可见,在147个差异蛋白中共得出上调蛋白20个,下调蛋白25个.在上调蛋白中,水牛MFGMPs中的磷酸钠溶质载体和γ-谷氨酰转肽酶(GGT)显著地高于牛乳.上调蛋白中有7个蛋白属于结合蛋白;处在膜上的蛋白有14个;参与生物体转运、代谢过程和应激反应作用的蛋白各有7个.和奶牛相比,水牛MFGMPs具有更多的载体活性和催化活性,参与生物体的转运过程,为生物体内的合成、代谢供应必要的成分.
在下调蛋白中,黄嘌呤氧化还原酶(XOR)、糖蛋白2(GP-2)、糖基化依赖性细胞黏附分子1(GlyCAM-1) 在奶牛MFGMPs中的含量显著地高于水牛乳,其中XOR含量是水牛乳的35倍;奶牛MFGMPs中有15种蛋白的含量超过水牛的4倍.下调蛋白中主要是结合蛋白;处在膜上的蛋白有12个,在胞外基质中的有11个;参与代谢过程的蛋白有11个具有细胞识别、信号传导、抑制肿瘤细胞的功能特性.
磷酸钠溶质载体蛋白是载体蛋白中专一性转运磷酸钠溶质的一种蛋白.载体蛋白可以高特异性的结合水溶性小分子,渗透并穿过细胞膜的脂质层,将承载物质转移到细胞当中[19].GGT是生物体内参与谷胱甘肽代谢的关键酶之一,是催化转移L-γ-谷氨酰基的特异性酶,与脂代谢紊乱、糖代谢异常、高血压和肥胖等呈正相关[20].
XOR是一种在细胞质基质内普遍存在的复合体黄素钼蛋白,可以控制将黄嘌呤转化为尿酸的嘌呤分解代谢的速率,在DNA降解、核酸合成和能量需求反应中发挥重要的作用[21].Linder等[22]发现XOR与低分化肿瘤和p53异常表达有关,与浆液性卵巢癌患者的预后不良有关是分泌选择素L的配体,可以刺激β2黏合素通路与GlyCAM-1结合,具有参与细胞识别、信号传导、诱导白细胞黏附等生物学功能,并参与到生物体免疫反应、炎症应激等过程中[23].GP-2是通过糖苷键链接羟基或酰胺基形成共价键而成的一种结合蛋白,其中N-糖苷键蛋白具备多种生物功能,并参与到很多细胞与细胞、细胞与基质之间相互作用的生物过程中[24].由于细菌、病毒对宿主细胞膜上某种特殊的糖链有专一识别和结合作用,因此糖蛋白中的糖链起到了阻挡和防御微生物入侵细胞的作用[25].
3 结论1) 利用iTRAQ技术比较奶牛和水牛MFGMPs的成分、含量及功能特性.将奶牛和水牛MFGMPs样品分别标记为113和115,采用Nano-HPLC-MS/MS系统对样品进行分离、鉴定,通过数据库查询蛋白质信息,并进行分析、比较.
2) 在水牛和奶牛MFGMPs中共鉴定鉴定出424个蛋白质,其中差异极显著蛋白有146个,2倍上调蛋白和下调蛋白分别有20个和25个(水牛/奶牛).显著差异蛋白大部分在细胞膜上,具备催化活性和蛋白质结合功能,参与生物体的代谢过程.
3) 水牛MFGMPs具有更多的载体活性和催化活性为生物体内的合成、代谢供应必要的成分.奶牛MFGMPs主要表现为蛋白质结合特性,具有细胞识别、信号传导、抑制肿瘤细胞的功能特性.奶牛和水牛MFGMPs具备的功能特性大部分有益于生物体的代谢调节和免疫功能,并可在一定程度上抑制肿瘤细胞的生长繁殖,具有一定的生物利用价值和药用前景.
| [1] |
WIKING L, STAGSTED J, LENNART B, et al. Milk fat globule size is affected by fat production in dairy cows[J].
International Dairy Journal, 2004, 14(10): 909-913.
DOI: 10.1016/j.idairyj.2004.03.005 |
| [2] |
MESILATI-STAHY R, ARGOV-ARGAMAN N. The relationship between size and lipid composition of the bovine milk fat globule is modulated by lactation stage[J].
Food Chemistry, 2014, 145(4): 562-570.
DOI: 10.1016/j.foodchem.2013.08.077 |
| [3] |
SPITSBERG V L. Invited review: Bovine milk fat globule membrane as a potential nutraceutical[J].
Journal of Dairy Science, 2005, 88(7): 2289-2294.
DOI: 10.3168/jds.S0022-0302(05)72906-4 |
| [4] |
PARDO C A, VARGAS D L, ZIMMERMAN A W. Immunity, neuroglia and neuroinflammation in autism[J].
International Review of Psychiatry, 2009, 17(6): 485-495.
DOI: 10.1080/02646830500381930 |
| [5] |
HARRISON R. Milk xanthine oxidase: properties and physiological roles[J].
International Dairy Journal, 2006, 16(6): 546-554.
DOI: 10.1016/j.idairyj.2005.08.016 |
| [6] |
MARTIN H M, HANCOCK J T, SALISBURY V, et al. Role of xanthine oxidoreductase as an antimicrobial agent[J].
Infection & Immunity, 2004, 72(9): 4933-4939.
DOI: 10.1128/IAI.72.9.4933-4939.2004 |
| [7] |
MATHER I H. A review and proposed nomenclature for major proteins of the milk-fat globule membrane[J].
Journal of Dairy Science, 2000, 83(2): 203-247.
DOI: 10.3168/jds.S0022-0302(00)74870-3 |
| [8] |
MERTINS P, UDESHI N D, CLAUSER K R, et al. iTRAQ labeling is superior to mTRAQ for quantitative global proteomics and phosphoproteomics[J].
Mol Cell Proteomics, 2012, 11(6): 1377-1391.
DOI: 10.1074/mcp.M111.014423 |
| [9] |
SHI Jiahua, FENG Huixing, LEE J, et al. Comparative proteomics profile of lipid-cumulating oleaginous yeast: an iTRAQ-coupled 2-D LC-MS/MS analysis[J].
PLoS One, 2013, 8(12): e85532.
DOI: 10.1371/journal.pone.0085532 |
| [10] |
WU W W, WANG G H, BAEK S J, et al. Comparative study of three proteomic quantitative methods, DIGE, cICAT, and iTRAQ, using 2D gel-or LC-MALDI TOF/TOF[J].
J Proteome Res, 2006, 5(3): 651-658.
DOI: 10.1021/pr050405o |
| [11] |
MERTINS P, UDESHI N D, CLAUSER K R, et al. iTRAQ labeling is superior to mTRAQ for quantitative global proteomics and phosphoproteomics[J].
Molecular & Cellular Proteomics Mcp, 2012, 11(6): 1377-1391.
DOI: 10.1074/mcp.M111.014423 |
| [12] |
PISANU S, GHISAURA S, PAGNOZZI D, et al. Characterization of sheep milk fat globule proteins by two-dimensional polyacrylamide gel electrophoresis/mass spectrometry and generation of a reference map[J].
International Dairy Journal, 2012, 24(2): 78-86.
DOI: 10.1016/j.idairyj.2011.05.009 |
| [13] |
WISNIEWSKI J, ZOUGMAN A, NAGARAJ N, et al. Universal sample preparation method for proteome analysis[J].
Nature Methods, 2009, 6(5): 359-362.
DOI: 10.1038/nmeth.1322 |
| [14] |
MA Lu. Identification of the characteristic component in milk from Holstein cow, buffalo, yak, Jersey cattle, goat, camel and horse[D]. Hohhot: Inner Mongolia Agricultural Universit, 2014.
|
| [15] |
CONSORTIUM G O. Creating the gene ontology resource: design and implementation[J].
Genome Research, 2001, 11(8): 1425-1433.
DOI: 10.1101/gr.180801 |
| [16] |
QIAN Min, LI Guanrong, LU Cheng. Research progress on ribonucleases[J].
Acta Sericologica Sinica, 2004, 30(2): 185-190.
DOI: 10.3969/j.issn.0257-4799.2004.02.014 |
| [17] |
LIU Jun, XUE Caifang. Advances in the research of therapeutic ribonucleases[J].
Chinese Bulletin of Life Sciences, 2002, 14(3): 139-140.
DOI: 10.3969/j.issn.1004-0374.2002.03.003 |
| [18] |
KIM J S, SOUCEK J, MATOUSEK J, et al. Structural basis for the biological activities of bovine seminal ribonuclease[J].
Journal of Biological Chemistry, 1995, 270(18): 10525-10530.
DOI: 10.1074/jbc.270.18.10525 |
| [19] |
PALMIERI F. Mitochondrial metabolite carrier protein family[J].
Encyclopedia of Biological Chemistry, 2013: 149-158.
DOI: 10.1016/B978-0-12-378630-2.00149-3 |
| [20] |
SAELY C H, VONBANK A, REIN P, et al. Alanine aminotransferase and gamma-glutamyl transferase are associated with the metabolic syndrome but not with angiographically determined coronary atherosclerosis[J].
Clinica Chimica Acta, 2008, 397(1/2): 82-86.
DOI: 10.1016/j.cca.2008.07.024 |
| [21] |
AGARWAL A, BANERJEE A, BANERJEE U C. Xanthine oxidoreductase: a journey from purine metabolism to cardiovascular excitation-contraction coupling[J].
Critical Reviews in Biotechnology, 2011, 31(3): 264-80.
DOI: 10.3109/07388551.2010.527823 |
| [22] |
LINDER N, BÜTZOW R, LASSUS H, et al. Decreased xanthine oxidoreductase (XOR) is associated with a worse prognosis in patients with serous ovarian carcinoma[J].
Gynecologic Oncology, 2012, 124(2): 311-318.
DOI: 10.1016/j.ygyno.2011.10.026 |
| [23] |
LI Jing, WANG Hongmei, WANG Changfa, et al. Analysis of Genetic Polymorphisms in glycosylation-dependent cell-adhesion molecule 1 gene (g1ycam1) of cattle[J].
Journal of Agricultural Biotechnology, 2009, 17(3): 439-444.
DOI: 10.3969/j.issn.1674-7968.2009.03.014 |
| [24] |
GUO Hui, DENG Wenxing, ZHANG Ying. Research progression of glycoprotein[J].
Biotechnology Bulletin, 2009(3): 16-19.
|
| [25] |
GOFFARD A, CALLENS N, BARTOSCH B, et al. Role of N-Linked glycans in the functions of hepatitis C virus envelope glycoproteins[J].
Journal of Virology, 2006, 79(13): 237-246.
DOI: 10.1128/JVI.79.13.8400-8409.2005 |
 2017, Vol. 49
2017, Vol. 49


