2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090
2. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China
基于亚硝化的全程自养脱氮工艺(CANON)是近年来发展起来的一种新型脱氮工艺,与传统工艺相比,具有工艺流程短、节省曝气量、无需外加碳源且污泥产量低等诸多优点[1],成为国内外学者研究重点.研究表明,亚硝化是CANON工艺中的限制阶段[2-3].在CANON的运行过程中,DO的控制不当很容易引起系统脱氮率下降,甚至崩溃.因此,合理控制反应器内部溶解氧是CANON工艺稳定运行的关键.
近年来,大量研究表明,与连续曝气相比,间歇曝气更有利于维持CANON的稳定运行. Ma等[4]在SBR处理低氨氮污水时采用间歇曝气成功运行了单级自养脱氮工艺; 秦宇等[5]在SBBR中采用间歇曝气运行自养脱氮工艺时,提出更有益于创造单级自养脱氮所需的反应环境; Yang等[6]采用间歇曝气在MBBR中运行CANON达到了较好的总氮去除效率; Sobotka等[7]在SBR中运行CANON工艺时发现, 间歇曝气与连续曝气相比具有较高的脱氮速率及稳定性; 而Corbalá-Robles等[8]在SBR中以含有部分絮状污泥的颗粒污泥运行CANON工艺处理高氨氮污水时,发现连续曝气脱氮效果优于间歇曝气.目前,关于不同曝气方式下CANON启动与运行的研究结果还存在争议,对遭遇延时曝气破坏后的恢复研究还很少.
本实验在常温条件下,采用2个SBR反应器,研究间歇曝气与连续曝气下CANON工艺的启动与稳定运行,并探讨延时曝气对两种曝气方式CANON工艺的影响,分析不同曝气方式下CANON工艺恢复性能,为常温低氨氮CANON工艺的快速启动与稳定运行提供基础数据与技术支持.
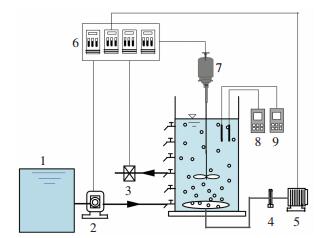
1 实验 1.1 实验装置实验装置如图 1所示.实验采用两个相同的SBR反应器R1、R2,反应器由有机玻璃制成,高35 cm,内径13 cm,有效容积4 L,换水比66.7%.在反应器壁垂直方向设置一排间距为5 cm的取样口,用以排水和取样.反应器底部安装曝气环进行微孔曝气,由气泵与气体流量计控制曝气强度,内置搅拌机使泥、水、气混合均匀.进水、曝气和排水均采用自动控制.
|
1—进水箱; 2—蠕动泵; 3—出水; 4—气体流量计; 5—鼓风机; 6—进水、出水、搅拌、曝气时序控制器; 7—搅拌机; 8—在线pH; 9—在线DO 图 1 实验装置示意 Figure 1 Schematic diagram of experimental device |
接种污泥采用实验室稳定运行的厌氧氨氧化活性污泥,初始污泥质量浓度为1 500 mg/L,接入R1和R2,进水采用人工配水,分别以(NH4)2SO4和NaHCO3作为NH4+-N和碱度的来源,营养液Ⅰ、Ⅱ作为营养物质[9],营养液Ⅰ包括EDTA 5 000 mg/L和FeSO4 5 000 mg/L.营养液Ⅱ包括EDTA 15 000 mg/L、ZnSO4·7H2O 430 mg/L、CoCl2·6H2O 240 mg/L、MnCl2·4H2O 990 mg/L、CuSO4·5H2O 250 mg/L、Na2MoO4·2H2O 220 mg/L、NiCl2·6H2O 190 mg/L、Na2SeO4·10H2O 210 mg/L和H3BO4 14 mg/L.实验用水水质见表 1.
| 表 1 实验期间进水水质 Table 1 Water quality during the test period |
采用SBR反应器,包括进水阶段(15 min)、反应阶段(反应时间根据周期实验结果确定)、沉淀时间(40 min)、排水(3 min).温度控制在(20~25) ℃,反应器换水比67.7%. 1号反应器曝气方式采用间歇曝气(曝气/停曝时间为30 min/30 min,内部DO为0.38 mg/L. 2号反应器采用连续曝气,内部DO为0.23 mg/L,两者曝气总量相同,其他运行条件均相同.实验分为2个阶段,即CANON启动阶段、延时曝气及恢复阶段.
1.4 分析项目与方法DO、T、pH均采用WTW在线测定仪测定; MLSS采用标准测定.水样分析中NH4+-N的测定采用纳氏试剂光度法,NO2--N采用N-(1-萘基)乙二胺光度法,NO3--N采用紫外分光光度法,其余水质指标的分析方法均采用国标方法[10].
反应速率的测定:在实验的第85~90天,从稳定运行的R1和R2中各取出1 L泥水混合液,放入2个相同的烧杯内,底部放置曝气环,设机械搅拌.分别测定CANON反应速率、厌氧氨氧化(Anammox)反应速率及硝化反应速率,用来表征好氧氨氧化菌(AOB)和厌氧氨氧化菌(AnAOB)的协同性、AnAOB的活性以及亚硝酸盐氧化菌(NOB)的活性.测定3种速率时,烧杯内温度均为25 ℃,pH为7.6左右.测定CANON反应速率时,进水只配氨氮(80 mg/L),曝气量为0.25 L/min,每隔1 h取出水测定氨氮、亚硝酸盐氮、硝酸盐氮,待出水中三氮质量浓度不再发生变化时停止反应.测定Anammox速率时,进水配亚硝酸盐氮(45.5 mg/L)与氨氮(34.5 mg/L),不曝气,每隔1 h取出水测定氨氮、亚硝酸盐氮、硝酸盐氮,待出水中三氮质量浓度不再发生变化时停止反应.测定硝化反应速率时,进水只配亚硝酸盐氮(80 mg/L),曝气量为0.25 L/min,每隔1 h取出水测定亚硝酸盐氮、硝酸盐氮,待出水中氮素质量浓度不再发生变化时停止反应. CANON和Anammox反应速率按式(1) 计算,硝化反应速率按式(2) 计算:
| $ {v_{{\rm{CANON, Anammox}}}} = \frac{{{\rho _{始}}\left( {{\rm{TN}}} \right)-{\rho _{末}}\left( {{\rm{TN}}} \right)}}{{t \cdot {\rho _{{\rm{MLSS}}}}}}, $ | (1) |
| $ {v_{硝化}} = \frac{{{\rho _{始}}\left( {{\rm{NO}}_3^--{\rm{N}}} \right)-{\rho _{末}}\left( {{\rm{NO}}_3^ -- {\rm{N}}} \right)}}{{t \cdot {\rho _{{\rm{MLSS}}}}}}. $ | (2) |
根据CANON工艺反应式,总氮的去除量(Δρ(TN))和硝态氮的产生量(Δρ(NO3--N)理论值比值为8[11],若Δρ(TN)/Δρ(NO3--N)大于8,可能是因为测量误差和发生了小部分反硝化等作用; Δρ(TN)/Δρ(NO3--N)小于8,反映了NOB有活性,Δρ(TN)/Δρ(NO3--N)越小,说明NOB活性越高[12].
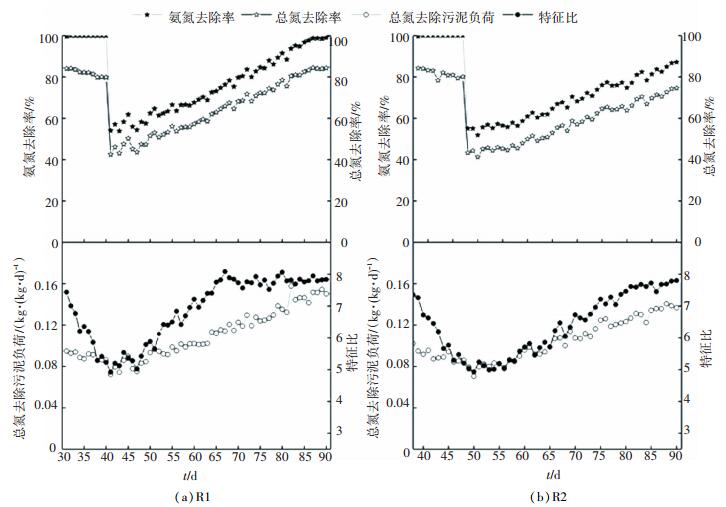
如图 2所示,R1和R2在经过2 d的适应期后,AOB活性开始提升,反应器有总氮去除.前7 d,R1和R2的反应器性能相似,特征比均在4.2左右,考虑两者接种种泥初始性能相同,含NOB基数一定,反应器刚启动阶段,效果基本相同.在8~21 d,R1的Δρ(TN)/Δρ(NO3--N)平稳上升,相比之下R2上升较平缓.在第21天之后,R1的Δρ(TN)/Δρ(NO3--N)平均在7.8,接近理论值8,CANON启动成功(图 2(a)).而R2在第27天的Δρ(TN)/Δρ(NO3--N)达7.6,也成功启动CANON.第2天以后,总氮去除率及污泥负荷均呈上升趋势,且没有出现亚硝酸盐氮积累,说明此时反应器脱氮性能主要决定于亚硝化率.在第11天时,R1的氨氮去除率和总氮去除率为48.92%、39.9%,R2的分别为46.58%、37.71%,R1均略微高于R2.到第21天时,R1的氨氮去除率和总氮去除率分别为82.79%、70.75%,R2为74.73%、62.57%. R1明显高于R2.

|
图 2 R1、R2反应器CANON工艺启动过程 Figure 2 Start-up diagram of CANON process in R1, R2 |
目前,国内90%的SBR反应器均采用固定周期的方式运行[13],由于进水水质的波动性,导致进水基质改变,固定的曝气时间易造成延时曝气,使得反应器内部溶解氧迅速升高,造成过多的溶解氧供应.过多溶解氧一方面会对AnAOB产生抑制,另一方面会增强NOB的活性.虽然溶解氧对AnAOB的抑制作用是可逆的,但是长时间的延时曝气可能不会恢复到以前的水平,AOB的活性又会因为延时曝气增大,导致产生更多亚硝酸盐氮,NOB也会利用AnAOB活性的暂时抑制及足够的基质进行生长. Lackner等[14]指出,CANON系统失稳的一个重要原因就是溶解氧的过量供应.因此,本实验研究两种曝气方式下通过实时监测反应器内氨氮、亚硝酸盐氮、硝酸盐氮变化情况,在氨氮反应完以后延长反应周期时间1 h(即连续曝气继续反应1 h,间歇曝气继续反应1 h(曝气30 min,停曝30 min)),CANON对延时曝气的抵抗力大小,探讨更适合高效稳定维持CANON工艺及快速恢复曝气的策略.待CANON启动成功并稳定运行10 d后,分别对R1和R2进行延时曝气10 d.对比两者在遭到延时曝气及恢复过程中的脱氮性能.
如图 3所示,延时曝气实验期间(R1 30~40 d,R2 37~47 d)R1和R2总氮去除率均有略微下降,但都处于较高水平,维持在80%左右,两者遭受延时曝气总氮去除差别不大.延时曝气之前AOB和AnAOB的活性较高,经过延时曝气NOB得到一定的增殖,但是此时反应器内优势菌种仍然为AOB和AnAOB,总氮去除率没有明显降低,可以看出两种方式对延时曝气都有一定的抵抗力.但是,两者Δρ(TN)/Δρ(NO3--N)降幅较大,R1由7.69降到5.23,R2由7.6降到5.2,说明此时反应器内NOB已经得到一定增殖,与AnAOB竞争基质产生过多的硝酸盐氮.张功良等[15]指出在温度范围(22±1)℃无其他抑制因素的前提下,有利于NOB的生长,导致系统内NOB不断增殖.因此,该种条件长期运行下去必然导致优势菌种的转化,使反应器向全程硝化转变.
|
图 3 延时曝气后不同曝气方式CANON的恢复及稳定运行 Figure 3 Performance of the reactor in running CANON process under different aeration patterns after extended aeration |
R1和R2分别在第40天和第47天进行恢复. Abeling等[16]认为,当游离氨(FA)质量浓度为1.0~10 mg/L时,NOB的活性受到抑制,而AOB不被抑制,较高的进水氨氮负荷(RAL)也对NOB有抑制作用[17],因此,本实验采用不改变进水水质的情况下缩短HRT为5 h,提高RAL(0.8 kg/(m3·d)),使反应器内部始终存在FA抑制(NH3为1.14~4.5 mg/L),作为此温度及DO条件下CANON的恢复策略.
如图 3所示,恢复期0~7 d,两个反应器总氮去除率略有上升,Δρ(TN)/Δρ(NO3--N)没有继续下降而是稳定在5.2左右,说明此时已经起到抑制NOB的作用,但是之前的延时曝气使NOB得到增殖,有了一定的基数.此时,由于周期的缩短导致两个反应器均出现了氨氮及总氮去除率急速下降的趋势,但是由于进水氨氮负荷的提高,使得反应器内菌种基质充足,微生物活性基本没有受到影响,因此,总氮去除污泥负荷几乎没有影响.随着反应进行,R1和R2对比逐渐明显. R1在第65天便恢复CANON活性,此后一直提高总氮去除负荷.而R2在第81天才恢复,之后一直稳定运行. R1和R2的恢复时间分别为25、33 d,R1的恢复时间较短,原因是NOB承受溶解氧波动的适应力低[18],缺氧环境下AOB和NOB的活性均受到抑制,而一旦恢复曝气,经历长期“饥饿”的AOB可以更多地利用氨产能大量增殖,NOB却不能很快恢复活性[19]; 间歇曝气还会使系统中出现短暂的厌氧环境,这种低溶解氧的条件也有利于AnAOB对基质的竞争[20]. Kornaros等[21]也提出利用间歇曝气对NOB造成的生长停滞是抑制NOB的一个重要方式,相对于投加药品或改变运行条件(温度)更经济简单.在相同时间内,由于R1启动及恢复时间均比R2短,R1有时间进行负荷提高,到第90天,R1的总氮污泥去除负荷为0.157 kg/(kg·d),总氮去除率为84.36%,而R2的总氮污泥去除负荷为0.14 kg/(kg·d),总氮去除率为73.62%.因此,间歇曝气对启动与运行CANON来说,均优于连续曝气.本文通过缩短HRT增大FA及通过增加周期个数增加进水氨氮负荷恢复CANON活性,既不改变进水水质又没有加温,对于实际工程应用很有意义.
2.3 脱氮路径及功能菌活性分析 2.3.1 典型周期脱氮路径对比图 4(a),(b)分别为R1、R2在恢复CANON活性后稳定运行时(第86天)一个典型周期氮素及DO的变化.由图 4(a)可知,好氧段DO维持在0.38 mg/L左右,TN及氨氮去除呈阶梯状,亚硝酸盐氮增加量小于氨氮消耗量,分析认为好氧段AOB利用氨氮进行亚硝化,伴随发生部分ANAMMOX反应导致部分TN损失,进入厌氧段,进行厌氧氨氧化,TN得到大量去除.第一个好氧段,亚硝酸盐氮积累了8.0 mg/L,随后进入厌氧段被AnAOB利用,其质量浓度下降到1.23 mg/L,TN去除了17.83 mg/L.其他阶段均类似.最终出水氨氮及TN为1.37、12.92 mg/L. 图 4(b)中,R2的DO维持在0.23 mg/L,R2的氨氮及总氮呈线性去除,前120 min有亚硝酸盐氮积累,最高为2.53 mg/L,达到最高点后逐渐降低,120 min后几乎无亚硝酸盐氮剩余.硝酸盐氮则逐渐上升,最终出水氨氮及总氮为12.56、22.92 mg/L.由上可知,在相同时间内,R1比R2总氮去除率高.

|
图 4 典型周期内氮素质量浓度及DO的变化 Figure 4 Change of nitrogen and DO during a typical cycle |
为了研究在不同曝气策略下氮素转变情况,对两个反应器的脱氮路径进行分析. 表 2列出了好氧段与厌氧段的氮素转化情况.可以看出,R1的好氧段中积累了30.30 mg/L亚硝酸盐氮,但是消耗了53.95 mg/L氨氮,产生的亚硝酸盐氮少于消耗的氨氮,认为好氧段中一部分氨氮与部分由氨氮转化的亚硝酸盐氮被AnAOB利用,共同完成CANON路径. R1的好氧段及厌氧段都有硝酸盐氮产生,NOB和AnAOB在自身代谢过程均产生硝酸盐氮,反硝化和异养厌氧氨氧化可以去除硝酸盐氮[22].在好氧段,除了进行亚硝化反应,还有(53.95~30.30) mg/L氨氮进行CANON反应,生成2.72 mg/L硝酸盐氮,Δρ(NO3--N)/Δρ(NH4+-N)为0.115,接近CANON公式1:0.11的化学计量比,说明此时反应器内部的优势菌种为AOB和AnAOB,已经成功抑制NOB.在厌氧段,由之前亚硝化积累的30.30 mg/L亚硝酸盐氮和剩余24.25 mg/L氨氮全部进行厌氧氨氧化反应.此阶段共产生6.02 mg/L硝酸盐氮,Δρ(NO3--N)/Δρ(NH4+-N)为0.248,较理论值0.26小.原因是反应器内由于长期的缺氧环境存在反硝化细菌利用部分硝酸盐氮进行反硝化.由此可以看出R1的脱氮路径一共有两个,一个是同时亚硝化/厌氧氨氧化(SNA),另一个是交替亚硝化/厌氧氨氧化(ANA),如图 5所示. R2由于是连续曝气,不存在厌氧段,脱氮路径较为简单,即同时亚硝化/厌氧氨氧化.共消耗了66.67 mg/L氨氮,反应末期几乎无亚硝酸盐氮,产生了7.85 mg/L硝酸盐氮,计算Δρ(NO3--N)/ Δρ(NH4+-N)为0.118,接近理论值0.11.
| 表 2 典型周期内好氧段/厌氧段氮素变化 Table 2 Change of nitrogen in aerobic/ anaerobic during a typical cycle |
|
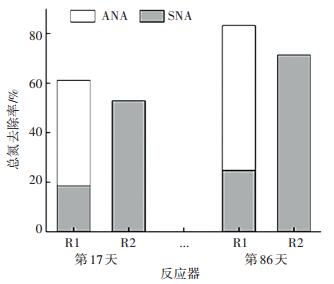
图 5 不同曝气方式下总氮去除途径分析 Figure 5 Total nitrogen removal pathway under different aeration patterns analysis |
图 5为R1和R2第17天和第86天的总氮去除比率.可以看出,R2的总氮去除只有SNA途径,而R1的总氮去除分为SNA和ANA两部分.第17天时,R1和R2的总氮去除率分别为61.07%、52.92%,第86天时,R1和R2的总氮去除率分别为83.24%、71.37%,R1的去除率更高.对于R1,第17天,SNA和ANA去除比率分别为15.87%、42.5%,第86天,SNA和ANA分别为24.7%、58.54%,ANA路径的贡献更大.在CANON系统中,连续曝气下的SNA路径达到更高的脱氮率往往是有限的[23].因为CANON工艺中,为了保护AnAOB及抑制NOB,限定的低溶解氧条件导致AOB的活性得不到很好的发挥,不能产生足够的亚硝酸盐氮供AnAOB利用,导致反应速率较慢,而加大溶解氧则有NOB增殖的风险.而间歇曝气可以适当增加溶解氧增大AOB活性,并且间歇曝气方式能更好抑制NOB,通过SNA及ANA路径联合脱氮使得脱氮效率更高.
综上,间歇曝气启动CANON时间较短,且达到的总氮去除率更高.原因可能是R1的AOB活性高于R2,导致R1中的亚硝化速率高于R2,AnAOB可利用基质较多,R1中的厌氧段对AnAOB也起到了一定的保护作用,并且NOB对溶解氧波动的适应能力低[18],限制氧的间歇曝气更有利于抑制NOB. Carlucci等[24]指出相比连续曝气系统,间歇曝气系统中AOB产率系数增加,衰减系数降低.蒋轶峰等[25]指出在间歇曝气短程硝化系统中,AOB产率系数的增加可以提高自身在反应器中的绝对生物量,并补偿因限制氧引起的比底物利用速率下降.在间歇曝气系统中,AOB可以通过提高自身在反应器的绝对生物量使氨氮去除负荷增加,并且可以适当地提高DO增大AOB活性,使亚硝化率达到更高,进而提高CANON的脱氮率.
然而Corbalá-Robles等[8]利用含有部分絮状的CANON颗粒污泥发现连续曝气总氮去除率高于间歇曝气; Sobotka等[7]在运行CANON工艺时发现间歇曝气更有利于提高脱氮率及维持较好的稳定性; 在本实验中,也发现间歇曝气无论在启动还是在稳定运行CANON工艺过程中,都优于连续曝气.分析认为,Corbalá-Robles采用含部分絮状污泥的颗粒污泥,而本实验及Sobotka采用完全絮状活性污泥.颗粒污泥反应机理与絮状污泥不同,CANON颗粒污泥本身具有好氧区和厌氧区,AnAOB在颗粒内部,有利于保护厌氧氨氧化菌,大大降低了DO对AnAOB的影响,可以通过合理控制DO,使亚硝化得以最大化,AnAOB有足够基质,进而提高脱氮率.而絮状污泥不同,在连续曝气下,AnAOB直接暴露在DO下,为了保护AnAOB,抑制NOB,使得DO一直处于很低的状态,导致亚硝化率很低,严重影响了总氮去除.而间歇曝气正好补偿这一点.利用AOB的“饱食饥饿”特性,有利于淘洗NOB,厌氧段又有利于保护AnAOB,间歇曝气还可以适当增加溶解氧增大AOB活性,通过亚硝化/厌氧氨氧化和交替亚硝化/厌氧氨氧化路径联合脱氮使得脱氮效率更高.
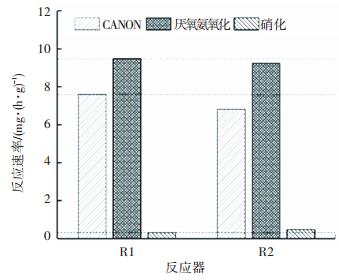
2.3.3 微生物活性的比较为了比较两个反应器功能菌活性以及NOB被抑制程度,分别测定了CANON反应速率、AnAOB反应速率及NOB反应速率.由图 6可知,单位MLSS R1与R2的CANON速率分别7.6、6.82 mg/(h·g),AnAOB速率分别为9.48、9.25 mg/(h·g).硝化速率分别为0.32、0.47 mg/(h·g),说明此时已经成功抑制NOB,反应器内的优势菌种为AOB和AnAOB. R1无论是CANON还是Anammox速率均高于R2,而硝化速率R1却小于R2.原因为间歇曝气中的厌氧段较好地?ち薃nAOB,且间歇曝气策略更好地利用了AOB的“饱食饥饿”特性[19],使得AOB的产率系数增加,而NOB不能适应这种环境遭到抑制,形成了一种良性循环,反应器内功能菌活性越来越高.
|
图 6 不同曝气方式下的反应速率对比 Figure 6 Comparison of reaction rates in different aeration patterns |
1) 间歇曝气与连续曝气分别用了21 d和27 d成功启动CANON,间歇曝气启动更快.
2) 间歇曝气与连续曝气遭到延时曝气破坏程度相差不大,但是间歇曝气恢复时间更短,最终R1与R2达到的总氮去除率分别为84.32%、73.62%(90 d).
3) SBR中间歇曝气CANON系统总氮去除有两种途径,同时亚硝化/厌氧氨氧化(SNA)和交替亚硝化/厌氧氨氧化(ANA),因此,达到了更高的总氮去除率.在R1中这种途径所占比例分别为24.7%、58.54%(86 d).
4) 间歇曝气较连续曝气系统,AOB及AnAOB活性更高,NOB淘洗得更为彻底,稳定性更高.
| [1] |
付昆明. 全程自养脱氮(CANON)反应器的启动及其脱氮性能[D]. 北京: 北京工业大学, 2010.
FU Kunming.Start-up and performance of nitrogen removal of CANON reactor[D].Beijing: Beijing University of Technology, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10005-2010107980.htm |
| [2] |
CEMA G, PLAZA E, TRELA J, et al. Dissolved oxygen as a factor influencing nitrogen removal rates in a one-stage system with partial nitritation and Anammox process[J].
Water Science and Technology, 2011, 64(5): 1009-1015.
DOI: 10.2166/wst.2011.449 |
| [3] |
ZUBROWSKA-SUDOL M, YANG J, TRELA J, et al. Evaluation of deammonification process performance at different aeration strategies[J].
Water Science and Technology, 2011, 63(6): 1168-1176.
DOI: 10.2166/wst.2011.356 |
| [4] |
MA B, BAO P, WEI Y, et al. Suppressing nitrite-oxidizing bacteria growth to achieve nitrogen removal from domestic wastewater via anammox using intermittent aeration with low dissolved oxygen[J].
Scientific Reports, 2015, 5: 13048.
DOI: 10.1038/srep13048 |
| [5] |
秦宇. SBBR单级自养脱氮工艺及其微生态特性研究[D]. 重庆: 重庆大学, 2009.
QIN Yu. Study on single-stage autotrophic denitrification process and micro-ecological characteristics in SBBR[D], Chongqing:Chongqing University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10611-2009148365.htm |
| [6] |
YANG J, TRELA J, ZUBROWSKA-SUDOl M, et al. Intermittent aeration in one-stage partial nitritation/anammox process[J].
Ecological Engineering, 2015, 75: 413-420.
DOI: 10.1016/j.ecoleng.2014.11.016 |
| [7] |
SOBOTKA D, CZERWIONKA K, MAKINIA J. The effects of diffe-rent aeration modes on ammonia removal from sludge digester liquors in the nitritation-anammox process[J].
Water Science & Technology, 2015, 71(7): 986.
|
| [8] |
CORBALÁ-ROBLES L, PICIOREANU C, LOOSDRECHT VAN M C M, et al. Analysing the effects of the aeration pattern and residual ammonium concentration in a partial nitritation-anammox process[J].
Environmental Technology, 2015, 37(6): 694-702.
|
| [9] |
DEGRAAF A, DEBRUIJN P, ROBERTSON L A, et al. Autotro-phic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor[J].
Microbiology-UK, 1996, 142(8): 2187-2196.
DOI: 10.1099/13500872-142-8-2187 |
| [10] |
国家环境保护总局.
水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002.
Ministry of Environmental Protection of the People's Republic of China. Water and wastewater monitoring and analysis methods[M]. Beijing: Vironmental Science Press, 2002. |
| [11] |
THIRD K A, SLIEKERS A O, KUENEN J G, et al. The CANON system (completely autotrophic nitrogen-removal over nitrite) under ammonium limitation: Interaction and competition between three groups of bacteria[J].
Syst Appl Microbiol, 2001, 24(4): 588-596.
DOI: 10.1078/0723-2020-00077 |
| [12] |
胡石, 甘一萍, 张树军, 等. 一体化全程自养脱氮(CANON)工艺的效能及污泥特性[J].
中国环境科学, 2014(1): 111-117.
HU Shi, GAN Yiping, ZHANG Shujun, et al. Performance and sludge characteristics of the CANON process[J]. China Environmental Science, 2014(1): 111-117. |
| [13] |
彭永臻.
SBR法污水生物脱氮除磷及过程控制[M]. 北京: 科学出版社, 2011: 240-251.
PENG Yongzhen. The process control of nitrogen and phosphorus removal from sewage treatment by SBR process[M]. Beijing: Science Press Co., Ltd., 2011: 240-251. |
| [14] |
LACKNER S, GILBERT E M, VLAEMINCK S E, et al. Full-scale partial nitritation/anammox experiences: An application survey[J].
Water Research, 2014, 55: 292-303.
DOI: 10.1016/j.watres.2014.02.032 |
| [15] |
张功良, 李冬, 张肖静, 等. 低温低氨氮SBR短程硝化稳定性实验研究[J].
中国环境科学, 2014(3): 610-616.
ZHANG Gongliang, LI Dong, ZHANG Xiaojing, et al. Stability for shortcut nitrification in SBR under low ammonia atlow temperature[J]. China Environmental Science, 2014(3): 610-616. |
| [16] |
ABELING U, SEYFRIED C. Anaerobic-aerobic treatment of high-strength ammonium wastewater nitrogen removal via nitrite[J].
Water science & Technology, 1992, 26(5/6): 1005-1007.
|
| [17] |
BELINE F, BOURSIER H, DAUMER M L, et al. Modelling of biological processes during aerobic treatment of piggery wastewater aiming at process optimisation[J].
Bioresource Technology, 2007, 98(17): 3298-3308.
DOI: 10.1016/j.biortech.2006.07.004 |
| [18] |
DANGCONG P, BERNET N, DELGENES J, et al. Effects of oxygen supply methods on the performance of a sequencing batch reactor for high ammonium nitrification[J].
Water Environment Research, 2000, 72(2): 195-200.
DOI: 10.2175/106143000X137284 |
| [19] |
李亚峰, 秦亚敏, 谢新立, 等. 间歇曝气条件下短程硝化的实现及影响因素研究[J].
环境工程学报, 2011(7): 1518-1521.
LI Yafeng, QIN Yamin, XIE Xinli, et al. Study on achievement and influencing factors of shortcut nitrification in intermittent aeration[J]. Chinese Journal of Environmental Engineering, 2011(7): 1518-1521. |
| [20] |
张辉, 白向玉, 李敬, 等. 间歇曝气短程硝化控制新途径的初步实验研究[J].
新疆环境保护, 2005(4): 28-32.
ZHANG Hui, BAI Xiangyu, LI Jing, et al. Study on a new way of shortcut nitrification with intermittent aeration[J]. Environmental Protection of Xinjiang, 2005(4): 28-32. |
| [21] |
KORNAROS M, DOKIANAKIS S N, LYBERATOS G. Partial nitrification/denitrification can be attributed to the slow response of nitrite oxidizing bacteria to periodic anoxic disturbances[J].
Environmental Science & Technology, 2010, 44(19SI): 7245-7253.
|
| [22] |
GUVEN D, DAPENA A, KARTAL B, et al. Propionate oxidation by and methanol inhibition of anaerobic ammonium-oxidizing bacteria[J].
Applied and Environmental Microbiology, 2005, 71(2): 1066-1071.
DOI: 10.1128/AEM.71.2.1066-1071.2005 |
| [23] |
NI B, JOSS A, YUAN Z. Modeling nitrogen removal with partial nitritation and anammox in one floc-based sequencing batch reactor[J].
Water Research, 2014, 67: 321-329.
DOI: 10.1016/j.watres.2014.09.028 |
| [24] |
CARLUCCI A F, MCNALLY P M. Nitrification by marine bacteria in low concentration of substrate and oxygren1[J].
Limnology and Oceanography, 1969, 14(5): 736-739.
DOI: 10.4319/lo.1969.14.5.0736 |
| [25] |
蒋轶锋, 陈浚, 王宝贞, 等. 间歇曝气对硝化菌生长动力学影响及NO2-积累机制[J].
环境科学, 2009(1): 85-90.
JIANG Yifeng, CHEN Jun, WANG Baozhen, et al. Effect of intermittent aeration on growth kinetics of nitrifiers and mechanism for NO2-accumulation[J]. Environmental Science, 2009(1): 85-90. |
 2017, Vol. 49
2017, Vol. 49


