“十三五”以来,氮氧化物排放标准日趋严格,燃煤机组超低排放提上日程,要求到2020年全部燃煤机组氮氧化物排放控制在50 mg/m3以内[1].工业上常用低氮燃烧(LNB)、选择性催化还原(SCR)、选择性非催化还原法(SNCR)等技术[2]控制氮氧化物排放,要达到上述排放标准,特别是在负荷变化时依靠单一的控制措施难以保证稳定达标.烟气低温氧化脱硝工艺因其不影响燃烧和工质换热过程而受到关注.目前,已有的NO氧化方法主要有等离子法[3]、臭氧法[4]、半导体光催化法[5]等,这些方法获取氧化活性物质的成本过高,KMnO4溶液[6]、NaClO2溶液[7]等也常作为NO脱除过程中的氧化剂,但产物中却存在MnO4-、MnO42-、ClO2-等离子,会带来废液二次污染问题.双氧水氧化后产物为O2,且过剩双氧水可采用CAT等方式处理[8],具有绿色价廉的优势,已被应用于NO氧化领域[9],能否进一步强化芬顿试剂低温条件下氧化NO的能力是本研究关注的重点.
微波是化工过程中常用的一种加热方式,通过热效应和敏化效应,可大幅提高反应速率[10].活性炭本身孔隙结构发达、吸附能力强,在微波辐射下孔隙内可产生“热点”[11-12],采用活性炭作为微波场中的吸波介质在污水处理领域得到广泛应用[13].
本文在液相体系中,温度23~65 ℃,考察了连续施加微波对芬顿试剂/活性炭氧化NO的强化效果,探讨了影响芬顿试剂/活性炭体系微波催化氧化NO的因素.
1 实验材料和方法 1.1 材料质量分数30% H2O2、果壳基活性炭粉(109~120 mm)、变色硅胶,AR级,天津市天力化学试剂有限公司;氢氧化钠、硫酸亚铁,AR级,天津市福晨化学试剂厂;盐酸(质量分数37%),GR级,北京化工厂;高纯氮气(体积分数99.99%),哈尔滨黎明气体有限公司;一氧化氮(体积分数1%),大连大特气体有限公司;实验用水为自制去离子水.活性炭粉物性参数见表 1.
| 表 1 活性炭粉物性参数 Table 1 Physical parameters of powder AC |
UWave-2000型微波多功能工作站,上海新仪微波化学科技有限公司,主要参数:可调微波功率0~1 000 W,内置磁力搅拌0~800 r/min,红外测温0~900 ℃;OPTIMA7型烟气分析仪,德国MRU公司;TGA/SDTA851热重分析仪,瑞士METTLER TOLEDO公司;VARIO MACRO CUBE型元素分析仪,德国Elementar公司;AUTOPORE 9500型压汞仪,美国Micrometics公司;FLIR A615型红外热像仪,美国FLIR公司.
1.3 实验装置及方法在带微波加热功能的气液反应系统中进行实验、流程见图 1.系统主要由配气系统、三颈石英反应器、微波工作站、MRU测试系统、洗气装置等构成.
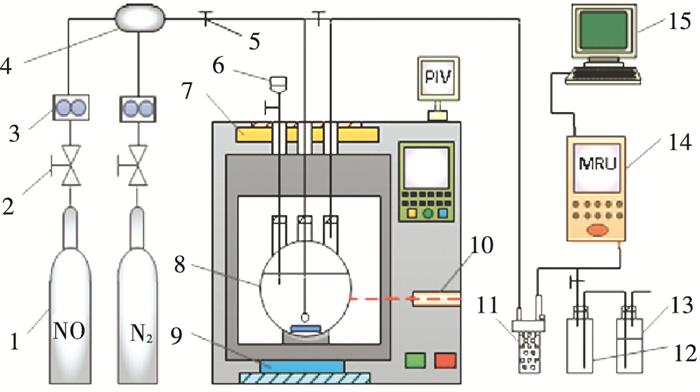
|
1—气瓶; 2—减压阀; 3—流量计; 4—混气罐; 5—阀门; 6—鼓泡反应器; 7—微波发生器; 8—石英反应器; 9—磁力搅拌仪; 10—红外测温; 11—干燥瓶; 12—安全瓶; 13—洗气瓶; 14—气体分析仪; 15—计算机 图 1 实验流程图 Figure 1 Flow chart of the experimental process |
本研究在UWave-2000型微波多功能工作站上进行,采用NO+N2模拟烟气,气体流量控制在1.5 L/min,NO初始体积分数为200 ×10-6,鼓泡器淹深为8.5 cm,反应液体积控制为800 mL,实验前配制750 mL不同浓度过氧化氢溶液、35 mL硫酸亚铁溶液(活性炭混合进硫酸亚铁溶液携带加入)及15 mL去离子水.硫酸亚铁溶液置于下层漏斗,去离子水置于上层漏斗.实验调试期观察到溶液添加过程中存在挂壁现象,自行设计双层加液漏斗,用上层去离子水再次冲刷壁面残余液,可有效解决溶液的挂壁问题,减小实验误差.实验条件见表 2.
| 表 2 实验条件 Table 2 Experimental conditions |
常温无催化剂条件下,H2O2不会和NO反应[14],NO的提前通入不会造成初始H2O2浓度的降低,可先将混合气通入溶液至浓度稳定,通过控制催化剂的添加、微波的开启来控制反应的开始.实验前先向四口反应瓶中加入H2O2溶液,控制烟气经鼓泡器后通入H2O2溶液中,尾部采用烟气分析仪测量烟气成分,待检测到体系内无残余O2且NO浓度稳定在设定值2 min后,开始连续施加微波(本次研究中微波均为连续施加,保持功率不变), 加入催化剂,反应开始.烟气经干燥瓶后测量NO浓度及O2浓度.
NO氧化产物为NO2,芬顿试剂在产生活性成分过程中会产生大量O2,在此实验中氧气与氧化产物NO2的摩尔比高达1000:1,氧气过量条件下NO2会发生水解反应:
| $ {\rm{4N}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O + 2}}{{\rm{O}}_{\rm{2}}} = {\rm{4HN}}{{\rm{O}}_{\rm{3}}} $ |
全部转化成NO3-,尾部烟气经MRU检测确未发现有NO2,本次研究中脱硝效率可由NO的脱除量反映.考虑到新生成的O2对总气量的稀释,对反应后NO浓度进行折算,NO脱除效率为
| $ {\eta _{{\rm{NO}}}} = \frac{{C_{{\rm{in}}}^{{\rm{NO}}} - C_{{\rm{out}}}^{{\rm{NO}}} \cdot 100/(100 - C_{{\rm{out}}}^{{{\rm{O}}_{\rm{2}}}})}}{{C_{{\rm{in}}}^{{\rm{NO}}}}}. $ |
式中:CinNO为反应前NO体积分数,×10-6;CoutNO为开启微波、加入催化剂后NO体积分数,×10-6;CoutO2为开启微波、加入催化剂后O2体积分数;%.
2 实验结果与讨论 2.1 添加AC、施加微波对NO脱除效率的影响芬顿试剂体系中主要有·OH、HO2·、O2-等物质,已有文献证明·OH、HO2·是氧化NO过程中的主要活性物质[15],芬顿体系主要是通过反应式(1)、反应式(2)产生这两种自由基:
| $ {\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}} + \cdot {\rm{OH + O}}{{\rm{H}}^ - }, $ | (1) |
| $ {\rm{F}}{{\rm{e}}^{3 + }} + {{\rm{H}}_{\rm{2}}}{{\rm{O}}_2} \to {\rm{F}}{{\rm{e}}^{2 + }} + {\rm{H}}{{\rm{O}}_2} \cdot + {{\rm{H}}^ + }. $ | (2) |
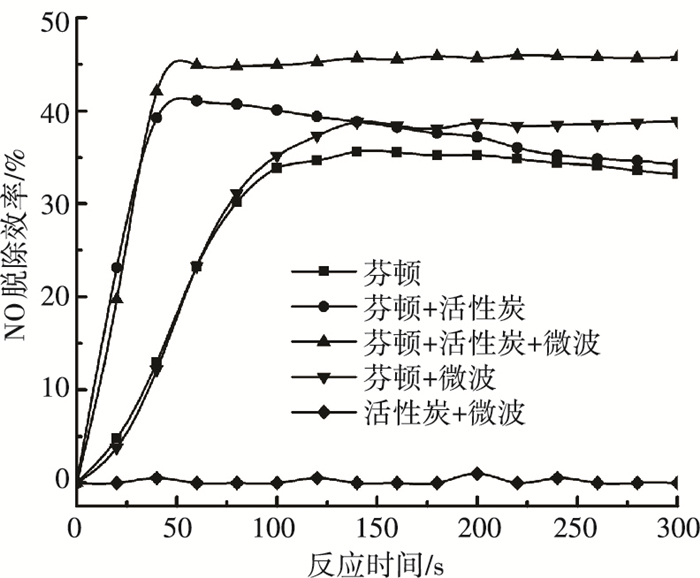
为考察添加AC和施加微波对Fenton体系氧化能力的影响,在pH=3,[Fe2+]0=5 mmol/L,[H2O2]0=0.3 mol/L条件下,通过调节是否添加4 g AC、是否施加400 W微波形成4组对照实验,实验结果见图 2.
|
图 2 添加AC、施加微波对NO脱除效率的影响 Figure 2 Effect of adding AC and microwave to reagent on NO removal efficiency |
由图 2可知,Fenton试剂结合微波NO脱除率稳定后可达到38.8%,高于单独使用Fenton试剂时的34.4%;Fenton试剂添加AC,前期NO脱除率高于单独使用Fenton试剂,可达41.1%,而后逐渐下降直至跟Fenton组持平;Fenton试剂添加AC结合微波的脱除率稳定后可达到46.3%,高于其它3组;空白组AC施加微波并无脱硝效果.这说明AC的添加和微波施加均可提高芬顿试剂氧化能力.
淹深是直接影响气液接触时间的因素,是NO脱除效率的重要影响因素.本次研究受限于微波工作站的尺寸,鼓泡器淹深仅8.5 cm,造成脱硝效率总体偏低.但参照相关文献,圆柱型反应器相同工况下淹深为12 cm时,NO的脱除效率仅为35.1% [16],而采用微波强化方式在淹深为8.5 cm时NO脱除效率即可达到46%,可见微波及AC的添加强化NO的氧化效果显著.
添加AC、持续施加微波可提高NO脱除效率,原因推测有:1)微波具有热效应,Fenton试剂的最佳反应温度为60 ℃[17],反应液经400 W微波加热5 min温度可升高至52 ℃,温度的提高有利于Fenton反应的进行.同时AC的相对介电常数在25~30,自身就可作为微波吸波介质,AC的添加会进一步提高液相体系的温度;2)微波具有敏化效应[18],可使部分NO达到活化状态,有利于氧化反应的进行;3)AC吸附能力强,比表面积大,增加了气液反应接触机会,进一步提高脱除效率. Fenton添加AC组前期脱除率高,而后趋于Fenton空白组也是由于AC的吸附作用,吸附位的饱和造成了脱除率的下降.
为考察AC的添加对液相体系升温速率的影响,需要测量液相升温曲线,但考虑到实际反应中存在微波辐射不可采用热电偶测温,而采用红外热像仪却只可监测液面温度,难以反应整个液相体系温度变化,因此单独设计模化试验.为去除温度梯度,以薄层静止流体作为加热对象.具体方案为:采用一直径50 mm石英圆底坩埚作为容器,添加3 g水,在石英坩埚底部恰好形成一薄层流体,400 W微波、控制是否添加0.4 g AC来模拟实际过程,过程采用红外热像仪测温,升温曲线见图 3.由图 3可知,AC添加后溶液升温速率明显高于未添加AC组,证实了微波场中AC的添加有利于提高升温速率,结合图 2,添加AC,液相升温速率升高,NO脱除效率显著上升,证实了微波的热效应有利于提高NO脱除率.

|
图 3 添加AC对液相温度的影响 Figure 3 Effect of AC dose on liquid-phase temperature |
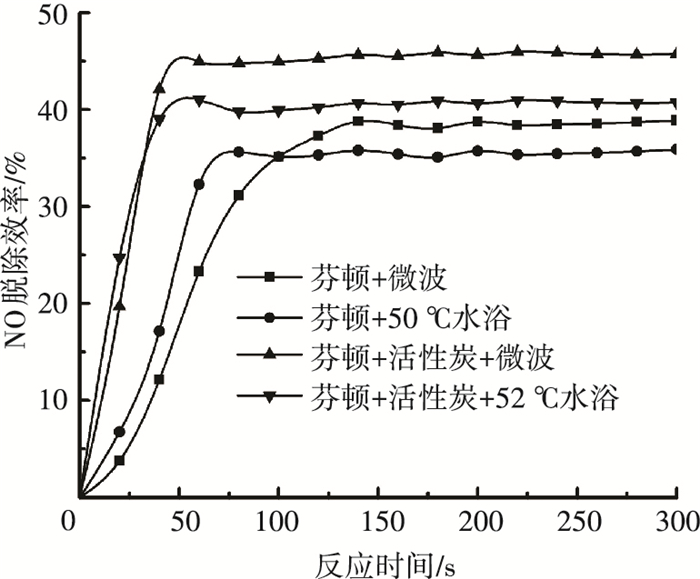
为进一步证实微波敏化效应的存在,采用水浴加热和微波加热进行对照.微波加热后经温度计测温,在pH=3,[Fe2+]0=5 mmol/L,[H2O2]0=0.3 mol/L,mAC=4 g,800 mL溶液条件下,微波加热300 s后温度为52 ℃,而未添加AC相同工况时,微波加热300 s后温度为50 ℃,设计52 ℃水浴和50 ℃水浴,分别在52、50 ℃水浴中进行添加AC和不添加AC相同工况下实验,实验结果见图 4.
|
图 4 微波加热和水浴加热对NO脱除效率的影响 Figure 4 Effect of microwave heating and water bath heating to reagent on NO removal efficiency |
由图 4可知,添加AC和未添加AC情况下,稳定后水浴温度和微波加热温度相同时,微波加热NO脱除效率都要强于水浴加热,说明微波加热不仅有热效应能够提高反应速率,还存在敏化效应.与文献[19-20]得出的结果(微波辐射条件下,确可通过“热点”效应[19]及降低反应活化能[20],加快反应速率从而提高NO脱除效率)相同.
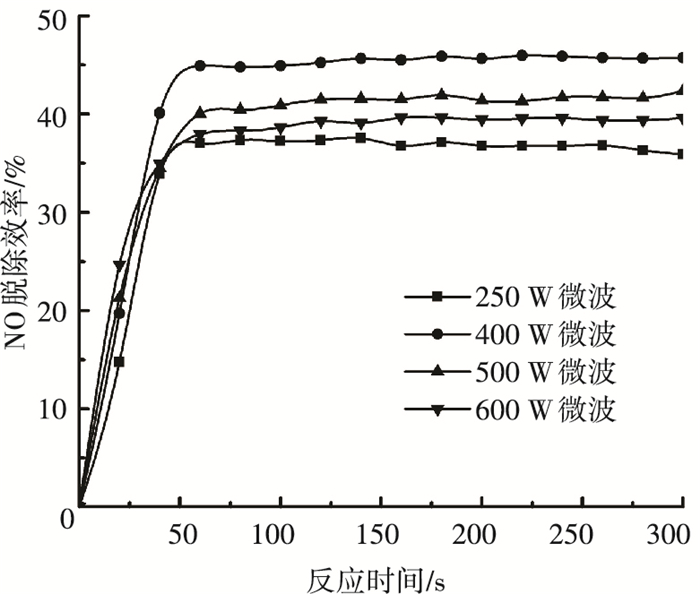
2.2 微波功率对NO脱除效率的影响保持pH=3,mAC=4 g,[Fe2+]0=5 mmol/L,[H2O2]0=0.3 mol/L不变,调节微波功率分别至250、400、500和600 W,实验结果见图 5.
|
图 5 微波功率对NO脱除效率的影响 Figure 5 Effect of microwave power on NO removal efficiency |
由图 5可知,微波功率从250 W增加至400 W时,NO脱除率得到大幅提高,NO脱除率稳定后可达46.3%;继续增加微波功率,NO脱除率随着微波功率的增加而下降.这说明适当功率的微波有利于提高NO的脱除率,但过高的微波功率不利于NO的脱除.温度的适当提高有利于加快反应速率,但微波功率过高时,液相体系升温过快,造成H2O2快速分解和挥发,不利于Fenton试剂中·OH的产生,同时高微波功率也带来能耗浪费,阻碍了NO氧化过程.综合考虑,实验最佳微波功率确定为400 W.
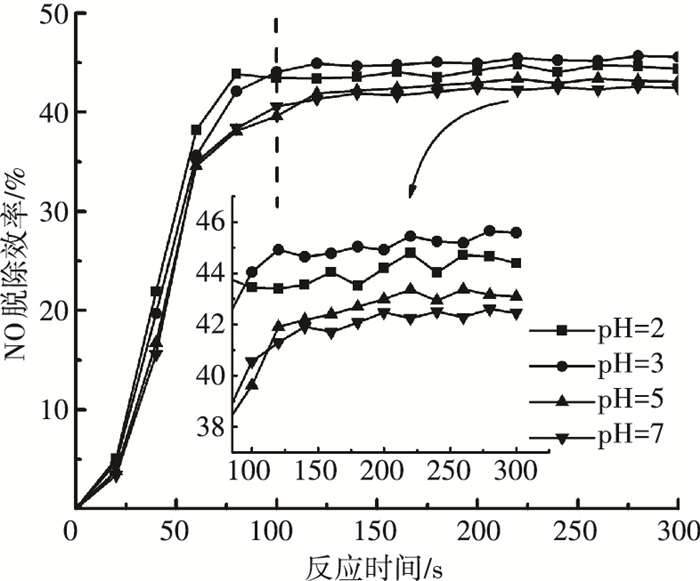
2.3 初始pH值对NO脱除效率的影响保持微波功率400 W,mAC=4 g,[Fe2+]0=5 mmol/L,[H2O2]0=0.3 mol/L不变,调节pH分别至2、3、5和7,实验结果见图 6.
|
图 6 pH值对NO脱除效率的影响 Figure 6 Effect of initial pH value on NO removal efficiency |
稳定后NO脱除率可达到46.3%. Fenton反应最佳pH在3左右[21],添加AC、施加微波之后不改变Fenton试剂的这一特性. pH过低,H+浓度高会导致反应
| $ {\rm{F}}{{\rm{e}}^{2 + }} + 2{{\rm{H}}_{\rm{2}}}0 \to {\rm{Fe}}{({\rm{OH}})_2} + 2{{\rm{H}}^ + }. $ |
难以进行,影响Fe3+向Fe2+的转化;pH过高,Fe2+会由于水解反应生成絮状胶体,起催化作用的Fe2+减少,导致NO脱除率下降.
但在微波加热、添加AC条件下,pH对NO脱除效率影响较小,可认为微波加热加宽了最适pH范围,降低了pH对Fenton试剂氧化能力的影响.
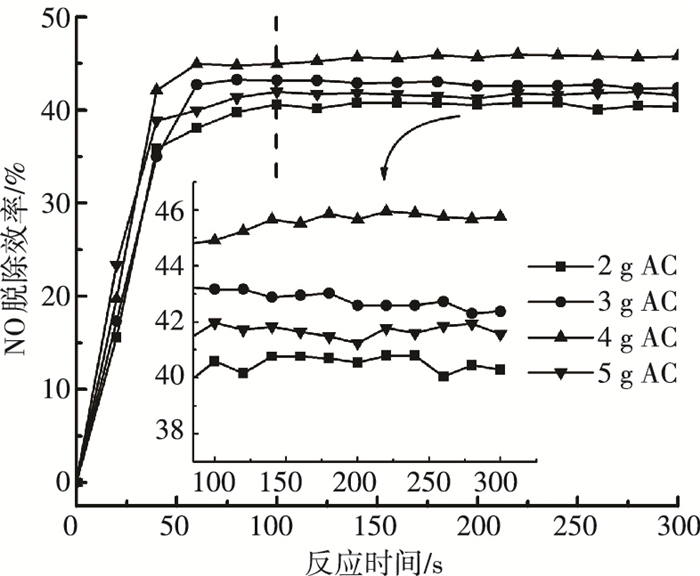
2.4 AC添加量对NO脱除效率的影响为探讨AC对NO脱除效率的影响,保持微波功率为400 W,pH=3,[Fe2+]0=5 mmol/L,[H2O2]0=0.3 mol/L不变,mAC分别为2、3、4和5 g,实验结果见图 7.
|
图 7 AC添加量对NO脱除效率的影响 Figure 7 Effect of AC dose on NO removal efficiency |
由图 7可知,AC添加量在2~4 g范围内升高时,NO脱除率提高; AC添加量为4 g时, NO脱除率最大,稳定后可达到46.3%;但AC添加量增加到5 g时,NO脱除率出现明显下降.说明AC的适当增加能够提高NO脱除率,但过量AC却会降低NO脱除效果.这是因为AC在2~4 g范围内的增加, 能够提高对微波的吸收,促进反应进行; 但AC本身能够催化过氧化氢的分解[22],过多的AC会催化分解H2O2,与Fe2+形成竞争,抑制芬顿反应的进行,抑制作用大于促进作用,此时NO脱除效率出现下降.综合考虑最佳AC添加量确定为4 g.
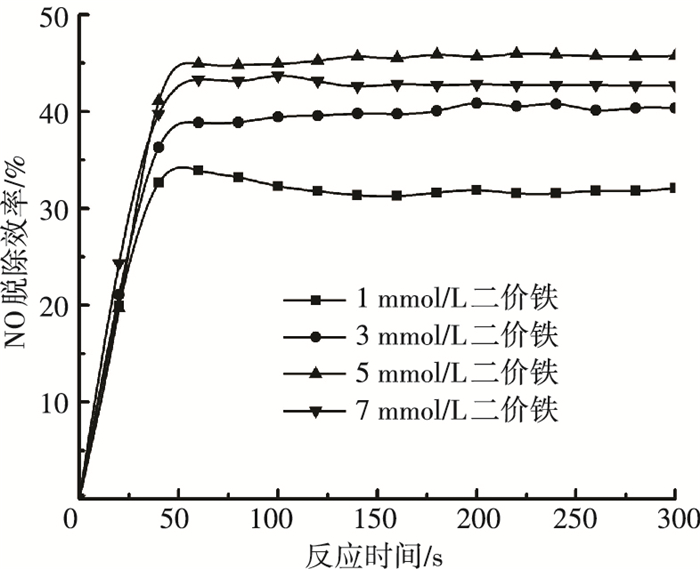
2.5 Fe2+初始浓度对NO脱除效率的影响H2O2和Fe2+作为Fenton试剂的主体,是影响体系氧化能力的重要因素.为探讨[Fe2+]0对NO脱除效率的影响,保持微波功率为400 W, pH=3, mAC=4 g,[H2O2]0=0.3 mol/L,控制[Fe2+]0分别为1、3、5、7 mmol/L,实验结果见图 8.
|
图 8 Fe2+初始浓度对NO脱除效率的影响 Figure 8 Effect of Fe2+ initial concentration on NO removal efficiency |
由图 8可知,[Fe2+]0为1~5 mmol/L时,NO脱除效率随着[Fe2+]0的提高而增加,Fe2+初始浓度为5 mmol/L时稳定后NO脱除率最大,达到46.3%;但[Fe2+]0达到7 mmol/L时,NO脱除效率出现下降.这是因为当体系Fe2+初始浓度过低时,催化反应式(1)、(2)受到限制,·OH产生量小,NO脱除效率低;而Fe2+初始浓度过高时,·OH和HO2·产生过多,会发生反应式(3)~(5)的自由基反应[23]:
| $ 4 \cdot {\rm{OH}} \to 2{{\rm{H}}_{\rm{2}}}{\rm{O}} + {{\rm{O}}_2}, $ | (3) |
| $ \cdot {\rm{OH}} + {\rm{H}}{{\rm{O}}_2} \cdot \to {{\rm{H}}_{\rm{2}}}{\rm{O}} + {{\rm{O}}_2}, $ | (4) |
| $ 2{\rm{H}}{{\rm{O}}_2} \cdot \to {{\rm{H}}_{\rm{2}}}{{\rm{O}}_2} + {{\rm{O}}_2}. $ | (5) |
·OH和HO2·互相消耗,减弱了体系的氧化能力.同时Fe2+自身可以通过反应式:
| $ {\rm{F}}{{\rm{e}}^{2 + }} + \cdot {\rm{OH}} \to {\rm{F}}{{\rm{e}}^{3 + }} + {\rm{O}}{{\rm{H}}^ - } $ |
捕获·OH自由基[24],进一步减少了活性成分,导致NO脱除率降低.
综上所述,实验最佳Fe2+初始浓度确定为5 mmol/L,此时[Fe2+]0与[H2O2]0比值为1:60.
2.6 H2O2初始浓度对NO脱除效率的影响保持微波功率为400 W,pH=3,mAC=4 g,[Fe2+]0=5 mmol/L不变,[H2O2]0分别为0.1、0.2、0.3、0.4 mol/L,实验结果见图 9.

|
图 9 H2O2初始浓度对NO脱除效率的影响 Figure 9 Effect of H2O2 initial concentration on NO removal efficiency |
由图 9可知,[H2O2]0<0.3 mol/L时,随着H2O2浓度的增加,NO脱除效率显著提高,[H2O2]0为0.3 mol/L时NO脱除率最大,稳定后可达到46.3%;继续增加到0.4 mol/L时,NO脱除效率轻微下降.这是因为H2O2作为氧化剂主体,对NO脱除效率影响大,Fe2+初始浓度不变,随着H2O2浓度的提高,加快催化反应速率,·OH产生量增加,有利于NO的氧化;在达到最佳H2O2与Fe2+配比后,继续提高H2O2浓度会导致H2O2过量,过量的H2O2会通过反应
| $ {{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} + \cdot {\rm{OH}} \to {\rm{H}}{{\rm{O}}_2} \cdot + {{\rm{H}}_{\rm{2}}}{\rm{O}}, $ |
与·OH发生反应[25],消耗部分·OH.实验最佳Fe2+初始浓度确定为0.3 mmol/L.
3 结论1) Fenton试剂添加AC结合微波的NO脱除率最高,高于其它3组,说明活性炭的添加和微波的施加促进了芬顿反应的进行,有利于NO氧化;
2) 微波能够提高NO脱除效率是微波热效应和敏化效应共同作用的结果;
3) 在芬顿试剂/活性炭耦合微波催化氧化NO的过程中,微波功率、pH值、AC添加量、Fe2+初始浓度、H2O2初始浓度是影响NO脱除效率的重要因素.实验得出的最佳反应工况为:微波功率400 W,pH=3,mAC=4 g,[Fe2+]0=5 mmol/L,[H2O2]0=0.3 mol/L,此时NO脱除效率可达到46.3%.
| [1] |
吴智鹏, 毛弈升. 火电厂超低排放脱硝控制策略优化研究与实践[J].
锅炉制造, 2016(3): 1-4.
WU Zhipeng, MAO Yisheng. Research and practice on DeNOx control strategy of ultra low emission in thermal power plant[J]. Boiler manufacturing, 2016(3): 1-4. |
| [2] |
郝吉明, 马广大, 王书肖.
大气污染控制工程[M]. 北京: 高等教育出版社, 2013: 404-411.
HAO Jiming, MA Guangda, WANG Shuxiao. Air pollution control project[M]. Beijing: Higher education press, 2013: 404-411. |
| [3] |
WANG T, SUN B, XIAO H. Effects of gas temperature on NOx removal by dielectric barrier Discharge[J].
Environmental Technology, 2013, 34(19): 2709-2716.
DOI: 10.1080/09593330.2013.786138 |
| [4] |
MOK Y S, LEE H J. Removal of sulfur dioxide and nitrogen oxides by using ozone injection and absorption-reduction technique[J].
Fuel Processing Technology, 2006, 87(7): 591-597.
DOI: 10.1016/j.fuproc.2005.10.007 |
| [5] |
IBUSUKI T, TAKEUEHI K. Removal of Low Concentration of nitrogen oxides through photo assisted heterogeneous catalysis[J].
Journal of Molecular Catalysis, 1994, 88(1): 93-102.
DOI: 10.1016/0304-5102(93)E0247-E |
| [6] |
BRORGEN C, KARLSSON H T, BJERLE I. Absorption of NO in an alkaline solution of KMnO4[J].
Chemical Engineering & Techno-logy, 1997, 20(6): 396-402.
DOI: 10.1002/ceat.270200607 |
| [7] |
CHIEN T W, CHU H, HSUEH H T. Kinetic Study on Absorption of SO2 and NOx with Acidic NaClO2 solutions using the spraying column[J].
Journal of Environmental Engineering, 2003, 129(11): 967-974.
DOI: 10.1061/(ASCE)0733-9372(2003)129:11(967) |
| [8] |
LOEW O. A new enzyme of general occurrence in organisms[J].
Science, 1900, 11(279): 701-702.
DOI: 10.1126/science.11.279.701 |
| [9] |
GUO R T, PAN W G, ZHANG X B, et al. Removal of NO by using Fenton reagent solution in a lab-scale bubbling reactor[J].
Fuel, 2011, 90(11): 3295-3298.
DOI: 10.1016/j.fuel.2011.06.030 |
| [10] |
孙宏伟, 陈建峰. 我国化工过程强化技术理论与应用研究进展[J].
化工进展, 2011, 30(1): 1-15.
SUN Hongwei, CHEN Jianfeng. Advances in fundamental study and application of chemical process intensification technology in China[J]. Chemical industry and engineering progress, 2011, 30(1): 1-15. |
| [11] |
刘龙, 赵浩, 徐炎华. 微波-H202-活性炭协同催化氧化处理苯酚废水[J].
南京工业大学学报, 2010, 32(1): 46-50.
LIU Long, ZHAO Hao, XU Yanhua. Synergetic oxidation of microwave and H2O2-activated carbon on phenol waste water[J]. Journal of Nanjing University of Technology, 2010, 32(1): 46-50. DOI: 10.3969/j.issn.1671-7627.2010.01.010 |
| [12] |
张国宇, 王鹏, 姜思朋, 等. 微波诱导氧化处理雅格素红BF-3B150%染料废水的研究[J].
环境科学, 2004, 25(S): 52-55.
ZANG Guoyu, WANG Peng, JIANG Sipeng, et al. Treatment of ARGAZOL BF-3B 150% by microwave induced oxidation process[J]. Environmental Science, 2004, 25(S): 52-55. DOI: 10.13227/j.hjkx.2004.s1.011 |
| [13] |
王杰, 马溪平, 唐凤德, 等. 微波催化氧化法预处理垃圾渗滤液的研究[J].
中国环境科学, 2011, 31(7): 1166-1170.
WANG Jie, MA Xiping, TANG Fengde, et al. Study on pretreatment of landfill leachate by microwave-assisted catalytic oxidation process[J]. China Environmental Science, 2011, 31(7): 1166-1170. |
| [14] |
赵海谦, 高继慧, 周伟, 等. Fe2+/H2O2体系内各种自由基在氧化NO中的作用[J].
化工学报, 2015, 66(1): 449-454.
ZHAO Haiqian, GAO Jihui, ZHOU Wei, et al. Roles of varied radicals in NO oxidation by Fe2+/H2O2 system.[J]. CIESC Journal, 2015, 66(1): 449-454. DOI: 10.11949/j.issn.0438-1157.20140976 |
| [15] |
JOSEPH D L, GALLARD H. Catalytic decomposition of hydrogen peroxide by Fe(Ⅲ) in homogeneous aqueous solution: Mechanism and kinetic modeling[J].
Environmental Science & Technology, 1999, 33(16): 2726-2732.
DOI: 10.1021/es981171v |
| [16] |
赵海谦. H2O2定向分解及NO氧化促进机制与方法研究[D]. 哈尔滨: 哈尔滨工业大学, 2015.
ZHAO Haiqian. Studies on promotion mechanism and methods of H2O2 directional decomposition and NO oxidation[D]. Harbin: Harbin Institute of Technology, 2015. |
| [17] |
杨柳, 王洪升, 廖伟平. H2O2同时脱硫脱硝的试验研究[J].
动力工程学报, 2011, 31(9): 689-692.
YANG Liu, WANG Hongsheng, LIAO Weiping. Simultaneous desulfurization and denitrification from flue gas of power plant by H2O2[J]. Journal of Chinese society of power engineering, 2011, 31(9): 689-692. |
| [18] |
RIVAS F J, BELTRAN F J. Oxidation of p-hydroxybenzoic acid by Fenton's reagent[J].
Water Research., 2001, 35(2): 386-397.
DOI: 10.1016/S0043-1354(00)00285-2 |
| [19] |
KIM J, SUEL K, DONG S, et al. Characteristic of microwave-induced NO decomposition on anthracite bed[J].
Fuel Science & Technology International, 1993, 11(9): 1175-1183.
DOI: 10.1016/S0926-3373(01)00171-0 |
| [20] |
ZHANG X L, HAYWARD D O, LEE C, et al. Microwaveassisted catalytic reduction of sulfur dioxide with methane over MoS2 Catalysts[J].
Applied Catalysis B: Environment, 2001, 33(2): 137-148.
DOI: 10.1016/S0926-3373(01)00171-0 |
| [21] |
ZHAO Y, WEN X, GUO T, et al. Desulfurization and denitrogenation from flue gas using Fenton reagent[J].
Fuel Processing Technology, 2014, 128: 54-60.
DOI: 10.1016/j.fuproc.2014.07.006 |
| [22] |
余谟鑫, 王书文, 黄思思, 等. 活性炭催化过氧化氢氧化脱附其表面吸附的二苯并噻吩[J].
化工学报, 2008, 59(6): 1425-1429.
YU Moxin, WANG Shuwen, HUANG Sisi, et al. Oxidative removal of dibenzothiophene by hydrogen peroxide catalyzed by activated carbon[J]. CIESC Journal, 2008, 59(6): 1425-1429. |
| [23] |
WALLING C. Fenton's reagent revisited[J].
Accounts of Chemical Research, 1975, 8(4): 125-131.
DOI: 10.1021/ar50088a003 |
| [24] |
程丽华, 黄君礼, 倪福祥. Fenton试剂生成·OH的动力学研究[J].
环境污染治理技术与设备, 2003, 4(5): 12-14.
CHEN Lihua, HUANG Junli, NI Fuxiang. Generation kinetics of hydroxyl radicals by Fenton's reagent[J]. Techniques and Equipment for Environmental Pollution Control, 2003, 4(5): 12-14. |
| [25] |
PIGNATELLO J J. Dark and photoassisted Fe3+-catalyzed degradation of chlorophenoxy herbicides by hydrogen peroxide[J].
Environmental Science & Technology, 1992, 26(5): 944-951.
DOI: 10.1021/es00029a012 |
 2018, Vol. 50
2018, Vol. 50


