气候变暖问题已越来越受到全球的关注,CO2被认为是温室效应最大的贡献者[1]. 2011年,我国CO2年排放量为93.6×108t,占全球总排放量的27.5%[2].以化石燃料为主的火电厂排放量占CO2总排放量的30%左右[3].其中燃煤电厂是主要排放源[4]. CO2捕集技术层出不穷[5],现阶段化学吸收法更适用于低压烟气分离[6].氨法吸收作为CO2化学吸收法的一种,因其具有担载能力强,不易氧化降解,再生能耗低,有望实现酸性气体的联合脱除等显著优势[7],近年来受到广泛关注.现阶段氨水吸收剂也存在吸收速率慢,易挥发,再生能耗较高等诸多问题. Wang等[8]研究表明,氨水吸收CO2生成氨基甲酸的反应速率常数比相应的MEA(monoethanolamine,一乙醇氨)的反应速率常数要低一个数量级[9]. Resnik等[10]研究发现,质量分数为14%的氨水总氨损失量可高达43.1%,且随再生温度的升高而进一步增大.王淑娟等[11]对300 MW燃煤电厂再生氨法脱碳系统的模拟结果表明,其初投资约占到电厂总投资的32.1%,相当于电厂输出电量的16%左右. Yeh等[12]认为,现阶段氨法再生脱碳工艺尚未达到“高效脱除”与“低损失循环”要求,主要是吸收效率及吸收剂担载能力没有达到标准.
为解决以上问题,本文提出混合吸收剂氨法捕碳新工艺[13],基本思路为:将溶析剂与氨水吸收剂按一定比例混合得到混合吸收剂,使碳化液在碳化度仅为0.42低碳化度条件下结晶,采用乙醇作为溶析剂.工艺过程如下:在吸收塔进行CO2的吸收过程,当混合吸收剂碳化度达到0.42时开始产生结晶,将浆液通入到固液分离器内进行固液分离,以晶体再生代替富液再生,大大降低再生过程能耗;由于混合吸收液在碳化度为0.42时即产生结晶,进行再生循环,因此可保证吸收塔内吸收液具有较高吸收速度;由于再生过程采用的是晶体再生代替富液再生,可忽略吸收液中溶剂水的含量对再生过程的影响,可以选用浓度较低的氨水作为吸收剂,降低氨逃逸的量.
1 实验 1.1 实验系统混合吸收剂氨法捕碳新工艺再生实验系统见图 1.鼓泡反应器主体为250 mL洗气瓶,配气装置提供N2与CO2为一定配比的模拟烟气,通入恒温水浴中的反应器,然后依次经两次水洗、冷凝器和CaCl2干燥器等后处理装置,最后由CO2分析仪测量出口处CO2浓度,并由电脑记录实时数据.反应前的CO2浓度由旁路测得,反应后产生的晶体可在去离子水溶解后,由自动滴定仪进行滴定分析.
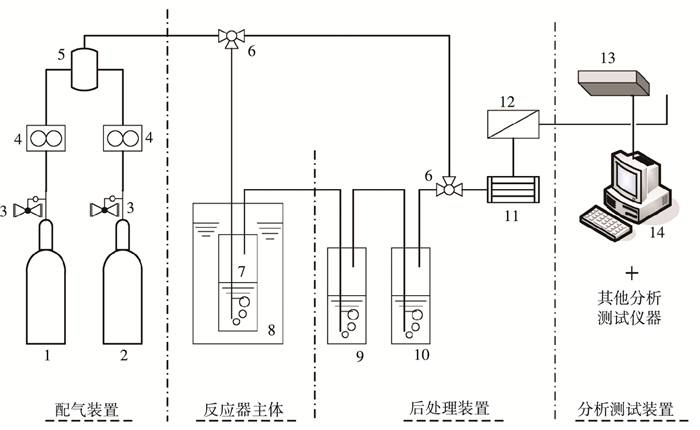
|
1—N2气瓶;2—CO2气瓶;3—减压阀;4—流量计;5—混气罐;6—三通;7—反应器;8—水浴装置;9—一次水洗瓶;10—二次水洗瓶;11—冷凝器;12—CaCl2干燥器;13—CO2分析仪;14—计算机 图 1 实验系统 Figure 1 Experiment system |
用Mettler TOLEDO TGA SDTA 8510热重仪对不同工况下产生的晶体产物采用等温升温法以及恒温热解法进行实验.将一定质量的干燥晶体产物置于坩埚中, 使之从环境温度以3种升温速率5、10及15 K/min加热至设定温度,并在恒温为60、80以及100 ℃条件下,以热天平同时记录晶体粉末质量随温度的变化.
1.2.2 动力学分析方法非等温动力学热分解研究是十分复杂的,而有用的动力学参数包括速率常数、活化能、反应级数等可通过分析热重数据得到.这些动力学参数通常采用样品失重的动力学模型来计算. Coats等[14]研究了等升温速率热重数据的动力学,固体产物的热分解动力学方程如下:
| $ {\rm{d}}\alpha /{\rm{d}}t = kf\left( \alpha \right). $ |
式中:
| $ \alpha = ({m_0} - m)/({m_0} - {m_{\rm{f}}}), $ | (1) |
| $ k = A \times {\rm{exp}}\left( { - E/RT} \right), $ | (2) |
| $ \beta = {\rm{d}}T/{\rm{d}}t. $ | (3) |
由式(1)~(3)可得
| $ g\left( \alpha \right) = \int\limits_0^\alpha {\frac{{{\rm{d}}\alpha }}{{f\left( \alpha \right)}}} = \left( {\frac{A}{\beta }} \right)\int_0^T {{\rm{exp}}\left( { - \frac{E}{{RT}}} \right)} \;{\rm{d}}T, $ |
近似可得[15]
| $ g\left( \alpha \right) = \frac{{AR\;{T^2}}}{{\beta E}}\left( {1 - \frac{{2RT}}{E}} \right){\rm{exp}}\left( { - \frac{E}{{RT}}} \right). $ | (4) |
对式(4)进行整理并给出对数形式:
| $ {\rm{ln}}\left[ {\frac{{g\left( \alpha \right)}}{{{T^2}}}} \right] = {\rm{ln}}\left( {\frac{{AR}}{{\beta E}}} \right)\left( {1 - \frac{{2RT}}{E}} \right) - \frac{E}{{RT}}. $ | (5) |
式中:α为转化率;m0为原始样品质量,mg;m为反应时间为t时样品剩余质量,mg;mf为反应结束时剩余样品质量,mg;k为反应速率常数;A为指前因子;E为活化能,kJ/mol;T为绝对温度,K;R为气体常数,kJ/mol·K;β为升温速率常数;g(α)为速度方程的积分形式.
由式(5)可看出,ln[g(α)/T2]与1/T间呈线性关系,直线的斜率可估测活化能E,通过截距可估算出指前因子.
表 1中为单一扫描速率法中常用的一些模式函数,也是本文动力学计算的备选函数.本文将这些函数分为Mampel幂函数模式、Avrami-Erofeev模式、几何相关模式、扩散模式和反应级数模式5类,分别以首字母M、A、R、D和F进行标记;每类中又根据方程特征数的不同取值分为若干子模式函数,分别以在首字母后附加一个阿拉伯数字的形式进行标记.如编号F2代表反应级数类中的一级反应模式函数.本文对一种工况下产生晶体热重数据分别采用表 1中16种模式函数进行计算,选出最适合本实验晶体产物的模式函数,并对其他工况下晶体产物进行计算.
| 表 1 固相反应动力学中常用的模式函数 Table 1 Common model functions in solid-state reaction kinetics |
温度对于再生过程有十分重要的作用.晶体产物质量及变化率随时间的变化如图 2,3所示.由图 2可见,随着升温速率失重曲线越来越陡,晶体完全分解的时间缩短;由图 3可见,升温速率越大,失重速率越大;晶体产物失重曲线呈单调下降趋势,没有出现拐点以及分段现象,并且不同升温速率条件下曲线的变化趋势相似,与Chen[16]等的研究一致.晶体产物发生如下分解反应:
| $ \begin{array}{c} {\rm{2N}}{{\rm{H}}_{\rm{4}}}{\rm{HC}}{{\rm{O}}_{\rm{3}}} \to {\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{ + C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O,}}\\ {\rm{N}}{{\rm{H}}_{\rm{4}}}{\rm{HC}}{{\rm{O}}_{\rm{3}}} \to {\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{ + C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O,}}\\ {\left( {{\rm{N}}{{\rm{H}}_{\rm{4}}}} \right)_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}\left( {{\rm{aq}}} \right) \to {\rm{2N}}{{\rm{H}}_{\rm{3}}}\left( {{\rm{aq}}} \right){\rm{ + C}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}{\rm{.}} \end{array} $ |
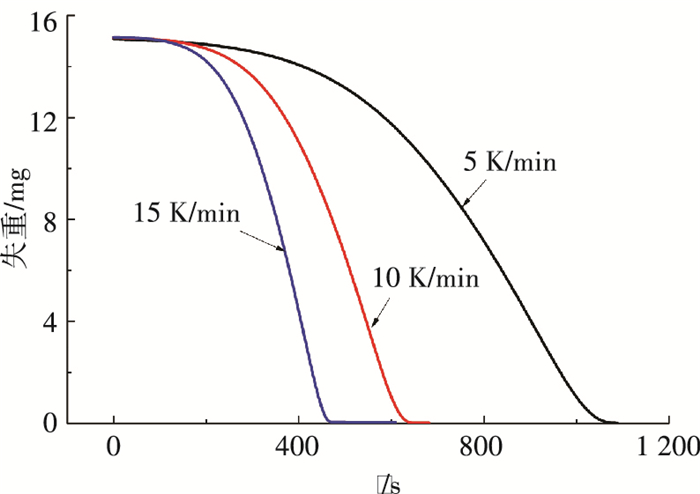
|
图 2 晶体产物质量随时间变化 Figure 2 The mass of crystal product varying with time |
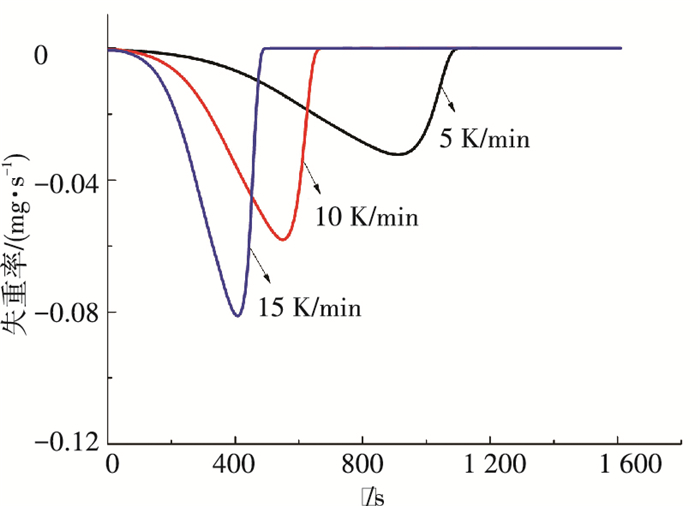
|
图 3 晶体产物质量变化率随时间的变化 Figure 3 The rate of mass loss varying with time |
氨法捕碳工艺的富液再生温度在60 ℃以上才开始分解,并且解析比低于50%[17];而本文工艺的晶体产物再生,常温下产物即开始分解(见图 3),并且转化率可达100%.由不同升温速率下晶体样品热解原始失重数据计算出的全部热解温度区间内的α-T曲线见图 4.在转化率α的计算中,样品的初始和最终质量分别定义为程序温度338 K和400 K时对应的质量.由图 4可见,不同升温速率下晶体样品的α-T曲线随升温过程变化的趋势一致.在温度相同情况下转化率随升温速率增大反而减少,主要原因是升温的起始温度相同,在达到同一温度时升温速率越高则热解时间越短,导致晶体产物热解总量低.
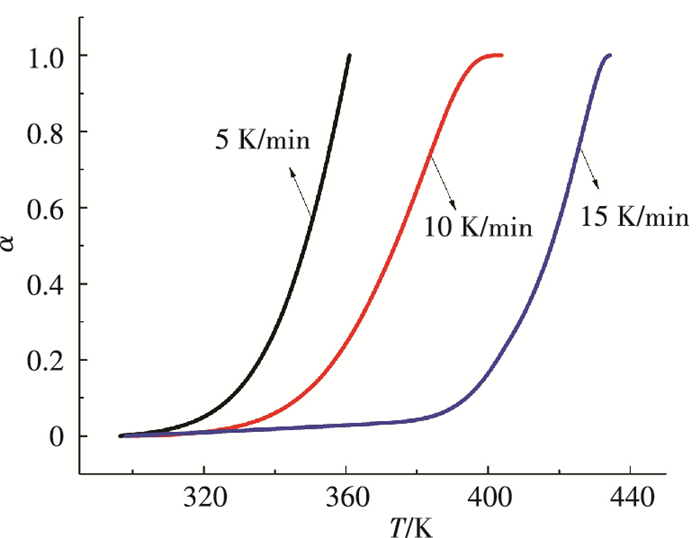
|
图 4 转化率随温度的变化 Figure 4 Percent conversion varying with temperature |
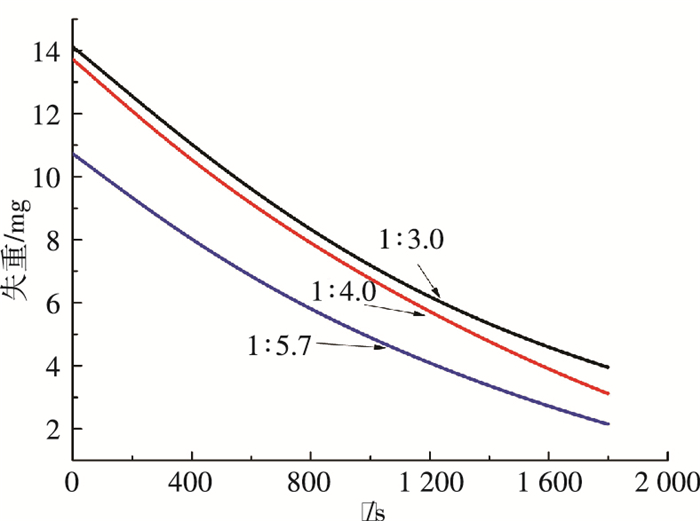
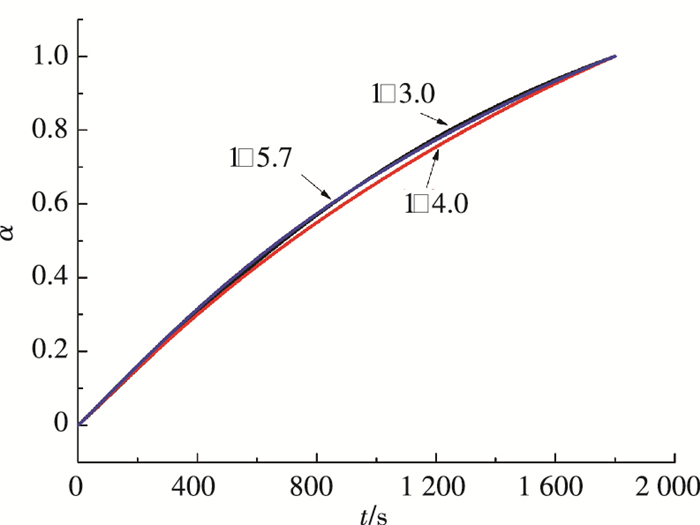
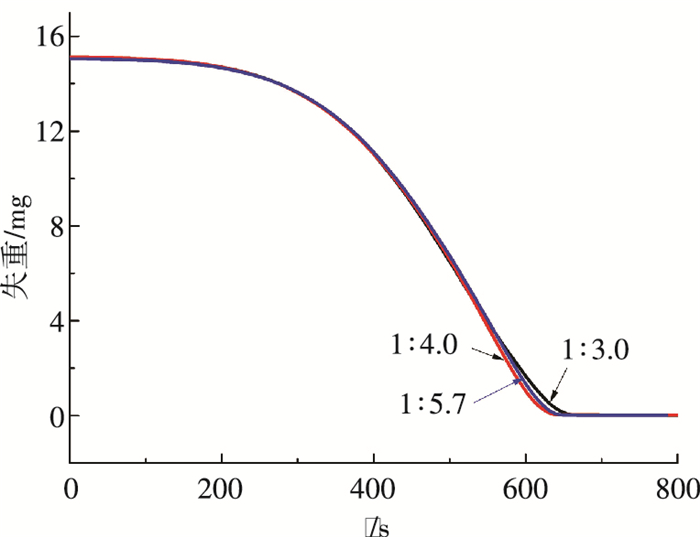
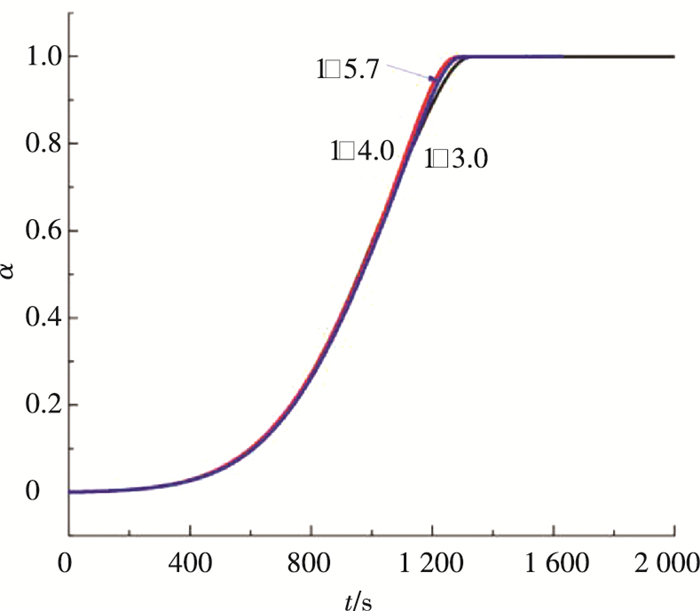
作为添加剂的乙醇添加量是混合吸收剂氨法捕碳新工艺结晶过程的主要影响因素,其影响主要表现在两方面,一是对结晶收率的影响[18],二是对晶体粒径的影响.本研究3种晶体产物产自乙醇氨与水体积比分别为1:3.0、1:4.0以及1:5.7吸收剂组成工况. 图 5、6为60 ℃恒温条件下,晶体的失重曲线以及转化率的变化,可见失重曲线的斜率基本一致,转化率的变化曲线几乎重合. 图 7、8是升温速率为10 K/min条件下的晶体失重曲线以及转化率的变化,3种工况下产生晶体的失重曲线呈相似的单调下降趋势,与熊为淼[19]等的研究结果相似.
|
图 5 60 ℃恒温条件下晶体质量随时间变化 Figure 5 The mass of crystal varying with time under the temperature of 60 ℃ |
|
图 6 转化率随时间的变化 Figure 6 Percent conversion varying with time |
|
图 7 升温速率为10 K/min条件下晶体质量随时间变化 Figure 7 The mass of crystal varying with time when the heating rate is 10 K/min |
|
图 8 升温速率为10 K/min条件下转化率随时间的变化 Figure 8 Percent conversion varying with time when the heating rate is 10 K/min |
通过比较发现, 无论是恒温加热还是以从室温开始以10 K/min升温速率加热,不同混合吸收剂组成工况下产生晶体的再生情况基本一致.主要原因是本工艺结晶主要是在溶析作用强化条件下的反应结晶,随着吸收CO2反应的进行,碳化液的浓度缓慢增大,有利于晶体的生长,在这种结晶条件下,溶析剂与氨水的体积比1:3.0、1:4.0、1:5.7差距不大,因此对晶体生长过程的影响很小,晶体粒径以及晶格结构均相似. 图 9、10为在恒温加热温度分别为60、80、100 ℃条件下,晶体的失重以及转化率曲线.
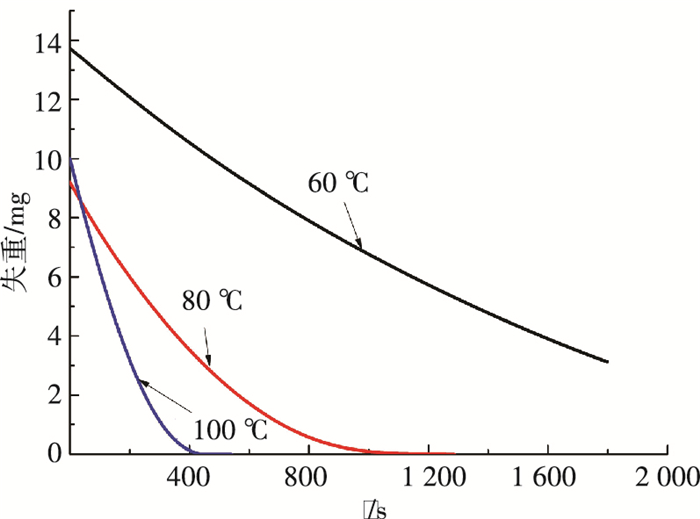
|
图 9 不同恒温加热温度条件下晶体质量随时间变化 Figure 9 The mass of crystal varying with time under different constant heating temperature |
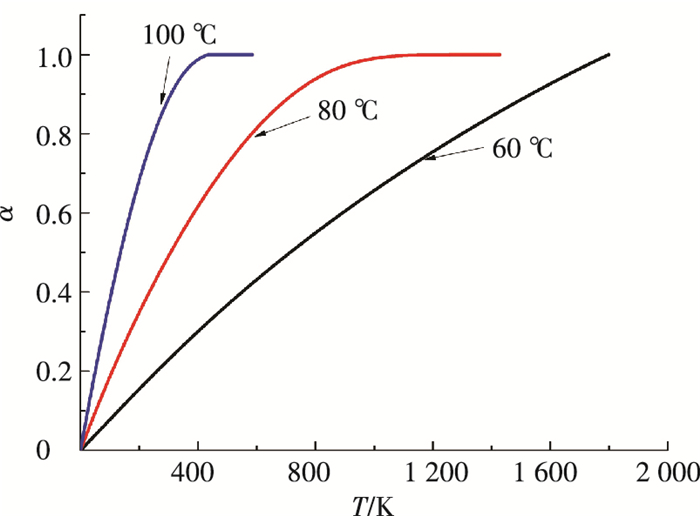
|
图 10 不同恒温加热温度条件下转化率随时间的变化 Figure 10 Percent conversion varying with time under different constant heating temperature |
由图 9、10可以看出,随着温度的升高,失重曲线越来越陡. 60 ℃时分解速度太慢,100 ℃时最快,但是鉴于这部分再生能耗可从脱硫废热中得到,经过热泵对低品位能的提升,得到80 ℃热源较为合适,因此可选取80 ℃作为再生温度.
2.3 反应动力学模式函数选择分别采用表 1的16种模式函数进行计算,以选择最适合晶体产物的模式函数. 图 11为从11个具有代表性的函数在10 K/min升温速率下整个热解温度区间内的Arrhenius曲线,其中α取0.05~0.95.由图 11可见,当对整个晶体产物热解过程应用C-R积分法,各类模式函数Arrhenius曲线均呈现明显阶段性,总体线性度不高,取其线性度高的部分进行计算.
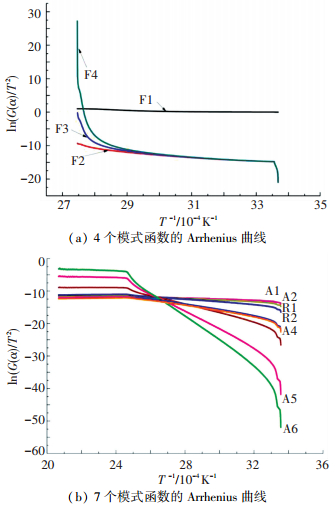
|
图 11 12个模式函数的Arrhenius曲线 Figure 11 Arrhenius curves of 12 model functions |
在10 K/min升温速率条件下整个热解温度区间内,分别将表 1中16个模式函数代入C-R积分方程, 计算得到ln[G(α)/T2]与1/T的线性相关系数r以及对应的表观活化能E值(见图 12),其中α为0.05~0.95.由图 12可见R2模式函数条件下, 线性相关系数最接近于-1.因此本文选择R2模式函数即1-(1-α)1/3,进行不同工况下动力学参数的计算.此模式函数与钱晓农[20]等以及熊为淼等[19]对于碳酸氢铵热解研究所选模式函数一致.
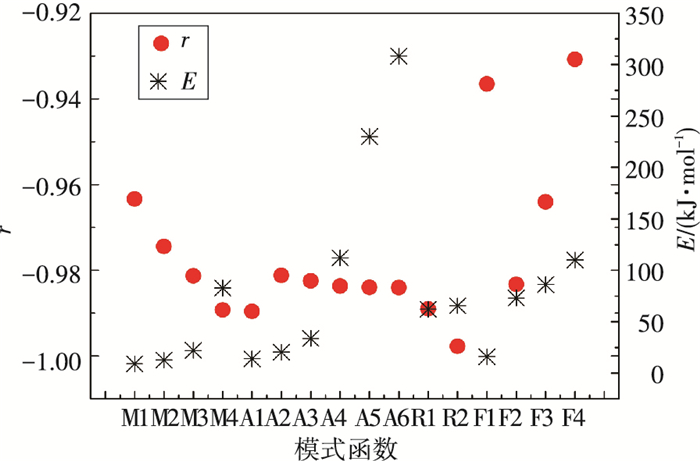
|
图 12 不同模式函数的r和E值 Figure 12 Values of r and E calculated by different model functions |
由于本实验晶体产物满足1-(1-α)1/3=kt,因此可判定此热分解过程反应级数为2/3.反应活化能表征反应进行的难易程度,活化能越低则反应越容易进行.通过1-(1-α)1/3=kt模式函数进行估算,活化能、指前因子以及相关系数如表 2所示.
| 表 2 不同工况动力学参数 Table 2 Kinetic parameters of different condition |
对比表 1中样品1 ~3的活化能发现,当升温速率均为10 K/min时,3种样品的活化能基本相同,与2.2节研究结果一致,随着吸收CO2反应的进行,碳化液的浓度缓慢增大,有利于晶体的生长过程.在这种结晶条件下,溶析剂与氨水的体积比1:3.0、1:4.0、1:5.7差距不大,因此对晶体生长过程的影响很小,晶体粒径以及晶格结构均相似.本工艺产生晶体热分解的活化能远低于碳酸氢铵晶体的活化能91.44 kJ/mol[20],主要原因是本工艺晶体是在乙醇与水组成的混合溶剂条件下产生的,并且容易产生包液现象,使得晶体内部成键更不稳定.本工艺条件下产生晶体有利于分解过程,降低再生能耗.
3 结论1) 本实验产生晶体产物在常温下即开始分解,分解速度随着升温速率升高不断升高,并且转化率可达100%.随着升温速率的升高,活化能随之降低,当升温速率为15 K/min时活化能可低达48.38 kJ/mol.
2) 对混合吸收剂,不同的溶析剂配比对于再生过程影响不大,因此混合吸收剂组成仅由吸收速率决定.
3) 以80 ℃为恒温再生温度,即可得到较好的再生速率,也适于从脱硫系统废热中提取热量作为再生热源,进一步降低系统的能耗.
4) 经过对16种经典模型的计算,选出了对本研究晶体产物适合的模式函数1-(1-α)1/3=kt.
| [1] |
韦保仁.
中国能源需求与二氧化碳排放的情景分析[M]. 北京: 中国环境科学出版社, 2007: 1-6.
WEI Baoren. Scene analysis of energy demand and CO2 emission in China[M]. Beijing: China Environmental Sciences Press, 2007: 1-6. |
| [2] |
HASZELDINE R S. Carbon capture and storage: how green can black be[J].
Science, 2009, 325(5948): 1647-1652.
DOI: 10.1126/science.1172246 |
| [3] |
杨明芬, 方梦祥, 张卫风, 等. 膜吸收法脱除电厂模拟烟气中的CO2[J].
环境科学, 2005, 26(4): 24-29.
YANG Mingfen, FANG Mengxiang, ZHANG Weifeng, et al. Removal of CO2 from simulated flue gas of power plants by membrane-based gas absorption processes[J]. Environmental Science, 2005, 26(4): 24-29. |
| [4] |
IEA.
World energy outlook 2007 China and India insight[M]. Pairs: Iea Publications, 2008: 13.
|
| [5] |
OLAJIRE A A. CO2 capture and separation technologies for end-of-pipe applications: A review[J].
Energy, 2010, 35(6): 2610-2628.
DOI: 10.1016/j.energy.2010.02.030 |
| [6] |
TOBIESEN F A, JULIUSSEN O, SVENDSEN H F. Experimental validation of a rigorous desorber model for CO2 post-combustion capture[J].
Chemical Engineering Science, 2008, 63(10): 2641-2656.
DOI: 10.1002/aic.11133 |
| [7] |
CIFERNO J P, DI P P, TARKA T. An economic scoping study for CO2 capture using aqueous ammonia[R]. Pittsburgh: National Energy Technology Laboratory, US Department of Energy, 2005.
|
| [8] |
WANG X G, CONWAY W, FERNANDES D, et al. Kinetics of the reversible reaction of CO2(aq) with ammonia in aqueous solution[J].
Physical Chemisity A, 2011, 115(24): 6405.
DOI: 10.1021/jp108491a |
| [9] |
CONWAY W, WANG X G, FERNANDES D, et al. Comprehensive kinetic and thermodynamic study of the reactions of CO2(aq) and HCO3- with monoethanolamine(MEA) in aqueous solution[J].
Physical Chemisity A, 2011, 115(50): 14340-14349.
DOI: 10.1021/jp2081462 |
| [10] |
RESNIK K P, GARBER W, HREHA D C, et al. A parametric scan for regenerative ammonia-based scrubbing for the capture of CO2[C]// Proceedings of the 23rd Annual International Pittsburgh Coal Conference. Pittsburgh: [s. n. ], 2006.
|
| [11] |
WANG S, LIU F, CHEN C, et al. Life cycle emissions of greenhouse gas for ammonia scrubbing technology[J].
Korean Journal of Chemical Engineering, 2007, 24(3): 495-498.
DOI: 10.1007/s11814-007-0086-7 |
| [12] |
YEH J T, RESNIK K P, RYGLE K, et al. Semi-batch absorption and regeneration studies for CO2 capture by aqueous ammonia[J].
Fuel Processing Technology, 2005, 86(14): 1533-1546.
DOI: 10.1016/j.fuproc.2005.01.015 |
| [13] |
GAO Jianmin, ZHANG Yu, FENG Dongdong, et al. A new technique of carbon capture by ammonia with the reinforced crystallization at low carbonized ratio and initial experimental research[J].
Fuel Processing Technology, 2015, 135: 207-211.
DOI: 10.1016/j.fuproc.2015.02.008 |
| [14] |
COATS A W, REDFERN J P. Kinetic parameters from thermogravi-metric data[J].
Nature, 1964, 201: 68-69.
DOI: 10.1038/201068a0 |
| [15] |
刘芳, 王淑娟, 张曦, 等. 碳酸氢铵溶液解吸二氧化碳研究[J].
环境科学学报, 2009(9): 1886-1890.
LIU Fang, WANG Shujuan, ZHANG Xi, et al. Study on ammonium bicarbonate decomposition after CO2 sequestration by ammonia method[J]. Acta Scientiae Circumstantiae, 2009(9): 1886-1890. |
| [16] |
CHEN H S, DOU B L, SONG Y C, et al. Studies on absorption and regeneration for CO2 capture by aqueous ammonia[J].
International Journal of Greenhouse Gas Control, 2012(6): 171-178.
|
| [17] |
张永昭, 艾宁, 计建炳. 碳酸氢铵水溶液热分解性能的研究[J].
广州化工, 2011(8): 56-57.
ZHANG Yongzhao, AI Ning, JI Jianbing. Dissociation of ammonium acid carbonate after CO2 sequestration by aqueous ammonia method[J]. Guangzhou Chemical Industry, 2011(8): 56-57. |
| [18] |
张宇, 高建民, 何明月, 等. 两种强化低碳化度氨水结晶的新型氨法脱碳工艺[J].
化工学报, 2015(6): 2123-2130.
ZHANG Yu, GAO Jianmin, HE Mingyue, et al. Two kinds of new carbon capture technology by ammonia based on reinforced crystallization[J]. CIESC Journal, 2015(6): 2123-2130. |
| [19] |
熊为淼, 吴淑荣, 田民同, 等. 粒度对碳酸氢铵热分解动力学影响的等温法研究[J].
化肥工业, 1983(5): 2-5.
XIONG Weimiao, WU Shurong, TIAN Mintong, et al. The effect of particle size on the kinetics of thermal decomposition of ammonium bicarbonate isothermal method research[J]. Chemical Fertilizer Industry, 1983(5): 2-5. |
| [20] |
钱晓农. 碳酸氢铵热分解动力学研究[J].
云南化工, 1994(1): 20-22.
QIAN Xiaonong. The research into ammonium bicarbonate about kinetics of thermo-dissociation[J]. Yunnan Chemical Industry, 1994(1): 20-22. |
 2018, Vol. 50
2018, Vol. 50


