生物燃料由于低排放及高效率已经成为了一项前景广阔的能源替代品[1].随着生物柴油工业的发展[2],大量甘油副产物随之产生,导致了甘油市场的饱和以及能源的浪费,因此寻找一种有效利用生物甘油的方法是十分必要的[3].甘油催化重整制氢在有效利用生物甘油方面有广阔的前景,近年来受到了人们大量的关注[4-9].
Wang等[10]实验研究了基于Ni-Mg-Al催化剂的甘油水蒸气重整法.研究表明,尽管低温下催化剂表现出较好的氢选择性,但有严重的碳沉积现象.自热式重整集成了水蒸气重整与部分氧化过程,通过引入氧气降低系统对外部能源的依赖,同时抑制碳的生成[11-13].然而随着氧气的引入,氢气的产率不断降低,为了减弱这一负面影响,通过强化重整的方式可以提高氢气的产率[14-16]. Silva等[17]对带有氢气分离的甘油水蒸气重整进行了热力学分析,通过对运行参数的评估,发现分离氢气可以促进氢气产量的提高. Leal等[18]进一步研究了粗甘油杂质对自热重整过程的影响.研究表明,随着杂质甲醇含量的增加,氢气的纯度提高.
本文基于吉布斯自由能最小原则,进行了膜反应器中自热式甘油重整的热力学分析,研究不同反应温度、氢气分离系数等对自热式重整过程中氢产量、积碳、反应热的影响,探究较低温度下二氧化碳吸附强化对甘油自热重整过程的影响,进而实现强化自热式甘油重整制氢的综合评估.
1 研究方法在研究中,选择膜反应器中自热式甘油重整过程为研究对象.反应式如下:
| $ \left\{ \begin{array}{l} {{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}{{\rm{O}}_{\rm{3}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\rightleftharpoons{\rm{3C}}{{\rm{O}}_{\rm{2}}} + {\rm{7}}{{\rm{H}}_{\rm{2}}},\\ \Delta {H_{{\rm{298K}}}} = 127.67\;{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - 1}}. \end{array} \right. $ | (1) |
自热系统所需能量通过甘油氧化反应提供,而这一反应会降低氢产量.因此关键在于平衡氢产量和能量消耗之间的关系.甘油氧化过程取决于甘油和氧气的比例,包含如下反应:
| $ \begin{array}{c} {{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}{{\rm{O}}_{\rm{3}}}{\rm{ + 0}}{\rm{.5}}{{\rm{O}}_{\rm{2}}}\rightleftharpoons {\rm{2CO + C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}},\\ {\rm{\Delta }}{H_{{\rm{298K}}}}{\rm{ = - 31}}{\rm{.79}}\;{\rm{kJ\cdot mo}}{{\rm{l}}^{{\rm{ - 1}}}};\\ {{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}}\rightleftharpoons {\rm{CO + 2C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}},\\ {\rm{\Delta }}{H_{{\rm{298K}}}}{\rm{ = - 314}}{\rm{.76}}\;{\rm{kJ\cdot mo}}{{\rm{l}}^{{\rm{ - 1}}}};\\ {{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}{{\rm{O}}_{\rm{3}}}{\rm{ + 1}}{\rm{.5}}{{\rm{O}}_{\rm{2}}}\rightleftharpoons {\rm{3C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}},\\ {\rm{\Delta }}{H_{{\rm{298K}}}}{\rm{ = - 579}}{\rm{.73}}\;{\rm{kJ\cdot mo}}{{\rm{l}}^{{\rm{ - 1}}}};\\ {{\rm{C}}_{\rm{3}}}{{\rm{H}}_{\rm{8}}}{{\rm{O}}_{\rm{3}}}{\rm{ + 3}}{\rm{.5}}{{\rm{O}}_{\rm{2}}}\rightleftharpoons {\rm{3C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}},\\ {\rm{\Delta }}{H_{{\rm{298K}}}}{\rm{ = - 1}}\;{\rm{564}}{\rm{.93}}\;{\rm{kJ\cdot mo}}{{\rm{l}}^{{\rm{ - 1}}}}. \end{array} $ |
水煤气反应在自热式甘油重整过程中发挥着重要的作用,反应方程式表示如下:
| $ \left\{ \begin{array}{l} {\rm{CO + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\rightleftharpoons {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}},\\ \Delta {H_{298{\rm{K}}}} = - 41.17\;{\rm{kJ\cdot mo}}{{\rm{l}}^{ - 1}}. \end{array} \right. $ | (2) |
除了上面主要反应之外,还有一些副反应,包括甲烷化反应和生成积碳反应如下:
| $ \begin{array}{c} {\rm{CO + 3}}{{\rm{H}}_{\rm{2}}}\rightleftharpoons {\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}},\\ {\rm{\Delta }}{{\rm{H}}_{{\rm{298K}}}}{\rm{ = - 206}}{\rm{.11}}\;{\rm{kJ\cdot mo}}{{\rm{l}}^{{\rm{ - 1}}}}{\rm{;}}\\ {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}}\rightleftharpoons {\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}},\\ \Delta {H_{298{\rm{K}}}} = - 164.94\;{\rm{kJmo}}{{\rm{l}}^{ - 1}};\\ {\rm{CO + }}{{\rm{H}}_{\rm{2}}}\rightleftharpoons {\rm{C + }}{{\rm{H}}_{\rm{2}}}{\rm{O}},\\ \Delta {H_{298{\rm{K}}}} = - 131.26\;{\rm{kJ\cdot mo}}{{\rm{l}}^{ - 1}}; \end{array} $ |
| $ \left\{ \begin{array}{l} {\rm{C}}{{\rm{H}}_{\rm{4}}}\rightleftharpoons {\rm{C + 2}}{{\rm{H}}_{\rm{2}}},\\ \Delta {H_{298{\rm{K}}}} = 74.85\;{\rm{kJ\cdot mo}}{{\rm{l}}^{{\rm{ - 1}}}}; \end{array} \right. $ | (3) |
| $ \begin{array}{c} 2{\rm{CO}}\rightleftharpoons {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + C}},\\ \Delta {H_{298{\rm{K}}}} = - 172.43\;{\rm{kJ\cdot mo}}{{\rm{l}}^{ - 1}}. \end{array} $ |
这些反应会导致氢气产量的降低以及催化剂失活,应该尽量抑制.将最小吉布斯自由能法应用于热化学平衡和相应的反应热的计算,这一方法可以避免选择解决方案和可能的反应上面的分歧.系统总的吉布斯自由能可以表示成每一组分的和:
| $ \begin{array}{l} {G^{\rm{t}}} = nG = \sum\limits_{i = 1}^N {{n_i}} \;{{\bar G}_i} = \sum\limits_{i = 1}^N {{n_i}} \;{{\bar \mu }_i} = \sum {{n_i}G_i^0} + \\ \quad \quad RT\sum {{n_i}\ln \frac{{{{\hat f}_i}}}{{f_i^0}},} \\ \sum\limits_i {{n_i}{a_{ik}}} = {A_k},{\rm{for}}\;i = 1,2,3, \cdot s ,w. \end{array} $ |
在甘油水蒸气重整过程中,也要考虑通过碳沉积产生的固体碳.固体碳的吉布斯自由能为
| $ {G_{{\rm{C}}({\rm{g}})}} = {G_{{\rm{C}}({\rm{s}})}} \cong G_{f{\rm{C}}({\rm{s}})}^0 = 0. $ |
选择Soavee-Redliche-Kwong方程来估算系统的热力学性质,使用ASPEN PLUS V7.3平台来计算反应平衡.在计算的过程中,甘油的初始总量为1 mol,而其他的组分会根据要求发生变化:氧气与甘油的比例为0~0.4,温度为600~1 000 K,氢气分离比例为0~0.8.
氢气分离过程使用一系列的子分离器sub-separators,并指定其分离系数,通过迭代的方法获得满足系统氢气分离比例的子分离器的分离系数[18],系统氢气分离系数表示如下:
| $ {f_{{{\rm{H}}_2}}} = \frac{{\sum {n_{{{\rm{H}}_2} - {\rm{separated}}}}}}{{\sum {n_{{{\rm{H}}_2} - {\rm{separated}}}} + {n_{{{\rm{H}}_2} - {\rm{unseparated}}}}}}. $ |
氢的分离能促进总反应的平衡向氢产率更高的方向移动. 图 1阐明了在不同的氢分离系数和反应温度下氢产量的变化.氢的产量首先随着温度的升高而提高,达到最大值后开始减少.随着温度的变化,氢的产量有显著的变化范围,表明将反应控制在合理范围内对于氢的生产是至关重要的.氢的去除增加了氢气的产量,最大氢产量出现的温度在降低,这为较低温度条件下的甘油重整提供了可能性.尽管低温下氢分离对氢产量的提高影响更为明显,然而氢气总体产量大幅度下降,说明去氢这种强化重整方式不太适于作为低温重整强化手段.

|
图 1 氢分离系数对自热重整中不同温度下氢产率的影响 Figure 1 Effect of hydrogen separation fraction on hydrogen yield with temperature |
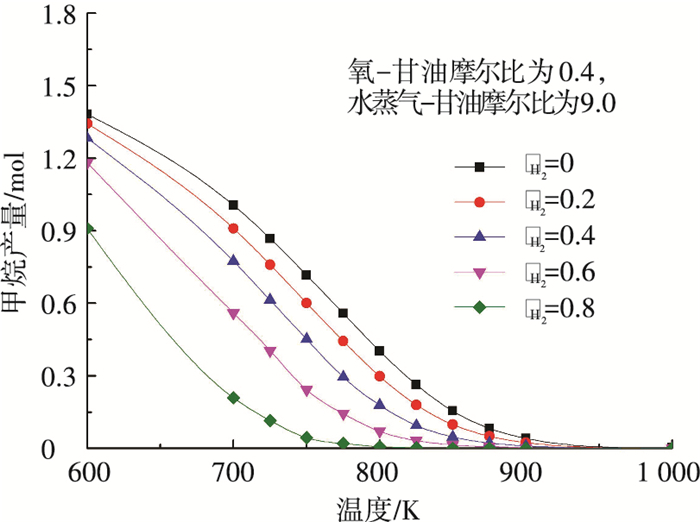
图 2显示了随着反应温度和氢气分离系数的变化产生甲烷的情况.当温度升高时,甲烷产量呈下降趋势,这意味着高温抑制甲烷的生成.原因是甲烷化反应是放热反应,温度升高会抑制反应的正向进行,并促进反应逆向进行.随着氢的分离,甲烷产量大幅度下降,由于甲烷化反应的反应物减少使得逆反应增强,甲烷产量降低,这意味着氢分离对于控制甲烷的生成是有益的,甲烷减少的程度也随着氢气分离程度的增加变得更为显著.
|
图 2 氢分离系数对自热重整中不同温度下甲烷产率的影响 Figure 2 Effect of hydrogen separation fraction on methane yield with temperature |
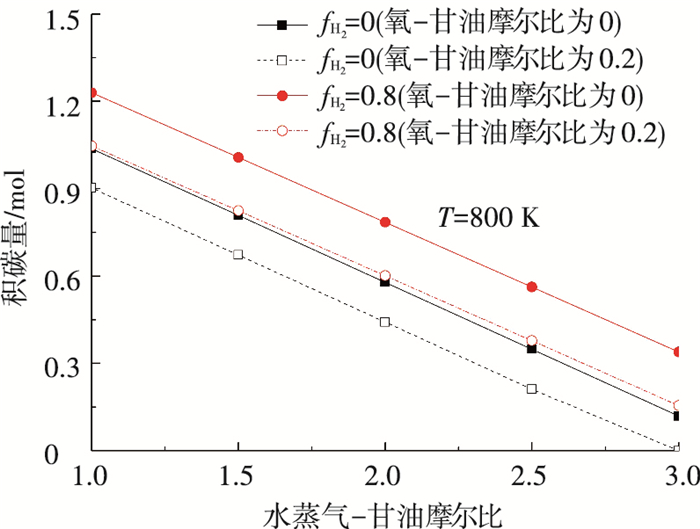
图 3给出了氢的分离和氧-甘油比对积碳形成的影响.相比于不分离氢,氢的分离促进了积碳的形成.从式(3)可以看出,氢的分离促进了甲烷的分解,增加了固体碳的形成; 而随着氧-甘油比的增大,积碳的生成量会减少,这是由于碳进一步被氧化造成的,这意味着在甘油自热式重整系统的连续操作中,综合考虑氢的分离程度和氧-甘油比是十分重要的.随着水蒸气-甘油比增大,积碳量大幅度减小,因此可以利用较高的水蒸气-甘油比进一步抑制积碳的增加.
|
图 3 氢分离和氧气-甘油比对不同水蒸气-甘油比条件下积碳量的影响 Figure 3 Effect of hydrogen removal and oxygen introduction on carbon formation with steam to glycerol ratio |
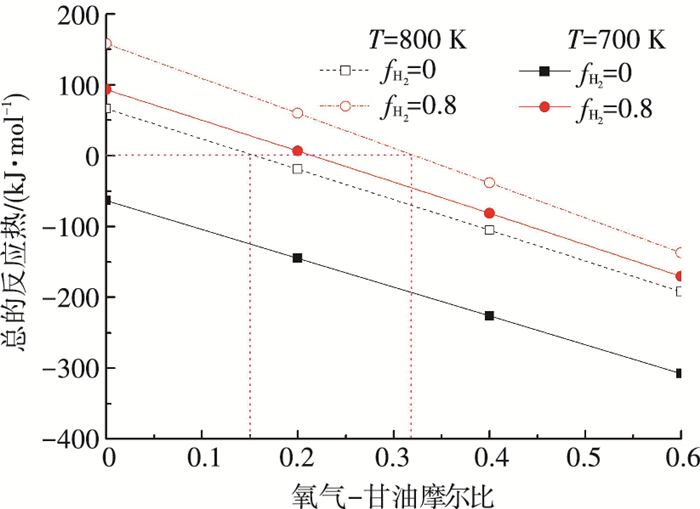
图 4给出了在不同的反应温度下,总反应热量的变化与氧-甘油投料比的关系.随着氧-甘油投料比的增加,总反应热量的变化近似于线性减少.氧气的引入通过氧化反应供应重整反应所需的热量.同时反应热随着氢分离系数的增加而增加,并且增加程度在700 K时更为明显,这与不同温度下分离系数对氢产量的影响差异有关. 700 K时氢的分离导致氢产量更为显著的变化, 使得反应热的增长幅度明显.从图中可以得到不同工况下自热所对应的氧气-甘油投料比.温度的升高使得达到自热条件需要更多氧气.在反应温度为800 K时,当氢的分离系数从0变化到0.8时,达到自热条件所需的氧-甘油投料比从0.15增加到0.32.
|
图 4 氢分离和温度对不同氧气-甘油比条件下反应热的影响 Figure 4 Effect of hydrogen removal and temperatures on reaction heat with oxygen to glycerol feed ratio |
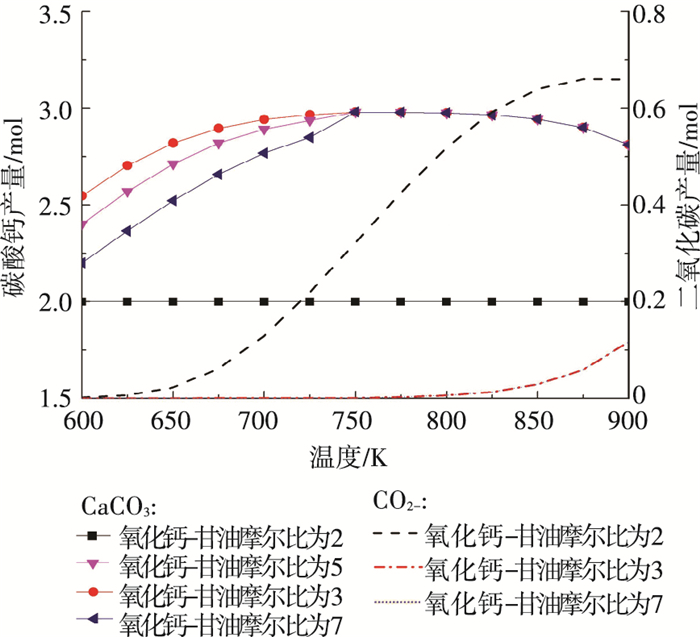
从图 5中可以看出,当氧化钙与甘油的投料比为2时(即吸附剂不足时),反应体系内部的二氧化碳无法被完全吸收,此时氧化钙完全反应生成碳酸钙.当氧化钙与甘油的投料比>3时,二氧化碳在750 K以下时几乎完全被氧化钙吸收.在<750 K的低温区,碳酸钙的量随着氧化钙-甘油投料比的增加而减少,这是因为过量的氧化钙在750 K以下会与水结合生成氢氧化钙,水的减少会使反应(1)与(2)发生平衡移动,减少二氧化碳的量,因此导致碳酸钙的量减少.当温度>750 K时,氢氧化钙分解,过量的氧化钙对二氧化碳吸附没有影响.当温度升高至800 K以上时,碳酸钙的量略有下降,二氧化碳的量略有上升,这说明温度过高会降低吸附剂对二氧化碳的吸附能力,进而影响氢气产量,合理地控温可以避免吸附剂在高温区失活.
|
图 5 不同氧化钙-甘油比下碳酸钙和二氧化碳产量随温度的变化 Figure 5 CaCO3 and CO2 yields with temperature at different calcium oxide to glycerol feed ratios |
图 6给出了不同氧化钙甘油投料比下氢气的产量随着温度的变化趋势.当氧化钙吸收剂不足时,氢气产量相对较低,随着氧化钙的增加,氢气产量大幅度增加.这说明二氧化碳去除极大地强化了甘油重整制氢.当氧化钙过量之后,750 K以下氢气产量会随着氧化钙的投料量的增加而减少.这是因为多余的氧化钙会吸收反应体系内部的水蒸气,以致反应(1)与(2)平衡发生移动,氢气产生受到抑制.而750 K以上时氢氧化钙分解,故对水蒸气没有影响,因此二氧化碳吸收达到饱和,氢气产量基本不变.
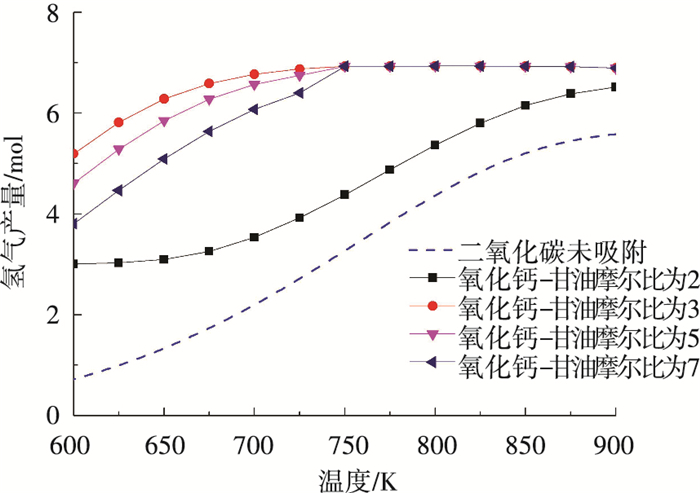
|
图 6 不同氧化钙-甘油比下氢气产量随温度的变化 Figure 6 H2 yield with temperature at different calcium oxide to glycerol feed ratios |
图 7给出了甘油重整二氧化碳吸附强化时反应热随温度的变化.在体系内部加入氧化钙会明显减少反应热,这是因为氧化钙与二氧化碳的反应是放热反应,会放出较为可观的热量,所放出的热量可以提供给整个反应体系,使反应热减少,使系统实现自热.当氧化钙的量不足时,此时生成的碳酸钙量恒定,吸收反应所放出的热量也恒定,因此反应体系的反应热虽然降低,随温度的变化趋势与未吸附时基本一致.当氧化钙过量时,在750 K以下的低温区,随着氧化钙投料量的增加,反应热大幅度减少.这是因为此时存在氧化钙与水生成氢氧化钙的反应,此反应为强放热反应,导致产生了此现象; 而当温度在750 K以上时,氢氧化钙全部受热分解,不产生影响,因此750 K以上的高温区,反应热的变化趋势与氧化钙的投料量无关.
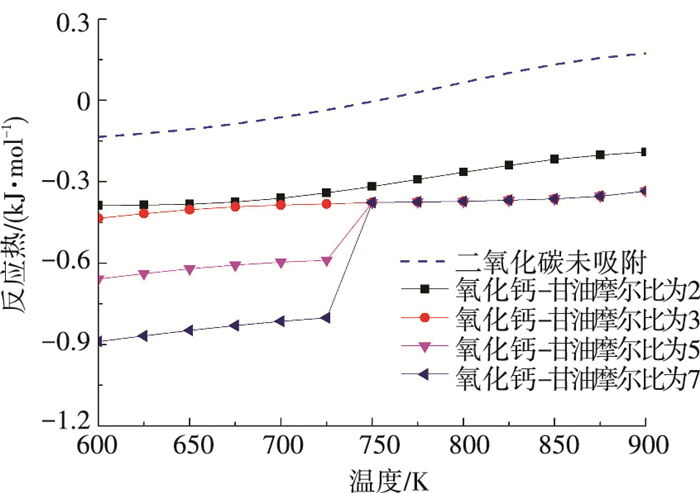
|
图 7 不同氧化钙-甘油比下反应热随温度的变化 Figure 7 Reaction heat with temperature at different calcium oxide to glycerol feed ratios |
综上所述,二氧化碳吸附反应所放出的热量足以提供甘油重整反应所需的热,多余的热量可以对入口物流进行预热,进而达到节能的效果.
3 结论1) 自热式甘油水蒸气重整过程中,氢气的分离在促进氢产量提高的同时,加剧了积碳的形成,同时提高了反应体系所消耗的热.这意味着当采用氢气分离强化甘油重整制氢时,为了维持反应体系的自热状态,需要提供更多的氧气.氢气分离强化重整技术在温度800 K以上时提高氢气产量和抑制甲烷生成的效果更为显著.
2) 利用氧化钙吸附二氧化碳强化甘油重整过程中,温度低于750 K会导致氢氧化钙的形成,进而降低氢气的产量.因此在低温下合理控制吸附剂的量是关键.二氧化碳吸附过程释放的热量可以在满足系统自热的条件下,进一步的为进口物料预热.
3) 当甘油重整温度升高至800 K以上时,吸附剂对二氧化碳的吸附能力下降,降低了氢气产量,因此对于二氧化碳吸附强化应该合理地控温,以避免吸附剂在高温区失活.
| [1] |
DEMIRBAS A. Political, economic and environmental impacts of biofuels:a review[J].
Applied Energy, 2009, 86(1): 108-117.
DOI: 10.1016/j.apenergy.2009.04.036 |
| [2] |
马敦超, 陈定江, 雪晶, 等. 不确定性因素下的生物柴油项目决策分析[J].
太阳能学报, 2013, 34(2): 324-330.
MA Dunchao, CHEN Dingjiang, XUE Jing, et al. Decision-making analysis of biodiesel project based on uncertain factors[J]. Acta Energiae Solaris Sinica, 2013, 34(2): 324-330. |
| [3] |
RAHMAT N, ABDULLAH A, MOHAMED A. Recent progress on innovative and potential technologies for glycerol transformation into fuel additives: a critical review[J].
Renewable & Sustainable Energy Reviews, 2010, 14(3): 987-1000.
DOI: 10.1016/j.rser.2009.11.010 |
| [4] |
SILVA J, SORIA M, MADEIRA L. Challenges and strategies for optimization of glycerol steam reforming process[J].
Renewable & Sustainable Energy Reviews, 2015, 42: 1187-1213.
DOI: 10.1016/j.rser.2014.10.084 |
| [5] |
SCHWENGBER C A, ALVES H J, SCHAFFNER R A, et al. Overview of glycerol reforming for hydrogen production[J].
Renewable & Sustainable Energy Reviews, 2016, 58: 259-266.
DOI: 10.1016/j.rser.2015.12.279 |
| [6] |
REMÓN J, JARAUTA-CÓRDOBA C, GARCÍA L, et al. Analysis and optimization of H2 production from crude glycerol by steam reforming using a novel two step process[J].
Fuel Processing Techno-logy, 2016, 145: 130-147.
DOI: 10.1016/j.fuproc.2016.01.035 |
| [7] |
SILVA J, SORIA M, MADEIRA L. Thermodynamic analysis of gly-cerol steam reforming for hydrogen production with in situ hydrogen and carbon dioxide separation[J].
Journal of Power Sources, 2015, 273: 423-430.
DOI: 10.1016/j.jpowsour.2014.09.093 |
| [8] |
REMÓN J, MERCADO V, GARCÍA L, et al. Effect of acetic acid, methanol and potassium hydroxide on the catalytic steam reforming of glycerol: thermodynamic and experimental study[J].
Fuel Processing Technology, 2015, 138: 325-336.
DOI: 10.1016/j.fuproc.2015.05.034 |
| [9] |
ADHIKARI S, FERNANDO S, GWALTNEY S, et al. A thermodynamic analysis of hydrogen production by steam reforming of glycerol[J].
International Journal of Hydrogen Energy, 2007, 32(14): 2875-2880.
DOI: 10.1016/j.ijhydene.2007.03.023 |
| [10] |
WANG C, DOU B, CHEN H, et al. Hydrogen production from steam reforming of glycerol by Ni-Mg-Al based catalysts in a fixed-bed reactor[J].
Chemical Engineering Journal, 2013, 220: 133-142.
DOI: 10.1016/j.cej.2013.01.050 |
| [11] |
AUTHAYANUN S, ARPORNWICHANOP A, PAENGJUNTUEK W. Thermodynamic study of hydrogen production from crude glycerol autothermal reforming for fuel cell applications[J].
International Journal of Hydrogen Energy, 2010, 35(13): 6617-6623.
DOI: 10.1016/j.ijhydene.2010.04.050 |
| [12] |
WANG H, WANG X, LI M, et al. Thermodynamic analysis of hydrogen production from glycerol autothermal reforming[J].
International Journal of Hydrogen Energy, 2009, 34(14): 5683-5690.
DOI: 10.1016/j.ijhydene.2009.05.118 |
| [13] |
LIN K, CHANG A, LIN W, et al. Autothermal steam reforming of glycerol for hydrogen production over packed-bed and Pd/Ag alloy membrane reactors[J].
International Journal of Hydrogen Energy, 2013, 38(29): 12946-12952.
DOI: 10.1016/j.ijhydene.2013.04.134 |
| [14] |
ALVARADO F, GRACIA F. Oxidative steam reforming of glycerol for hydrogen production: thermodynamic analysis including different carbon deposits representation and CO2 adsorption[J].
International Journal of Hydrogen Energy, 2012, 37(19): 14820-14830.
DOI: 10.1016/j.ijhydene.2012.01.158 |
| [15] |
GALLUCCI F, BASILE A, TOSTI S, et al. Methanol and ethanol steam reforming in membrane reactors: an experimental study[J].
International Journal of Hydrogen Energy, 2007, 32(9): 1201-1210.
DOI: 10.1016/j.ijhydene.2006.11.019 |
| [16] |
CHANG A, LIN W, LIN K. Reforming of glycerol for producing hydrogen in a Pd/Ag membrane reactor[J].
International Journal of Hydrogen Energy, 2012, 37(17): 13110-13117.
DOI: 10.1016/j.ijhydene.2012.04.099 |
| [17] |
SILVA J M, SORIA MA, MADEIRA L M. Thermodynamic analysis of glycerol steam reforming for hydrogen production with in situ hydrogen and carbon dioxide separation[J].
Journal of Power Sources, 2015, 273: 423-430.
DOI: 10.1016/j.jpowsour.2014.09.093 |
| [18] |
LEAL A L, SORIA M A, MADEIRA L M. Autothermal reforming of impure glycerol for H2 production: Thermodynamic study including in situ CO2 and/or H2 separation[J].
International Journal of Hydrogen Energy, 2016, 41(4): 2607-2620.
DOI: 10.1016/j.ijhydene.2015.11.132 |
 2018, Vol. 50
2018, Vol. 50


