2. 北京桑德环保集团技术研发中心,北京 101102;
3. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090
2. Technology Research and Development Center, Beijing Sander Environmental Group, Beijing 101102, China;
3. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090, China
与传统脱氮工艺相比,厌氧氨氧化工艺具有脱氮途径短、节省曝气量、无需外加碳源、污泥产量少等优点[1],已成为目前最具前景的污水脱氮工艺[2].厌氧氨氧化以亚硝化工艺为基础.亚硝化工艺难以控制,出水中含有较高质量浓度的硝氮[3-4].同时,厌氧氨氧化工艺将污水中的氨氮和亚氮转化为氮气和少量硝氮,极限脱氮效率为89%[5],且无法去除进水中固有的硝氮,因此,在实际应用中整体工艺的出水氮素质量浓度偏高.随着污水排放标准日益严格,提高氮素去除率也迫在眉睫.有文献指出,采用厌氧氨氧化耦合反硝化的方法可以有效地提高反应器的氮素去除率[6-8],但国内外对SAD工艺的研究停留在配水上,实际应用极少.
本实验在污水处理厂进行,利用A/O除磷和亚硝化工艺处理后的实际生活污水为基质,投加有机物启动SAD工艺,研究SAD工艺在实际应用时的处理效果.
1 实验 1.1 实验装置实验采用上向流生物滤柱(图 1).反应器由有机玻璃制成,内径20 cm,承托层高5 cm,滤料高50 cm,有效体积15 L.滤柱每隔10 cm设置取样口,承托层采用粒径为4~8 mm的砾石,内部装填直径5~10 mm的火山岩填料.为了避免生物膜过量增殖导致滤柱堵塞的问题,在底部设曝气装置以进行气水反冲洗.整个反应器外部用黑色保温棉缠绕以避光和保温.
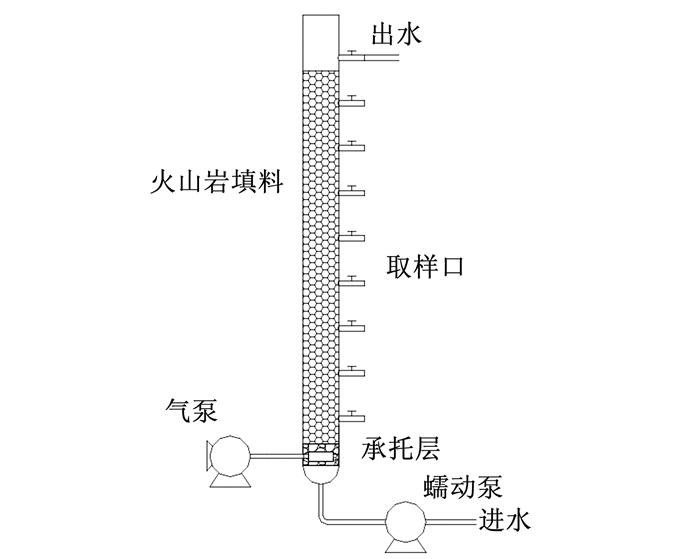
|
图 1 反应器装置示意 Figure 1 Schematic diagram of the experimental equipment |
反应器启动时接种5 L厌氧氨氧化絮状污泥,污泥质量浓度为2 000 mg/L.厌氧氨氧化絮状污泥来自于稳定运行的厌氧氨氧化SBR反应器,SBR反应器总氮去除率稳定在85%左右,总氮去除负荷为0.5 kg/(m3·d).
实验采用的基质为A/O除磷和亚硝化工艺处理后的实际生活污水,具体水质如表 1所示.亚硝化工艺采用两组两级连续搅拌反应器(CSTR).反应器在交替缺氧/好氧条件下运行,亚硝化率大于80%.
| 表 1 亚硝化出水水质 Table 1 Characteristics of the effluent from nitrification process |
根据基质中投加葡萄糖数量的不同,反应器运行分为5个阶段,各阶段运行参数如表 2所示.
| 表 2 各阶段反应器参数变化 Table 2 Parameter variations of each stage |
S1阶段为厌氧氨氧化工艺启动阶段,基质为A/O除磷和亚硝化工艺处理后的生活污水.S2~S5阶段为SAD工艺运行阶段,S2、S3、S4和S5阶段分别投加10,20,30,20 mg/L葡萄糖.
1.4 检测方法水样分析中NH4+-N的测定采用纳氏试剂光度法,NO2--N采用N-(1-萘基)乙二胺光度法,NO3--N采用紫外分光光度法,COD采用国标法测定(对水样进行预处理排除亚硝酸盐的影响),DO、pH和水温通过WTW便携测定仪测定,其余水质指标的分析均采用国标方法.滤料表面生物膜厚度通过电子显微镜精确测量[9].
反应速率的测定:从反应器取出滤料,刮下生物膜解离并在烧杯中测定反应速率.烧杯设置机械搅拌,测定厌氧氨氧化反应速率和反硝化反应速率.测定厌氧氨氧化反应速率时,基质氨氮和亚氮质量浓度为50 mg/L,调节碱度使碱度与氨氮之比为10,温度控制在24~26 ℃,pH稳定在7.0~8.0,DO维持0.3 mg/L以下.测定反硝化反应速率时,以150 mg/L甲醇作为碳源,硝氮质量浓度为50 mg/L,温度控制在24~26 ℃,pH稳定在7.0~7.8,DO维持0.3 mg/L以下.
2 结果与讨论 2.1 反应器的启动污水处理厂厌氧氨氧化工艺在春季末期进行启动,水温为15~19 ℃.启动时反应器接种5 L污泥质量浓度为2 000 mg/L的厌氧氨氧化絮状污泥.为了减少厌氧氨氧化污泥的流失,启动初期对出水进行收集并循环进水.运行3 d后,出水中SS质量浓度小于20 mg/L,絮状污泥已稳定截留在反应器中.此时将反应器改为连续流运行,进入S1阶段.
反应器启动时采用较低的水力负荷以减小厌氧氨氧化菌的流失,滤速定为0.15 m/h,HRT约为5 h.进出水氮素质量浓度如图 2所示.可以看出,随着反应器的运行,出水氨氮和亚氮质量浓度逐步降低,运行到第19天时,氨氮亚氮去除率大于90%,反应器初步启动成功.相较于其他研究成果[10-11],本实验反应器启动较快是由于接种了大量的厌氧氨氧化菌.第25~34天时,反应器氨氮、亚氮去除率大于95%,出水总氮质量浓度为9.6~13.4 mg/L,超过了北京市地方标准的A类排放标准,反应器平均出水总氮质量浓度为10.88 mg/L.出水中氮素质量浓度主要以硝氮的形式存在,一方面,由于亚硝化工艺难以控制,进水中硝氮质量浓度为4~7 mg/L;另一方面,厌氧氨氧化工艺会有少量硝氮产生,且无法去除进水中固有的硝氮,因此,导致出水含有大量硝氮.

|
图 2 进出水氮素变化 Figure 2 Nitrogen variation of influent and effluent |
厌氧氨氧化反应方程式如式如下[5]:
| $\begin{array}{l} {\rm{NH}}_{\rm{4}}^{\rm{ + }}{\rm{ + 1}}{\rm{.32NO}}_{\rm{2}}^{\rm{ - }}{\rm{ + 0}}{\rm{.13}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 0}}{\rm{.066HCO}}_{\rm{3}}^{\rm{ - }} \to \\ {\rm{1}}{\rm{.02}}{{\rm{N}}_{\rm{2}}}{\rm{ + 0}}{\rm{.26NO}}_{\rm{3}}^{\rm{ - }}{\rm{ + 0}}{\rm{.066C}}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{{\rm{2}}{\rm{.5}}}}{{\rm{N}}_{{\rm{0}}{\rm{.15}}}}{\rm{ + 2}}{\rm{.03}}{{\rm{H}}_{\rm{2}}}{\rm{O}}{\rm{.}} \end{array} $ | (1) |
由式(1)可知,厌氧氨氧化菌按1.32: 1的比例消耗亚氮和氨氮基质,总氮去除量和出水硝氮增量之比为8,该值称为特征比.亚氮氨氮消耗比和特征比的大小受反硝化作用的影响,反硝化作用增强,亚氮氨氮消耗比和特征比均会上升.反应器亚氮氨氮消耗比如图 3所示.

|
图 3 COD变化及亚氮氨氮消耗比 Figure 3 Variation of COD and consumption ratio of nitrite to ammonia |
S1阶段末期,平均亚氮氨氮消耗比为1.19,经计算平均特征比为8.18,表明反硝化作用较弱. Mathava Kumar指出,高碳氮比会使反硝化细菌取代厌氧氨氧化菌[7],成为反应器的优势菌种.而在本实验中,S1阶段进水中COD为25~50 mg/L,COD与NH4+质量比为1.2~2,处于较高水平,但未观察到明显的反硝化作用.反应器出水COD维持在20~45 mg/L,COD去除率仅为10%~25%.原因是A/O工艺和亚硝化工艺出水中COD大多数为难降解的有机物[12],反硝化菌缺少碳源,活性处于较低水平.而难降解的有机物对厌氧氨氧化菌影响较小[13],因此,在厌氧氨氧化菌和反硝化菌的竞争中占据优势,维持了厌氧氨氧化工艺的稳定.
2.2 SAD工艺的运行S2阶段进水中投加10 mg/L葡萄糖,启动SAD工艺.投加Glu以后,反应器氨氮和亚氮去除率由95%降低到60%左右.运行6 d后,氨氮和亚氮去除率恢复至90%以上.第41~80天,出水总氮质量浓度为8.2~10.7 mg/L,平均值为9.16 mg/L.相比S1阶段,S2阶段出水氮素质量浓度明显下降,但仍超过了北京市地方标准的A类水平.S2阶段反应器的亚氮氨氮消耗比为1.31,平均特征比为12.60,亚氮氨氮消耗比及特征比的升高表明反硝化作用的增强.根据厌氧氨氧化生化反应方程式计算[5],厌氧氨氧化途径的氮损大约为94%,反硝化途径的氮损约占6%.投加10 mg/L葡萄糖有效地提高了反硝化菌活性,且不会对厌氧氨氧化菌产生抑制作用.
S3阶段进水中Glu质量浓度提高到20 mg/L,其他参数保持不变.在S3阶段初期,厌氧氨氧化菌活性受到暂时的抑制.运行3 d后,氨氮和亚氮去除率大于98%.相比S2阶段,反应器用较短的时间恢复了高效的氨氮和亚氮去除效果,抗有机物冲击负荷得到明显提升.第85~117天,出水总氮质量浓度为6.5~9.8 mg/L,平均出水总氮质量浓度为8.10 mg/L.S3阶段亚氮氨氮消耗比上升至1.34,特征比上升至21.92,表明硝化作用进一步得到提高.此时厌氧氨氧化途径的氮损约为90%,反硝化氮损约占10%.反应器保持着高效厌氧氨氧化活性的同时,提高了反硝化菌的活性.
S4阶段,进水中的Glu质量浓度提高到30 mg/L.该阶段进水温度、氨氮亚氮去除率如图 4所示.第123~170天,水温为12.3~15.2 ℃,出水总氮质量浓度为4.8~7.3 mg/L,平均6.41 mg/L,满足北京市地方标准的A类排放标准.与厌氧氨氧化工艺相比,SAD工艺大大降低了出水总氮质量浓度,有利于满足日趋严格的污水排放标准.厌氧氨氧化和反硝化途径的氮损分别为83%和17%,在常温条件下,进水中投加30 mg/L葡萄糖,厌氧氨氧化菌和反硝化菌耦合效果良好.

|
图 4 温度及氮素去除率 Figure 4 Temperature and nitrogen removal rate |
第171天,运行进入冬季,进水温度降低到12 ℃以下.亚氮的去除几乎不受影响,氨氮去除率明显下降.由图 4可知,第171~189天,氨氮去除率随温度变化而变化.当温度为10~12 ℃时,出水氨氮质量浓度为1.7~6.2 mg/L,远远超过了排放标准.研究表明,厌氧氨氧化菌活性受温度影响大而反硝化菌活性受温度影响小[14].在本实验中,基质中投加30 mg/L葡萄糖,温度为10~12 ℃时,反硝化途径的氮损提高到30%左右,SAD工艺的平衡受到破坏并向反硝化工艺转变.
S5阶段,为了恢复并提高SAD工艺中厌氧氨氧化菌的活性,进水Glu质量浓度降为20 mg/L.第191~223天,水温为10~12 ℃,反应器最大出水氨氮质量浓度为0.8 mg/L,最大出水总氮质量浓度为8.7 mg/L,SAD工艺冬季出水氮素达标.
S1~S5阶段,出水COD稳定在20~45 mg/L.SAD生物滤柱对有机物有良好的去除效果,投加Glu几乎不会导致出水COD增加.其原因是:实验投加Glu质量浓度仅为10~40 mg/L,处于较低水平,反硝化菌等异养菌可以充分利用.因此,避免了人工投加碳源未能有效利用而导致出水COD升高的现象.
总体而言,有机物浓度和温度对SAD工艺有较大影响.S1~S4阶段中期,随着有机物浓度的提高,SAD工艺出水总氮质量浓度不断降低.S4阶段,进水有机物浓度一定时,水温大于12 ℃时,SAD工艺出水良好;水温为10~12 ℃时,SAD工艺出水恶化并向反硝化工艺转变.S4阶段中期~S5阶段,反应器均处于低温状态(10~12 ℃),低浓度的有机物不会导致SAD工艺的崩溃.
在实际运行过程中,有机物的投加浓度与温度密切相关.水温较高时,可以适当加大有机物使SAD工艺出水总氮质量浓度处于较低水平;水温较低时,应减小有机物的投加量以避免SAD工艺的崩溃.建议污水处理厂SAD工艺实际运行过程中,进水温度在14 ℃以上时,基质中投加30 mg/L葡萄糖;进水温度在10~14 ℃时,基质中投加20 mg/L葡萄糖;进水温度小于10 ℃时,基质宜投加10 mg/L葡萄糖.
2.3 生物学特性研究为了研究滤柱微生物的活性,定期取滤料进行分析.每次取等量距底部10, 30, 50 cm的滤料,测定滤料表面平均生物膜厚度以及功能微生物活性,结果如图 5所示.可以看出,在反应器运行过程中,生物膜厚度不断增加.由于S2阶段基质投加了Glu,有利于异养菌的生长,生物膜厚度增长迅速.S2~S4阶段中期,随着反应器的运行,生物膜厚度持续增加.S4阶段末期~S5阶段,运行进入冬季,进水水温较低,微生物的生长缓慢,因此,该阶段生物膜厚度变化较小.S5阶段生物膜厚度达121 μm,超过同类相关报道[15-17].与其他微生物相比,厌氧氨氧化菌基质亲和力强[18],且易于实现自固定[19],生物膜厚度可以达到较高水平.

|
图 5 生物膜厚度及反应速率 Figure 5 Biomembrane thickness and reaction rate |
S1阶段进水中可降解有机物较少,不利于异养菌的生长,因此,S1阶段污泥厌氧氨氧化速率较高,反硝化速率较低.S2阶段基质中投加了Glu,有机碳源充足,有利于反硝化菌的生长,反硝化速率大大提高.由于反硝化菌的大量增殖,厌氧氨氧化菌在生物膜中的比例下降,因此,厌氧氨氧化速率有所降低.S3~S4阶段中期,随着基质中Glu质量浓度的升高,反硝化速率进一步提高,厌氧氨氧化速率逐渐下降.因此,污泥厌氧氨氧化速率和反硝化速率与基质中有机碳源浓度有关.
宏观上,S4阶段前期SAD工艺有着良好的去除效果,S4阶段后期SAD工艺崩溃并向反硝化工艺转变.微观上,S4阶段前期和后期,污泥厌氧氨氧化速率和反硝化速率几乎保持不变.低温SAD工艺崩溃时,污泥依然有着较高的厌氧氨氧化速率.表明本实验中SAD工艺崩溃的原因不是生物膜中厌氧氨氧化菌被反硝化菌取代,而是厌氧氨氧化菌活性受温度影响大[20].S5阶段进水Glu质量浓度降低,厌氧氨氧化速率升高而反硝化速率降低,再次证明污泥厌氧氨氧化速率和反硝化速率与基质中有机碳源质量浓度有关.
3 结论1) 常温条件下,进水投加10,20和30 mg/L Glu,SAD工艺耦合效果良好.相较厌氧氨氧化工艺,SAD工艺出水总氮质量浓度降低了16%~42%.
2) 冬季水温为10~12 ℃,投加30 mg/L葡萄糖,SAD工艺受到破坏并向反硝化工艺转变.葡萄糖质量浓度降至20 mg/L时,冬季SAD工艺出水氨氮和总氮满足北京市地方标准的A类排放标准.
3) SAD滤柱生物膜厚度不断增加,最终达121 μm.污泥厌氧氨氧化速率和反硝化速率与基质中有机碳源浓度有关,与运行温度无关.
| [1] |
STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589. DOI:10.1007/s002530051340 |
| [2] |
贾方旭, 彭永臻, 杨庆. 厌氧氨氧化菌与其他细菌之间的协同竞争关系[J]. 环境科学学报, 2014(6): 1351. DOI:10.13671/j.hjkxxb.2014.0206 |
| [3] |
CHUANG H P, OHASHI A, IMACHI H, et al. Effective partial nitrification to nitrite by down-flow hanging sponge reactor under limited oxygen condition[J]. Water Research, 2007, 41(2): 295. DOI:10.1016/j.watres.2006.10.019 |
| [4] |
FUX C, BOEHLER M, HUBER P, et al. Biological treatment of ammonium-rich wastewater by partial nitritation and subsequent anaerobic ammonium oxidation (anammox) in a pilot plant[J]. Journal of Biotechnology, 2002, 99(3): 295. DOI:10.1016/S0168-1656(02)00220-1 |
| [5] |
MULDER A, VAN DE GRAAF A A, ROBERTSON L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed reactor[J]. FEMS Microbiology Ecology, 1995, 16(3): 177. DOI:10.1016/0168-6496(94)00081-7 |
| [6] |
DU R, PENG Y, CAO S, et al. Advanced nitrogen removal with simultaneous anammox and denitrification in sequencing batch reactor[J]. Bioresource Technology, 2014, 162: 316. DOI:10.1016/j.biortech.2014.03.041 |
| [7] |
KUMAR M, LIN J G. Co-existence of anammox and denitrification for simultaneous nitrogen and carbon removal: Strategies and issues[J]. Journal of Hazardous Materials, 2010, 178(1/2/3): 1. DOI:10.1016/j.jhazmat.2010.01.077 |
| [8] |
GANIGUÉ R, GABARRÓ J, LÓPEZ H, et al. Combining partial nitritation and heterotrophic denitritation for the treatment of landfill leachate previous to an anammox reactor[J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2010, 61(8): 1949. DOI:10.2166/wst.2010.968 |
| [9] |
张成林, 倪琦, 徐皓, 等. 导流式移动床生物膜反应器流速选择及流态分析[J]. 水产学报, 2011, 35(2): 283. DOI:10.3724/SP.J.1231.2011.17089 |
| [10] |
WANG T, ZHANG H, YANG F, et al. Start-up of the Anammox process from the conventional activated sludge in a membrane bioreactor[J]. Bioresource Technology, 2009, 100(9): 2501. DOI:10.1016/j.biortech.2008.12.011 |
| [11] |
田智勇, 李冬, 杨宏, 等. 上向流厌氧氨氧化生物滤池的启动与脱氮性能[J]. 北京工业大学学报, 2009(4): 509. DOI:10.11936/bjutxb2009040509 |
| [12] |
马斌, 张树军, 王俊敏, 等. A/O工艺实现城市污水半亚硝化与生物除磷[J]. 哈尔滨工业大学学报, 2012, 44(2): 70. DOI:10.11918/j.issn.0367-6234.2012.02.015 |
| [13] |
JENSEN M M, THAMDRUP B, DALSGAARD T. Effects of specific inhibitors on anammox and denitrification in marine sediments[J]. Applied & Environmental Microbiology, 2007, 73(10): 3151. DOI:10.1128/AEM.01898-06 |
| [14] |
AHN Y H, HWANG I S, MIN K S. ANAMMOX and partial denitritation in anaerobic nitrogen removal from piggery waste[J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2004, 49(5/6): 145. DOI:10.2166/wst.2004.0748 |
| [15] |
李冬, 赵世勋, 关宏伟, 等. 常温低氨氮CANON工艺稳定性研究[J]. 中国环境科学, 2017, 37(1): 102. DOI:10.3969/j.issn.1000-6923.2017.01.012 |
| [16] |
LIANG Y, LI D, ZHANG X, et al. Nitrogen removal and microbial characteristics in CANON biofilters fed with different ammonia levels[J]. Bioresource Technology, 2014, 171: 168. DOI:10.1016/j.neurenf.2012.05.476 |
| [17] |
张肖静, 李冬, 梁瑜海, 等. MBR-CANON工艺处理生活污水的快速启动及群落变化[J]. 哈尔滨工业大学学报, 2014, 46(4): 25. DOI:10.11918/j.issn.0367-6234.2014.04.005 |
| [18] |
STROUS M, KUENEN J G, JETTEN M S. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 1999, 65(7): 3248. |
| [19] |
李冬, 田海成, 梁瑜海, 等. 无机碳对SNAD工艺硝氮积累问题恢复的影响[J]. 哈尔滨工业大学学报, 2016, 48(8): 17. DOI:10.11918/j.issn.0367-6234.2016.08.003 |
| [20] |
DAVEREY A, HUNG N, DUTTA K, et al. Ambient temperature SNAD process treating anaerobic digester liquor of swine wastewater[J]. Bioresource Technology, 2013, 141: 191. DOI:10.1016/j.biortech.2013.02.045 |
 2018, Vol. 50
2018, Vol. 50


