2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090
2. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090, China
砷是毒性较强的水体污染物之一,长期暴露在砷环境中会造成砷中毒并引起癌变、神经和心血管系统疾病等健康问题,目前,亚洲印度、孟加拉国、越南、内蒙古及非洲加纳、美洲智利等数以千万计居民饮用含砷地下水,仅中国受地下水砷污染影响的人数就高达1 500多万[1].近年来,水砷污染问题已经引起了广泛关注,世界卫生组织将饮用水健康标准规定为10 μg/L,中国于2007年7月1日开始实施的《生活饮用水卫生标准》(GB5749—2006)将饮用水中的砷质量浓度下调为10 μg/L.标准中水砷质量浓度的下调对饮用水除砷技术有了更高的要求[2-3].
目前,常采用的饮用水除砷技术有吸附法、离子交换法、生物法和膜分离法.吸附法除砷因经济环保、操作简易、高效低能且可再生被广泛应用.含铁锰氧化物的吸附剂对阴阳离子吸附能力强,对砷具有较高的亲和力,是目前国内外研究的热点[4].天然铁锰矿石杂质较多[5],人工合成铁锰氧化物吸附剂药剂用量大、成本较高[6],负载型铁锰氧化物材料需要高温反复负载且负载量有限[7].长期运行的除铁除锰水厂生物滤池反冲洗过程中产生反冲洗废水,废水中含有大量富含铁锰氧化物的污泥,以1万t水厂为例,原水中铁质量浓度为6 mg/L,则每年产生含铁污泥约35 t,东北地区集中式含铁地下水的日处理能力估计至少300万t以上,因此,产生的污泥量能达近万吨[8-11].这些铁锰氧化物反冲洗泥如果处理不当会成为环境污染源,考虑到铁锰氧化物对砷的高效吸附性能,本文采用预处理后的除铁除锰水厂反冲洗污泥,进行除砷性能研究,比较其对As(Ⅲ)和As(V)的吸附效果并研究相关除砷机理,为除铁除锰水厂生物滤池产生的反冲洗污泥资源化提供参考.
1 实验 1.1 实验试剂及仪器实验使用的主要试剂硼氢化钾、氢氧化钠、硫脲均为优级纯,且测定时均使用超纯水,盐酸、NaAsO2、Na2HAsO4·7H2O均为分析纯.
实验使用的的主要仪器:电子分析天平、THZ-82恒温振荡器、聚乙烯瓶(容量为1 L),AFS-8230原子荧光分光光度计(北京吉天仪器有限公司)、ASAP2020物理吸附仪(美国麦克)、BRUCKER D8 X射线粉末衍射仪(布鲁克公司)、JEM 1200EX透射电子显微镜(日本电子株式会社)、pHSJ-3F实验室pH计.
1.2 供试材料供试材料来源于除铁除锰给水厂稳定运行阶段的生物滤池,该水厂进水Fe2+10 mg/L、Mn2+0.8~1.0 mg/L,滤池采用锰砂滤料,滤速5 m/h,反冲洗周期24~48 h,反冲洗强度10~12 L/(s·m2).收集滤池的反冲洗废水,静置数日,将沉积在底部的污泥取出自然风干,用研钵磨碎后过100目筛置于干燥处备用.铁锰氧化物反冲洗泥中铁锰元素比约为10:1,铁主要以FeOOH的形式存在,锰主要以高价态(+3、+4锰氧化物混合物形式)存在,铁锰氧化物占90%左右,二氧化硅约占5%,还有其他的钙、钾、磷等物质.pHzpc为6.7左右.
1.3 铁锰氧化物反冲洗泥的表征用X射线粉末衍射仪(BRUCKER D8,布鲁克公司,德国)和透射电子显微镜(JEM 1200EX,电子株式会社,日本)对富含铁锰氧化物的反冲洗泥进行表征.
1.4 实验方法配制质量浓度为1 000 mg/L的As(Ⅲ)和As(Ⅴ)的储备液,静态吸附试验使用时根据所需质量浓度逐级稀释.
1.4.1 吸附动力学实验称取0.1 g经过预处理后富含铁锰氧化物的反冲洗泥粉末置于聚乙烯瓶中,各加入1 L质量浓度分别为100 μg/L、1 mg/L、5 mg/L的As(Ⅲ)、As(Ⅴ)溶液,在25 ℃条件下以100 r/min的转速恒温振荡,自反应开始至48 h,共设置19个取样点.样品用0.45 μm的滤膜过滤测试.
1.4.2 吸附等温实验称取0.1 g样品置于一系列锥形瓶中,分别加入初始质量浓度在0.1~50 mg/L内的As(Ⅴ)溶液1 L,As(Ⅲ)溶液500 mL,在25 ℃条件下以100 r/min的转速恒温振荡,12 h后取样用0.45 μm的微孔滤膜过滤后测试.
1.4.3 影响因素研究初始pH对除砷效率的影响.天然水pH通常为6~9,在一系列聚乙烯塑料瓶中各加入1 L质量浓度为1 mg/L的As(Ⅴ)溶液,500 mL质量浓度2 mg/L的As(Ⅲ)溶液,调节初始pH分别为3~12不等,然后向As(Ⅴ)溶液和As(Ⅲ)溶液中各加入0.5 g/0.2 g富含铁锰氧化物的反冲洗泥粉末,在25 ℃下以100 r/min的转速恒温振荡,12 h后取样,静置后用0.45 μm的微孔滤膜过滤后测试.
共存离子对除砷效率的影响.取富含铁锰氧化物的反冲洗泥粉末0.5 g于一系列聚乙烯塑料瓶中,加入1 L质量浓度为1 mg/L的As(Ⅴ)溶液,500 mL质量浓度2 mg/L的As(Ⅲ)溶液,再加入不同浓度的HCO3-、SiO32-、H2PO4-、SO42-,在25 ℃下以100 r/min的转速恒温振荡,12 h后取样用0.45 μm的微孔滤膜过滤后测试.
1.5 分析方法取上清液用原子荧光光度计(AFS)测定两个平行样的砷质量浓度,取平均值,计算样品吸附砷的量,即
| $ Q = \frac{{({\rho _0} - {\rho _t})}}{m}V. $ | (1) |
吸附率
| $ \eta = \frac{{({\rho _0} - {\rho _t})}}{m}V. $ | (2) |
式中:Q为固相中砷质量分数,mg/g;ρ0为加入的待去除砷离子初始质量浓度,mg/L;ρt为t时刻溶液中剩余的砷离子质量浓度,mg/L;V为参加反应溶液的体积,L;m为在吸附过程中吸附剂的质量,g.
数据处理及拟合使用Origin 8.5软件.
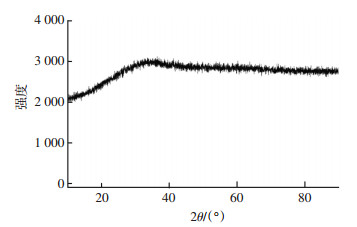
2 结果与讨论 2.1 铁锰氧化物反冲洗泥表征(XRD/TEM)除铁除锰水厂生物滤池在除铁除锰过程中生成的铁锰氧化物一部分负载在滤料表面,另一部分存在于滤料缝隙,在滤池反冲洗过程中大量铁锰氧化物会随反冲洗水流出,形成富含铁锰氧化物反冲洗污泥的废水.预处理后的铁锰氧化物反冲洗污泥的形貌和定性分析可由XRD和TEM观测得到.图 1为铁锰氧化物反冲洗泥XRD图谱,可以看出,在XRD图谱中没有明显的特征衍射峰,但在34.6°附近出现较宽的峰,与水铁矿的XRD图谱类似但不完全相同[12-13],说明铁锰氧化物反冲洗泥的结晶程度较差,以非晶态为主.
|
图 1 铁锰氧化物反冲洗泥X射线衍射图谱 Figure 1 X-Ray diffraction (XRD) spectra of iron and manganese oxide sludge |
图 2为铁锰氧化物反冲洗泥透射电镜图,可以看出,铁锰氧化物反冲洗泥中存在针状晶体结构且交织排列出片状几何体,此外还出现细小的球形颗粒状结构,分析认为分别与针铁矿及水铁矿的结构相似.张杰等[11]研究证实天然水体中的Fe2+在空气氧化作用下容易形成铁基氧化物,但由于地下水中其他离子如硅酸、钙、锰、锌等一起掺杂在含水氧化铁中,妨碍了含水氧化铁结晶化,X射线检测可知天然水形成的γ-FeOOH不具有X射线可检出的完整结晶构造,而是具有在检出界限之下的细微的γ-FeOOH构造,是含有大量各种杂质的含水氧化铁.此外,有相关研究发现载铁锰砂晶型为无定型结构,负载过程中的烘干温度在100 ℃以下时,铁氧化物的种类主要为水铁矿[14].通过EDS能谱分析得知铁的质量分数远高于其他元素,并含有锰元素,说明样品富含铁锰氧化物,同时样品中的硅、钙、钾含量相对也较高,且Si含量占比重相对较大,说明地下水中富含Si、Ca、K.单点BET法测得的比表面积为253.1 m2/g,BJH法孔体积为0.22 cm3/g,平均孔径为3.691 nm.从铁锰氧化物反冲洗泥的比表面积、孔容和孔径等物理性质可以看出,铁锰氧化物反冲洗泥比表面积大且孔隙发达.综上,铁锰氧化物反冲洗泥晶型为无定型结构,粒径小且比表面积大,表面可以提供更多的吸附位点,均有利于增强吸附除砷能力.

|
图 2 铁锰氧化物反冲洗泥透射电镜图谱 Figure 2 Transmission electron microscope (TEM) image of iron and manganese oxide sludge |
吸附等温线可以考察溶液中吸附行为,能反映吸附质在不同质量浓度下的吸附容量,运用模型拟合可得吸附剂最大吸附容量.
表 1为3个不同温度下铁锰氧化物反冲洗泥对As(Ⅲ)吸附实验结果进行Freundlich和Langmuir模型拟合.由表 1可见,在25 ℃时,Langmuir模型(R2=0.982)与Freundlich模型(R2=0.974)均能很好地描述吸附过程.在35和45 ℃时,Freundlich等温吸附模型(R2>0.99)对As(Ⅲ)等温吸附数据的拟合较优,这说明随着温度升高,铁锰氧化物反冲洗泥表面与As(Ⅲ)之间作用力增强,存在多分子层吸附过程.Langmuir模型假设铁锰氧化物反冲洗泥表面吸附位点的吸附能均相同,但是从实验结果分析可知,当温度较高时铁锰氧化物反冲洗泥对As(Ⅲ)去除包含表面氧化还原和吸附两个过程,吸附能存在一定差异.
| 表 1 As(Ⅲ)吸附等温线非线性拟合参数 Table 1 Nonlinear fitting parameters of As (Ⅲ) adsorption isotherm |
表 2为将实验结果用Freundlich和Langmuir模型非线性拟合,可以看出,Langmuir模型对于不同温度下As(Ⅴ)等温吸附拟合数据的相关系数均较高(R2>0.99),Freundlich等温吸附模型拟合相关系数稍低(0.972~0.976),说明铁锰氧化物反冲洗泥对As(Ⅴ)的吸附以单分子层吸附为主.在25、35、45 ℃条件下最大吸附容量分别为40.37、42.84和45.81 mg/g,温度越高吸附效果越优,分析认为吸附过程为吸热反应,化学吸附力在温度升高时成为吸附As(Ⅴ)的主要作用力.在25 ℃下计算得到As(Ⅲ)和As(Ⅴ)最大吸附容量分别为36.53和40.37 mg/g.分析认为As(Ⅲ)在铁锰氧化物反冲洗泥表面是先氧化再吸附,而本实验所取的反冲洗泥中锰质量浓度极低,不能对As(Ⅲ)进行充分吸附,故表现为对As(Ⅲ)最大吸附容量低于As(Ⅴ). 表 3为与其他研究中吸附剂对砷的最大吸附量对比,可以看出,铁锰复合氧化物反冲洗泥最大吸附容量远大于负载型吸附剂,略小于化学合成的铁锰氧化物吸附剂,作为除砷吸附剂具有良好的实际应用前景.
| 表 2 As(Ⅴ)吸附等温线非线性拟合参数 Table 2 Nonlinear fitting parameters of As(Ⅴ) adsorption isotherm |
| 表 3 一些吸附剂对As的最大吸附容量 Table 3 Maximum adsorption capacity of some adsorbent |
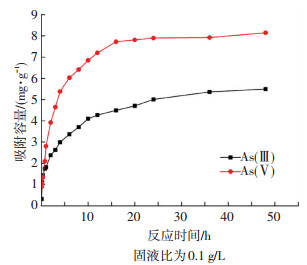
图 3为初始质量分数为1 mg/g的As(Ⅲ)和As(Ⅴ)铁锰氧化物反冲洗泥吸附As(Ⅲ)和As(Ⅴ)的动力学曲线.可以看出,在反应初期无论是As(Ⅴ)还是As(Ⅲ),吸附容量均增加较快,在24 h后逐渐趋于平衡.铁锰氧化物反冲洗泥吸附动力学过程符合多孔吸附剂发生吸附的3个阶段[15]:瞬间吸附阶段即在反应初期(< 5 h)吸附容量随时间急速上升,此时吸附过程发生在吸附剂外表面,铁锰氧化物反冲洗泥表面有足够吸附位点可吸附砷,且溶液中存在较高的砷浓度差,故吸附效率较快;逐渐吸附阶段即随着吸附的进行,溶液中砷离子浓度逐渐降低,表层吸附饱和后会逐渐向内部扩散,扩散阻力的增加会使吸附速率逐渐降低;最终平衡阶段即吸附24 h后,吸附过程主要发生在吸附剂内表面高能电位,且质量浓度差形成的推动力越来越小,最终达到吸附平衡.与As(Ⅴ)相比,As(Ⅲ)达到平衡的时间更长,推断可能是因为As(Ⅲ)去除过程中反应复杂,且在氧化还原的过程中在铁锰氧化物反冲洗泥表面产生新的活性吸附位,不断进行吸附.
|
图 3 As(Ⅲ)、As(Ⅴ)的吸附动力学曲线 Figure 3 Adsorption kinetics curve of As(Ⅲ), As(Ⅴ) |
为了研究铁锰氧化物反冲洗泥去除水中As(Ⅲ)和As(Ⅴ)的吸附动力学特征,将实验数据用准一级和准二级动力学模型进行拟合,.表 4为Lagergren准一级和Lagergren准二级动力学模型拟合结果,可以看出,两个动力学模型均能描述此吸附反应,拟合参数0.998 6>0.887 5,0.992 3>0.985,说明准二级动力学拟合优于准一级动力学,化学吸附是铁锰氧化物反冲洗泥对砷吸附的关键因素.拟合系数均在0.99以上说明包含多种吸附过程,如吸附质在吸附剂外部液膜中扩散、吸附和吸附质在吸附剂内部微孔结构发生扩散等,且吸附过程涉及专性吸附反应.已有研究表明,铁锰氧化物在砷表面的吸附符合准二级动力学模型.
| 表 4 准一级和二级动力学模型拟合参数 Table 4 Parameters of kinetic models |
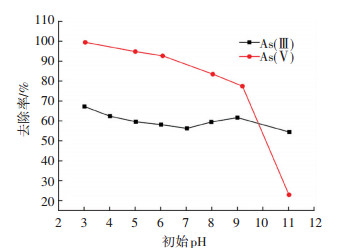
pH影响砷在水溶液中的形态,砷的不同存在形式进一步影响了吸附剂的吸附效果.为了研究铁锰氧化物反冲洗泥除砷时较为适宜的pH,在不同初始pH条件下进行吸附除砷实验.图 4为铁锰氧化物反冲洗泥除砷性能受初始pH影响的实验结果,可以看出,与As(Ⅲ)相比,As(Ⅴ)溶液的吸附初始pH对砷去除率影响较大.当pH由6升高到8时,As(Ⅴ)去除率从92.67%下降到83.47%,随着pH继续升高,去除率逐渐下降,当pH为11时去除率仅为22.19%.分析认为,溶液pH的变化能改变溶液中砷的存在形态,同时,吸附剂表面正负电荷也会发生变化,铁锰氧化物反冲洗泥Zeta电位在pH为3时大约28 mV,随着pH升高至10而逐步减低至-32 mV,pHzpc为6.7左右.因此,pH较低时铁锰氧化物反冲洗泥吸附剂表面吸附H+形成带正电的基团,增加了吸附剂表面正电荷,从而使得与砷离子之间的静电力增强,表现为吸附容量较高.
|
图 4 初始pH对除砷效率的影响 Figure 4 Effect of pH on As removal |
As(Ⅲ)去除率随初始pH变化下降趋势不明显,在3 < pH < 7时,溶液中As(Ⅲ)去除率由67.2%下降到56.2%,在7 < pH < 9时溶液中As(Ⅲ)反向升高到61.7%,随后As(Ⅲ)去除率急剧下降.在3 < pH < 9的砷溶液中As(Ⅴ)主要以带负电的砷阴离子形式存在,As(Ⅲ)则主要以H3AsO3的形式存在,As(Ⅲ)相对于As(Ⅴ)迁移性强,不容易被吸附剂吸附,因此,水处理工艺中常选氯气、高锰酸钾预氧化剂将其氧化为As(Ⅴ)提高去除率.铁锰氧化物反冲洗泥中富含的锰氧化物可氧化As(Ⅲ),有研究表明锰氧化物对As(Ⅲ)的氧化作用随pH升高呈下降趋势.分析认为在3 < pH < 7时砷吸附去除率与As(Ⅲ)氧化率一致,在7 < pH < 9时砷去除率较快,可能是由于锰氧化物氧化使得Mn2+溶出从而导致吸附剂表面结构被破坏,提供了更多的吸附位点,在pH大于9时吸附剂表面负电荷增加,与溶液中砷阴离子之间在静电斥力的作用下造成去除率急剧下降,溶液中剩余As(Ⅲ)质量浓度升高[20].
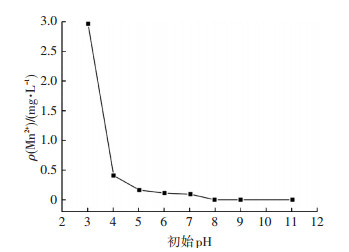
《生活饮用水卫生标准》(GB5749—2006)规定,铁和锰的最高质量浓度分别为0.3和0.1 mg/L,因此,有必要研究铁锰氧化物反冲洗泥除砷过程中铁锰溶出情况.实验结果表明,pH在3~12时,As(Ⅴ)去除过程中几乎没有铁锰离子溶出,质量浓度完全符合饮用水标准,而在去除As(Ⅲ)时由于二氧化锰还原溶解会向溶液中释放Mn2+.图 5为铁锰氧化物反冲泥粉末除As(Ⅲ)过程中随pH变化锰离子溶出情况.可以看出,在pH为3.02时,溶液中锰离子质量浓度为2.96 mg/L,随pH增加,溶液中锰离子质量浓度迅速降低,当pH大于7时,溶液中锰离子质量浓度完全符合国标规定的0.1 mg/L以下.这一现象说明释放到溶液中的锰离子可能被吸附在吸附剂表面,从而导致溶液中锰离子质量浓度减小.因此,实际中饮用的地下水pH通常大于7,不存在锰离子溶出的风险.
|
图 5 不同pH条件下As(Ⅲ)去除过程Mn2+溶出 Figure 5 Effect of pH on the dissolution of Mn2+ |
吸附剂的吸附速率是描述吸附剂吸附能力的一个重要指标,吸附剂在有限时间内吸附速率越快,吸附能量越强.不同的吸附机理使铁锰氧化物反冲洗泥对As(Ⅲ)和As(Ⅴ)吸附速率不同,图 6为铁锰氧化物反冲洗泥对溶液中砷的吸附速率随时间变化的结果.可以看出,铁锰氧化物反冲洗泥对As(Ⅴ)吸附速率较快,在12 h后逐渐趋于平衡,对As(Ⅲ)的吸附速率在10 h后逐渐降低,24 h后逐渐趋于平缓.初始As(Ⅴ)质量浓度为1 mg/L时,As(Ⅲ)和As(Ⅴ)的初始吸附速率分别为1.81和2.81 mg/(g·h).与As(Ⅴ)的吸附速率相比,As(Ⅲ)的初始吸附速率较低.分析认为,由于As(Ⅲ)反应初始阶段存在复杂的反应,表现为As(Ⅴ)吸附速率高于As(Ⅲ),因此,推断As(Ⅲ)的吸附需先经锰氧化物氧化再进行吸附,氧化还原反应的进行需要反应时间,而As(Ⅴ)则可以直接通过静电引力或专性吸附被吸附[17, 21].
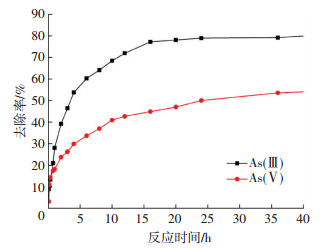
|
图 6 As(Ⅲ)和As(Ⅴ)吸附速率 Figure 6 Adsorption rate of As(Ⅲ) and As(Ⅴ) |
As(Ⅲ)和As(Ⅴ)通常以阴离子形式存在于天然水体中,而天然水体成分复杂,含有多种离子,特别是结构与(亚)砷酸根相似的阴离子如SiO32-、H2PO4-等.因此,研究共存离子对铁锰氧化物反冲洗泥除砷效率的影响有助于将其应用于实际水溶液.在25 ℃下,向1 L初始As(Ⅴ)质量浓度为1 mg/L和500 mL初始As(Ⅲ)质量浓度为2 mg/L的溶液中各加入等量的不同浓度的HCO3-、SO42-、SiO32-、H2PO4-,图 7为共存阴离子对As(Ⅲ)和As(Ⅴ)的去除率影响.可以看出,当HCO3-浓度在0.1~10 mmol/L时,去除率为91%>79%>58%,HCO3-浓度越高抑制越明显.当吸附As(Ⅲ)时,不同浓度的HCO3-对吸附效率的影响程度大小仍为:73%>63%>55%.不同浓度HCO3-的存在会影响溶液的pH,前述实验pH研究结果表明,pH越大As(Ⅴ)去除率越低,pH对As(Ⅲ)的影响则呈现出随pH增高去除率先降低、后升高、最后下降,推测此为主要原因.当SO42-浓度在0.1~10 mmol/L时,对As(Ⅴ)的吸附效果影响不大,浓度由0.1增加到10 mmol/L时,去除率从94%增加到99%,去除率略微增强,对As(Ⅲ)的影响不大.当SO42-浓度高达10 mmol/L时,As(Ⅲ)仅仅受到略微的增强.当H2PO4-与SiO32-浓度在0.1~10 mmol/L时,共存离子浓度为0.1 mmol/L存在明显抑制.H2PO4-与SiO32-浓度为0.1 mmol/L时,对As(Ⅴ)去除率分别为37%和63%,As(Ⅲ)去除率则更低,浓度为10 mmol/L时,铁锰氧化物反冲洗泥对As(Ⅲ)和As(Ⅴ)几乎无去除效果.由于磷与砷位于同一主族,H2PO4-、SiO32-与砷酸根分子结构相似,除静电斥力之外,H2PO3-还可以与吸附剂表面的羟基或水合基发生配位交换,竞争材料表面活性吸附位点,替代砷阴离子在双电子层发生专性吸附,降低对砷的去除率.不同浓度的H2PO4-与SiO32-对于As(Ⅲ)的影响程度低于As(Ⅴ),当加入H2PO4-与SiO32-由0.1 mmol/L增加到1 mmol/L时,As(Ⅲ)去除率分别下降7.1%和11.4%,而As(Ⅴ)去除率则下降了27.4%和32.1%,推测可能是由于As(Ⅲ)初始浓度是As(Ⅴ)的2倍造成,浓度越大,共存离子对除砷效果影响越小.实验结果与其他研究中结果一致[19-20, 22].
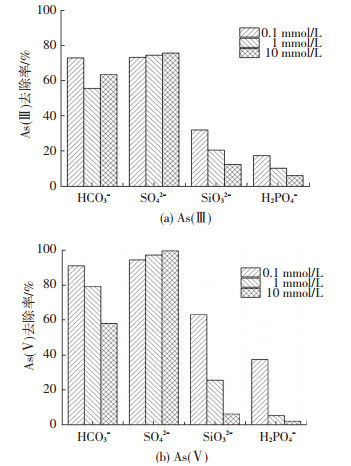
|
图 7 共存阴离子对As(Ⅲ)、As(Ⅴ)去除率影响 Figure 7 Effect of coexistence anionic on As(Ⅲ), As(Ⅴ) removal |
已有大量研究证实铁锰氧化物具有一定的吸附除砷能力,铁锰氧化物对砷的吸附主要包括物理吸附和化学吸附.文献[9]表明,铁锰氧化物反冲洗泥表面存在大量排列松散的小颗粒,孔隙结构发达.前述XRD和TEM分析可知,铁锰氧化物反冲洗泥为无定型结构,比表面积较大,因此,铁锰氧化物反冲洗泥可物理吸附除砷.铁锰氧化物反冲泥含有大量羟基铁氧化物,Fe-OH表面羟基中的H+较为活泼,容易离解,实验室配制的含砷水,As(Ⅲ)在水中离解后主要存在形式为H3AsO3,与羟基铁最终生成FeH3AsO3+、FeH3AsO30和FeH3AsO3-等物质.此外,根据前述铁锰氧化物反冲洗泥吸附除砷过程中Mn2+溶出可以推测,铁锰氧化物反冲洗泥中的锰氧化物可能将As(Ⅲ)氧化为As(Ⅴ),自身还原为Mn2+,氧化后的As(Ⅴ)可在反冲洗泥表面很快被FeOOH吸附.实验室配水中As(Ⅴ)多以HAsO42-、AsO43-形态存在,铁锰氧化物反冲洗泥中的γ-FeOOH在吸附As(Ⅴ)的过程中可以通过表面配位机制将砷阴离子捕获到其表面,进而与AsO43-生成FeH2AsO40、FeHAsO4-、FeAsO42-和FeOHAsO43-等物质[23].因此,可推测铁锰氧化物反冲洗泥对砷的吸附也是物理吸附和专性吸附共同作用的结果.
3 结论1) XRD和TEM表征得知,铁锰氧化物反冲洗泥的晶型为无定型结构,粒径小且比表面积大,Langmiur模型可以较好地模拟铁锰氧化物反冲洗泥对As(Ⅴ)的等温吸附过程,推测为单层吸附,对As(Ⅲ)则不能用单一模型拟合,25 ℃时As(Ⅲ)和As(Ⅴ)最大吸附容量分别为36.53和40.37 mg/g,单位吸附容量随温度升高不断增加.对地下水中的As(Ⅲ)和As(Ⅴ)吸附过程均符合准二级动力学模型,初始吸附阶段速率较高,随吸附过程进行速率逐渐减慢.As(Ⅲ)初始吸附速率低于As(Ⅴ),对As(Ⅲ)的去除包含氧化和吸附两个阶段.
2) 随pH升高,As(Ⅲ)吸附容量先降低、后升高、再降低,As(Ⅴ)吸附容量则一直降低.H2PO4-与SiO32-浓度为0.1 mmol/L时,能明显抑制反冲洗泥粉末对As(Ⅲ)和As(Ⅴ)的吸附,其他离子影响不大.
3) 铁锰氧化物反冲洗泥对As(Ⅲ)和As(Ⅴ)的吸附可能包含物理吸附和专性吸附,吸附后溶液中铁锰质量浓度均符合国家生活饮用水卫生标准.
4) 本文主要针对铁锰氧化物反冲洗泥吸附除砷性能进行研究,证实了其对含砷水深度净化的可行性,但对于实际应用仍有很多内容尚待完善.首先铁锰氧化物反冲洗泥吸附除砷后难以泥水分离,其次吸附饱和后的再生及废料妥善处置问题也是实际应用当中必须解决的问题.
| [1] |
郭华明, 倪萍, 贾永锋, 等. 原生高砷地下水的类型、化学特征及成因[J].
地学前缘, 2014(4): 1-12.
GUO Huaming, NI Ping, JIA Yongfeng, et al. Types, chemical characteristics and genesis of geogenic high arsenic groundwater in the world[J]. Earth Science Frontiers, 2014(4): 1-12. |
| [2] |
云奋, 杨咪咪, 马彩凤, 等. 大同市饮水型地方性砷中毒病区环境生态中砷暴露水平调查[J].
卫生研究, 2015(1): 82-85.
YUN Fen, YANG Mimi, MA Caifeng, et al. Investigation of the arsenic levels in ecosystem aspect in water type of endemic arsenicosis area in Datong City[J]. Journal of Hygiene Research, 2015(1): 82-85. |
| [3] |
SMEDLEY P L, KINNIBURGH D G. A review of the source, behaviour and distribution of arsenic in natural waters[J].
Applied Geochemistry, 2002, 17(5): 517-568.
DOI: 10.1016/S0883-2927(02)00018-5 |
| [4] |
董玉良, 高晓慧, 孙娅婷, 等. 铁锰复合氧化物吸附作用研究进展[J].
矿物学报, 2015, 35(3): 288-292.
DONG Yuliang, GAO Xiaohui, SUN Yaping, et al. Progress on the adsorption effect by Fe-Mn binary oxide[J]. Acta Mineralogica Sinica, 2015, 35(3): 288-292. |
| [5] |
CHAKRAVARTY S, DUREJA V, BHATTACHARYYA G, et al. Removal of arsenic from groundwater using low cost ferruginous manganese ore[J].
Water Research, 2002, 36(3): 625-632.
DOI: 10.1016/S0043-1354(01)00234-2 |
| [6] |
常方方, 曲久辉, 刘锐平, 等. 铁锰复合氧化物的制备及其吸附除砷性能[J].
环境科学学报, 2006(11): 1769-1774.
CHANG Fangfang, QU Jiuhui, LIU Ruiping, et al. Preparation of Fe-Mn bmietal oxide adsorbent and its adsorption characteristics of arsenic[J]. Acta Scientiae Circumstantiae, 2006(11): 1769-1774. DOI: 10.3321/j.issn:0253-2468.2006.11.003 |
| [7] |
刘振中, 邓慧萍. 负载铁锰氧化物的活性炭除砷酸盐的性能研究[J].
哈尔滨工业大学学报, 2010(8): 1317-1322.
LIU Zhenzhong, DENG Huiping. Arsenate removalperformance on GAC impregnated with Fe-Mn oxide[J]. Journal of Harbin Institute of Technology, 2010(8): 1317-1322. DOI: 10.11918/j.issn.0367-6234.2010.08.029 |
| [8] |
高洁, 丁时宝, 张杰. 生物除铁除锰滤池稳定运行阶段反冲洗研究[J].
湘潭矿业学院学报, 2003(4): 83-86.
GAO Jie, DING Shibao, ZHANG Jie. Study on the backwashing of biological iron and manganese removal filter in stable operation stage[J]. Journal of Xiangtan Mining Institute, 2003(4): 83-86. |
| [9] |
曾辉平. 生物除铁除锰滤池长期运行后除锰能力下降原因的探究[D]. 哈尔滨: 哈尔滨工业大学, 2007.
ZENG Huiping. A research into the reason why the manganese removal efficiency of the biological iron and manganese removal filter declines after long-time operation. [D]. Harbin: Harbin Institute of Technology, 2007. |
| [10] |
李冬, 张杰, 陈立学, 等. 生物除铁除锰在地下水处理厂的应用[J].
中国给水排水, 2004(12): 85-88.
LI Dong, ZHANG Jie, CHEN Lixue, et al. Application of biological removal of iron and manganese from ground water treatment plant[J]. China Water & Waste Water, 2004(12): 85-88. DOI: 10.3321/j.issn:1000-4602.2004.12.026 |
| [11] |
张杰, 李冬, 杨宏, 等.
生物固锰除锰机理与工程技术[M]. 北京: 中国建筑工业出版社, 2005: 52-62.
ZHANG Jie, LI Dong, YANG Hong, et al. Mechanuism of biological manganese fixation and removal and biological iron and manganese removal technology[M]. Beijing: China Building Industry Press, 2005: 52-62. |
| [12] |
孙林, 王寅, 司友斌. 三种铁氧化物对As(Ⅲ)和As(Ⅴ)的吸附研究[J].
土壤通报, 2016, 47(1): 198-206.
SUN Lin, WANG Yin, SI Youbin. Comparison ofadsorption of As(Ⅲ) and As(Ⅴ)by three iron oxides[J]. Chinese Journal of Soil Science, 2016, 47(1): 198-206. |
| [13] |
崔慧瑛, 梁成华, 杜立宇, 等. 水铁矿对As(Ⅲ)的吸附性能的研究[J].
浙江农业学报, 2012(3): 490-493.
CUI Huiying, LIANG Chenghua, DU Liyu, et al. Study on characteristics of adsorption of As(Ⅲ) by ferrihydrite[J]. Acta Agriculturae Zhejiangensis, 2012(3): 490-493. |
| [14] |
WU K, LIU R, LIU H, et al. Arsenic (Ⅲ, V) adsorption on iron-oxide-coated manganese sand and quartz sand: Comparison of different carriers and adsorption capacities[J].
Environmental Engineering Science, 2011, 28(9): 643-651.
DOI: 10.1089/ees.2010.0307 |
| [15] |
KUMAR K V, RAMAMURTHI V, SIVANESAN S. Modeling the mechanism involved during the sorption of methylene blue onto fly ash[J].
Journal of Colloid and Interface Science, 2005, 284(1): 14-21.
DOI: 10.1016/j.jcis.2004.09.063 |
| [16] |
刘喜, 敖鸿毅, 刘剑彤. 铁改性竹炭去除水中的As(Ⅲ)和As(Ⅴ)[J].
环境工程学报, 2012(9): 2958-2962.
LIU Xi, AO Hongyi, LIU Jiantong. Removal ofAs(Ⅲ) and As(Ⅴ) from water by iron modified bamboo charcoal[J]. Chinese Journal of Environmental Engineering, 2012(9): 2958-2962. |
| [17] |
代天娇, 彭彤, 陶晨, 等. 天然锰砂去除水中的砷[J].
环境工程学报, 2013(1): 58-64.
DAI Tianjiao, PENG Tong, TAO Chen, et al. Removal of arsenic from water by natural manganese sand[J]. Chinese Journal of Environmental Engineering, 2013(1): 58-64. |
| [18] |
黄永炳, 李晓娟, 王丽丽, 等. 铁改性锰矿对砷的吸附性能研究[J].
武汉理工大学学报, 2011(9): 115-119.
HUANG Yongbing, LI Xiaojuan, WANG Lili, et al. Study on the adsorption performance of iron modified manganese ore of arsenic[J]. Journal of Wuhan University of Technology, 2011(9): 115-119. |
| [19] |
ZHANG G, QU J, LIU H, et al. Preparation and evaluation of a novel Fe-Mn binary oxide adsorbent for effective arsenite removal[J].
Water Research, 2007, 41(9): 1921-1928.
DOI: 10.1016/j.watres.2007.02.009 |
| [20] |
CHANG F, QU J, LIU H, et al. Fe-Mn binary oxide incorporated into diatomite as an adsorbent for arsenite removal: Preparation and evaluation[J].
Journal of Colloid and Interface Science, 2009, 338(2): 353-358.
DOI: 10.1016/j.jcis.2009.06.049 |
| [21] |
赵安珍, 徐仁扣. 二氧化锰对As(Ⅲ)的氧化及其对针铁矿去除水体中As(Ⅲ)的影响[J].
环境污染与防治, 2006(4): 252-253.
ZHAO Anzhen, XU Renkou. Oxidation of As(Ⅲ) by MnO2 and its effect on theremoval of arsenic from water by goethite[J]. Environmental Pollution and Control, 2006(4): 252-253. |
| [22] |
董婧. 铁锰复合氧化物的制备及除砷性能研究[D]. 武汉: 武汉理工大学, 2013.
DONG Jing. Synthesis and arsenic removal on ferruginous manganese[D]. Wuhan: Wuhan University of Technology, 2013. |
| [23] |
JANG J, DEMPSEY B A. Coad sorption of Arsenic(Ⅲ) and Arsenic(V) onto hydrous ferric oxide: Effects on abiotic oxidation of Arsenic(Ⅲ), extraction efficiency, and model accuracy[J].
Environmental Science & Technology, 2008, 42(8): 2893-2898.
|
 2018, Vol. 50
2018, Vol. 50


