2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学), 哈尔滨 150090
2. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China
近年来,地下水砷污染问题受到越来越多的关注,世界卫生组织、美国、中国等先后将饮用水中砷的最大允许质量浓度由50 μg/L调为10 μg/L.基于铁基吸附剂的地下水除砷技术较传统工艺经济高效,成为国内外研究重点[1-2].然而砷去除效率高低很大程度上取决于砷的存在形态,地下水通常呈厌氧状态,pH一般为6.5~8.5,砷主要以As(Ⅲ)的溶解性分子H3AsO3存在,较难被正价离子吸附去除.因此,通常As(Ⅲ)需要氧化预处理为As(Ⅴ),以提高去除效率.Thon Phommavong等[3]通过KMnO4氧化及锰砂过滤工艺研究发现,当进水As(Ⅲ)质量浓度为100 μg/L时,投加一定量的KMnO4能够氧化As(Ⅲ)、Fe(Ⅱ)、Mn(Ⅱ),并能实现Fe、As质量比20:1条件下,80%左右的砷去除率;吴鹍等[4]采取投加FeCl3与KMnO4溶液原位生成铁锰氧化物(即FMBO)净化含砷水,以10 m/h的高滤速运行,实现了进水总砷由50 μg/L降至10 μg/L以下.添加氧化剂能够促进FMBO原位生成,利于砷的氧化吸附,但由于生成絮体量及截污能力增加,滤柱运行48 h内水头急剧增长,总水头损失由40 cm增加至245 cm,而顶部30 cm区域水头损失占总水头损失的83.7%.
Fe、As常共存于厌氧地下水中[5],滤柱可以借助原位生成的铁氧化物实现砷的吸附去除,整个过程不需外加氧化剂,经济方便、适用性广.杨柳[6]采用滤柱去除铁砷共存地下水,在进水As(Ⅲ)质量浓度为80~120 μg/L、Fe(Ⅱ)质量浓度为0.4~1.6 mg/L、Mn(Ⅱ)质量浓度为1~1.5 mg/L、滤速为3 m/h的条件下运行生物滤柱120 d,出水铁、锰、砷同时稳定达标.Damodar.Pokhrel[7]以低滤速0.2 m/h运行生物滤柱发现:当进水As(Ⅲ)质量浓度为100 μg/L,Fe、As比为40:1条件下,出水As质量浓度能够保持在5 μg/L以下,除砷效果非常好.而地下水中铁与砷质量浓度相关性并不明显,一些地区如河套盆地(铁0.5 mg/L,砷213 μg/L)、大同盆地(铁0.08 mg/L,砷308 μg/L)铁砷比例非常低[8],原水中铁氧化生成的吸附剂不充分,需要外加铁盐才能将砷去除干净.因此,有必要明晰低铁情况下含砷地下水滤柱净化过程中铁砷比及滤速对除砷效果的影响,为实际水厂运行提供可靠的依据.为此,在不添加氧化剂条件下,采用原位生成铁基吸附剂的滤柱除砷工艺处理含砷地下水,以分布较广、利用价值较高、质量浓度低于100 μg/L的砷污染饮用水源[6]为研究对象,探究能否在合适的铁盐质量浓度下实现砷的达标去除,并对比分析不同铁砷比、滤速下除砷效能,筛选出较合适滤柱运行条件,同时探究砷沿程去除规律.
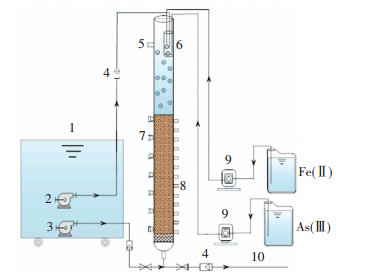
1 实验 1.1 实验装置实验装置如图 1所示.采用3个相同的有机玻璃滤柱R1、R2、R3,滤柱高2 500 mm,内径90 mm,承托层卵石厚度为300 mm,滤层厚度为1 200 mm,滤料为粒径0.8~1.2 mm的石英砂.从滤层低端开始每隔200 mm设置一个取砂口(共7个),每隔100 mm设置一个取水样口(共12个),2个水箱联用,尺寸均为0.7 m(宽)×1 m(长)×1 m(高),配药箱体积为25 L.
|
1—进水箱; 2—进水泵; 3—反冲洗水泵; 4—转子流量计; 5—溢流口; 6—静态混合器; 7—取砂口; 8—取水样口; 9—进药蠕动泵; 10—出水 图 1 实验装置示意 Figure 1 Experimental equipment of the reactor |
实验模拟地下水水质采用人工配制的方法,原水中的铁、砷根据需求浓度由自来水与FeSO4·7H2O及NaAsO2溶液按不同比例混合而得,高浓度Fe2+、As(Ⅲ)、原水经多头蠕动泵输送至静态混合器跌水后进入滤层,由于滤柱中滤层滤料上方一定的水深,导致原水不能及时进入滤层,在进入滤层时原水中部分亚铁离子(约1/4至1/3左右)发生自然氧化现象.实验用水水质见表 1.
| 表 1 实验用水水质 Table 1 Physicochemical characteristics of the experimental water |
本实验主要分为3部分.第1部分:滤速为5 m/h条件下,分别筛选滤柱R1在进水As(Ⅲ)质量浓度为50 μg/L、滤柱R2在进水As(Ⅲ)质量浓度为100 μg/L时的最优铁砷比例;第2部分:启动滤柱R3并以进水As质量浓度为50~70 μg/L、总Fe质量浓度为2 mg/L为基础运行36 d,期间滤速由3 m/h逐渐提升到10 m/h,研究滤速提升对砷沿程去除效果的影响、滤柱长期运行过程中除砷效果及反冲洗周期的变化.第3部分:探究滤柱沿程除砷规律及机理.在每个运行周期内分别从取水口、取砂口取样(从上往下每隔20 cm)进行沿程Fe、As去除规律分析.其中砂样经浓盐酸解吸处理,溶解掉石英砂表面负载的铁氧化物薄膜,并对解吸液进行检测.实验中所有的玻璃器皿清洗后均用10%稀硝酸浸泡24 h,浸泡后用超纯水清洗干净备用.
1.4 测定项目与方法实验进出水测定Fe2+,Fe3+,As(Ⅲ)、As(Ⅴ),pH、浊度和水温等参数,其中Fe2+,Fe3+均采用二氮杂菲分光光度法;As(Ⅲ)及As(Ⅴ)测定采用原子荧光光度法(原子荧光光度计AFS-8230与形态分析仪SA-10);pH采用雷磁pHSJ-3F测定;浊度、水温采用WTW测定仪.
2 结果与讨论 2.1 滤柱除砷最佳铁砷比基于原位生成铁基吸附剂的滤柱除砷过程,既能实现铁的沿层氧化、过滤,又能提供大量的r-FeOOH表面吸附位点及共沉淀条件,促进砷沿层同步去除[9].铁砷比作为滤柱除砷过程的限制因素,控制不当易引起整个系统除砷率下降,水质难以达标.为明晰低质量浓度含砷地下水在滤柱净化过程中铁砷比例关系,以滤柱R1、R2分别在进水As(Ⅲ)质量浓度为50、100 μg/L左右条件下,探究满足出水要求的最优铁砷比例.同时,本实验也拟探究不添加氧化剂条件下,原位生成铁基吸附剂净化低质量浓度含砷水的可行性.为排除新石英砂滤料吸附砷对滤柱除砷过程的分析产生干扰,滤柱实验首先配置进水仅含As(Ⅲ)离子,其质量浓度约为100 μg/L,在滤速为5 m/h的条件下运行,发现运行4 d后进出水砷质量浓度基本吻合,石英砂吸附除砷能力耗尽.滤柱R1、R2在铁盐质量浓度为0.4、0.8、1.2、1.6、2.0 mg/L条件下均运行5 d,为防水头损失过大,影响后续实验进行,对滤柱进行周期性的反冲洗,反冲洗强度为20 L/(s·m2)左右,反冲洗时间约为5 min.
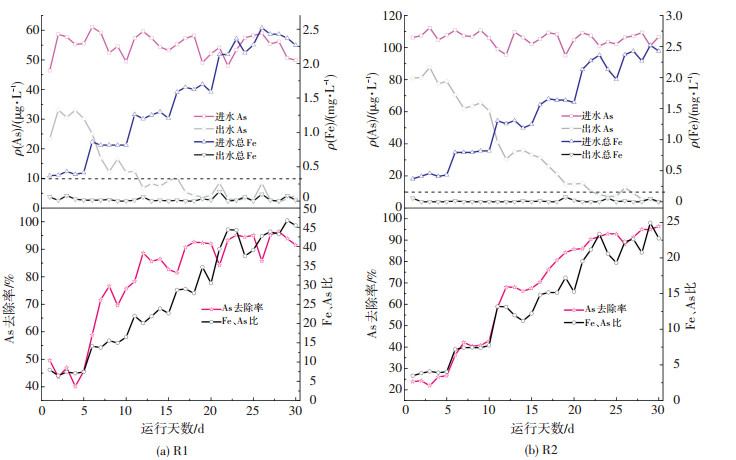
如图 2(a)所示,R1运行前5 d内,进水总Fe质量浓度为0.4 mg/L左右,其中Fe2+质量浓度约为0.2 mg/L,砷去除率仅为50%,质量浓度降低约20 μg/L,出水明显不能达标.此过程中由于滤柱中除铁滤膜尚未形成,石英砂滤料表面负载形成的r-FeOOH较少,多数亚铁盐经自然氧化过程形成Fe(OH)3,并被滤料拦截,但是由于投加的铁盐数量有限,生成的铁基吸附剂不能为砷的吸附提供充足吸附位点[10-12],同时共沉淀作用微弱,除砷效率较低.随着进水中铁盐质量浓度不断增加,砷去除率相应提高,出水砷质量浓度逐渐降低,直至10 μg/L以下.进水中铁盐投加量为1.2 mg/L时,连续运行5 d,出水砷能够一直保持达标状态,继续提高进水铁盐质量浓度,出水砷质量浓度始终满足达标条件.由图 2(b)可知,出水砷质量浓度始终满足达标条件.R2运行规律同R1相似,随着铁氧投加量的不断增加,砷去除效果大幅度提升,当进水Fe质量浓度高于2.0 mg/L时,出水砷质量浓度一直维持在达标状态.滤柱R1和R2在整个实验过程中出水中Fe质量浓度一直保持在0.1 mg/L以下.对比图 2(a)、(b)可知,在不添加氧化剂条件下,As去除率随着Fe、As比的不断增加而提高,R1、R2满足净水要求的最佳铁砷比约为20:1.
|
图 2 不同进水Fe质量浓度条件下滤柱出水Fe、As质量浓度及As去除率 Figure 2 Fe, As concentration and As removal rate of filter column under different Fe concentration conditions |
前述实验证明滤柱原位生成铁基吸附剂工艺对低质量浓度砷有良好的吸附去除效果,为进一步开发工艺潜力、探究其工程应用可行性,以滤柱除砷工艺的重要运行参数——滤速为研究对象,分别探究滤速提升过程中滤柱运行效果、实验条件下可以实现的极限滤速及滤速对砷沿程去除效果的影响.实验启动滤柱R3,进水As(Ⅲ)质量浓度为50~70 μg/L,铁盐投加量为2.0 mg/L左右,设计滤速逐渐从3 m/h提升到10 m/h,滤柱在每个滤速条件下运行时间均为9 d.
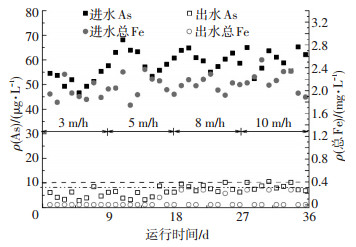
2.2.1 滤速提升对滤柱运行效果的影响由图 3可知,当进水As(Ⅲ)质量浓度为50~70 μg/L、总Fe质量浓度为2 mg/L左右、滤速由3 m/h逐渐提升至10 m/h时,出水中Fe质量浓度一直稳定达标,残留As质量浓度呈增加趋势,但基本维持在10 μg/L以下.滤柱运行初期Fe2+可以自然氧化为Fe(OH)3,运行一段时间后石英砂表面的铁质活性滤膜成熟,进水中Fe2+可借助铁盐自催化氧化过程氧化为FeOOH,并过滤得以去除.由滤柱除砷最佳铁砷比实验结果可知,在进水As质量浓度为50 μg/L、滤速为5 m/h条件下,保证砷出水达标的铁盐质量浓度仅为1.2 mg/L,因此,滤柱R3在进水As质量浓度为50~70 μg/L、Fe质量浓度为2 mg/L左右、滤速为3 m/h以及5 m/h条件运行过程中,沿程生成的铁氧化物吸附剂含量相对过剩,滤层间富集大量的未饱和铁基吸附剂,当水质发生波动时,滤柱除砷能力具有一定的抗冲击性,滤柱整体除砷效果最佳.实验结果显示,滤柱以低滤速3、5 m/h条件运行1~18 d内,出水中As质量浓度均值为3 μg/L,滤柱除砷能力充足,这与上述推论一致.而当滤速不断提升至10 m/h时,出水As质量浓度已非常接近10 μg/L的出水极限,可以确定滤柱R3在该运行过程可实现的极限滤速为10 m/h,滤柱出水中Fe质量浓度接近于0.滤柱长期运行过程中滤料表面及滤料孔隙中形成了大量的r-FeOOH、Fe(OH)3吸附位点,但是当滤速由5 m/h提升至10 m/h,溶液中砷在滤层滤料间的停留时间由14.4 min骤减为7.2 min,导致除砷效果明显降低.滤柱运行36 d内,滤速提升过程中滤柱纳污能力增强,水头损失增加,反冲洗周期基本维持在72 h以内,反冲洗强度18 L/(s·m2),反冲洗时间8 min.反冲洗后1 h以内出水As质量浓度会出现短暂超标,但基本维持在15 μg/L以内.2 h后取样检测,出水中As质量浓度已经优于国家标准值(小于10 μg/L).
|
进出水pH为7左右,滤柱运行1~9 d滤速为3 m/h,10~18 d滤速为5 m/h,19~27 d滤速为8 m/h,28~36 d滤速为10 m/h 图 3 滤速提升过程中滤柱运行效果 Figure 3 Operation effect of filter column in filteration velocity increasing process |
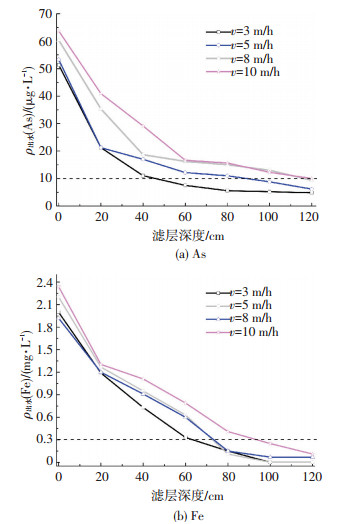
分析图 4(a),滤柱在低滤速3 m/h及5 m/h条件下运行时,除砷主要区域为液面下20 cm滤层,砷去除率高达60%,去除质量浓度约为30 μg/L,而20~60 cm滤层除砷能力约为10 μg/L;当以高滤速8 m/h条件运行时,上部20 cm滤层砷去除质量浓度约为25 μg/L,对应去除率为41%,而20~60 cm滤层有接近20 μg/L的砷被去除;当滤速为10 m/h时,20 cm以上滤层的除砷能力仅为20 μg/L左右,而20~60 cm滤层区间砷去除质量浓度高于25 μg/L.由此可见,随着滤速的不断提升,滤柱内砷去除条带发生明显下移.对比图 4(b),滤速提升过程中液面下20 cm和20~80 cm滤层内Fe去除质量浓度均约为1 mg/L,去除条带并没有发生明显变化.由此可知,不同滤速条件下,滤柱沿程产生的r-FeOOH、Fe(OH)3吸附剂含量并没有太大区别,而造成除砷效果明显差异的主要原因可能是吸附时间[13],即高滤速条件下砷与r-FeOOH、Fe(OH)3的接触时间明显缩短,砷不能被滤层间铁氧化物充分吸附.因此,可以说滤速是制约滤柱除砷效率的关键因素.整体看来,当进水As质量浓度为50~70 μg/L时,只要将滤速控制在5 m/h以内,出水Fe、As质量浓度均能实现稳定达标.而高滤速条件下运行时,出水中Fe能够始终低于0.1 mg/L,但是As出水质量浓度非常接近10 μg/L,没有富余空间,一旦进水水质波动,出水水质难以保障.
|
进出水pH为7,(a)中虚线表示As出水水质标准10 μg/L、(b)中虚线表示Fe出水水质标准0.3 mg/L 图 4 不同滤速条件下Fe、As沿层去除规律 Figure 4 Removal rule of Fe and As along the layer under different filtration velocity |
应当指出的是,本实验中的极限滤速是在最佳投药量的情况下得到的,如果此时增加进水中铁的投药量则可以增加滤层中上部铁基吸附剂的生成量,从而一定程度上弥补接触时间的缩短对除砷效果的影响,保证10 m/h高滤速下的水质稳定,但是此方法一定程度上造成了铁盐量的浪费.
综上,滤速提升过程中,铁主要在滤层中上部快速氧化去除,使得接触时间成为砷去除的关键制约因素,因此,推荐在以后的实验中使用粒径较大的滤料,能使除铁带延伸至滤层深处[14],从而增加生成的铁氧化物吸附剂与原水中砷接触机会,提高除砷效率,并且滤层孔隙率变大,能避免上部滤层过快堵塞,从而能够使得滤层容纳更多的杂质延长反冲洗周期,节约反冲洗时消耗的水资源及能源.
2.3 滤柱沿程除砷规律及机理 2.3.1 砷沿程去除规律为进一步探究滤柱除砷规律,明晰铁、砷沿程去除效果变化以及不同深度滤层在除砷过程中所起的作用,以进水As(Ⅲ)50 μg/L、总Fe 2 mg/L左右的滤柱R3为研究对象,沿程每隔20 cm分别选取水样和砂样进行砷质量浓度检测,对砷沿程去除规律进行探究.所选砂样经100 ℃烘箱干燥去除表面水分,再准确称取9 g干燥砂样并用浓盐酸溶解完全,稀释一定倍数后进行Fe、As质量浓度测定,最终以Fe、As负载量mg/g砂、μg/g砂计算.
由图 5(a)知,随着滤层深度的增加,出水铁、砷质量浓度不断降低.进水经过静态混合器后跌入滤柱中,在进入滤层前近40% Fe2+已被氧化,剩余的Fe2+离子进入滤层后在滤料表面发生接触自催化氧化反应,生成无定型态r-FeOOH包裹在石英砂上[14-15].Fe、As去除空间主要集中在60 cm以上滤层,去除率均能达到80%以上,其中液面下20 cm滤层Fe去除率约为43%,As有效去除量为37 μg/L,去除率高达65%,20~60 cm滤层砷去除量为10 μg/L左右,去除率达17.5%,而60 cm以下滤层内砷去除质量浓度仅为5 μg/L左右.由图 5(b)可知,液面下20 cm石英砂滤料表面Fe、As负载量最大,As负载量为226.95 μg/g砂,Fe负载量为8.833 mg/g砂,大略估算可知吸附剂r-FeOOH表面As负载量为16.17 mg/g FeOOH,这与上述图 5(a)显示结果吻合,即液面下20 cm滤层是最有效的铁砷去除条带.从20 cm滤层处到120 cm滤层处,铁负载量从8.833 mg/g逐渐降低为1.611 mg/g,对应的砷含量从226.95 μg/g降低为28.82 μg/g.可以看出,滤料表面铁负载量以及r-FeOOH吸附的砷质量浓度沿程降低.大部分Fe2+在上部滤层通过接触自催化氧化作用生成无定型态r-FeOOH并负载在石英砂滤料上,成为水中砷去除的吸附剂,随着滤层深度的增加,水中剩余的亚铁越来越少,能生成的r-FeOOH吸附剂量相应减少,砷去除效果自然降低.
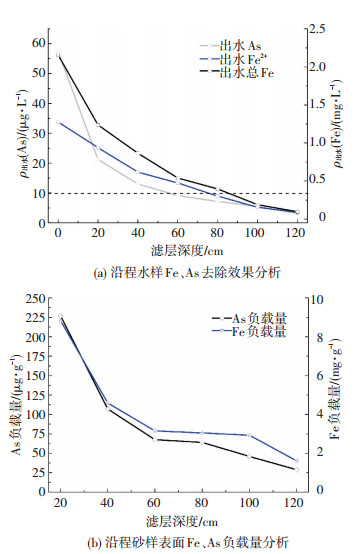
|
进水pH为7左右,滤速为5 m/h 图 5 As沿程去除规律分析 Figure 5 Analysis of As removal rule along the process |
本实验进水中的砷为As(Ⅲ),在处理流程中并不存在预氧化步骤,同时pH为7左右,因此,砷主要以中性分子态H3AsO3形式存在,难以被铁氧化物吸附、共沉[16],但实验结果表明:进水Fe2+质量浓度在2 mg/L范围内变化时,通过自催化氧化作用生成了原位负载的铁氧化物r-FeOOH,并实现了对砷的同步高效吸附去除.Lin Wang等[17]认为Fe2+氧化过程中能够生成具有氧化能力的·OH、Fe4+中间产物,促进As(Ⅲ)向As(Ⅴ)转化,利于砷的吸附去除.为探究本滤柱除砷工艺内是否存在As(Ⅲ)的氧化,以2.3.1中沿程砂样解吸液为研究对象,对负载在石英砂表面的As价态进行分析.
由图 6可知,不同滤层内砂样表面负载的As主要以As(Ⅴ)形态存在,占该滤层As负载总量的80%~90%,而As(Ⅲ)负载量仅为10%~20%,由于进水中As(Ⅲ)在滤柱内停留时间不足15 min,而且空气中As(Ⅲ)的氧化速率极其缓慢,故排除过滤过程中溶解氧对As(Ⅲ)的氧化作用.推测As(Ⅲ)氧化过程有可能伴随着铁盐自催化氧化过程同时发生,且该氧化过程对砷的吸附去除起到促进作用.
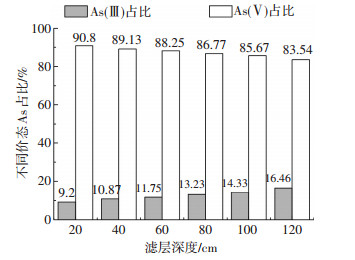
|
进水pH 7左右,滤速为5 m/h 图 6 沿程砂样表面负载As的不同价态占比关系 Figure 6 Relationship between different valence states of As loaded on the sand along the layer |
通过滤柱原位生成的铁基吸附剂沿程除砷规律研究,对滤柱除砷过程归纳如下(见图 7):
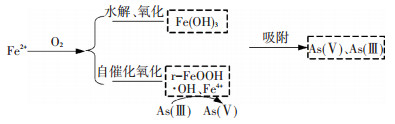
|
图 7 滤柱除砷过程机理推测 Figure 7 Filter specimen of arsenic removal process |
1) 原水跌水曝气后进入滤柱,在进水pH为7左右条件下,溶液中部分Fe2+离子会水解并氧化生成Fe(OH)3,部分Fe2+在滤料表面r-FeOOH的自催化作用下迅速氧化并负载在滤料表面,无定型态r-FeOOH的特殊结构为As(Ⅴ)、As(Ⅲ)提供了大量的吸附位点[18].
2) Fe2+在滤层中自催化氧化生成r-FeOOH过程中,可能会产生具有氧化能力的·OH、Fe4+中间产物,促进As(Ⅲ)的氧化,从而提高As在铁氧化物表面的吸附.
3) As(Ⅴ)及As(Ⅲ)被滤料孔隙以及负载于滤料表面的Fe(OH)3和r-FeOOH吸附,并在滤层中截留去除.
3 结论1) 原位生成铁基吸附剂的滤柱除砷工艺能够实现低质量浓度含砷地下水的净化.在进水pH 7左右、滤速为5 m/h条件下,进水As质量浓度50、100 μg/L所对应的最佳铁盐质量浓度分别为1.2、2 mg/L,最佳铁砷比约为20:1,运行周期内Fe、As出水均能达标.
2) 滤速是滤柱除砷工艺的重要影响参数,在进水As(Ⅲ)质量浓度为50~70 μg/L、总Fe质量浓度为2 mg/L条件下,滤速由3 m/h逐渐提升至10 m/h过程中,As去除条带逐渐下移,而Fe去除条带并没有发生明显变化.控制滤速在5 m/h以内,Fe、As出水能够持续稳定达标,并且实验滤柱的极限滤速为10 m/h.
3) Fe、As有效去除带主要集中在上部60 cm滤层,去除率均能达到80%以上,其中液面下20 cm滤层内砷去除率高达58%,去除质量浓度为20 μg/L.随着滤层深度增加,As去除效果不断降低:60 cm以下滤层,厚度每增加20 cm出水As质量浓度仅降低5 μg/L左右.
4) 滤柱原位除砷的主要机理为吸附、共沉,铁盐自催化氧化过程中伴随着As(Ⅲ)的氧化,滤柱中砷的去除依赖于滤料表面及间隙内生成的r-FeOOH、Fe(OH)3对砷的有效吸附.
| [1] |
FENDORF S, MICHAEL H A, GEEN A V. Spatial and temporal variations of groundwater arsenic in south and southeast Asia[J].
Science, 2010, 328(328): 1123-1127.
|
| [2] |
王琪. 铁盐混凝过程中As(Ⅲ)和As(Ⅴ)去除规律的研究[D]. 哈尔滨: 哈尔滨工业大学, 2011.
WANG Qi. Behavior of As(Ⅲ) and As(Ⅴ) removal in FeCl3 coagulation process[D]. Harbin: Harbin Institute of Technology, 2011. |
| [3] |
PHOMMAVONG T. Arsenic removal from drinking water by manganese greensand[D]. Regina: University of Regina, 1995.
|
| [4] |
吴鹍. 吸附凝聚除砷的中试与工程应用研究[D]. 北京: 中国科学院大学, 2011.
WU Kun. The applied research on the pilot-scale experiment and engineering application of treatment of arsenic-polluted water by the process of adsorption and cogaulation[D]. Beijing: Chinese Academy of Sciences University, 2011. |
| [5] |
SMEDLEY P L, KINNIBURGH D G. A review of the source, behaviour and distribution of arsenic in natural waters[J].
Applied Geochemistry, 2002, 17(5): 517-568.
DOI: 10.1016/S0883-2927(02)00018-5 |
| [6] |
杨柳. 生物滤池同步去除地下水中铁、锰、砷的工艺及机理研究[D]. 哈尔滨: 哈尔滨工业大学, 2014.
YANG Liu. Performance and mechanism of the biofilter for simultaneous removal of iron manganese and arsenic in groundwater[D]. Harbin: Harbin Institute of Technology, 2014. |
| [7] |
POKHREL D, VIRARAGHAVAN T. Biological filtration for removal of arsenic from drinking water[J].
Journal of Environmental Management, 2009, 90(5): 1956-1961.
DOI: 10.1016/j.jenvman.2009.01.004 |
| [8] |
郭华明, 郭琦, 贾永锋, 等. 中国不同区域高砷地下水化学特征及形成过程[J].
地球科学与环境学报, 2013, 35(3): 83-96.
GUO Huaming, GUO Qi, JIA Yongfeng, et al. Chemical characteristics and geochemical processes of high arsenic groundwater in different regions of China[J]. Journal of Earth Sciences and Environment, 2013, 35(3): 83-96. |
| [9] |
ROBERTS L C, HUG S J, RUETTIMANN T, et al. Arsenic removal with iron(Ⅱ) and iron(Ⅲ) in waters with high silicate and phosphate concentrations[J].
Environmental Science & Technology, 2004, 38(1): 307-315.
|
| [10] |
MITRAKAS M G, PANTELIADIS P C, KERAMIDAS V Z, et al. Predicting Fe3+ dose for As(Ⅴ) removal at pHs and temperatures commonly encountered in natural waters[J].
Chemical Engineering Journal, 2009, 155(3): 716-721.
DOI: 10.1016/j.cej.2009.09.011 |
| [11] |
LIU Ruiping, SUN Lihua, QU Jiuhui, et al. Arsenic removal through adsorption, sand filtration and ultrafiltration:In situ precipitated ferric and manganese binary oxides as adsorbents[J].
Desalination, 2009, 249(3): 1233-1237.
DOI: 10.1016/j.desal.2009.06.032 |
| [12] |
GHURYE G, CLIFFORD D, TRIPP A. Iron coagulation and direct microfiltration to remove arsenic from groundwater[J].
American Water Works Association, 2004, 96(4): 143-152.
|
| [13] |
OUZOUNIS K, KATSOYIANNIS I, ZOUBOULIS A, et al. Is the coagulation-filtration process with Fe(Ⅲ) efficient for As(Ⅲ) removal from groundwaters[J].
Separation Science and Technology, 2015, 50(10): 1587-1592.
DOI: 10.1080/01496395.2014.978470 |
| [14] |
张杰, 李冬, 杨宏, 等.
生物固锰除锰机理与工程技术[M]. 北京: 中国建筑工业出版社, 2005.
ZHANG Jie, LI Dong, YANG Hong, et al. Mechanism and engineering technology of manganese removal from biological[M]. Beijing: China Construction Industry Press, 2005. |
| [15] |
蔡言安, 李冬, 曾辉平, 等. 生物滤池净化含铁锰高氨氮地下水实验研究[J].
中国环境科学, 2014, 34(8): 1993-1997.
CAI Yan'an, LI Dong, ZENG Huiping, et al. Removal of iron, manganese and high ammonia from groundwater by biofilter[J]. Chinese Journal of Environmental Science, 2014, 34(8): 1993-1997. |
| [16] |
NITZSCHE K S, LAN V M, TRANG P T K, et al. Arsenic removal from drinking water by a household sand filter in Vietnam: Effect of filter usage practices on arsenic removal efficiency and microbiological water quality[J].
Science of The Total Environment, 2015, 502: 526-536.
DOI: 10.1016/j.scitotenv.2014.09.055 |
| [17] |
WANG L, GIAMMAR D E. Effects of pH, dissolved oxygen, and aqueous ferrous iron on the adsorption of arsenic to lepidocrocite[J].
Journal of Colloid and Interface Science, 2015, 448: 331-338.
DOI: 10.1016/j.jcis.2015.02.047 |
| [18] |
KATSOYIANNIS I A, ZOUBOULIS A I, JEKEL M. Kinetics of bacterial As(Ⅲ) oxidation and subsequent As(Ⅴ) removal by sorption onto biogenic manganese oxides during groundwater treatment[J].
Industrial & Engineering Chemistry Research, 2004, 43(2): 486-493.
|
 2018, Vol. 50
2018, Vol. 50


