在众多污水处理方式中,微生物电化学系统(BES)由于可以同时进行产能和水体净化得到广泛关注[1-3].微生物电化学系统利用微生物将生物质能源转换成其他能源,一般分为微生物燃料电池、微生物电解池和微生物脱盐池等类型.在微生物燃料电池中,位于阳极的电化学活性微生物在分解污水底物的同时释放电子,所释放的电子通过外电路到达阴极,质子在溶液培养基中运动到阴极与氧离子结合生成水,并且在外电路中产生电流.因此,微生物电化学系统的阳极和阴极均是反应中的重要组成部分,其上分布的微生物群落会对反应器的效能产生重要的影响.
涉及微生物电化学系统的研究工作有很多,一方面研究致力于开发高效并且价廉的材料,例如碳刷阳极、多孔的碳化材料,以及无贵金属的活性炭阴极等等;另一个方面则是对微生物电化学系统微生物代谢机制的研究[4-6].在阳极微生物中,已经明确的金属还原菌属包括Geobacter和Shewanella,这两种菌株广泛存在于微生物化学系统中的阳极表面,此外,部分来自Rhodocyclaceae、Bordetella和Stenotrophomonas等种属的微生物也在BES系统中占据重要位置[7-9].电活性微生物之间存在着种内与种间的电子传递,还观察到导电纤毛fela的结构,并进行了一系列生理状态的测定[10-11].其中阳极微生物作为整个微生物燃料电池的核心装置,其群落决定了阳极的功能.大部分关于不同种类金属氧化还原菌的研究,揭示了两种不同的电子胞外传递:外膜细胞色素和分泌电子介体[2; 12-13].此外,一部分研究人员找到了第3种传递形式:某些细菌的纤毛可以作为微型导线进行电子的直接传递[13-15].已知的高能产电细菌的种类除了研究中常见的Geobacter和Shewanella属,还包括Rhodopseudomonas、Desulfovibrio、Clostridium、Thermincola等菌属中的某些菌株.对于群落的形成及代谢状态、接种物的来源、反应器运行中使用的碳源、反应器运行环境(pH、温度等)都会造成不同的影响[16-18].因此,阳极微生物的群落研究在微生物燃料电池产电机制的研究中占据着重要的作用.
为了更好地对阳极表面生物膜进行研究,研究人员使用了各种平板导电材料,包括镀金玻璃、碳纸等.其中氧化铟锡玻璃由于具备导电、半透明而且平整、易于生物膜提取及原位观察分析等诸多优点,进入了研究人员的视野.研究表明,不同有机材料的修饰可以大大提升氧化铟锡玻璃表面的导电性,简单的酸洗预处理也可以大大提升微生物在氧化铟锡玻璃表面的附着程度[19].同时,氧化铟锡玻璃电极更利于收集全部阳极生物膜以进行后续高通量测序分析,从而更加准确地得到微生物燃料电池的阳极微生物群落结构.在本项研究中,分别以不同来源的污泥作为接种物,以氧化铟锡为阳极制备的微生物燃料电池为反应器,测试其运行状态及效能.在运行稳定后提取反应器电极上面的微生物群落进行高通量测序分析,来探究不同地区、不同工艺中的污泥接种物对反应器中微生物群落构建的影响.
1 实验 1.1 微生物燃料电池的构建本实验使用的器材为单室空气阴极的瓶式反应器.反应器由250 mL螺口瓶改造而成,容积为330 mL,一侧开口,将空气阴极密封在开口侧,空气阴极的催化剂层与溶液接触,防水透气层与空气接触.空气阴极在Logan实验室的方法上进行了修改,用PTFE涂布—晾干—加热300 ℃—冷却为一个循环,重复3遍,制造3层防水透气层;另一侧在彻底冷却后使用Nafion溶液和Pt/C粉末混合,涂布催化剂层20.阳极采用单面镀膜的氧化铟锡玻璃,为增加表面的附着性能和表面积,使用体积比1:2稀释的盐酸浸泡120 s,去离子水漂洗后晾干.以钛丝连接纯铜制的平口夹连接入闭合回路,外电阻为1 000 Ω.
反应器组装后经过密封性测试,连接电路,接种,使用Keithley 2700型电子记录仪,每半小时记录一次外阻电压.培养基为PBS溶液,每升添加2 g乙酸钠作为碳源,此外每升还添加5 mL的微量元素和10 mL的矿质元素作为补充.反应器全部以序批式运行,每当反应器外电压持续2 h低于50 mV后,更换其中2/3体积的培养基.
1.2 接种物来源及用量CS反应器的接种物来自中国黑龙江省哈尔滨市文昌污水厂的污泥(Chinese sludge,简写为CS).该厂主要处理马家沟排水区的生活污水,采用A/O脱氮除磷工艺处理和深度处理后,出水水质达到国家一级B排放标准.本次实验中接种CS反应器选取的污泥即是二沉池的活性污泥.
AS反应器的接种物来自美国加州北部戴维斯市污水厂的污泥(American sludge,简写为AS).戴维斯市污水厂负责承担戴维斯市的生活污水,与320英亩的植被与池塘一起,既承担了处理污水的任务,又形成了戴维斯市特有的野生动植物栖息地.取样的AS污泥来自戴维斯市污水厂的厌氧消化反应器.污水经收集后进行初级曝气与格栅过滤走固体废物和砂石,进入初沉池去掉漂浮物和污泥后进入氧化曝气浮萍塘,经过40 d的停留期后进入地表漫流,然后经过氯化处理和脱氯后进入戴维斯湿地.戴维斯湿地中的植物已经适应了环境,与系统中微生物共同将流经湿地的水中污染物部分降解掉,然后进入厌氧消化反应器.本次实验中,AS反应器的接种物来自戴维斯市污水厂厌氧消化反应器中的污泥.
抽取两个污水厂中的未脱水污泥(含水量均为96%~98%)作为接种物,用量为每反应器10 mL.两种不同来源的污泥,经历了不同的处理工艺,其有机质种类、含量和菌群情况具有明显差异.CS污泥与AS的一大区别是CS污泥未经历过氯化处理与脱氯,所以,微生物菌群中会存在更多的对氯不耐受的微生物菌群.两种污泥接种物均在取样后放入冰箱冷藏室进行储存以保存活性,实验于当地展开以消除长途运输对污泥活性造成的下降.其余的实验材料(阳极、阴极、反应器等)均相同以保证实验的均一性.
1.3 常规分析项目与方法本实验采取标准方法,利用重铬酸钾滴定法测量溶液中的COD值21.COD(mg/L)去除率计算公式为
| $ {R_{{\rm{总COD}}}} = {\rm{ }}\frac{{({\rm{CO}}{{\rm{D}}_{{\rm{进水}}}} - {\rm{CO}}{{\rm{D}}_{{\rm{出水}}}})}}{{{\rm{CO}}{{\rm{D}}_{{\rm{进水}}}}}} \times {\rm{ }}100\% . $ |
在反应器运行平稳后,采用由高到低切换外电阻的方式测量反应器的输出功率,即
| $ P = UI\;;I = \frac{U}{R}{\rm{ ; 所以}}P = \frac{{{U^2}}}{R}. $ |
式中:P为反应器输出功率(W),U为电压(V),I为电流(A),R为外电阻(Ω).
功率密度P′计算公式为
| $ P' = {\rm{ }}\frac{{{U^2}}}{{RS}}. $ |
式中:P′为反应器输出功率密度(W/m2),S为反应器空气阴极表面积(m2).
1.4 分子生物学分析方法反应器运行平稳60 d后,使用美国MOBIO公司的Powersoil强力土壤DNA试剂盒,提取阳极表面微生物膜与接种污泥的基因组DNA.经过琼脂糖凝胶电泳、分光光度计检测DNA质量后,使用Illumina Miseq平台进行16s第二代基因测序.
2 结果与讨论 2.1 不同接种物微生物燃料电池的运行情况以两种污泥为接种物的反应器均成功启动并平稳运行,其中以中国污泥为接种物的反应器启动时长为40 h,远远低于以美国污泥为接种物的反应器(187 h).两种反应器启动后均使用序批式运行模式,反应器皆可以平稳运行.反应器在外阻电压小于50 mV时进行培养基的更新,每次更新量为总量的2/3.反应器培养基更新前后均取样进行培养基COD的测量.
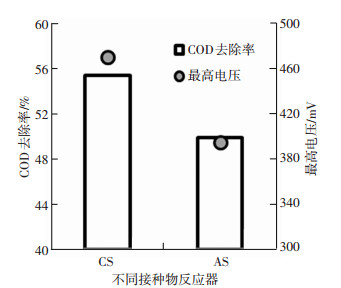
CS反应器与AS反应器的运行电压均稳定在350 mV左右,其中CS反应器平稳电压总体高于AS反应器.而CS反应器的最高电压为470 mV,也高于AS反应器的最高电压395 mV.
两种反应器的COD去除率大致在相同水平,其中CS反应器COD去除率为55.4%,略高于AS反应器的49.9%(见图 1).均低于相同条件下碳刷阳极反应器的COD去除率9.
|
图 1 不同接种物反应器运行情况 Figure 1 Performance of reactors with different inoculum |
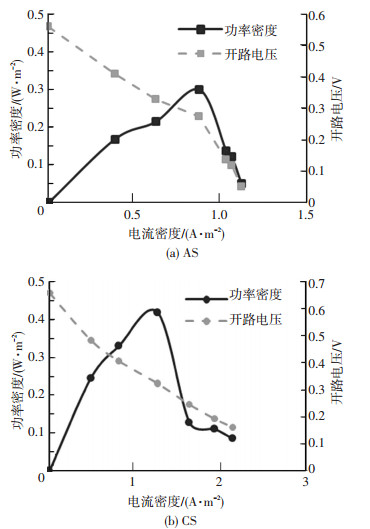
两个反应器均在启动后60 d左右输出功率达到峰值.与反应器外阻电压类似,CS反应器的开路电压与输出功率也均高于AS反应器.其中CS反应器开路电压为618 mV,AS反应器开路电压为562 mV.CS反应器输出功率密度峰值为418.7 mW/m2,所对应的电流密度为1.27 A/m2 (图 2(a));AS反应器输出功率密度峰值为300.7 mW/m2,所对应的电流密度为0.88 A/m2(图 2(b)).CS反应器阳极生物膜可以耐受更高的电流,并且给出更高的输出功率,说明CS污泥更适合用来启动用于产电的微生物燃料电池.
|
图 2 不同接种物反应器的输出功率与开路电压的比较 Figure 2 Power densities and open circuit voltages of reactors with different inoculum |
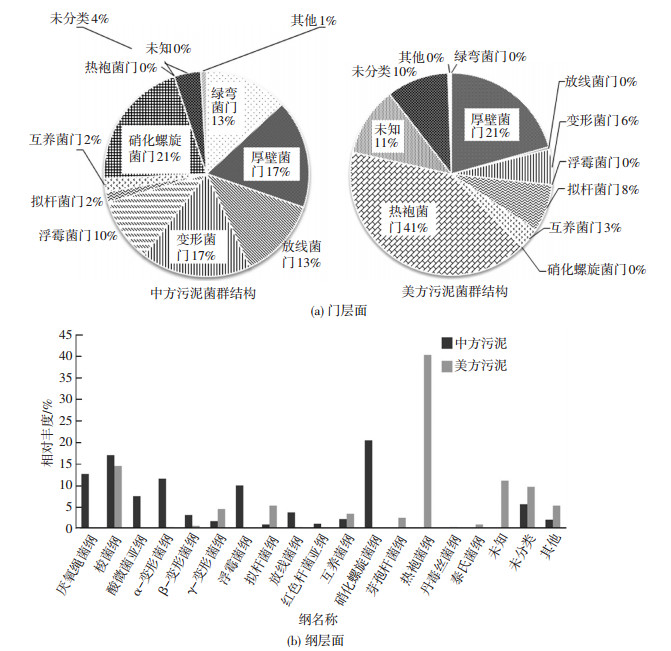
为了分析接种物的群落,对两种污泥均进行基因组DNA提取, 使用Miseq平台进行DNA测序,结果如图 3所示.其中厚壁菌门(Firmicutes)在中美污泥中均占据很高的比例(CS 17.1%,AS 20.7%),互养体门(Synergistete)亦存在中美污泥中,但是比例不高(CS 2.2%,AS 3.4%).放线菌门(Actinobacteria)、变形菌门(Proteobacteria)在CS污泥中的含量远远大于AS污泥,绿弯菌门(Chloroflexi)、浮霉状菌(Planctomycetes)和硝化螺旋菌门(Nitrospirae)都是仅存在于CS污泥中的菌群,含量在10%~20%不等,说明这3种菌群可能是对氯/脱氯过程,以及厌氧发酵的过程敏感,导致AS污泥中没有分布.AS污泥中含有独特的热袍菌门(Thermotogae),含量高达40%,原因是AS反应器中经过了中温厌氧发酵的过程,筛选出了很大部分的嗜热菌群.拟杆菌门(Bacteroidetes)在AS污泥中的含量大于CS污泥,说明其对氯/脱氯过程不敏感,并且可以在厌氧发酵的过程中继续扩增.
|
图 3 接种物污泥的菌群分析 Figure 3 Sludge microbial community |
在反应器输出功率达到峰值的时间段,使用干净的刀片刮取ITO玻璃阳极表面生物膜,提取DNA后,使用Miseq测序平台进行测序.为了减少细小数据带来的干扰,去掉了出现频率不足0.1%的OTU以简化数据.
由于中国哈尔滨文昌污水厂与美国戴维斯污水厂采用的污水处理工艺具有较大区别,采用二者污泥作为接种物的微生物燃料电池反应器内部微生物群落也具有较大的区别.
在门的层面上分析阳极的微生物种群(图 4),变形菌门(Proteobacteria)在两种反应器的阳极上均占绝对多数的优势,其中在CS反应器中达57.2%,在AS反应器中更是高达80.8%.拟杆菌门(Bacteroidetes)在两种反应器的阳极上均占据着第二多的位置,其中CS反应器阳极上达到24.3%,而AS反应器阳极上仅占据7.6%.

|
图 4 阳极微生物群落组成(门) Figure 4 Anode microbial community at phylum level |
从门的层面上分析,CS微生物燃料电池反应器阳极的物种多样性要高于AS反应器阳极,CS反应器阳极微生物分布在5个门中,而AS反应器上阳极微生物仅分布在3个门.由此可见,氯处理和脱氯过程会对螺旋菌门(Spirochaetae)、厚壁菌门(Firmicutes)、绿菌门(Chlorobi)这3个门的细菌造成巨大的影响,而这3个门的细菌与种间电子传递相关[22-24].因此,AS污泥接种的反应器,无论是电压还是输出功率都比CS污泥接种的反应器低,也是符合预期的.此外,拟杆菌门(Bacteroidetes)也受到部分影响,种群丰度在AS反应器阳极中仅有7%,远小于CS反应器阳极中的24%.只有变形菌门(Proteobacteria)对氯和脱氯处理工艺的耐受度最好,相比较CS反应器阳极,AS阳极上变形菌门的种群丰度有了大规模的提高.
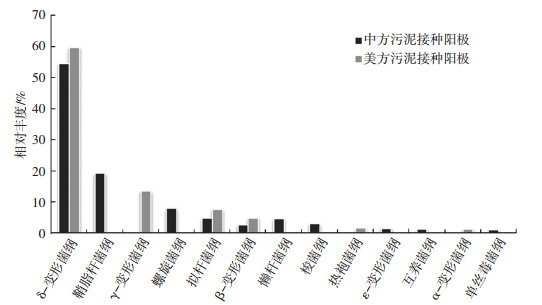
从纲的层面上分析阳极种群,也得到相似结果(如图 5).CS反应器的微生物群落集中在10个纲里,而AS反应器的微生物群落集中在6个纲.其中δ-变形菌纲(Deltaproteobacteria)、拟杆菌纲(Bacteroidia)、β-变形菌纲(Betaproteobacteria)这3个纲为两个反应器的阳极共有,鞘脂杆菌纲(Sphingobacteriia 19.2%)螺旋体纲(Spirochaetes 7.8%)等7个纲为CS反应器阳极中特有的菌群,γ-变形菌(Gammaproteobacteria 13.4%)等3个纲为AS反应器阳极中特有的菌群.可以推断AS反应器中的细菌对氯/脱氯过程有一定的耐受程度,因此,才可能在接种的污泥中生存下来,然而与未经过氯/脱氯过程中的污泥相比,种群的结构更加简单,会有其他可以进行种间传递或者与电活性细菌共生的细菌存活下来,尽管效率略低,但是仍然可以进行代谢和产电.
|
图 5 阳极微生物群落组成(纲) Figure 5 Anode microbial community at classes level |
ITO玻璃作为一个平整的易于附着阳极生物膜的表面,价格低廉,容易获得.此外,其在瓶式反应器中的接入方式灵活,可以在工作状态下取出在显微镜下观察,然后再放回反应器中,为阳极生物膜的原位观察打下了良好的工作基础[25].
在传统的测序取样中,经常在碳刷上选取几点使得菌群与真实分布更加接近,而本实验中选择测序的是肉眼可见的所有的阳极生物膜DNA,信息更加真实可信.此外,后续还可以进行分区块测序,结合阳极生物膜镜下的原位观察,对电活性微生物在阳极的形成机制与代谢进行进一步的研究.
3 结论1) 不同接种物对微生物燃料电池效能和细菌群落形成的影响研究表明,中国水厂污泥接种的反应器显示出更优异的总体性能.表现在较短的反应器启动时间,较高的运行电压、输出功率密度和电流密度及COD去除效率.而美国水厂污泥接种反应器的启动时间相对较长,运行电压、输出功率密度和电流密度以及COD去除率相对较低.
2) 原始污泥的菌群分析发现,放线菌门(Actinobacteria)、变形菌门(Proteobacteria)在CS污泥中的含量远远大于AS污泥,绿弯菌门(Chloroflexi)、浮霉状菌(Planctomycetes)和硝化螺旋菌门(Nitrospirae)都是仅存在于CS污泥中的菌群,含量在10%~20%不等.
3) 反应器阳极的菌群分析表明,CS微生物燃料电池反应器阳极的物种多样性要高于AS反应器阳极,微生物分布在5个门中,而AS反应器上阳极微生物仅分布在3个门.由此可见,氯处理和脱氯过程会对螺旋菌门(Spirochaetae)、厚壁菌门(Firmicutes)、绿菌门(Chlorobi)这3个门的细菌造成巨大的影响.由于这3个门的细菌与种间电子传递相关,AS污泥接种的反应器,无论是电压还是输出功率都比CS污泥接种的反应器低.
4) 利用ITO玻璃作为阳极可以得到全阳极生物膜DNA来进行后续测序,为进行阳极微生物群落组成的研究打下了良好的工作基础.
| [1] |
DAVIS F, HIGSON S P. Biofuel cells-ecent advances and applications[J].
Biosensors and Bioelectronics, 2007, 22(7): 1224-1235.
DOI: 10.1016/j.bios.2006.04.029 |
| [2] |
LOGAN B E, REGAN J M. Electricity-producing bacterial communities in microbial fuel cells[J].
TRENDS in Microbiology, 2006, 14(12): 512-518.
DOI: 10.1016/j.tim.2006.10.003 |
| [3] |
WANG M, YANG Z, XIA M, et al. Performance improvement of microbial fuel cells by lactic acid bacteria and anode modification[J].
Environmental Engineering Science, 2017, 34(4): 251-257.
DOI: 10.1089/ees.2016.0110 |
| [4] |
綦琪, 王许云, 贾云. 微生物燃料电池电极材料研究进展[J].
科技导报, 2015, 33(14): 28-31.
QI Qi, WANG Xuyun, JIA Yun. Latest research development of electrode materials for microbial fuel cells[J]. Sci Technol Rev, 2015, 33(14): 28-31. DOI: 10.3981/j.issn.1000-7857.2015.14.004 |
| [5] |
周亚, 彭新红, 阮国岭, 等. 微生物燃料电池阳极材料修饰研究进展[J].
水处理技术, 2017(3): 9-13.
ZHOU Ya, PENG Xinhong, RUAN Guoling, et al. Progress in modification of anode materials for microbial fuel cells[J]. Technology of Water Treatment, 2017(3): 9-13. DOI: 10.16796/j.cnki.1000-3770.2017.03.003 |
| [6] |
王鑫. 微生物燃料电池中多元生物质产电特性与关键技术研究[D]. 哈尔滨: 哈尔滨工业大学, 2010.
WANG Xin. Electricity generation from multiple biomass and the development of key technologies in microbial fuel cells[D]. Harbin: Harbin Institute of Technology, 2010. |
| [7] |
WU W, YANG F, LIU X, et al. Influence of substrate on electricity generation of Shewanella loihica PV-4 in microbial fuel cells[J].
Microbial Cell Factories, 2014, 13(1): 69.
DOI: 10.1186/1475-2859-13-69 |
| [8] |
LOVLEY D R. Electromicrobiology[J].
Annual Review of Microbiology, 2012, 66: 391-409.
DOI: 10.1146/annurev-micro-092611-150104 |
| [9] |
JIANG Q, XING D, SUN R, et al. Anode biofilm communities and the performance of microbial fuel cells with different reactor configurations[J].
RSC Advances, 2016, 6(88): 85149-85155.
DOI: 10.1039/C6RA08790F |
| [10] |
RABAEY K, CLAUWAERT P, AELTERMAN P, et al. Tubular microbial fuel cells for efficient electricity generation[J].
Environmental Science & Technology, 2005, 39(20): 8077-8082.
|
| [11] |
NAKAMURA R, KAI F, OKAMOTO A, et al. Self-constructed electrically conductive bacterial networks[J].
Angewandte Chemie International Edition, 2009, 48(3): 508-511.
DOI: 10.1002/anie.v48:3 |
| [12] |
RABAEY K, BOON N, HöFTE M, et al. Microbial phenazine production enhances electron transfer in biofuel cells[J].
Environmental Science & Technology, 2005, 39(9): 3401.
|
| [13] |
GORBY Y A, YANINA S, MCLEAN J S, et al. Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms[J].
Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(30): 11358-11363.
DOI: 10.1073/pnas.0604517103 |
| [14] |
MYERS C R, MYERS J M. Localization of cytochromes to the outer membrane of anaerobically grown Shewanella putrefaciens MR-1[J].
Journal of Bacteriology, 1992, 174(11): 3429-3438.
DOI: 10.1128/jb.174.11.3429-3438.1992 |
| [15] |
REGUERA G, MCCARTHY K D, MEHTA T, et al. Extracellular electron transfer via microbial nanowires[J].
Nature, 2005, 435(7045): 1098-1101.
DOI: 10.1038/nature03661 |
| [16] |
XING D, ZUO Y, CHENG S, et al. Electricity generation by Rhodopseudomonas palustris DX-1[J].
Environmental Science & Technology, 2008, 42(11): 4146.
|
| [17] |
ZHAO F, RAHUNEN N, VARCOE J R, et al. Activated carbon cloth as anode for sulfate removal in a microbial fuel cell[J].
Environmental Science & Technology, 2008, 42(13): 4971.
|
| [18] |
WRIGHTON K C, AGBO P, WARNECKE F, et al. A novel ecological role of the Firmicutes identified in thermophilic microbial fuel cells[J].
Isme Journal, 2008, 2(11): 1146.
DOI: 10.1038/ismej.2008.48 |
| [19] |
QIAO Y, BAO S, LI C, et al. Nanostructured polyaniline/titanium dioxide composite anode for microbial fuel cells[J].
Acs Nano, 2007, 2(1): 113-119.
|
| [20] |
LOGAN B E, HAMELERS B, ROZENDAL R, et al. Microbial fuel cells: methodology and technology[J].
Environmental Science & Technology, 2006, 40(17): 5181-5192.
|
| [21] |
GILCREAS F W. Standard methods for the examination of water and wastewater[J].
American Public Health Association, 1966, 56(3): 387.
|
| [22] |
LU L, XING D, REN Z J. Microbial community structure accompanied with electricity production in a constructed wetland plant microbial fuel cell[J].
Bioresource Technology, 2015, 195: 115-121.
DOI: 10.1016/j.biortech.2015.05.098 |
| [23] |
AHMED F, RODRIGUES D F. Investigation of acute effects of graphene oxide on wastewater microbial community: A case study[J].
Journal of Hazardous Materials, 2013, 256: 33-39.
|
| [24] |
EL-CHAKHTOURA J, ELFADEL M, RAO H, et al. Electricity generation and microbial community structure of air-cathode microbial fuel cells powered with the organic fraction of municipal solid waste and inoculated with different seeds[J].
Biomass and Bioenergy, 2014, 67: 24-31.
DOI: 10.1016/j.biombioe.2014.04.020 |
| [25] |
JAIN A, CONNOLLY J O, WOOLEY R, et al. Extracellular electron transfer mechanism in Shewanella loihica PV-4 biofilms formed at indium tin oxide and graphite electrodes[J].
International Journal of Electrochemical Science, 2013, 8(2): 1778.
|
 2018, Vol. 50
2018, Vol. 50


