抗生素属于一种常见的微量有机污染物,近年来在水体、底泥、农田土壤等介质中被频繁检出[1-3].诺氟沙星(以下简称NFX)为第三代氟喹诺酮类抗生素的代表,在人和动物医学方面应用广泛,由于难以被传统的水处理工艺降解,可采用高级氧化技术去除.SO4-·和羟基自由基(·OH)一样,具有很强的氧化还原电位,且在中性pH附近,相比于·OH,SO4-·展现了更好的氧化还原能力,这使得SO4-·在有机污染物的矿化方面优势更大[4].
SO4-·的前驱物是过一硫酸盐(PMS)或过二硫酸盐(PDS).活化PMS和PDS的常规方法通常有热[5]、紫外[6]、超声[7]、碱[8]、过渡金属离子[9](如Fe2+、Co2+、Cu2+)以及金属氧化物(如Fe3O4、CuO)[10-11]等.热、紫外以及超声都属于能量活化方式,需要投入很大的能量,在实际应用中增大了水处理的成本.相比PDS,PMS由于具有非对称分子结构,更容易被过渡金属活化.PMS被过渡金属催化的均相反应在去除有机污染物方面表现出很高的效率,应用也很广泛.然而,过渡金属催化PMS的均相反应,容易造成重金属离子的二次污染,此外在活化过程中,过量的低价金属离子能反过来作为自由基的清除剂,导致催化效率低[12].为了降低溶液中的金属离子浓度及提高催化效率,学者们将注意力转移到了非均相催化体系.尖晶石铁氧体材料MeFe2O4 (Me=Mn、Co、Ni、Cu、Zn,etc.)是一种具有磁性的铁氧体材料,常用来作为非均相体系催化剂,高效稳定并且容易分离.Yang等[13]制备的CoFe2O4能有效活化PMS,相比Co2+/PMS系统能大大减少钴离子的溶出.马军等[14]发现,溶胶-凝胶法制备的CuFe2O4能有效活化PMS降解阿特拉津,活化效果仅次于CoFe2O4.Zhang等[15]以碘普罗胺为降解底物,比较了CuO、CuFe2O4、Fe2O3、MnFe2O4以及Cu2+活化PMS的效能,发现CuFe2O4的活化效果最好.考虑到钴是潜在的致癌物质,CoFe2O4催化PMS过程中无法避免钴离子的溶出,而铜并非潜在的致癌物质,且CuFe2O4的催化能力很强.因此,认为CuFe2O4活化PMS在处理水中难降解有机污染物方面具有良好的应用前景.
本研究首次以NFX为目标污染物,PMS为氧化剂,通过溶胶-凝胶法制备不同煅烧温度下的纳米CuFe2O4,探讨CuFe2O4的催化活性及降解机制,以期为含抗生素有机废水的深度处理提供技术支撑.
1 实验 1.1 实验材料Cu(NO3)2·3H2O、Fe(NO3)3·9H2O、NaOH、HClO4、Na2S2O3、FeSO4、KSCN、硝基苯(NB)、柠檬酸、叔丁醇和甲醇,分析纯;NFX(≥99.5%),过一硫酸氢钾(PMS,ACS级别);实验用水均为超纯水,由Mill-QUV Plus系统制备.
1.2 纳米CuFe2O4的制备与表征 1.2.1 纳米CuFe2O4的制备方法采用柠檬酸辅助溶胶-凝胶法[16-17]制备纳米CuFe2O4.先将0.008 mol Cu(NO3)2·3H2O和0.016 mol Fe(NO3)3·9H2O溶于装有100 mL超纯水的烧瓶中,随后在60 ℃水浴中搅拌1 h;再加入0.024 mol的柠檬酸粉末,混合溶液继续在60 ℃水浴中搅拌3 h;将得到的透明溶胶转入烘箱中,90 ℃干燥数小时得到凝胶;将凝胶转入马弗炉中,在400 ℃下焙烧2 h,研磨后用超纯水漂洗多次至溶液呈中性,再转入烘箱中,120 ℃干燥数小时即得到纳米CuFe2O4.
1.2.2 表征方法采用Bruker D8 Advance X射线衍射仪(XRD)检测CuFe2O4晶体的结构,检测条件为:铜阳极、石墨单色器、Cu靶ka射线(λ=0.154 2 nm)、管电压40 kV、管电流40 mA、扫描速度5 (°)/min、扫描范围5~80°.
采用日本Jeol公司的JEM2011用于TEM分析,点分辨率为0.23 nm,晶格分辨率为0.14 nm,可放大倍率为50~1 500 000,并配有Piezo防漂移控制系统.
采用美国康塔公司的Autosorb-iQ型全自动气体吸附分析仪测定所制备材料的比表面积和孔径分布情况.采用BET方法计算样品的比表面积,采用BJH方法分析材料的孔径分布,采用吸附-脱附点数据计算材料的总孔容.
1.3 实验步骤催化降解实验中,首先在反应器中加入一定量的氧化剂溶液,用1%的HClO4溶液和0.01 mol/L的NaOH溶液调节溶液的pH为7.0±0.1.再在反应器中加入稀释到一定浓度的NFX溶液后迅速加入称量好的催化剂启动反应.反应过程中持续磁力搅拌,考察60 min内目标污染物的去除效果.在不同反应时间取出1.0 mL反应溶液,通过0.22 μm水性膜过滤到事先加入Na2S2O3溶液(0.2 mL,浓度为0.1 mol/L)的液相小瓶中进行淬灭,然后进入色谱分析.
1.4 分析方法NFX浓度采用Waters公司的ACQUITY UPLC H-class系统进行测定,选用C18液相色谱柱(100×2.1 mm,1.7 μm).流动相为色谱纯乙腈与0.1%(体积分数)的甲酸溶液,流量比为14:86,流速为0.5 mL/min,柱温为35 ℃,采用紫外可见光(UV-Vis)检测器,检测波长为273 nm.溶出的金属离子质量浓度用Agilent电感耦合等离子发射光谱仪(ICP)检测,最低检测限为0.1 mg/L.PMS浓度检测方法[18]如下:1)取1 mL水样过0.22 μm的水性膜于4 mL的玻璃管中;2)在玻璃管中加入1 mL浓度为10 mmol/L的FeSO4溶液(1 mol/L的H2SO4酸化);3)反应5 min后,加入0.2 mL浓度为0.3 mol/L的KSCN溶液,立即将血红色溶液倒入石英比色皿(1 cm x 1 cm)于450 nm的分光光度计中读数.
2 结果与表征 2.1 表征结果催化剂在不同煅烧温度下的XRD表征结果如图 1,煅烧温度对纳米CuFe2O4的晶型影响很大.当温度低时,纳米CuFe2O4的结晶性较差,出现较多的Fe2O3(JCPDS39-1346)和CuO(JCPDS44-0706)衍射峰.温度升高到400 ℃时,出现了明显的铜铁尖晶石的衍射峰,包括c-CuFe2O4(JCPDS25-0283)和t-CuFe2O4(JCPDS34-0425),其中c-CuFe2O4占大多数.当温度升高到500 ℃时,c-CuFe2O4的比例明显减少而t-CuFe2O4占比增多,出现了c-CuFe2O4晶型向t-CuFe2O4晶型的转变.
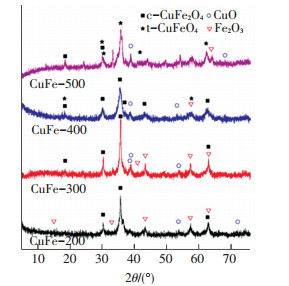
|
图 1 催化剂在不同煅烧温度下的XRD表征结果 Figure 1 XRD patterns of Cu-Fe catalysts calcined at different temperatures |
表 1列出了不同煅烧温度下,催化剂的比表面积、孔容积和平均孔径.由表 1可知,200和300 ℃下制备的材料相似,有着相近的比表面积、孔容积和孔径.400 ℃时,材料的比表面积与300 ℃时接近,而孔容积和平均孔径分别是300 ℃时的1.9倍和1.5倍,是由于CuFe2O4晶体的生长.当温度由400 ℃升高到500 ℃时,其比表面积和孔容积急剧下降,可能是由于温度过高导致晶体颗粒变大或孔道坍塌.
| 表 1 煅烧温度对催化剂比表面积的影响 Table 1 Effect of synthesis temperature on surface area of catalysts |
图 2为纳米CuFe2O4的透射电镜照片.可以看出,CuFe2O4晶体的颗粒尺寸在100~200 nm,400 ℃时CuFe2O4颗粒大小较均一,能较明显地区分颗粒边缘.500 ℃时颗粒尺寸较大、团聚现象较严重.这与表 1中的结果符合.

|
图 2 CuFe2O4的透射电镜照片 Figure 2 TEM images of CuFe2O4 |
由图 3可知,单独PMS对NFX的氧化能力较弱,60 min内氧化36%的NFX.加入催化剂后,NFX的浓度下降得很明显,且CuFe2O4的煅烧温度对其催化性能有一定的影响.当温度为400 ℃时,CuFe2O4晶型好,比表面积和孔容大,活性位点多,催化效率最高,60 min内NFX降解率高达98%.当温度升高到500 ℃时,由c-CuFe2O4转化为t-CuFe2O4,且比表面和孔容急剧下降,导致其催化效率最低.故选择400 ℃为最佳煅烧温度,之后的实验均采用该煅烧温度下的纳米CuFe2O4.
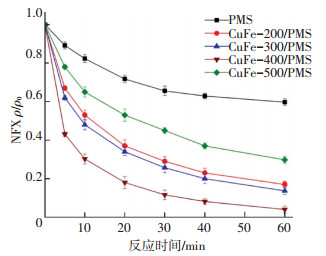
|
ρ(NFX)0=5 mg/L,[PMS]0=0.5 mmol/L,催化剂投加量0.1 g/L,反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 3 煅烧温度对催化性能的影响 Figure 3 Effect of synthesis temperature on catalyst activity |
由图 4可知:1)单独PMS、PDS和H2O2对NFX的降解率分别为45%、7%和4%.单独PDS和H2O2的氧化能力很弱,很难降解NFX.2)加入的CuFe2O4能提高NFX的去除率.CuFe2O4/PMS、CuFe2O4/PDS和CuFe2O4/H2O2系统对NFX的去除率分别为98%、38%和12%(反应60 min).CuFe2O4对H2O2几乎未体现出活化作用.CuFe2O4能活化PDS和PMS,其对PDS的活化效果较弱,而对PMS的活化作用最强.3)PMS、PDS和H2O2这3种过氧化物在多相CuFe2O4催化氧化体系中体现出的反应活性差别与其在均相体系中与金属离子的反应活性差别相似[19].原因是PMS的非对称结构使得其更容易被活化生成自由基.
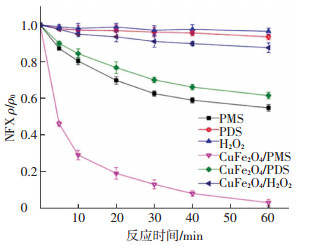
|
ρ(NFX)0=5 mg/L, [氧化剂]0=1.0 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 4 不同氧化体系中CuFe2O4的催化性能 Figure 4 Catalytic properties of CuFe2O4 in different systems |
纳米CuFe2O4材料具有磁性,其回收简单方便,如图 5所示,在磁铁的吸引下,3 min后纳米CuFe2O4聚集到烧杯单侧,溶液变得澄清.纳米CuFe2O4的磁性有助于催化剂的回收、重复利用.反应结束后,用磁铁回收CuFe2O4,洗涤并干燥后其质量为反应前的96%,损失质量为4%.

|
图 5 CuFe2O4的磁性性能 Figure 5 Magnetic characterization of CuF2O4 |
图 6为纳米CuFe2O4重复使用5次催化PMS降解NFX效能的变化.可以看出,随着循环使用次数的增加,CuFe2O4对NFX的催化降解率呈现下降趋势,但幅度不大,5次循环后NFX的去除率降低了8%左右,仍然具有良好的催化效果.
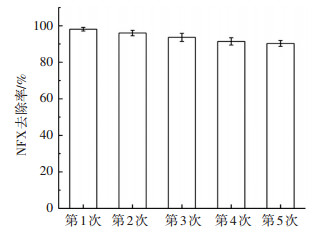
|
ρ(NFX)0=5 mg/L, [PMS]0=0.5 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 6 CuFe2O4多次循环催化效能 Figure 6 Catalytic properties of CuFe2O4 in several rounds |
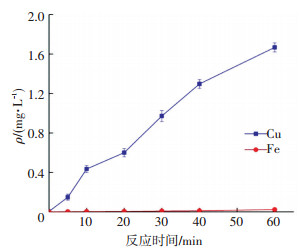
图 7为纳米CuFe2O4在溶液中溶出的铜、铁离子浓度.可以看出,在纳米CuFe2O4/PMS非均相体系中,反应时间内溶液中铁离子浓度很低.溶出的铜离子浓度随着反应的进行逐渐增多,反应60 min时,溶出量为1.6 mg/L.由此说明,纳米CuFe2O4在溶液中能稳定存在,且该反应条件下,纳米CuFe2O4的催化反应主要为非均相催化反应.
|
ρ(NFX)0=5 mg/L, [PMS]0=0.5 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 7 反应体系中金属离子溶出情况 Figure 7 Metal ions leaching of different reactive system |
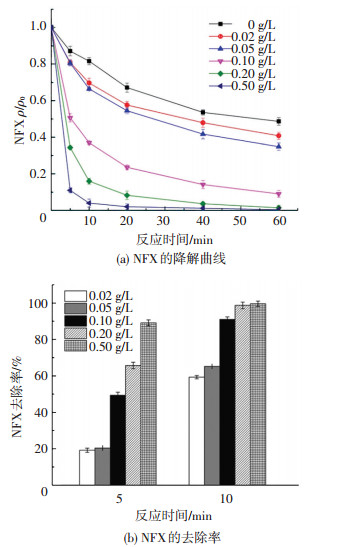
由图 8(a)可知,当催化剂的剂量由0.02 g/L提高到0.50 g/L时,5 min内NFX的去除率由20%提高到89%.由图 8(b)可知,当CuFe2O4由0.10 g/L增至0.50 g/L时,5 min内NFX的降解率由49%提高到89%,但随后反应时间内NFX的降解逐渐变得很缓慢,60 min内NFX的降解率增加并不很明显,仅由91%提高到99%,这可能源于CuFe2O4的比表面积大且催化活性高,剂量高时(0.50 g/L)能为氧化剂和底物提供充足的活性位点,导致PMS在短时间内(5 min)被大量活化分解产生自由基,故降解率在前期很快,后期PMS的浓度已很低,催化氧化能力变弱.
|
ρ(NFX)0=5 mg/L, [PMS]0=0.5 mmol/L,反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 8 CuFe2O4的投加量对催化效能的影响 Figure 8 Effect of CuFe2O4 dosage |
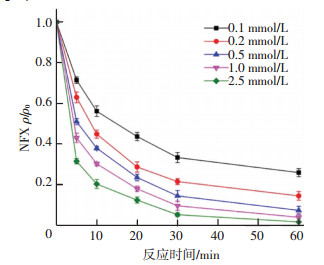
由图 9可知:1)当加入0.1 mmol/L的PMS时,60 min内能去除掉74%的NFX.这主要是因为PMS能被CuFe2O4活化产生活性强的自由基,自由基与污染物的反应速率极快,可达到106~109 L/(mol·s).2)NFX的降解速率随着PMS初始浓度的增高而增强,当PMS初始浓度由0.1 mmol/L提高到2.5 mmol/L时,5 min内NFX的降解率由28%增高到69%.当PMS初始浓度>0.5 mmol/L时,其降解率提高较慢,产生这种现象的原因一方面是PMS浓度过高时,CuFe2O4并不能提供充足的活性位点.另一方面是PMS浓度较高时,产生的自由基相互间发生淬灭,从而使得部分PMS被消耗但并没有产生有效的自由基.
|
ρ(NFX)0=5 mg/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 9 PMS浓度对NFX去除的影响 Figure 9 Effect of PMS concentration on NFX removal |
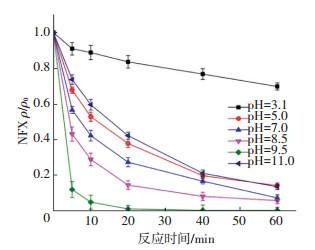
由图 10可知,当初始pH为3.1时,60 min内CuFe2O4活化PMS对NFX的去除率仅为30%;当初始pH由3.1变为5.0时,去除率急剧升高到85%;当初始pH由5.0增加到11.0时,NFX的去除率呈现先升高后降低的趋势,在pH=9.5时最大,其在5 min内去除率高达90%.
|
ρ(NFX)0=5 mg/L,[PMS]0=0.5 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃ 图 10 不同初始pH对NFX去除的影响 Figure 10 Effect of initial pH on NFX removal |
图 11为不同初始pH条件下,CuFe2O4对NFX的吸附情况.pH由3到8.5,CuFe2O4对NFX的吸附率由5.7%逐渐增加到13%,且pH由5到7区间内,吸附率变化很明显;当pH>8.5时,CuFe2O4对NFX的吸附率随pH升高急剧下降;当pH为11时,CuFe2O4对NFX几乎没有吸附.
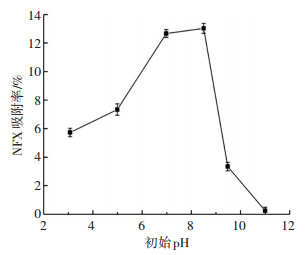
|
ρ(NFX)0=5 mg/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃ 图 11 不同pH下CuFe2O4对NFX吸附率 Figure 11 Adsorption rate of NFX under different pH values |
金属氧化物在水溶液中其表面既可能带正电荷也可能带负电荷,这取决于溶液pH及催化剂的等电点所对应的pH(即pHPZC).当溶液pH<pHPZC时,催化剂表面呈正电性,当溶液pH>pHPZC时,其表面呈负电性[20].用Zata电位仪测出纳米CuFe2O4的pHPZC约为7.87.此外,NFX在水中存在解离,过程如图 12所示,其对应的解离常数pKa1=6.30, pKa2=8.38[21] (或pKa1=6.20, pKa2=8.70[22]),即当pH<6.20时,NFX带正电,当pH>8.70时,NFX带负电.
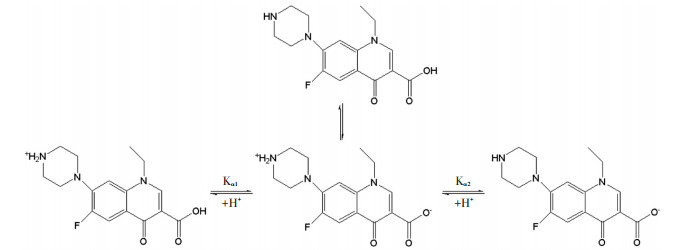
|
图 12 诺氟沙星解离示意 Figure 12 Dissociation diagram of Norfloxacin |
由以上实验结果有如下推论:1)当溶液初始pH<5.0时,NFX的去除率很低.一方面,酸性条件下,NFX和CuFe2O4表面均带正电不易于接触(如图 11所示),且溶液中的H+能与HSO5-中的O—O键形成氢键抑制了PMS与CuFe2O4表面接触[23-24];另一方面,溶液中的H+能清除掉PMS活化产生的自由基[25-26].2)当溶液初始pH>9.5时,随着pH升高NFX的去除率降低明显.在此pH范围内CuFe2O4和NFX均带负电,且PMS大部分以SO52-形式存在(PMS的pKa为9.4,即H2SO5的二级酸离解常数),即氧化剂、催化剂以及底物因静电排斥作用,相互间接触的机会大大减少,另一方面SO52-的氧化性较弱,从而导致NFX的去除率降低;3)当溶液初始pH在5.0~9.5时,PMS存在形式为HSO5-,随着pH升高CuFe2O4表面所带正电荷减少,不利于其与PMS的结合,可能导致CuFe2O4活化PMS的效果减弱,但NFX的去除率却有明显提高,造成这种现象的原因可能是PMS被碱活化产生了氧化能力更强的自由基[27].
2.3.4 腐殖质的影响选用腐殖酸(HA)作为腐殖质的代表成分,分别对HA质量浓度为0、0.5、2、5、10、20 mg/L时,CuFe2O4催化PMS体系中NFX的降解效果进行考察.结果如图 13所示,当腐殖酸质量浓度由0增加至20 mg/L时,CuFe2O4/PMS体系中NFX的降解率由93.8%降到70.7%(40 min内).这说明实际水体中存在的腐殖酸对CuFe2O4/PMS体系氧化降解NFX的效能有一定的抑制作用.产生这种抑制现象的原因可能有两个:1)HA中的酚羟基和羧酸基团对催化剂活性位点的吸附占据,导致CuFe2O4不能有效活化PMS;2)HA扮演自由基清除剂角色,与底物竞争消耗CuFe2O4/PMS体系中产生的活性自由基,从而致使底物的降解率降低.
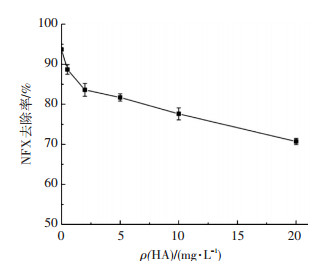
|
ρ(NFX)0=5 mg/L,[PMS]0=0.5 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 13 HA质量浓度对NFX去除的影响 Figure 13 Effect of HA concentration on NFX removal |
由图 14可知,单独的PMS浓度随着时间的变化可忽略不计(小于3%),在加入底物NFX后,由于氧化作用导致PMS稍有分解,60 min内其浓度降低了11%,加入催化剂CuFe2O4后,PMS浓度急剧下降,5 min其浓度下降了20%,60 min后剩余浓度为初始浓度的37%.不加底物时,CuFe2O4导致PMS浓度下降得更加明显,5 min内PMS浓度下降1/3.以上实验结果表明,催化剂CuFe2O4能有效活化PMS,导致其分解生成了氧化能力更强的活性物种,从而致使底物NFX的浓度快速下降.底物NFX吸附在催化剂表面,占据了部分活性位点,从而导致CuFe2O4对PMS的分解作用有所阻碍.
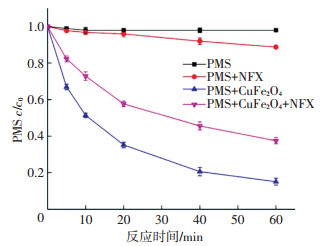
|
ρ(NFX)0=5 mg/L,[PMS]0=0.5 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 14 不同系统中PMS的浓度变化 Figure 14 PMS concentration changes in different systems |
PMS能够被多相催化剂活化产生·OH、SO4-·和SO5-·等活性自由基.马军等[14]发现CuFe2O4活化PMS降解阿特拉津时,在pH为中性附近时,·OH和SO4-·为主要的活性物种.而Zhang Tao等[28]在CuFe2O4活化PMS系统中,加入NB作为·OH的探针,发现NB并没有降解,推断反应体系中没有·OH产生,SO4-·是主要的活性物种.因此,为了鉴定CuFe2O4/PMS系统的主要活性自由基,进行了甲醇(Me)和叔丁醇(TBA)的抑制实验.
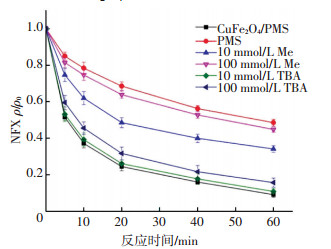
由图 15可知,当CuFe2O4/PMS系统中加入Me时NFX的降解受到了很大的抑制,且随着Me剂量的提高抑制作用增强,当Me浓度为100 mmol/L时,CuFe2O4/PMS体系中NFX的降解率由91%降低为54%(60 min),且与单独PMS体系中NFX的降解率接近,表明此时CuFe2O4/PMS体系中的活性自由基基本被淬灭,同时意味着SO5-·并不是主要的活性物种.当CuFe2O4/PMS系统中加入TBA时,NFX的降解抑制随TBA剂量的提高(10~100 mmol/L)而略有增强,60 min内NFX降解率为83%,明显高于Me终止体系(54%),这意味着体系中同时存在·OH和SO4-·,而Me和TBA终止效果的差别说明SO4-·是主要的活性自由基.
|
ρ(NFX)0=5 mg/L, [PMS]0=0.5 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 15 Me和TBA对CuFe2O4/PMS系统去除NFX的抑制 Figure 15 Inhibition of methanol and tert-butyl alcohol on NFX degradation by CuFe2O4/PMS |
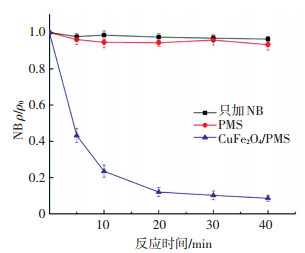
然而,两种自由基终止剂对CuFe2O4/PMS系统抑制效果的差别一方面是它们与自由基清除能力的不同,另一方面也可能与其吸附在CuFe2O4表面占据了催化活性位点有关.Zhang Tao等[29]研究发现TBA能吸附在催化剂CuO的表面,从而抑制草酸盐的氧化降解,且TBA作为·OH的终止剂加入CuFe2O4/PMS系统后表现的抑制效果较弱,有可能是TBA吸附在催化剂表面造成的.因此,仅仅TBA对系统的抑制效果不足以说明反应系统中产生了·OH.由于硝基苯(NB)与·OH(k=3.9×109L/(mol·s))的一级反应速率常数远高于其与SO4-·(k≤106 L/(mol·s))的,选用NB作为·OH的目标指示剂进一步探究CuFe2O4/PMS系统中·OH的作用.由图 16可以看出,在CuFe2O4/PMS系统中加入NB后,NB在40 min内降解90%左右,而单独的PMS对NB几乎没有降解作用,这意味着CuFe2O4/PMS体系中产生了·OH.
|
ρ(NB)0=0.5 mg/L, [PMS]0=1.0 mmol/L,CuFe2O4投加量0.1 g/L, 反应温度(25±0.2) ℃,初始pH=7.0±0.1 图 16 CuFe2O4/PMS系统对NB的去除 Figure 16 Degradation of nitrobenzene by CuFe2O4/PMS |
1) 纳米CuFe2O4的最佳煅烧温度为400 ℃,此温度下制备的纳米CuFe2O4晶型较好,比表面积大,表现出较高的催化活性和稳定性.
2) 纳米CuFe2O4对PMS的活化效果最强,对PDS活化效果较弱,对H2O2几乎没有活化效果.
3) CuFe2O4/PMS系统中,NFX快速降解最适宜的反应条件是:纳米CuFe2O4投加量为0.1 g/L,PMS浓度为0.5 mmol/L,初始pH为9.5.在pH为9.5附近,PMS可能被碱活化产生了氧化能力更强的自由基.
4) 纳米CuFe2O4可有效活化PMS分解产生·OH和SO4-·,SO4-·是实现NFX快速降解的主要活性自由基,·OH次之.
| [1] |
ZHANG Dandan, LIN Lifeng, LUO Zhuanxi, et al. Occurrence of selected antibiotics in Jiulongjiang River in various seasons, South China[J].
Journal of Environmental Monitoring, 2011, 13: 1953-1960.
DOI: 10.1039/c0em00765j |
| [2] |
陈涛. HPLC/LC-MS分析广州和珠海污水处理厂废水中多种抗生素污染研究[D]. 广东: 暨南大学, 2010.
CHEN Tao. Research on a variety of antibiotics of wastewater treatment plant in Guangzhou and Zhuhai by HPLC/LC-MS analysis method[D]. Guangdong: Jinan University, 2010. |
| [3] |
LI Yanwen, WU Xiaolian, MO Cehui, et al. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the Pearl River Delta area, Southern China[J].
Journal of Agricultural and Food Chemistry, 2011, 59: 7268-7276.
DOI: 10.1021/jf1047578 |
| [4] |
ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J].
Environmental Science & Technology, 2004, 38(13): 3705-3712.
|
| [5] |
GAO Yuqiong, GAO Naiyun, DENG Yang, et al. Heat-activated persulfate oxidation of sulfamethoxazole in water[J].
Desalination and Water Treatment, 2015, 56(8): 2225-2233.
DOI: 10.1080/19443994.2014.960471 |
| [6] |
GAO Yuqiong, GAO Naiyun, DENG Yang, et al. Ultraviolet (UV) light-activated persulfate oxidation of sulfamethazine in water[J].
Chemical Engineering Journal, 2012, 195: 248-253.
|
| [7] |
SU Shengnan, GUO Weilin, YI Chunliang, et al. Degradation of amoxicillin in aqueous solution using sulphate radicals under ultrasound irradiation[J].
Ultrasonics Sonochemistry, 2012, 19(3): 469-474.
DOI: 10.1016/j.ultsonch.2011.10.005 |
| [8] |
FUNMAN O S, TEEL A L, WATTS R J. Mechanism of base activation of persulfate[J].
Environmental Science & Technology, 2010, 44(16): 6423-6428.
|
| [9] |
ZHANG Botao, ZHANG Yang, TENG Yanguo, et al. Sulfate radical and its application in decontamination technologies[J].
Critical Reviews in Environmental Science & Technology, 2015, 45(16): 1756-1800.
|
| [10] |
FANG Guodong, DIONYDIOU D D, AL-ABED S R, et al. Superoxide radical driving the activation of persulfate by magnetite nanoparticles: Implications for the degradation of PCBs[J].
Applied Catalysis B-Environmental, 2013, 129: 325-332.
DOI: 10.1016/j.apcatb.2012.09.042 |
| [11] |
HE Xuexiang, DE L C, ARMAH A, et al. Kinetics and mechanisms of cylindrospermopsin destruction by sulfate radical-based advanced oxidation processes[J].
Water Research, 2014, 63: 168-178.
DOI: 10.1016/j.watres.2014.06.004 |
| [12] |
LIANG C J, BRUELL C J, MARLRY M C, et al. Persulfate oxidation for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate-thiosulfate redox couple[J].
Chemosphere, 2012, 55: 1213-1223.
|
| [13] |
YANG Q, CHOI H. Iron-cobalt mixed oxide nanocatalysts: Heterogeneous peroxymonosulfate activation, cobalt leaching, and ferromagnetic properties for environmental applications[J].
Applied Catalysis B: Environmental, 2009, 88(3/4): 462-469.
|
| [14] |
YING Hong. Efficient degradation of atrazine by magnetic porous copper ferrite catalyzed peroxymonosulfate oxidation via the formation of hydroxyl and sulfate radicals[J].
Water Research, 2013, 47: 5431-5438.
DOI: 10.1016/j.watres.2013.06.023 |
| [15] |
ZHANG Tao, ZHU H. Production of sulfate radical from peroxymonosulfate induced by a magnetically separable CuFe2O4 spinel in water: Efficiency, stability, and mechanism[J].
Environmental Science & Technology, 2013, 47: 2784-2791.
|
| [16] |
LAOKUL P, AMOMKITBAMNMG V, SERAPHIN S, et al. Characterization and magnetic properties of nanocrystalline CuFe2O4, NiFe2O4 ZnFe2O4 powders prepared by the Aloe vera extract solution[J].
Current Applied Physics, 2011, 11: 101-108.
DOI: 10.1016/j.cap.2010.06.027 |
| [17] |
ZHANG Xiaoling, FENG Mingbao, QU Ruanjuan, et al. Catalytic degradation of diethyl phthalate in aqueous solution by persulfate activated with nano-scaled magnetic CuFe2O4/MWCNTs[J].
Chemical Engineering Journal, 2016, 301: 1-11.
DOI: 10.1016/j.cej.2016.04.096 |
| [18] |
WANG Zhaohui, BUSH R T, SULLIVAN L A, et al. Selective oxidation of arsenite by peroxymonosulfate with high utilization efficiency of oxidant[J].
Environmental Science & Technology, 2014, 48: 3978-3985.
|
| [19] |
ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J].
Environmental Science & Technology, 2004, 38(13): 3705-3712.
|
| [20] |
MA Jun, SUI Minghao, ZHANG Tao, et al. Effect of pH on MnOx/GAC catalyzed ozonation for degradation of nitrobenzene[J].
Water Research, 2005, 39(5): 779-786.
DOI: 10.1016/j.watres.2004.11.020 |
| [21] |
ROSS D L, RILEY C M. Aqueous solubilities of some variously substituted quinolone antimicrobials[J].
International Journal of Pharmaceutics, 1900, 63: 237-250.
|
| [22] |
BARBOSA T, FONRODONA G, MARQUES I, et al. Factor analysis applied to the correlation between dissociation constants and solvatochromic parameters in water-acetonitrile mixtures.1. Solvent effects on the dissociation of carboxylic acid group in some diuretics, quinolones, buffers and peptides[J].
Trac-trends in Analytical Chemistry, 1997, 16: 104-111.
DOI: 10.1016/S0165-9936(96)00101-X |
| [23] |
DU Yunchen, MA Wenjie, LIU Pingxin, et al. Magnetic CoFe2O4 nanoparticles supported on titanate nanotubes as a novel heterogeneous catalyst for peroxymonosulfate activation and degradation of organic pollutants[J].
Journal of Hazardous Materials, 2016, 308: 58-66.
DOI: 10.1016/j.jhazmat.2016.01.035 |
| [24] |
GUAN Yinghong, MA Jun, LI Xuchun, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J].
Environmental Science & Technology, 2011, 45: 9308-9314.
|
| [25] |
HUANG Yaohui, HUANG Yifong, HUANG Chuning. Efficient decolorization of azo dye Reactive Black B involving aromatic fragment degradation in buffered Co2+/PMS oxidative processes with a ppb level dosage of Co2+-catalyst[J].
Journal of Hazard Materias, 2009, 170: 1110-1118.
DOI: 10.1016/j.jhazmat.2009.05.091 |
| [26] |
SUN Jianhui, SONG Mengke, FENG Jinglan, et al. Highly efficient degradation of ofloxacin by UV/Oxone/Co2+ oxidation process[J].
Environmental Science Pollution Research, 2011, 19: 1536-1543.
|
| [27] |
ZHANG Botao, XIANG Weixu, JIANG Xuemei, et al. Oxidation of dyes by alkaline-activated peroxymonosulfate[J].
Journal of Environmental Engineering, 2016, 142(4).
DOI: 10.1061/(ASCE)EE.1943-7870.0001084 |
| [28] |
ZHANG Tao, CHEN Yin, LEIKNESD T, et al. Oxidation of refractory benzothiazoles with PMS/CuFe2O4: Kinetics and transformation intermediates[J].
Environmental Science & Technology, 2016, 50: 5864-5873.
DOI: 10.1021/acs.est.6b00701 |
| [29] |
ZHANG Tao, LI Weiwei. CROUE J P. A non-acid-assisted and non-hydroxyl-radical-related catalytic ozonation with ceria supported copper oxide in efficient oxalate degradation in water[J].
Applied Catalysis B-environmental, 2012, 121: 88-94.
|
 2018, Vol. 50
2018, Vol. 50


