2. 哈尔滨工业大学 环境学院,哈尔滨 150090;
3. 上海晶宇环境工程股份有限公司,上海 200439
2. School of Environment, Harbin Institute of Technology, Harbin 150090, China;
3. Shanghai Jing Yu Environment Engineering Co., Ltd., Shanghai 200439, China
垃圾渗滤液是一种较为复杂的高浓度废水,处理不当可能对水体和生态环境造成极大危害[1-2].对于垃圾渗滤液中高质量浓度氨氮的去除,应用较广的是传统硝化反硝化生物脱氮,但渗滤液碳氮比很低,该工艺脱氮效率较差[3-4],需外加碳源,导致运行成本升高.短程硝化反硝化是近年出现的一种新型生物脱氮技术,具有诸多优势,如在低氧浓度下积累亚硝酸盐氮[5-6],不仅可大幅减小供氧量,节省25%的能耗,还能节省约40%的反硝化碳源,减少污泥产量,降低运行费用等[7-8].因此,短程硝化反硝化工艺成为当前废水生物脱氮领域研究的热点[9].
在短程硝化反应中,氨氮与COD是微生物生长的基质,但基质浓度过高可能会抑制氨氧化细菌(ammonia oxidizing bacteria,AOB)生长[10-11].此外,作为关键因素之一,pH对生物系统中短程硝化反应和微生物活性有显著影响,有必要结合数学模型,探究不同pH条件下短程硝化过程中氨氮与COD的动力学降解特性,目前上述研究较少[12-14].因此,本研究采用间歇进水生物反应器进行短程硝化实验,探究并建立氨氮与COD降解动力学模型,解析反应器微生物菌落特征,以期为短程硝化反应器的设计、操作和应用提供依据.
1 实验 1.1 接种污泥接种污泥取自本实验室运行的短程硝化反应器,污泥质量浓度MLSS为4.2 g/L,挥发性固体质量浓度VSS为2.7 g/L,VSS与MLSS比为0.64.
1.2 实验水样原垃圾渗滤液取自上海市崇明县生活垃圾填埋场,本研究以垃圾渗滤液的稀释液作为实验进水,两种废水的水质特征如表 1所示.
| 表 1 垃圾渗滤液及其稀释液的水质特征 Table 1 Water quality of landfill leachate and its diluent |
间歇进水生物反应器的总体积为500 mL,设置有曝气装置,主要在水浴恒温振荡器(实验装置如图 1所示)中进行短程硝化实验,过程如下:
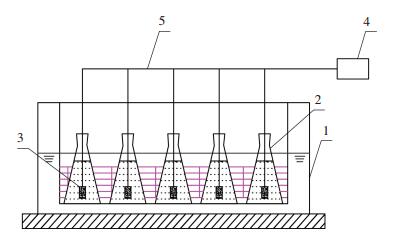
|
1—水浴恒温振荡器;2—反应器;3—曝气器;4—鼓风机;5—气管 图 1 实验装置 Figure 1 Schematic of experimental setup |
设置振荡器水温为30 ℃,将编号分别为1#、2#、3#、4#和5#的反应器置入振荡器中.由低到高配制5种浓度的垃圾渗滤液稀释液,各取150 mL加至上述5个反应器,并分别加入100 mL接种污泥.开启振荡器摇匀约2 min后,记为0时刻,取样测试氨氮、COD、亚硝态氮和硝态氮质量浓度.然后开启曝气和振荡,控制DO为0.8~1.2 mg/L,每间隔1 h取样测试氨氮、COD、亚硝态氮和硝态氮质量浓度,至第5小时后结束.调节稀释液pH分别为6.5、7.0、7.5、8.0和8.5,保持温度为30 ℃,同上进行实验,考察pH对氨氮和COD降解的影响.
1.4 分析方法COD采用重铬酸钾法测定,氨氮采用纳氏试剂比色法测定,硝态氮采用麝香草酚分光光度法测试,亚硝态氮采用N-(1-萘基)-乙二胺分光光度法测试.
微生物菌种使用DNAzol试剂抽提微生物DNA,然后将其作为PCR(polymerase chain reaction)的模板[15].反应体系为50 μL,2×Hotstart-PCR mix 25 μL,上下游引物各0.8 μL;DNA模板1 μL,无菌去离子水22.4 μL,均采用通用引物为细菌16SrDNA:F(5′-AGAGTTTGATCC-TGGCTCAG-3′)和R(5′-CAKAAAGGAGGTGAT-CC-3′) [16].PCR扩增的反应条件为:预变性94 ℃ 4 min;随后94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,此步骤重复35个循环;最后72 ℃延伸10 min,PCR产物经1%的琼脂糖凝胶电泳分析后使用DNA纯化试剂盒(鼎国生物有限公司,北京)分离得到,目的基因片段克隆到pMD-18T-vector载体上,转化入E.coliDH5α感受态细胞,随后对阳性克隆进行测序分析(捷瑞生物有限公司,上海),将测序得到的16SrDNA序列用basic local alignment searc tool(BLAST)的方法在GenBank数据库上进行比对分析[15].
1.5 计算方法1) 污染物降解速率方程:
| $ r =-\frac{{{\rm{d}}\rho }}{{{\rm{d}}t}}. $ | (1) |
对式(1)进行变形,积分得
| $ {\rho _0}-{\rho _t} = rt. $ | (2) |
式中:ρ0为污染物初始质量浓度,mg/L;ρt为t时刻污染物质量浓度,mg/L;r为降解速率,mg/(L·h);t为反应时间,h.对(ρ0-ρt)-t作图,直线斜率即为污染物降解速率.
2) 米氏方程(Michaelis-Menten)模型[17]:
| $ r = \frac{{{r_{\max }}\rho }}{{{K_{\rm{S}}} + \rho }}. $ | (3) |
采用双倒数法,对式(3)两边取倒数:
| $ \frac{1}{r} = \frac{{{K_{\rm{S}}}}}{{{r_{\max }}}} \cdot \frac{1}{\rho } + \frac{1}{{{r_{\max }}}}. $ | (4) |
修正后的米氏方程模型
| $ r = \frac{{{r_{\max }}\left( {\rho-1000} \right)}}{{{K_{\rm{S}}} + \left( {\rho-1000} \right)}}. $ | (5) |
对式(5)两边取倒数:
| $ \frac{1}{r} = \frac{{{K_{\rm{S}}}}}{{{r_{\max }}}} \cdot \frac{1}{{\rho-1000}} + \frac{1}{{{r_{\max }}}}. $ | (6) |
式中:r为基质降解速率,mg/(L·h);rmax为基质最大降解速率,mg/(L·h);KS为饱和常数,mg/L;ρ为基质质量浓度,mg/L.根据斜率和截距,可求出KS及rmax.
3) 基质抑制Aiba动力学模型[18]:
| $ r = \frac{{{r_{\max }}\left( {\rho-200} \right)}}{{{K_{\rm{S}}} + \left( {\rho-200} \right)}}\exp \left( {-\frac{{\rho - 200}}{{{K_{{\rm{SI}}}}}}} \right). $ | (7) |
式中:r为基质转化速率,mg/(L·d);rmax为最大基质转化速率,mg/(L·d);ρ为基质质量浓度,mg/L;KS为半饱和常数,mg/L;KSI为抑制常数,mg/L.
2 结果与讨论 2.1 pH对氨氮降解速率的影响在氨氮初始质量浓度ρ1~ρ5分别为20.1、37.9、57.2、74.4和100 mg/L,温度为30 ℃条件下,pH不同时氨氮降解曲线和动力学参数如图 2所示.可以看出,当氨氮初始质量浓度为20~100 mg/L,不同pH条件下,随着氨氮初始质量浓度增加,氨氮降解速率也逐渐增加.而在ρ1~ρ5每个初始质量浓度下,当pH从6.5增至8.5时,氨氮降解速率均出现先增加后减小的趋势.李冬等[19]研究指出,当pH为5.0~8.0时,氨氧化速率随pH增加而增加,pH为8.0~10.0时氨氧化速率随pH增加而减小,且pH为8.0时氨氮氧化速率为6.6 mg/(L·h),这与本研究的结果基本一致.

|
ρ1=20.1 mg ·L-1;ρ2=37.9 mg/L;ρ3=57.2 mg/L;ρ4=74.4 mg/L;ρ5=100 mg/L 图 2 不同氨氮初始质量浓度下的降解曲线 Figure 2 Degradation of NH4+-N under different initial concentrations |
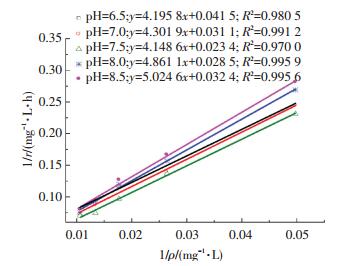
采用动力学模型方程(4)拟合,得到不同pH的拟合方程如图 3所示,动力学参数如表 2所示.
|
图 3 不同pH下氨氮降解拟合曲线 Figure 3 Fitting curves of NH4+-N degradation under different pH |
| 表 2 氨氮降解动力学参数 Table 2 Kinetic parameters of NH4+-N degradation |
由表 2知,pH从6.5增至8.5时,氨氮的最大降解速率rmax与饱和常数KS均是先增加后减小.当pH为7.5时达最大,分别为42.7 mg/(L·h)和1 77.3 mg/L,较pH为6.5分别增加了43.6%和42.9%.这说明在短程硝化过程中,氨氮的最大降解速率与饱和常数均受pH影响较大,在pH不超过7.5时,适当提高pH,有利于提高氨氮降解的最大速率和饱和常数.吕斌等[20]在对晚期垃圾渗滤液进行短程硝化研究中发现,当pH为6.0~8.0时,适当提高体系pH,能够增大最大氨氧化速率,从而提高对氨氮的去除效率,降低出水氨氮质量浓度,这与本研究结果较为一致.左剑恶等[21]在研究高质量浓度氨氮短程硝化过程中证实,pH为7.5时的氨氧化速率和亚硝化速率均明显高于pH为7.0和8.0,这与本研究的结果极为相似.
此外,众多研究指出,生物系统pH对氨氧化速率的影响机制主要有两种途径,一是生物系统中不同的pH会直接影响微生物细胞内的电解质平衡,从而影响其活性;二是尽管pH对氨氧化菌活性没有直接影响,但pH能显著影响混合液中作为氨氧化细菌的真正基质——游离NH3 (free ammonia, FA)的质量浓度,在一定氨氮质量浓度下,pH较高时游离NH3质量浓度较高,而pH较低时,则相反.结合上述影响机制,本研究中pH对氨氧化速率的显著影响很可能主要通过影响游离NH3质量浓度来实现,主要原因是pH能显著影响游离NH3质量浓度.文献[22]指出,在ρNH4+-N=65 mg/L、t=28 ℃条件下,pH为6.5时FA仅有0.17 mg/L,而pH为8.0时FA的质量浓度则高达5.18 mg/L,由此可知,当pH从6.5增加到8.时,FA质量浓度增加约30.5倍.另一方面,在pH为6.5时最大氨氮降解速率达到24.1 mg/(L·h),尽管低于pH为8.0时的35.1 mg/(L·h),但仍能实现氨氮的高效去除.这间接说明pH在6.5~8.0波动时,微生物细胞内的电解质平衡和活性虽受到影响,但并不是主要因素.
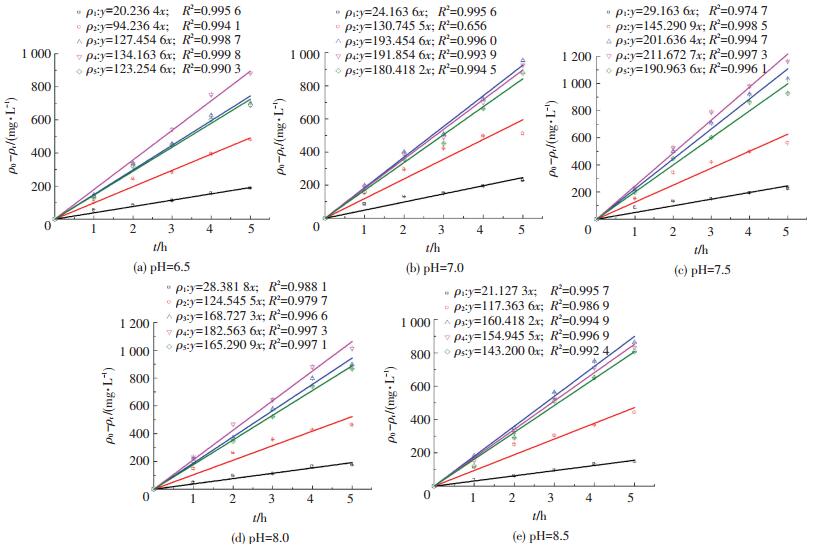
2.2 pH对COD降解速率的影响COD初始质量浓度ρ1~ρ5分别为238、550、1 298、1 416和1 900 mg/L,温度为30 ℃,不同pH条件下,COD降解曲线和对应的动力学参数如图 4所示.
|
ρ1=20.1 mg/L; ρ2=37.9 mg/L; ρ3=57.2 mg/L; ρ4=74.4 mg/L; ρ5=100 mg/L 图 4 不同COD初始质量浓度下的降解曲线 Figure 4 Degradation of COD under different initial concentrations |
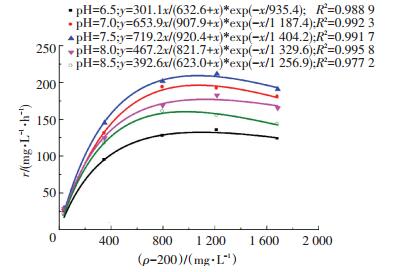
由图 4可以看出,当初始质量浓度ρ在200~1 416 mg/L时,随着COD初始质量浓度的增加,COD降解速率逐渐增加,但ρ高于1 416 mg/L时,COD降解速率则逐渐下降,表现为抑制特征.采用基质抑制Aiba动力学模型(7)[18],对r~(ρ-200)拟合,可得各pH条件下的拟合曲线及方程(图 5),动力学参数如表 3所示.可以看出,当pH由6.5升高至8.5,最大降解速率rmax、饱和常数KS与抑制常数KSI均是先增大后减小,在pH为7.5时,三者均达到最大值719.2 mg/(L·h)、920.4和1 404.2 mg/L,表明在短程硝化过程中,pH对COD降解有较大影响,pH过高或过低均不利于COD降解,最佳pH应控制在7.0~8.0.
|
图 5 COD降解拟合曲线 Figure 5 Fitting curves of COD degradation under different pH |
| 表 3 COD降解动力学参数 Table 3 Kinetic parameters of COD degradation |
短程硝化过程中氨氮和COD的降解常数如表 4所示.可以看出,短程硝化过程中COD的降解速率和最大降解速率分别是氨氮的5.6~11.3倍和12.4~16.8倍,说明有机物降解速率远高于氨氮,这可能是由于本研究进水中含有较高浓度有机物,导致生物系统中异养菌生长代谢较快,且异养菌丰度远高于自养菌.尹军等[23]指出,在生物系统中,进行有机物氧化的异养菌生长速率(128.2 mg/(g·h))远高于进行硝化反应的自养型硝化菌(7.2 mg/(g·h)).
| 表 4 COD和氨氮降解参数对比 Table 4 Comparison of the degradation parameters of COD and ammonia |
同时需要指出的是,由于垃圾渗滤液中组分复杂,含有较多的重金属等有毒有害物等,这些复杂物质也可能对生物系统中异养菌活性和COD降解速率造成影响,有待后续研究进一步证实.
2.3 系统中微生物的群落结构特征长期实验表明,通过控制溶氧质量浓度为0.8~1.2 mg/L,间歇进水生物系统出水中亚硝态氮质量浓度远高于硝态氮,亚硝态氮积累基本维持在50%~90%,说明该生物系统中成功实现了短程硝化反应.为了进一步确认该生物系统中短程硝化反应的进行,采用PCR技术对污泥菌群进行测序,随机挑选100个克隆测序,将测序结果与GenBank数据库BLAST进行比对,分析硝化菌种及其所占比例,结果如表 5所示.
| 表 5 间歇进水生物反应器菌种分析 Table 5 Proportions of AOB and NOB in an intermittent flow reactor |
从表 5可知,污泥中微生物种群较为丰富,共检测出19种菌种.其中,Nitrosomonas europ-aea ATCC19178、Nitrosomonas stercoris、Nirospina moscoviensis X82558、Nitrosospira sp.PM2、Micro-coccus luteus NCTC 2665、Alkaliphilus metalliredigensQYMF、Anaerolinea thermophila UNI-1及Paracoccus denitrificans PD1222菌属共8种细菌占据了整个细菌群落的绝大部分,是系统中的主要功能菌种,而其他劣势菌群占比相对较小(11%).
在主要功能菌种中,Nitrosomonas europaea AT-CC19178、Nitrosomonas stercoris和Nitrosospira sp.PM2均属于AOB菌群,共占比达66%,是该系统中最优势的菌种.这3类菌群的主要功能是将氨氮氧化为亚硝态氮,促进亚硝态氮积累,是生物系统实现短程硝化反应最主要的菌群.另外,Nirospina moscoviensis X82558占比也高达13%,这类菌群属于亚硝酸盐氧化菌(nitrite-oxidizing bacteria, NOB),主要功能是将亚硝态氮转化为硝态氮,这说明生物系统中NOB并没有完全被淘汰,反应器中同时存在部分全程硝化反应.
3 结论1) 在pH为6.5~8.5时,氨氮降解符合米氏模型,而COD降解适用于抑制Aiba动力学模型.随pH增加,氨氮和COD的最大降解速率与饱和常数均先增加后降低,pH为7.5时达到最大值.这说明短程硝化反应中,氨氮与COD降解受pH影响较大,最佳pH应控制为7.5~8.0.
2) 间歇进水生物反应器微生物中3种AOB菌群Nitrosomonas europaea ATCC19178、Nitrosomonas stercoris和Nitrosospira sp.PM2的总占比达66%,说明AOB菌群是最主要的优势菌群,这类菌群有利于短程硝化反应去除氨氮.
| [1] |
AZIZ S Q, AZIZ H A, YUSOFFM S, et al. Landfill leachate treatment using powdered activated carbon augmented sequencing batch reactor (SBR) process: Optimization by response surface methodology[J].
Journal of Hazardous Materials, 2011, 18: 404-413.
|
| [2] |
PENG Y Z, ZHANG S J, ZENG W, et al. Organic removal by denitrification and methanogenesis and nitrogen removal by nitritation from landfill leachate[J].
Water Research, 2008, 42: 883-892.
DOI: 10.1016/j.watres.2007.08.041 |
| [3] |
BERNET N, SANCHEZ O, DABERT P, et al. Effect of solid hold-up on nitrite accumulation in a biofilm reactor-molecular characterization of nitrifying comm-unities[J].
Water Science and Technology, 2004, 49(11/12): 123-130.
|
| [4] |
BOUGARD D, BERENT N, CHENEBY D, et al. Nitrification of a high strength wastewater in an inverse turbulent bed reactor: Effect of temperature on nitrite accumulation[J].
Process Biochemistry, 2006, 41(1): 106-113.
DOI: 10.1016/j.procbio.2005.03.064 |
| [5] |
PENG Y, ZHU G. Biological nitrogen removal with nitrification and denitrification via nitrite pathway[J].
Applied Microbiology and Biotechnology, 2006, 1: 15-26.
|
| [6] |
HELLINGA C, SCHELLEN J W, MULDER M C, et al. The SHARON process: An innovative method for nitrogen removal from ammonium-rich waste water[J].
Water Science and Technology, 1998, 37: 135-142.
|
| [7] |
RUIZ G, JEISON D, CHAMY R. Nitrification with high nitrite accumulation for the treatment of wastewater with high ammonia concentration[J].
Water Research, 2003, 37(6): 1371-1377.
DOI: 10.1016/S0043-1354(02)00475-X |
| [8] |
FDZ-POLANCO F, VILLAVERDE S, GARCIA P A. Temperature effect on nitrifying bacteria activity in biofilters: Activation and free ammonia inhibition[J].
Water Science and Technology, 1994, 30(11): 121-130.
|
| [9] |
YOON H J, KIM D J. Nitrification and nitrite accumulation characteristics of high strength ammonia wastewater in a biological aerated filter[J].
Journal of Chemical Technology and Biotechnology, 2003, 78: 377-383.
DOI: 10.1002/(ISSN)1097-4660 |
| [10] |
KIM D J, LEE D I, JURG K. Effect of temperature and free ammonia on nitrification and nitrite accumulation in landfill leachate and analysis of its nitrifying bacterial community by FISH[J].
Bioresource Technology, 2006, 97: 459-468.
DOI: 10.1016/j.biortech.2005.03.032 |
| [11] |
WIESMANN U. Biological nitrogen removal form waste-water[J].
Advances in Biochemical Engineering-Biotech-nology, 1994, 51: 113-154.
|
| [12] |
KATARZYNA K, LEDAKOWICZ S. Kinetics of nitrogen removal from sanitary landfill leachate[J].
Bioprocess and Biosystems Engineering, 2006, 29(5/6): 291-304.
|
| [13] |
ZUMFT W G. Cell biology and molecular basis of denitri-fication[J].
Microbiology and Molecular Biology Reviews, 1997, 61(4): 533-616.
|
| [14] |
COELHO M A Z, RUSSO C, ARAUJO O Q F. Optimi-zation of a sequencing batch reactor for biological nitrogen removal[J].
Water Research, 2000, 34(10): 2809-2817.
DOI: 10.1016/S0043-1354(00)00010-5 |
| [15] |
GODON J J, ZUMSTEIN E, DABERT P, et al. Molecular microbial diversity in an anaerobic diversity in an anaer-obic digester as determined by small-subunit r-DNA sequence analysis[J].
Applied and Environmental Micro-biology, 1997, 63(7): 2802-2813.
|
| [16] |
WATANABE K, TERAMOTO M, HARAYAMA S, et al. An outbreak of non-flocculating catabolic populations caused the breakdown of a phenol-digesting activated-sludge process[J].
Applied and Environmental Micro-biology, 1999, 65(7): 2813-2819.
|
| [17] |
MICHAELIS L, MENTEN M. Diekinetik der invertin-wirkung[J].
Biochemische Zeitschrift, 1913, 49: 333-369.
|
| [18] |
AIBA S, SHODA M, NAGATANI M. Kinetics of product inhibition in alcohol fermentation[J].
Biotechnology and Bioengineering, 1968, 10: 845-864.
DOI: 10.1002/(ISSN)1097-0290 |
| [19] |
李冬, 苏庆岭, 梁瑜海, 等. 碱度和pH值对CANON工艺脱氮效果的影响[J].
中国给水排水, 2015, 31(3): 13-18.
LI Dong, SU Qingling, LIANG Yuhai, et al. Effect of alkalinity and pH value on performance of completely autotrophic Nitrogen removal over nitrite process[J]. China Water & Wastewater, 2015, 31(3): 13-18. |
| [20] |
吕斌, 杨开, 周培疆, 等. 晚期垃圾渗滤液实现短程硝化影响因素分析[J].
哈尔滨工业大学学报, 2006, 38(6): 931-934.
LV Bin, YANG Kai, ZHOU Peijiang, et al. Factors effecting shortcut nitrification for treatment of advanced stage landfill leachate[J]. Journal of Harbin Institute of Technology, 2006, 38(6): 931-934. |
| [21] |
左剑恶, 杨洋, 蒙爱红. 高氨氮浓度下的亚硝化过程及其影响因素研究[J].
环境污染与防治, 2003, 25(6): 332-335.
ZUO Jianwu, YANG Yang, MENG Aihong. Study on short-cut nitrification process and its affecting factors under high ammonia concentration condition[J]. Huanjing Wuran Yu Fangzhi, 2003, 25(6): 332-335. DOI: 10.15985/j.cnki.1001-3865.2003.06.005 |
| [22] |
杨宏, 姚仁达. pH和硝化细菌浓度对氨氮氧化速率的影响[J].
环境工程学报, 2017, 11(5): 2660-2665.
YANG Hong, YAO Renda. Effects of pH level and nitrifying bacteria concentration on ammonia oxidation rate[J]. Chinese Journal of Environmental Engineering, 2017, 11(5): 2660-2665. DOI: 10.12030/j.cjee.201512155 |
| [23] |
尹军, 谭学军, 王雪峰, 等. 有机物降解和硝化过程中污泥摄氧速率的变化[J].
中国环境科学, 2007, 27(4): 524-528.
YIN Jun, TAN Xuejun, WANG Xuefeng, et al. Variation of oxygen uptake rate in organic matter biodegradation and nitrification[J]. China Environmental Science, 2007, 27(4): 524-528. |
 2018, Vol. 50
2018, Vol. 50


