2. 哈尔滨工业大学 环境学院,哈尔滨 150090
2. School of Environment, Harbin Institute of Technology, Harbin 150090, China
近年来,土壤重金属污染因其影响面积广泛、造成的环境影响恶劣等受到广泛关注[1],其中镉污染面积最大、影响最为显著[2-3].而水稻是镉富集植物,土壤镉污染直接影响粮食安全问题[4].为了控制土壤重金属污染,加强耕地重金属污染治理修复,寻找切实有效的原位修复技术迫在眉睫[5].在大面积镉污染的形势下,受污染土壤的完全弃耕难以实现,有关稻米中重金属含量超标的问题也日益突出[6-7].目前,对于遭受重金属污染的轻度污染区农田土壤,主要通过加入一些土壤改良剂,如石灰、有机酸以及EDTA等[8-9],改变重金属在土壤中的赋存形态使其钝化,但这些措施都会在不同程度上改变土壤的理化性质,造成二次污染.相对于投加土壤改良剂,生物改良的方法具有投资省、费用低以及不产生二次污染的优点[10-11].
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)与植物共生现象广泛存在于自然界各类生态环境中,具有直接联系土壤和植物根系的桥梁作用[12-13].已有研究表明,AMF在土壤中伸展的根外菌丝可扩大宿主植物根系水分及营养物质吸收阈[14],进而提高植物在胁迫环境下的生长与生理活性,有效缓解低镉污染土壤对水稻生长的胁迫作用[15-16];同时,AMF可通过菌丝固持作用和菌丝分泌物的螯合作用实现对重金属的根际固定,减少向地上器官的转运[17],从而降低水稻籽实镉富集浓度,实现低镉污染条件下的原位安全生产.本研究主要探讨菌根技术在低镉污染土壤中保障水稻安全生产的应用,而不再研究高浓度镉污染对水稻生长的影响,这对低镉污染土壤的原位修复具有重要意义.
1 试验 1.1 试验材料试验于2015年4月—9月在哈尔滨工业大学城市水资源与水环境国家重点实验室面源污染防治与生态修复综合试验区进行,供试水稻种子购于黑龙江省农业科学院,品种为龙稻5号.试验用菌种摩西管柄囊霉(Funnelliformis mosseae),保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.3012.以白三叶草为宿主植物,土壤、沙子、蛭石以体积比2:5:3混合作为基质进行扩繁,获得内含侵染植物根段、菌丝及孢子体的根际土作为接种菌剂.试验用土壤为腐殖质土,经黑龙江省农业科学院植株肥料检测中心检测,有机质146.9 g/kg,碱解氮430.4 mg/kg,有效磷48.9 mg/kg,速效钾160 mg/kg,土壤镉含量本底值为0.099 mg/kg.
1.2 试验设计试验采用盆栽,每盆装土3 kg,所用土壤经自然风干后磨碎,经121 ℃下高温、高压蒸汽灭菌2 h,以保证去除土壤中原本含有的丛枝菌根真菌.
以CdCl2·2.5H2O的溶液形式,将Cd均匀加入供试土壤,共设置0、0.1、0.2、0.3、0.4、0.5、1 mg/kg(纯Cd计)7个模拟浓度梯度.同一镉浓度梯度下分别设置不接种(CK)和接种(GM)两个实验组,每个实验组设置3个平行对照组.每盆接种AMF菌剂100 g,花盆装土后,将AMF菌剂均匀平铺于花盆表面,之后加一层土覆盖.
水稻种子用质量分数0.1%~0.2%的高锰酸钾溶液浸泡24 h后,放置于托盘上28 ℃恒温箱中加水浸润催芽一周,将长势相对良好且均匀的秧苗移栽到试验用塑料盆中,每盆留苗12株,待生长两周后,将所有水稻移至室外,在完全自然的环境下生长,并于2015年9月收割.
1.3 测定方法AMF侵染率的测定:剪取1 cm长的根段,用酸性品红溶液染色法,于10倍显微镜下观察菌根发育状况,由根段侵染率加权法计算侵染率,共观察100条根段.
菌根依赖性测定:接菌水稻生物量与未接菌水稻生物量的比值.
植物生长指标测定:1)水稻株高(cm).在水稻成熟期用刻度软尺测量,从茎基部至穗顶部的长度,数据取10个样本的平均值.2)水稻根长(cm).在水稻成熟期用刻度软尺测量,得到水稻最长主根长,数据取10个样本的平均值.3)根冠比.根冠比=水稻地下部分生物量/水稻地上部分生物量.4)水稻生物量(g).以水稻根部周围土壤为介质,将水稻连根挖出,小心去除根系周围泥土及杂物,用蒸馏水洗净,装于干净纸袋中,放入电热恒温鼓风干燥箱内,105 ℃杀青5 min后,于70 ℃烘干24 h至恒质量.每个处理条件下取10个样本,分为地上部分和地下部分,分别称质量.5)水稻产量.于收获期,每个处理条件下取10个样本,测得每株水稻的籽实质量.
水稻籽实Cd含量测定:水稻籽实经湿法消解,通过ICP-MS测定含量.
1.4 统计分析数据统计分析采用SPSS 17.0软件,显著性分析采用Duncan法,作图采用Origin 2015软件.
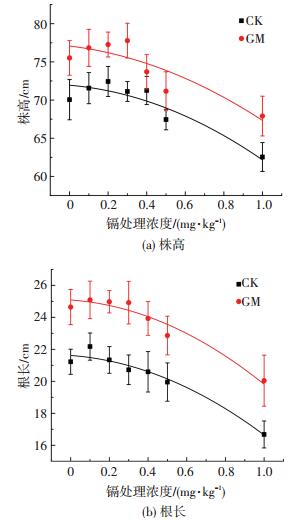
2 结果与分析 2.1 AMF对水稻生长的促进作用摩西管柄囊霉侵染后一个月,可在湿生条件下与宿主水稻形成稳定侵染,对低镉污染条件下水稻根系进行侵染率测定,测得水稻根系平均侵染率达(27.31±4.25)%,这与前人的研究结果相似,表明水稻与菌剂形成了良好的稳定共生关系.在收获期,测量不同低镉污染条件下水稻植株高度及根长,探究低镉污染条件下菌剂对水稻株高及根长生长的促进作用,结果如图 1所示.通过曲线拟合可以看出,随着Cd2+胁迫浓度的提高,水稻株高及根长均呈现先升高后下降趋势,表明低浓度的镉对水稻株高、根长的生长有一定的促进作用.两种处理条件下,水稻株高根长均差异显著(P<0.05).当无外源添加Cd2+时,GM组水稻平均株高为(75.5±2.3) cm,而CK组仅为(70.1±2.6) cm,GM组比CK组提高7.70%;GM组水稻平均根长为(24.6±1.1) cm,而空白对照组仅为(21.2±0.8)cm,GM组比空白对照组平均高出3.4 cm.结果表明,菌剂对水稻株高及根系的生长有良好的促进作用,进而降低Cd2+胁迫对水稻生长的不利影响.根系长度的增加增强了水稻对营养物质的吸收能力和利用效率,根系作为水稻与土壤中重金属直接接触的器官,受到的毒害作用最为明显,而在低镉污染土壤中施加菌剂,可以有效地保证水稻根系的健康成长,从而缓解重金属对水稻的毒害作用.
|
图 1 低镉污染条件下菌剂对水稻株高及根长的影响 Figure 1 Effects of AMF on plant height and root length of rice under low cadmium contamination |
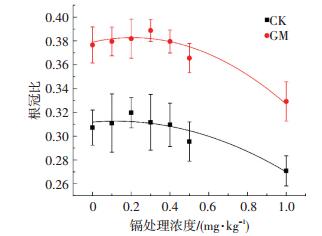
水稻的根冠比可以反映水稻植株的生长发育情况,一般以地下部分干重与地上部分干重的比值来表示,比值越高则根系生理机能越好.不同低镉污染条件下水稻根冠比结果如图 2所示.可以看出,随着镉胁迫浓度的提高,水稻根冠比总体呈先升高后下降趋势,低镉污染对水稻地下器官的抑制作用更强,且低浓度的镉对水稻地下器官的生长有一定的促进作用.菌剂的施加,可有效提高植物的根冠比(P<0.05),GM组根冠比的平均值较CK组提高22.37%,这使得植物的空间构型发生改变,更倾向于地下器官的扩张,增强植物对元素的吸附吸收功能,进而缓解重金属对植物的损害,从而保护植物在逆境中正常生长.
|
图 2 低镉污染条件下菌剂对水稻根冠比的影响 Figure 2 Effects of AMF on root-shoot ratio of rice under low cadmium contamination |
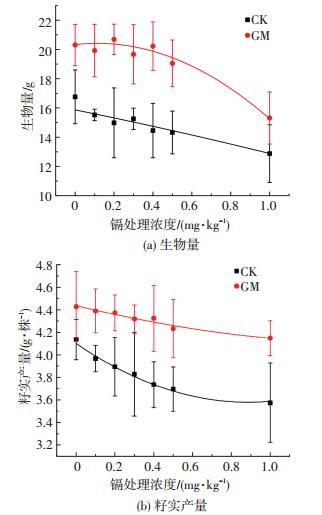
生物量是植物对干物质的积累量,水稻干质量的测量能够反映低镉胁迫对水稻营养生长的影响,水稻的籽实产量则是评估水稻生产状况的重要指标.于水稻收获期测得水稻生物量及籽实产量,结果如图 3所示.可以看出,人工施加菌剂的水稻菌根依赖性指数高于空白对照组,达120.43%,表明菌剂的添加对水稻生物量的增加有显著的促进作用,对保障水稻生长有重要意义.通过拟合曲线可以看出,水稻生物量随着镉胁迫浓度的增加总体呈现下降趋势,GM组的水稻生物量整体高于CK组(P<0.05),平均增加幅度为29.76%.菌剂侵染水稻根系后,菌根与水稻形成良好的共生体,促进植物生长,进而增强水稻的生长和抗逆境能力,缓解低镉污染对水稻的胁迫.同时,低镉污染条件下,水稻籽实产量表现为降低趋势,GM组较CK组籽实产量平均提高12.61%(P<0.05),表明AMF强化处理能够提高水稻产量.
|
图 3 低镉污染条件下菌剂对水稻生物量及籽实产量的影响 Figure 3 Effects of AMF on rice biomass and seed yield under low cadmium contamination |
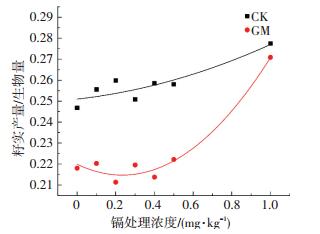
水稻籽实产量与水稻生物量的比值可以反映水稻生物量的分配不同,水稻产量与水稻生物量的比值结果如图 4所示.可以看出,GM组的比值均低于CK组,菌剂的添加虽然对水稻生物量和籽实产量均有增加,但其对生物量积累的促进作用更为显著.同时,随着镉浓度的升高,两组处理下比值均有不同程度的升高,这可能是因为随着镉浓度的升高,对水稻生物量减少的影响较大,而对籽实产量降低的影响相对较小,致使比值逐渐升高.在逆境或胁迫条件下,生物通过优先生殖以保证种群适合度和遗传信息的稳定传递.因此,镉胁迫程度增加导致植物繁殖分配的增加.
|
图 4 低镉污染条件下菌剂对水稻籽实产量与水稻生物量比值的影响 Figure 4 Effects of AMF on the ratio of rice seed yield to rice biomass under low cadmium contamination |
水稻籽实中的镉含量是评价食品安全的重要指标,土壤中的镉被水稻吸收后转运到籽实内.中国对大米镉含量有严格的限定标准,2012年颁布的食品安全国家标准《食品中污染物限量》(GB2762—2012)中规定,大米、糙米中镉含量不可超过0.2 mg/kg(以Cd计).收获期不同低镉污染条件下水稻籽实镉含量如图 5所示.可以看出,随着土壤中镉浓度的提高,水稻籽实中的镉含量也随之增加,但GM组的籽实镉含量均不同程度低于CK组(P<0.05),菌剂的添加可以明显降低镉在水稻籽实中的富集.这是因为一方面水稻生物量的增加对镉在水稻体内的浓度有一定的稀释作用,另一方面,菌剂的添加使重金属更多地在根系钝化及固定,减少其向地上部分的转运.对水稻籽实镉含量与土壤中镉浓度进行拟合,得到拟合曲线:CK,y=-0.413 0x2+0.694 2x+0.077 1,GM,y=-0.317 4x2+0.472 1x+0.081 3,计算可得GM组和CK组引起水稻籽实镉含量超标的土壤镉含量临界值分别为0.32和0.20 mg/kg,而且GM组的籽实镉含量均低于0.25 mg/kg.因此,菌剂的添加可使保障粮食安全生产的土壤镉含量范围由0.20 mg/kg提高到0.32 mg/kg,扩大了可利用的低镉污染土壤的范围,对保障水稻的安全生产具有重要意义.
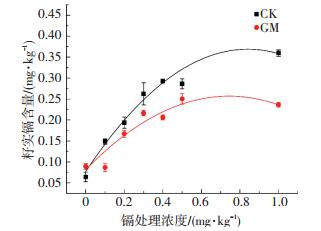
|
图 5 低镉污染条件下菌剂对水稻籽实镉含量的影响 Figure 5 Effects of AMF on the cadmium content in rice seed under low cadmium contamination |
通过对土壤镉含量、水稻株高、根长、根冠比、生物量、籽实产量与水稻籽实镉含量的相关性分析,比较各组曲线拟合的结果,其中线性拟合的结果最好,如表 1所示.可以看出, 无菌剂侵染条件下,籽实镉含量与水稻营养和生殖生物量的累计均呈现显著负相关关系,表明作物生长对籽实镉含量具有稀释作用;接菌条件下,籽实镉含量与作物生长累积的相关性降低,但与根冠比的负相关性显著升高,菌剂侵染对镉在生物体内的分配起到了调节作用,根际镉固定效应增强表明其降低了对营养器官生长稀释作用的依赖性.
| 表 1 水稻籽实镉含量与各因素相关性 Table 1 Correlation between cadmium content in rice seeds and various factors |
1) 人工施加AMF菌剂后,GM的平均侵染率达(27.31±4.25)%,水稻的菌根依赖性指数达120.43%.在低镉污染条件下,AMF的侵染率并无较大差异,水稻对AMF菌剂的依赖性是存在的,表明菌剂可与水稻形成良好的共生关系,并对镉污染具有一定的抗性.
2) 随着镉胁迫浓度的增大,水稻株高、根长及根冠比均呈现下降趋势,施加菌剂可有效缓解低镉污染对水稻生长的抑制作用.当无外源添加Cd2+时,GM组株高比CK组提高7.70%,根长较CK组高3.4 cm,根冠比的平均值较CK组提高22.37%.表明AMF菌剂的添加可有效促进水稻的生长,尤其是向地下器官的扩张,提高植物对元素的吸收利用效率,从而缓解低镉污染对水稻的毒害作用.
3) 随着镉胁迫浓度的增大,水稻生物量及籽实产量均呈现下降趋势.GM组比CK组生物量平均增加29.76%,较CK组籽实产量平均提高12.61%.表明在低镉污染条件下,菌剂的添加可以明显提高水稻生物量和籽实产量,但其对生物量积累的促进作用更为显著[18],二者的比值是下降的.
4) 土壤镉含量的增大直接影响镉在水稻籽实中的富集,土壤镉浓度为0.20 mg/kg时,水稻籽实镉含量在国家食品安全标准范围内.施加菌剂后,土壤的镉污染阈值在0.32 mg/kg以内,即可保证水稻籽实镉含量在安全标准范围内.这表明菌剂的添加对于保证水稻粮食安全生产以及减少镉大米的产生是一条有效的途径.菌剂侵染对镉在生物体内的分配起到调节作用,根际镉固定效应增强[19]表明其降低了对营养器官生长稀释作用的依赖性.
| [1] |
LI Y, PENG J, SHI P, et al. The effect of Cd on mycorrhizal development and enzyme activity of Glomus mosseae and Glomus intraradices in Astragalus sinicus L[J].
Chemosphere, 2009, 75(7): 894-899.
DOI: 10.1016/j.chemosphere.2009.01.046 |
| [2] |
WU J, WANG L, MA F, et al. Effects of vegetative-periodic-induced rhizosphere variation on the uptake and translocation of metals in Phragmites australis (Cav.) Trin ex. Steudel growing in the Sun Island Wetland[J].
Ecotoxicology, 2013, 22(4): 608-618.
DOI: 10.1007/s10646-013-1052-2 |
| [3] |
WANG C X, MO Z, WANG H, et al. The transportation, time-dependent distribution of heavy metals in paddy crops[J].
Chemosphere, 2003, 50(6): 717-723.
DOI: 10.1016/S0045-6535(02)00211-4 |
| [4] |
MCLAUGHLIN M J, PARKER D R, CLARKE J M. Metals and micronutrients-food safety issues[J].
Field Crops Research, 1999, 60(1): 143-163.
|
| [5] |
刘侯俊, 梁吉哲, 韩晓日, 等. 东北地区不同水稻品种对Cd的累积特性研究[J].
农业环境科学学报, 2011(2): 220-227.
LIU H J, LIANG J Z, HAN X R, et al. Accumulation and distribution of cadmium in different rice cultivars of Northeastern China[J]. Journal of Agro-Environment Science, 2011(2): 220-227. |
| [6] |
程旺大, 姚海根, 张国平, 等. 镉胁迫对水稻生长和营养代谢的影响[J].
中国农业科学, 2005(3): 528-537.
CHENG W D, YAO H G, ZHANG G P, et al. Effect of cadmium on growth and nutrition metabolism in rice[J]. Scientia Agricultura Sinica, 2005(3): 528-537. |
| [7] |
WONG S C, LI X D, ZHANG G, et al. Heavy metals in agricultural soils of the Pearl River Delta, South China[J].
Environmental Pollution, 2002, 119(1): 33-44.
DOI: 10.1016/S0269-7491(01)00325-6 |
| [8] |
ZHANG H B, LI Y R, XU W H, et al. Cd uptake in rice cultivars and Cd fractions in soil treated with organic acids and EDTA[J].
Huan Jing Ke Xue, 2011, 32(9): 2625-2631.
|
| [9] |
XU W, LI Y, HE J, et al. Cd uptake in rice cultivars treated with organic acids and EDTA[J].
Journal of Environmental Sciences, 2010, 22(3): 441-447.
DOI: 10.1016/S1001-0742(09)60127-3 |
| [10] |
WU J, MA F, WANG L, et al. Seedling performance of Phragmites australis (Cav.) Trin ex. Steudel in the presence of arbuscular mycorrhizal fungi[J].
Journal of Applied Microbiology, 2014, 116(6): 1593-1606.
DOI: 10.1111/jam.2014.116.issue-6 |
| [11] |
WU G, KANG H, ZHANG X, et al. A critical review on the bio-removal of hazardous heavy metals from contaminated soils: Issues, progress, eco-environmental concerns and opportunities[J].
Journal of Hazardous Materials, 2010, 174(1): 1-8.
|
| [12] |
王立, 贾文奇, 马放, 等. 菌根技术在环境修复领域中的应用及展望[J].
生态环境学报, 2010(2): 487-493.
WANG L, JIA W Q, MA F, et al. Perspective of mycorrhizal technology application for environmental remediation[J]. Ecology and Environmental Sciences, 2010(2): 487-493. |
| [13] |
SECILIA J, BAGYARAJ D J. Selection of efficient vesicular-arbuscular mycorrhizal fungi for wetland rice: A preliminary screen[J].
Mycorrhiza, 1994, 4(6): 265-268.
DOI: 10.1007/BF00206775 |
| [14] |
张雪, 王立, 马放, 等. 生物肥氮肥耦合对水稻资源利用的影响[J].
哈尔滨工业大学学报, 2012, 44(8): 39-42, 66.
ZHANG X, WANG L, MA F, et al. Effects of nitrogen and biological fertilizer coupling on rice resource utilization[J]. Journal of Harbin Institute of Technology, 2012, 44(8): 39-42, 66. DOI: 10.11918/j.issn.0367-6234.2012.08.008 |
| [15] |
ANDRADE S A L, SILVEIRA A P D, MAZZAFERA P. Arbuscular mycorrhiza alters metal uptake and the physiological response of Coffea arabica seedlings to increasing Zn and Cu concentrations in soil[J].
Science of the Total Environment, 2010, 408(22): 5381-5391.
DOI: 10.1016/j.scitotenv.2010.07.064 |
| [16] |
贺学礼, 张焕仕, 赵丽莉. 不同土壤中水分胁迫和AM真菌对油蒿抗旱性的影响[J].
植物生态学报, 2008(5): 994-1001.
HE X L, ZHANG H S, ZHAO L L. Effects of AM fungi and water stress on drought resistance of artemisia ordosica in different soils[J]. Chinese Journal of Plant Ecology, 2008(5): 994-1001. |
| [17] |
ZHANG X H, ZHU Y G, CHEN B D, et al. Arbuscular mycorrhizal fungi contribute to resistance of upland rice to combined metal contamination of soil[J].
Journal of Plant Nutrition, 2005, 28(12): 2065-2077.
DOI: 10.1080/01904160500320871 |
| [18] |
ZHANG X H, WANG Y S, LIN A J. Effects of arbuscular mycorrhizal colonization on the growth of upland rice (Oryza sativa L.) in soil experimentally contaminated with Cu and Pb[J].
J Clin Toxicol, 2012, 10(4172): 2161-0495.
|
| [19] |
WANG L, WU J, MA F, et al. Response of arbuscular mycorrhizal fungi to hydrologic gradients in the rhizosphere of Phragmites australis (Cav.) Trin ex. Steudel growing in the Sun Island Wetland[J].
Biomed Research International, 2015: 810124.
|
 2018, Vol. 50
2018, Vol. 50


