2. 四川泸州川南发电有限责任公司, 四川 泸州 646007
2. SichuanLuzhou Chuannan Power Generation Co., Ltd., Luzhou 646007, Sichuan, China
当前, SO2的污染防治一直是研究的热点, 在强制氧化湿法烟气脱硫工艺中, SO32-的氧化是一个重要的反应过程.在强制氧化过程中, 氧化风机把空气鼓入脱硫塔中, 氧化SO32-成为SO42-.然而, 由于氧化率较低, 大多数空气被浪费, 浪费了能量, 增加了投资.尽管如此, 吸收塔的结垢仍然很严重.
国内外对石灰石湿法脱硫过程中亚硫酸钙的氧化研究已有30年的历史[1-5].亚硫酸钙氧化对实验条件非常敏感, 仍未形成统一的认识.吴晓琴等[6]研究了亚硫酸钙的均相和非均相氧化, 指出均相体系和非均相体系之间既紧密联系, 又具有不同的反应特征.均相体系中仅存在气-液传质和氧化反应过程, 而非均相体系远比均相体系复杂, 同时存在溶解-氧化-结晶过程.彭朝晖等[7]进行了亚硫酸钙氧化实验探究, 考察了pH、反应温度、空塔气速、固含量和停留时间对氧化效率的影响, 指出亚硫酸钙最佳氧化条件.文献[8-13]报道了Mn2+、Fe3+、Mg2+、Cu2+、Fe2+、Co2+柠檬酸添加剂对SO32-氧化影响, 指出Mn2+、Fe3+、Cu2+、Fe2+、Co2+均会催化SO32-的氧化, 但Mg2+对氧化影响不大, 柠檬酸对氧化有抑制作用.Ulrich R K[14]对比金属离子的催化活性, 认为催化活性顺序为:Cu>Mn>Cr, Fe, Co, Ni.
钟秦[15]对亚硫酸钙非均相氧化动力学进行研究, 指出亚硫酸钙氧化速率对氧是1级反应, 对亚硫酸钙浓度是0级和0.75级反应.赵毅等[16]以MnSO4为催化剂, 研究了亚硫酸钙氧化的宏观反应动力学, 认为亚硫酸钙氧化速率对亚硫酸钙是0.75级响应, 对MnSO4是零级响应, 并指出总反应速率受氧扩散传质和亚硫酸钙溶解共同控制.Lidong Wang[17]研究了过乙酸存在条件下, CaSO3的氧化反应动力学, 指出CaSO3氧化速率对过乙酸、SO32-浓度和溶解氧分别是1级、1.5级和0级反应.杜谦[18]研究指出, 反应器内pH为5.0、浆液浓度大于50 mol/L时, 在三相反应体系中的气液反应处于氧的扩散传质控制区.但国内外文献均未见对于高TDS条件下亚硫酸钙氧化研究的报道.造纸白泥由于其本身的成分特性广泛应用于湿法烟气脱硫工艺中[19-21], 但由于白泥中杂质较多, 运行时会出现脱硫效率下降、亚硫酸根含量超标、石膏含水率过高等问题.
1 实验 1.1 白泥脱硫浆液成分白泥是造纸过程中经过一系列流程产生的工业副产品, 白泥的产生发生在碱回收阶段, 目的是回收NaOH, 涉及化学反应方程式如下:
Na2CO3+CaO+H2O→2NaOH+CaCO3↓.
白泥主要成分是CaCO3和少量残留的NaOH, 由于造纸原料是草、木或竹等植物, 植物体内富含的B、P、K、Mg、Fe、Mn、Cu、Zn、Co、Cr等常量与微量元素均能在白泥中检测出来.
取白泥脱硫浆液上清液经稀盐酸、硝酸、高氯酸酸化后用ICP-MS(Agilent 7500cx)对其成分进行测定, 结果如表 1所示.SO42-、Cl-以离子色谱仪(安徽皖仪, IC6200)测定, 取白泥脱硫浆液原液稀释100倍, 测定条件和参数如下:泵, 流速0.8 mL/min、压力10.267 MPa; 柱温箱, 温度为45 ℃; 电导池, 电流40.00 mA、量程为3档、温度45 ℃.待仪器基线稳定后进行测定.白泥脱硫浆液成分如表 1所示.可以看出, 白泥脱硫浆液上清液中, 总可溶性固体可达62.275 g/L, 主要成分是SO42-、Na+、K+、Mg2+、Cl-等, 这5种物质占浆液中可溶性固体含量的98.8%, 其中SO42-占浆液总可溶性固体含量的71.2%, 而白泥脱硫浆液上清液中SO42-含量是Cl-含量的15倍, 这是由于白泥中的NaOH、KOH和Mg(OH)2在脱硫过程中生成可溶性硫酸盐并在脱硫系统内累积所致.B、P、K、Mg、Fe、Mn、Zn、Co、Cr等植物体内富含的元素也均被检测出来, 但含量较低基本不会对脱硫系统造成影响.此外, 白泥脱硫浆液中重金属含量较低, 因此, 白泥作为湿法烟气脱硫剂有明显的优势, 但其总可溶性固体过高, 不仅会影响CaSO3的氧化进程, 也会使系统水耗增加, 进而增加废水投资成本.此外, 白泥脱硫浆液固含量中SiO2含量很高.设计实验研究TDS对CaSO3氧化和石膏脱水性能的影响.
| 表 1 白泥脱硫浆液成分 Table 1 Components of white mud desulfurization slurry |
实验过程中所用药品如表 2所示.实验用水为RO高纯水机(保定市信嘉环境保护专用设备制造有限公司)制备的超纯水, 电阻率为17 MΩ以上.
| 表 2 药品纯度与产地 Table 2 Purity and origin of reagent |
实验装置如图 1所示, 主体反应装置为500 mL三口烧瓶, pH计为杭州陆恒生物科技有限公司仪器, 型号为DG160.恒温磁力搅拌器采用DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司), 调温范围20~80 ℃.抽滤装置(天津津腾, T-50.2L), 0.45 μm水相微孔滤膜(上海兴亚净化材料厂).
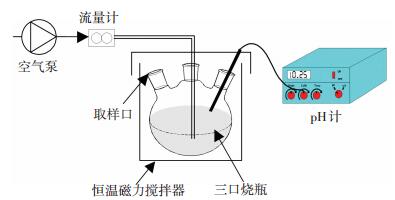
|
图 1 实验装置 Figure 1 Experimental apparatus |
配置20 g/L的亚硫酸钙悬浊液, 以空气泵通入空气, 利用空气中的O2氧化亚硫酸钙, 测定三口烧瓶中剩余亚硫酸钙的含量, 并测量产物的含水率.
亚硫酸钙在溶液pH为5时已经很容易氧化.实验设置初始pH为5, 并保证氧化过程中pH保持在5±0.1, 4 h内若pH有波动, 以NaOH(1 mol/L)和H2SO4(1 mol/L)调节.实验中保持转速不变, 空气通入速率为0.2 m3/min.实验中测定Na、K、Mg盐等对氧化效率的影响, 改变加入可溶性盐的量为80、110、140 g/L, 每30 min测定一次溶液中亚硫酸钙的量, 实验时间为4 h.并测量产物的含水率.
溶液配制参照GB/T601—2002和GB/T603—2002.亚硫酸钙的测定采用碘量法.
溶液中剩余CaSO3浓度用下式计算:
| $ c = \frac{{\left( {10 \times {c_1}-{V_1} \times {c_2}} \right) \times 40}}{{{V_2}}} \times \frac{{120}}{{80}}. $ |
式中:10为所取碘溶液的体积, mL; c1为碘标准溶液浓度, mol/L; V1为滴定用的硫代硫酸钠体积, mL; c2为硫代硫酸钠标准溶液浓度, mol/L; V2为所取待测溶液的体积, mL.
亚硫酸钙氧化效率用下式计算
| $ \eta = \frac{{{\rho _0}-{\rho _t}}}{{{\rho _0}}}. $ |
式中:η为亚硫酸钙氧化效率, %; ρ0为初试亚硫酸钙质量浓度, mg/L; ρt为t时刻亚硫酸钙质量浓度, mg/L.
产物抽滤条件控制为压力0.1 MPa, 抽滤15 min.石膏含水率测定方法参照GB/T5484—2000.
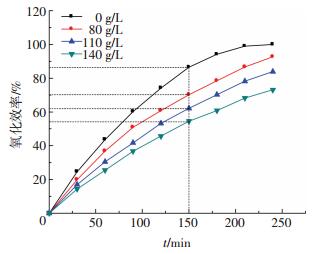
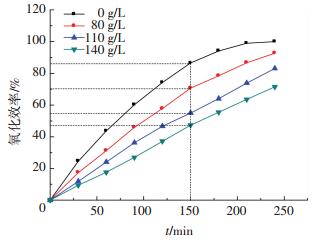
2 结果与讨论 2.1 TDS对CaSO3氧化的影响 2.1.1 钠盐对CaSO3氧化的影响加入不同质量浓度硫酸钠和氯化钠时, 溶液中亚硫酸钙氧化效率分别如图 2、3所示.
|
图 2 Na2SO4对亚硫酸钙氧化效率的影响 Figure 2 Effect of Na2SO4 on Calcium sulfite oxidation efficiency |
|
图 3 NaCl对亚硫酸钙氧化效率的影响 Figure 3 Effect of NaCl on Calcium sulfite oxidation efficiency |
由图 2可知, 在亚硫酸钙质量浓度过饱和状态下, 保持pH为5不变时, 亚硫酸钙氧化效率基本上和时间呈正比例关系, 这是由于亚硫酸根虽然在低pH以亚硫酸氢根形式存在, 但毕竟溶解度较小, 溶液中亚硫酸氢根在前期始终保持饱和状态, 因此, 在氧化过程中基本不受底物浓度的影响, 而实验中保持转速和通入空气量不变, 因此, 亚硫酸钙氧化效率基本与时间成正比.
加入不同浓度的TDS后, 亚硫酸钙氧化速率明显变慢, 氧化效率明显降低, 原因是在非均相溶液中, 氧是难溶气体, 溶解度很小, 氧气传递速率主要受液膜的控制[22].
根据Fick定律, 氧气从气相向液相传递过程中, 浓度梯度大小影响着传质速率, 即[22]
| $ {v_{\rm{d}}} =-D\frac{{{\rm{d}}c}}{{{\rm{d}}\delta }}. $ | (1) |
式中:vd为氧气的扩散速率; c为氧气浓度; δ为扩散路程长度; D为扩散系数, 与介质的特性及温度有关.
氧气的扩散速率与界面面积存在如下关系:
| $ {v_{\rm{d}}} \cdot A = \frac{{{\rm{d}}M}}{{{\rm{d}}t}}. $ | (2) |
式中:A为界面面积,
一般情况下, 由于液膜厚度很小, 液膜内的浓度可以按直线变化考虑, 则液膜两侧的溶解氧浓度梯度可表示为
| $ -\frac{{{\rm{d}}c}}{{{\rm{d}}\delta }} = \frac{{{\rho _{\rm{S}}}-\rho }}{{{\delta _{\rm{L}}}}}. $ | (3) |
式中δL为液膜厚度.
液膜中氧分子传质系数由下式表示:
| $ {K_{\rm{L}}} = \frac{D}{{{\delta _{\rm{L}}}}}. $ | (4) |
设液相主体体积为V, 联立式(1)~(4), 可得液相中氧转移速率
| $ \frac{{{\rm{d}}c}}{{{\rm{d}}t}} = {K_{\rm{L}}}\frac{A}{V}\left( {{\rho _{\rm{S}}}-\rho } \right). $ |
式中:
在湿法脱硫系统中, 氧化风量和曝气方法固定条件下, ρS和A、V等值是固定的, 因此, 氧转移速率和液膜厚度成正比关系.加入TDS后, 溶液黏度增大[23], 提高液膜厚度[22], 使氧分子从气膜转移到液膜时受到的阻力增大, 扩散系数降低.此时, 气液反应处于氧的扩散传质控制区.
对比150 min时的氧化效率, 不加入NaCl时, 氧化效率为86.5%, 加入80、110和140 g/L NaCl后, 氧化效率分别为70.6%、55.0%和47.3%, 可见氧化效率随加入TDS量的升高逐渐降低.定义氧化效率的抑制率为
| $ \beta = \frac{{{\eta _0}-{\eta _{\rm{T}}}}}{{{\eta _0}}} \times 100\%. $ |
式中:β为TDS对亚硫酸钙氧化效率的抑制率, %; η0为不加入TDS时的氧化效率, %; ηT为加入不同浓度TDS时的氧化效率, %.由上式可知, 加入80、110和140 g/L NaCl后, 对亚硫酸钙氧化效率的抑制率分别为19.4%、36.5%和45.3%, 由此可见, 加入TDS后对氧化效率有明显的抑制作用, 且随着TDS的升高, 对氧化效率的抑制作用更加明显.
同理计算可得, 加入80、110和140 g/L Na2SO4后, 氧化效率分别为70.1%、62.2%和54.5%, 对亚硫酸钙氧化效率的抑制率分别为18.9%、28.2%、37.1%.随着TDS的升高, 亚硫酸钙氧化效率的抑制率更高; 与NaCl对亚硫酸钙氧化效率的抑制率对比知, 同TDS下, NaCl的抑制作用比Na2SO4大, Cl-对亚硫酸钙氧化效率的抑制率要大于SO42-.
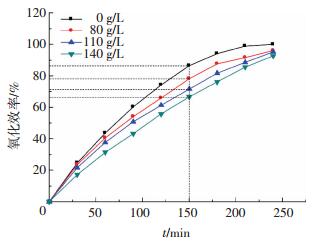
2.1.2 钾盐对氧化效率的影响加入不同浓度硫酸钾和氯化钾时, 溶液中亚硫酸钙氧化效率分别如图 4、5所示.
|
图 4 K2SO4对亚硫酸钙氧化效率的影响 Figure 4 Effect of K2SO4 on Calcium sulfite oxidation efficiency |

|
图 5 KCl对亚硫酸钙氧化效率的影响 Figure 5 Effect of KCl on Calcium sulfite oxidation efficiency |
对比150 min时的氧化效率, 加入80、110和140 g/L K2SO4后对亚硫酸钙氧化效率的抑制率分别为9.7%、17.3%和23.0%.加入80、110、140 g/L KCl后对亚硫酸钙氧化效率的抑制率分别为41.5%、57.8%和66.4%.同样可知, 随着加入TDS量的升高, 亚硫酸钙氧化效率的抑制率升高; 同TDS下KCl的抑制作用比K2SO4大, Cl-对亚硫酸钙氧化效率的抑制率要大于SO42-.
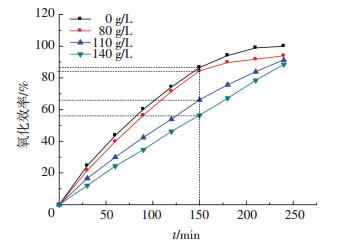
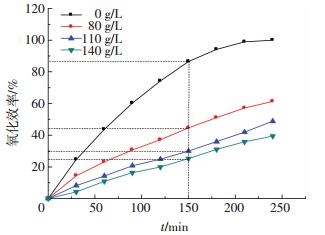
2.1.3 镁盐对氧化效率的影响加入不同质量浓度硫酸镁和氯化镁时, 溶液中亚硫酸钙氧化效率分别图 6、7所示.
|
图 6 MgSO4对亚硫酸钙氧化效率的影响 Figure 6 Effect of MgSO4 on Calcium sulfite oxidation efficiency |
|
图 7 MgCl2对亚硫酸钙氧化效率的影响 Figure 7 Effect of MgCl2 on Calcium sulfite oxidation efficiency |
对比150 min时的氧化效率, 加入80、110和140 g/L MgSO4后对亚硫酸钙氧化效率的抑制率分别为2.4%、23.6%和34.9%.加入80、110、140 g/L MgCl2后对亚硫酸钙氧化效率的抑制率为48.5%、65.3%和70.8%.同样可知, 随着加入TDS量的升高, 亚硫酸钙氧化效率的抑制率升高; 同TDS下MgCl2的抑制作用比K2SO4大, Cl-对亚硫酸钙氧化效率的抑制率要大于SO42-.
对比加入140 g/L TDS时Na、K、Mg盐的抑制率可知, 加入140 g/L TDS时, 对亚硫酸钙氧化的抑制率大小为MgCl2>KCl>NaCl, Na2SO4>MgSO4>K2SO4.
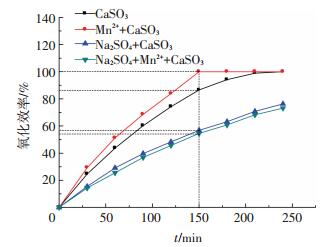
2.2 Mn2+和TDS对氧化效率的影响加入140 g/L硫酸钠和Mn2+时, 溶液中亚硫酸钙氧化效率分别如图 8所示.可以看出, 对比150 min时的氧化效率, 单纯亚硫酸钙氧化效率为86.54%, 加入0.02 mol Mn2+后, 氧化效率已达到100%, 可知Mn2+有明显的催化作用.加入140 g/L Na2SO4后无Mn2+催化剂时, 氧化效率为54.5%, 有催化剂时氧化效率为56.7%, 可知在高TDS下, Mn2+催化作用已不再明显.
|
图 8 Mn2+和TDS对亚硫酸钙氧化效率的影响 Figure 8 Effects of Mn2+and TDS on Calcium sulfite oxidation efficiency |
Linek[1]对催化反应的自由链理论进行了丰富的研究, 认为Mn2+催化剂在湿法烟气脱硫氧化过程中催化氧化反应方程式为
| $ {\rm{SO}}_3^{2-} + {\rm{M}}{{\rm{n}}^{2 + }} \to {\rm{M}}{{\rm{n}}^ + } + \cdot {\rm{SO}}_3^-, $ | (5) |
| $ \cdot {\rm{SO}}_3^-+ {{\rm{O}}_2} \to \cdot {\rm{SO}}_5^-, $ | (6) |
| $ \cdot {\rm{SO}}_5^-+ {\rm{SO}}_3^{2-} \to {\rm{SO}}_5^{2-} + \cdot {\rm{SO}}_3^ -, $ | (7) |
| $ {\rm{SO}}_5^{2-} + {\rm{SO}}_3^{2-} \to 2{\rm{SO}}_4^{2-}, $ | (8) |
| $ \cdot {\rm{SO}}_5^-+ \cdot{\rm{SO}}_5^-\to {\rm{polythinonates}}. $ | (9) |
其中, 反应(7)在均相中是快速反应, 这是由于在均相反应中, 总反应对溶解氧是零级反应[11], 不影响总反应进程, 反应(9)是催化反应终止的条件.但是在非均相溶液中TDS存在时, 由于氧分子从气膜转移到液膜时受到的阻力增大, 氧气的传质受到抑制, 反应(6)、(7)受到影响, 降低了总反应速率.
白泥脱硫过程中, 亚硫酸盐氧化过程的反应式为
| $ {\rm{HSO}}_3^-, {\rm{SO}}_3^{2-} + 1/2\;{{\rm{O}}_2}\mathop \to \limits^{{\rm{catalyst}}} {\rm{HSO}}_4^-, {\rm{SO}}_4^{2 - }. $ | (10) |
研究表明, 在一定条件下, 式(10)表示的反应速率由Mn2+的氧化速率控制[24]:
| $ 2{\rm{M}}{{\rm{n}}^{2 + }} + {{\rm{O}}_2} + 2{{\rm{H}}^ + } \to 2{\rm{M}}{{\rm{n}}^{3 + }} + {{\rm{H}}_2}{{\rm{O}}_2}. $ | (11) |
在式(11)表示的反应中, 溶解氧含量直接影响了Mn2+的催化效果, 因此, 在TDS存在条件下, Mn2+的催化作用会受到影响.
相较于石灰石-石膏湿法烟气脱硫, Mn2+大量存在于白泥脱硫浆液中, 但本实验结果表明高TDS时, Mn2+对氧化的催化作用降低, 因此, 白泥脱硫浆液仍然存在氧化不足的问题.
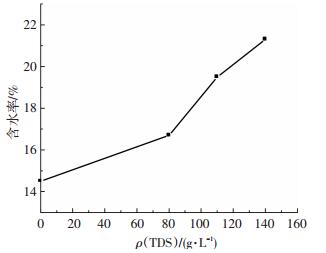
2.3 TDS对石膏含水率的影响不同浓度Na2SO4产物石膏的含水率如图 9所示, 本实验中其他TDS影响下的反应产物均呈现类似图 9的规律.由图 9可以看出, 实验4 h后, 产物抽滤后含水率随TDS升高呈现升高的趋势.反应4 h后, 由于TDS对氧气扩散传质的影响, 产物的氧化率不同, CaSO3的粒度较小, 难以脱水, 并会包裹在CaSO4·H2O表面[25], 抑制石膏的结晶和生长, 导致产物难以脱水.有研究表明, Al、Fe的存在会抑制石膏向特定方向的生长[26], 导致石膏呈现针状, 难以脱水, 但白泥中Al、Fe含量相较于石灰石较低, Na、Mg含量高, 并且Na盐是助晶剂[27], 能促进石膏的结晶, 因此, 认为白泥脱硫石膏难以脱水的原因之一是高TDS影响了CaSO3的氧化, 导致浆液中CaSO3超标, 进而影响了石膏的脱水.此外, 白泥脱硫浆液中SiO2等杂质含量过高会堵塞石膏晶体之间自由水流通的通道和滤布, 造成石膏脱水困难.
|
图 9 TDS对产物含水率的影响 Figure 9 Effect of TDS on moisture content ofexperimental products |
对实验中产物进行SEM分析, 并与600 MW机组脱硫系统正常运行时白泥脱硫石膏产物进行对比, SEM分析结果如图 10所示.由图 10(a)可以看出, 由于实验过程中亚硫酸钙浓度较低, 溶液过饱和度较低, 石膏粒径较小, 为5~10 μm, 且大部分为长柱状.由图 10(b)可以看出, 加入80 g/L Na2SO4后, 产物粒径为30~50 μm, 且晶型良好, 呈现短柱状.原因是加入Na2SO4后, 溶液过饱和度变大, 生成的晶体粒径变大, Na2SO4基本不会对晶型产生影响, 但会促进结晶, 使石膏粒径增大.由图 10(c)可以看出, 加入110 g/L Na2SO4后, 由于氧化不完全, 生成的产物为CaSO3·1/2H2O, 出现了簇状晶型[27], 生成簇状产物时, 石膏脱水困难.由图 10(d)可以看出, 白泥脱硫石膏晶型为均匀的短柱状, 晶体表明有微小颗粒, 是浆液中的可溶性盐, 粒径在50~100 μm, 结晶效果较好.TDS抑制了白泥脱硫浆液的氧化, 但是会提高溶液的过饱和度, 使石膏晶体结晶良好.

|
图 10 实验产物及白泥脱硫石膏SEM Figure 10 SEM figures of experimental products and white mud desulfurization gypsum sample |
1) 白泥中的高TDS对浆液的氧化有明显的抑制作用, 且随着TDS含量的升高, 亚硫酸钙氧化效率的抑制率越高; 同TDS条件下Cl-对CaSO3氧化的抑制作用大于SO42-.抑制的机理为高TDS时, 氧气的扩散传质受到抑制.Mn2+在高TDS条件下对CaSO3氧化的催化作用不明显.
2) 白泥脱硫浆液中Na、Mg含量较高, 而Al、Fe含量较低, 白泥脱硫石膏脱水困难的原因之一是TDS抑制了CaSO3氧化, 导致浆液中CaSO3过高, 进而降低了脱硫石膏的脱水性能, 白泥脱硫应用时应适当优化氧化风设备.
3) 由SEM可知, TDS会提高浆液的过饱和度, 使晶体变大, 结晶良好.TDS抑制亚硫酸钙氧化时, 生成簇状晶体, 使脱水性能下降.
4) 白泥成分与天然石灰石不同, 白泥脱硫浆液中Cl-含量不高时, SO42-已经在浆液中累积, 因此, 白泥脱硫应用时, 应增加废水排放量, 控制浆液中TDS的含量, 而不仅仅是控制Cl-.控制TDS可保证白泥脱硫系统的正常运行, 但废水排放量增大会导致脱硫废水处理成本增加, 同时, 白泥脱硫废水中主要成分是Na+、Mg2+、K+、SO42-, 其他金属含量很低, 可考虑对脱硫废水系统进行优化, 进而节约成本.
| [1] |
LINEK V, VACEK V. Chemical engineering use of catalyzed sulfite oxidation kinetics for the determination of mass transfer characteristic of gas-Liquid contactors[J].
Chemical Engineering Science, 1981, 36(11): 1747-1768.
DOI: 10.1016/0009-2509(81)80124-8 |
| [2] |
PASIUKBRONIKOWSKA W, BRONIKOWSKI T, ULEJCZYK M. Mechanism and kinetics of autoxidation of calcium sulfite slurries[J].
Environmental Science & Technology, 1992, 26(10): 1976-1981.
|
| [3] |
颜俭. 湿法脱硫工艺的控制氧化[J].
电力环境保护, 1997, 13(2): 41-44.
YAN Jian. Controlled oxidation of wet FGD process[J]. Electric Power Environmental Protection, 1997, 13(2): 41-44. |
| [4] |
LANCIA A, MUSMARRA D, PRISCIANDARO M, et al. Catalytic oxidation of calcium bisulfite in the wet limestone-gypsum flue gas desulfurization process[J].
Chemical Engineering Science, 1999, 54(15): 3019-3026.
|
| [5] |
ZHAO B, LI Y, TONG H, et al. Mass transfer and kinetics of sulfite forced oxidation reaction[J].
Huagong Xuebao/Journal of Chemical Industry & Engineering, 2005, 56(11): 2059-2064.
|
| [6] |
吴晓琴, 吴忠标, 汪大翚. 均相/非均相体系中亚硫酸钙非催化氧化过程[J].
环境科学学报, 2004, 24(3): 534-538.
WU Xiaoqin, WU Zhongbiao, WANG Dahui. Uncatalyzed oxidation process for calcium sulfite in homogeneous /eterogeneous systems[J]. Chinese Journal of Environmental Science, 2004, 24(3): 534-538. |
| [7] |
彭朝辉, 童志权. 亚硫酸钙氧化为石膏的研究[J].
中国计量学院学报, 2002, 13(2): 59-63.
PENG Chaohui, TONG Zhiquan. Study on the oxidation of calcium sulfite to gypsum[J]. Journal of China Jiliang University, 2002, 13(2): 59-63. |
| [8] |
刘盛余, 高瑾, 肖文德, 等. 柠檬酸强化烟气脱硫体系中亚硫酸钙的氧化过程[J].
煤炭学报, 2009, 34(11): 1531-1534.
LIU Shengyu, GAO Jin, XIAO Wende, et al. Oxidation of calcium sulfite in the citric acid enhanced limestone flue gas desulfurization system[J]. Journal of China Coal Society, 2009, 34(11): 1531-1534. DOI: 10.3321/j.issn:0253-9993.2009.11.019 |
| [9] |
尹传烈, 杨有余, 吕应兰, 等. 电石渣中杂质对亚硫酸钙氧化及石膏浆液脱水性能影响[J].
环境工程, 2013, 31(2): 109-114.
YIN Chuanlie, YANG Youyu, LV Yinglan, et al. Effects of impurities of carbide slag on the oxidation of calcium sulfite and dewatering performance of gypsum slurry[J]. Environmental Engineering, 2013, 31(2): 109-114. DOI: 10.11835/j.issn.1005-2909.2013.02.028 |
| [10] |
杜谦, 吴少华, 朱群益, 等. 湿法烟气脱硫锰催化对亚硫酸钙氧化的影响[J].
哈尔滨工业大学学报, 2004, 36(3): 391-394.
DU Qian, WU Shaohua, ZHU Qunyi, et al. Mn-catalyzed oxidation kinetics of calcium sulfite in wet FGD process[J]. Journal of Harbin Institute of Technology, 2004, 36(3): 391-394. |
| [11] |
KARATZA D, PRISCIANDARO M, LANCIA A, et al. Reaction rate of sulfite oxidation catalyzed by cuprous ions[J].
Chemical Engineering Journal, 2008, 145(2): 285-289.
DOI: 10.1016/j.cej.2008.07.031 |
| [12] |
BO Z, YAN L, TONG H, et al. Study on the reaction rate of sulfite oxidation with cobalt ion catalyst[J].
Chemical Engineering Science, 2005, 60(3): 863-868.
DOI: 10.1016/j.ces.2004.09.064 |
| [13] |
MO Jiansong, WU Zhongbiao, CHENG Changjie, et al. Oxidation inhibition of sulfite in dual alkali flue gas desulfurization system[J].
Journal of Environmental Sciences, 2007, 19(2): 226-231.
DOI: 10.1016/S1001-0742(07)60037-0 |
| [14] |
ULRICH R K, ROCHELLE G T, PRADA R E. Enhanced oxygen absorption into bisulphite solutions containing transition metal ion catalysts[J].
Chemical Engineering Science, 1986, 41(8): 2183-2191.
DOI: 10.1016/0009-2509(86)87134-2 |
| [15] |
钟秦. 亚硫酸钙非均相氧化动力学的研究[J].
南京理工大学学报, 2000, 24(2): 172-176.
ZHONG Qin. Heterogeneous oxidation kinetics of calcium sulphite[J]. Journal of Nanjing University of Science and Technology, 2000, 24(2): 172-176. |
| [16] |
赵毅, 汪黎东, 王小明, 等. 烟气脱硫中间产物亚硫酸钙的宏观反应动力学[J].
华北电力大学学报, 2006, 33(6): 93-96.
ZHAO Yi, WANG Lidong, WANG Xiaoming, et al. Macroscopical oxidation kinetics of wet flue gas desulfurization by-product calcium sulfite catalyzed by manganese sulfate[J]. Journal of North China Electric Power University, 2006, 33(6): 93-96. |
| [17] |
WANG L, ZHAO Y. Kinetics of sulfite oxidation in wet desulfurization with catalyst of organic acid[J].
Chemical Engineering Journal, 2008, 136(2/3): 221-226.
|
| [18] |
杜谦, 吴少华, 朱群益, 等. 湿法烟气脱硫环境下亚硫酸钙的非催化氧化[J].
化工学报, 2003, 54(10): 1490-1493.
DU Qian, WU Shaohua, ZHU Qunyi, et al. Non-catalytic oxidation kinetics of calcium sulfite in wet limestone-gypsum FGD process[J]. Journal of Chemical Industry, 2003, 54(10): 1490-1493. DOI: 10.3321/j.issn:0438-1157.2003.10.028 |
| [19] |
文晓春, 陈凡, 闫天元, 等. 白泥脱硫浆液氧化性能对石膏品质的影响[J].
热力发电, 2016, 45(7): 32-36.
WEN Xiaochun, CHEN Fan, YAN Tianyuan, et al. Effect of oxidation performance of white mud slurry on FGD gypsum quality[J]. Thermal Power Generation, 2016, 45(7): 32-36. |
| [20] |
宋晓旭, 王桂春, 胡山鹰. 以白泥作脱硫剂的脱硫石膏资源化利用[J].
现代盐化工, 2015(1): 10-16.
SONG Xiaoxu, WANG Guichun, HU Shanying. Resource utilization of desulphurized gypsum Using Lime as desulfurizer[J]. Modern Salt and Chemical Industry, 2015(1): 10-16. |
| [21] |
于峥, 程波, 林志宁. 脱硫增效剂与白泥在湿式FGD系统中的应用分析[J].
电力科技与环保, 2014, 30(4): 39-40.
YU Zheng, CHENG Bo, LIN Zhining. Applications of desulfurization synergistic agent and white mud in wet FGD system[J]. Electric Power Technology & Environmental Protection, 2014, 30(4): 39-40. |
| [22] |
顾国维.
水污染控制工程.下册[M]. 3版. 北京: 高等教育出版社, 2012.
GU Guowei. Water pollution control engineering.Volume Ⅱ[M]. 3rd. Beijing: Higher Education Press, 2012. |
| [23] |
LALIBERTÉ M. A model for calculating the heat capacity of aqueous solutions, with updated density and viscosity data[J].
Journal of Chemical & Engineering Data, 2009, 54(6): 1725-1760.
|
| [24] |
PASIUK-BRONIKOWSKA W, BRONIKOWSKI T. Kinetic model of sulphite autoxidation under heterogeneous conditions[J].
Chemical Engineering Science, 1989, 44(44): 1361-1368.
|
| [25] |
梁磊. 火电厂脱硫系统石膏脱水困难案例分析及对策[J].
中国电力, 2013, 46(1): 99-102.
LIANG Lei. Case analysis and solutions of gypsum dewatering for FGD systems of power plants[J]. China Electric Power, 2013, 46(1): 99-102. |
| [26] |
李军, 王国平, 钟本和. Fe3+、Al3+、Mg2+对石膏结晶习性影响的研究[J].
化学工业与工程, 1997, 14(2): 3-7.
LI Jun, WANG Guoping, ZHONG Benhe. The effects of Fe3+, Al3+, and Mg2+ on the crysta1 habits of gypsum[J]. Chemical Industry and Engineering, 1997, 14(2): 3-7. |
| [27] |
郭东明.
脱硫工程技术与设备[M]. 北京: 化学工业出版社, 2007.
GUO Dongming. Desulfurization engineering technology and equipment[M]. Beijing: Chemical Industry Press, 2007. |
 2018, Vol. 50
2018, Vol. 50


