2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨150090
2. State Key Laboratory of Urban Water Resource and Environment(Harbin Institute of Technology), Harbin 150090, China
自养脱氮工艺是近年来发展起来的新型脱氮工艺,相比传统的硝化-反硝化工艺,可以节省60%以上的曝气量和100%的有机碳源,符合污水处理节能降耗及资源化利用的要求,被认为是目前最经济高效的脱氮途径[1].自养脱氮包括亚硝化和厌氧氨氧化两个过程.在亚硝化中,氨氮被好氧氨氧化菌(ammonia-oxidizing bacteria,AOB)氧化为亚硝酸盐氮,同时亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)的活性需被有效抑制,实现亚氮积累.之后,剩余的氨氮和亚氮在厌氧氨氧化阶段被厌氧氨氧化菌(anaerobic ammonia-oxidizing bacteria,AAOB)转化为氮气排放,完成脱氮.亚硝化是自养脱氮工艺的关键步骤,决定了该工艺的脱氮效率及稳定性[2].然而,亚硝化不仅受到DO、pH、温度等运行参数的影响,还受到废水中多种物质成分的影响,例如抗生素、金属离子、盐度、基质质量浓度[3-5]等,限制了自养脱氮工艺的发展及应用.
随着纳米科学的发展,纳米材料的应用范围越来越广泛,从而增加了纳米颗粒进入污水厂的可能性[6-7].纳米颗粒由于具有极小的粒径,易于接触微生物细胞,影响微生物酶的分泌,从而影响其活性.已有研究证明了多种纳米颗粒对污水处理效果及功能微生物的不利作用[8-10].然而,这些研究均集中在传统污水处理工艺,目前尚无关于纳米颗粒对于自养脱氮亚硝化工艺的研究.此外,目前常用的纳米颗粒主要为金属颗粒或者金属氧化物颗粒,这两类材料进入水中均有可能释放出金属离子,而金属离子对自养脱氮工艺影响严重[6, 11-12].因此,本文以纳米铜为研究对象,考察其急性冲击及长期作用对亚硝化工艺生物活性、反应速率及污泥性能的影响,为亚硝化工艺遭受纳米颗粒胁迫的调控奠定基础.
1 实验 1.1 接种污泥和实验用水接种污泥取自以亚硝化工艺运行的膜生物反应器(MBR),MBR进水氨氮为200 mg/L,水力停留时间为6 h,单位VSS氨氮氧化速率为10.78 mg/(g·h),亚氮积累率为98%.反应器运行过程中有20%~30%的总氮损失.MLSS为5.16 g/L,MLVSS为3.73 g/L.接种污泥中主要功能微生物为AOB,NOB被长期抑制.
实验用水为人工配水,主要成分以mg/L计:(NH4)2SO4 942.8,NaHCO3 2 685.3,KH2PO4 68,MgSO4·7H2O 150,CaCl2 68,以及微量元素Ⅰ号溶液(以mg/L计,EDTA 5 000,FeSO4 5 000)和Ⅱ号溶液(以mg/L计,EDTA 15 000,ZnSO4·7H2O 430,CoCl2·6H2O 240,MnCl2·4H2O 990,CuSO4·5H2O 250,Na2MoO4·2H2O 220,NiCl2·6H2O 190,Na2SeO4·10H2O 210,H3BO4 14)各1 mL/L.实验中所用纳米铜购自阿拉丁试剂,粒径为10~30 nm,配制溶液质量浓度为1 g/L的贮备液,在使用前超声30 min分散,加入相应体积进入反应器.
1.2 实验设置实验包括短期实验(8 h)和长期实验(20 d).短期实验设置8个相同的SBR亚硝化反应器,有效体积为1 L,分别接种等量的种泥,采用电动搅拌,底部曝气.开始前用配水充分洗泥,以保证8个反应器中三氮质量浓度一致.8个反应器中分别添加0、1、3、5、10、20、30、50 mg/L的纳米铜,每隔1 h测定反应器内部的pH、DO及温度,同时取水样测定三氮质量浓度的变化.
长期影响实验采用一个SBR反应器,实验共运行40 d,120个周期,分为3个阶段.阶段Ⅰ(周期1~ 30),不投加纳米铜运行;周期Ⅱ(周期31~90),投加纳米铜质量浓度为1 mg/L;阶段Ⅲ(周期91~120),停止投加纳米铜,考察亚硝化恢复性能.反应器每天运行3个周期,周期设置如下:进水5 min、曝气搅拌反应240 min、沉淀30 min、排水5 min、换水比90%,其他时间静置.每个周期开始前用配好的水充分洗泥,以保证各周期开始时三氮质量浓度一致,之后加入相应的纳米铜溶液,开始反应.以每天第2个周期的数据来分析长期的影响.配水水质及运行参数见表 1.
| 表 1 配水水质及运行参数 Table 1 Influent and operational parameters |
NH4+-N:纳氏试剂分光光度法;NO2--N:N-(1-萘基)-乙二胺分光光度法;NO3--N:紫外分光光度法;DO、pH、T:WTW多电极测定仪;各种反应速率计算公式如下
| $ 氨氮氧化速率=\frac{{{\rho }_{始}}\left( \text{NH}_{4}^{+}-\text{N} \right)-{{\rho }_{末}}\left( \text{NH}_{4}^{+}-\text{N} \right)}{t\times {{\rho }_{\text{MLVSS}}}}, $ | (1) |
| $ 亚氮生成速率=\frac{{{\rho }_{末}}\left( \text{NO}_{2}^{-}-\text{N} \right)-{{\rho }_{始}}\left( \text{NO}_{2}^{-}-\text{N} \right)}{t\times {{\rho }_{\text{MLVSS}}}}, $ | (2) |
| $ 总氮去除速率=\frac{{{\rho }_{末}}\left( \text{TN} \right)-{{\rho }_{始}}\left( \text{TN} \right)}{t\times {{\rho }_{\text{MLVSS}}}}, $ | (3) |
| $ 氨氮去除率=\frac{{{\rho }_{始}}\left( \text{NH}_{4}^{+}-\text{N} \right)-{{\rho }_{末}}\left( \text{NH}_{4}^{+}-\text{N} \right)}{{{\rho }_{始}}\left( \text{NH}_{4}^{+}-\text{N} \right)}\times 100\%, $ | (4) |
| $ 总氮去除率=\frac{{{\rho }_{始}}\left( \text{TN} \right)-{{\rho }_{末}}\left( \text{TN} \right)}{{{\rho }_{始}}\left( \text{TN} \right)}\times 100\%, $ | (5) |
| $ 亚氮积累率=\frac{\rho \left( \text{NO}_{2}^{-}-\text{N} \right)}{\rho \left( \text{NO}_{2}^{-}-\text{N} \right)+\rho \left( \text{NO}_{3}^{-}-\text{N} \right)}\times 100\%. $ | (6) |
公式中采用的周期末质量浓度均为氮素质量浓度不再发生变化前1个小时的数值.污泥中的铜含量、污泥中的金属离子含量用强酸(V(硝酸):V(硫酸)=1:1)消解后采用ICP-MS测定.
1.4 胞外聚合物(extracellular polymeric substance,EPS)的提取及测定EPS的提取方法参考文献[13]所述,并进行了调整,具体如下:取8 mL泥水混合物于10 mL离心管中,配平后在8 000 r/min的条件下离心15 min,去除上清液,加磷酸盐缓冲溶液至原体积,摇散后超声3 min,然后在80 ℃的条件下恒温水浴30 min(每10 min摇散一次),在8 000 r/min的条件下离心15 min,取上清液待测.蛋白质的测定采用福林酚法,在500 nm波长下测定吸光度.多糖的测定采用蒽酮法, 在625 nm波长下测定吸光度.
2 结果与讨论 2.1 纳米铜对亚硝化的短期影响在8个相同的SBR反应器内分别考察了纳米铜为0、1、3、5、10、20、30、50 mg/L时对亚硝化的短期影响,各质量浓度下相应的氮素转化情况如图 1所示,氨氮氧化速率、亚氮生成速率和总氮去除速率如图 2所示.可以看出,在不添加纳米铜的SBR内,氨氮的去除在第6个小时完成,周期结束时出水氨氮质量浓度为0,大部分转化为亚氮,氨氮氧化速率为10.35 mg/(g·h),亚氮生成速率为6.85 mg/(g·h).值得注意的是,在周期结束后,有一定的总氮损失,总氮去除速率为3.51 mg/(g·h).虽然接种的污泥为亚硝化污泥,但是该污泥在MBR中就存在一定的脱氮能力,氮损失的可能路径包括氨的同化作用、氨挥发、异养反硝化以及厌氧氨氧化等.此外,据报道某些AOB也具备脱氮能力[14].在纳米铜为1 mg/L的反应器中,氨氮氧化速率增加到11.78 mg/(g·h),氨氮质量浓度在第5个小时即不再变化,最终出水氨氮为0.同时,亚氮生成速率也进一步增加为8.72 mg/(g·h),然而总氮去除速率则下降为3.00 mg/(g·h).这个结果说明,1 mg/L的纳米铜可以促进AOB的活性,但是对总氮去除有抑制作用,这与已有研究中认为低质量浓度的纳米颗粒抑制脱氮效果的结论是一致的[15].

|
图 1 不同纳米铜质量浓度下各周期内三氮变化 Figure 1 Nitrogen variation in one cycle with different Cu NPs concentrations |

|
图 2 不同纳米铜质量浓度下的反应速率 Figure 2 Reaction rates under different Cu NPs concentrations |
在纳米铜为3 mg/L的反应器中,氨氮氧化速率迅速降低为8.08 mg/(g·h),反应一直到第8个小时才完成.同时,总氮去除速率受到进一步的抑制,降低为2.34 mg/(g·h).在纳米铜质量浓度为5和10 mg/L的反应器中,氨氮氧化速率变化不大,一直处于被抑制的状态,AOB活性进入平台期,几种反应速率均相差不大.这个结果说明纳米铜为3~10 mg/L时对亚硝化的影响程度相同.在纳米铜为20和30 mg/L的反应器中,氨氮氧化速率急剧下降,AOB的活性受到抑制,并且随着纳米铜的增加,氨氮氧化速率下降程度加强.氨氮氧化速率分别下降为不加纳米铜时的73.7%和55.1%.同时,总氮去除速率降低到1.17 mg/(g·h),这说明在高质量浓度的纳米铜短期作用下,AOB受到抑制,同时氮的去除也受到抑制.有研究表明[16],纳米铜质量浓度较高时,将促进Cu(Ⅱ)在反应器中的释放.pH在弱碱性范围内有利于促进纳米铜的溶解,进而促进Cu(Ⅱ)的释放[17].此外,纳米铜在有氧气的环境中,可以被氧化为氧化铜,而氧化铜则可以释放出Cu(Ⅱ)[18].因此推断,高质量浓度纳米铜对亚硝化污泥的抑制可能是由于Cu(Ⅱ)的释放.Cu(Ⅱ)可以与核酸及酶活性位点作用,破坏细胞膜,进而导致生物死亡[12].
然而,在纳米铜为50 mg/L的反应器中,氨氮氧化速率增加为12.49 mg/(g·h),高于不加纳米铜和纳米铜为1 mg/L的反应器.据报道[19],纳米颗粒质量浓度较高时将促进EPS的分泌,EPS中的多糖将促进纳米颗粒的团聚.另有研究表明[21],通过物料衡算得知,纳米颗粒进入水中后大部分发生聚集.纳米铜的聚集减小了真正作用于污泥的纳米颗粒质量浓度[18],因此表现为促进.总氮去除速率降低为2.97 mg/(g·h),这和纳米铜为1 mg/L的反应器相似,说明即使低质量浓度的纳米颗粒也将抑制亚硝化反应器的脱氮性能.此外,由图 1可知,在所有反应器中,硝氮质量浓度一直比较低,在整个周期中没有明显升高.硝氮的含量取决于NOB的活性,这说明纳米铜的短期刺激对NOB影响不大.
2.2 纳米铜长期作用对亚硝化的影响在短期影响实验结束后,由于观察到1 mg/L的纳米铜有利于促进污泥的亚硝化活性,继续考察了1 mg/L长期作用对亚硝化的影响,结果见图 3.在阶段Ⅰ不加纳米铜时,反应器的出水氨氮为34.8 mg/L,氨氮去除率为82.7%,亚氮积累率在99%以上.与短期实验中相似,反应器有一定程度的总氮损失,总氮去除率为23.7%.之后进入第Ⅱ阶段,在反应器中投加纳米铜为1 mg/L.初期,反应器表现出较好的亚硝化活性,氨氮去除率逐步升高到90%左右,出水氨氮降低为20 mg/L以下.这说明低质量浓度的纳米铜对AOB的活性有促进作用,加快了氨氮氧化,与短期实验结果一致.然而,从第53个周期开始,出水氨氮开始上升,氨氮去除率逐步下降,最后降低为44.5%,出水氨氮升高为110.2 mg/L.由此可知,AOB活性受到了严重的抑制,原因是虽然低质量浓度的纳米铜有助于促进AOB的活性,但长时间接触纳米铜后,纳米铜在污泥中累积,质量浓度逐渐升高,释放出的Cu(Ⅱ)也逐渐增多,进而对AOB的活性及酶分泌等造成抑制.总氮去除率也逐渐降低,最终总氮损失消失.此外,从第44个周期开始,出水硝氮开始升高,最终升高到8.36 mg/L,这个结果说明低质量浓度纳米铜的长期刺激下,NOB开始恢复活性.纳米铜对AOB和NOB的促进作用是一致的,但AOB更加敏感.在AOB活性下降之后,从第71个周期开始,出水硝氮再次降低,NOB受到抑制,一方面污泥中NOB含量不高,另一方面NOB不如AOB对纳米铜更加敏感.因此,NOB活性的改变总是发生在AOB之后.由此可知,低质量浓度的纳米铜有利于促进AOB活性,但长期作用将对微生物产生毒害作用.
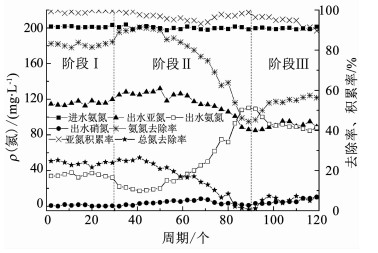
|
图 3 纳米铜对亚硝化的长期作用 Figure 3 Long-term effect of CuO NPs on partial nitrification |
在阶段Ⅲ,停止添加纳米铜,继续运行30个周期,考察亚硝化反应器的恢复性能.在本阶段开始前,对污泥进行彻底淘洗,以尽量排出泥中吸附的纳米颗粒.由图 3可知,反应器依然处于受抑制状态,氨氮的去除虽然有所提升,最终升高到55%左右,但远低于之前的水平,这说明纳米铜对亚硝化的毒害作用是长期的.在本阶段,出水硝氮逐渐升高,亚氮积累率降低到90%左右,代表着NOB的活性再次恢复,这可能是因为在上一阶段NOB活性得到诱导后,本阶段解除了抑制,NOB再次表现出活性.NOB的活性对于亚硝化的稳定运行非常不利,因此应尽力避免.纳米铜长期作用会导致纳米颗粒在污泥中的累积,较高质量浓度的纳米铜将破坏细胞膜,进入微生物细胞,改变脂肪酸的组成,增加膜渗透压或者引起氧化还原损伤[16].从实验结果可知,即使是低质量浓度的纳米铜长期作用于亚硝化工艺,也将严重抑制其反应速率、污泥活性及亚硝化稳定性.
2.3 污泥性能的变化对纳米铜作用前的污泥(第Ⅰ阶段末)、作用后的污泥(第Ⅱ阶段末)及停止添加纳米铜恢复后的污泥(第Ⅲ阶段末)中的铜元素质量分数做分析,结果如表 2所示.在纳米铜作用前,污泥中单位SS铜质量分数为1.67 mg/g,在经过纳米铜作用后,污泥中的铜质量分数增加到6.01 mg/g,增加率为263%.在停止添加纳米铜并运行30个周期之后,污泥中的铜质量分数降低到3.58 mg/g.这个结果说明污泥对纳米铜有一定的吸附能力,在停止添加之后,污泥中铜质量分数减少,降低了对各种微生物活性的抑制.对阶段Ⅱ纳米铜长期作用过程中的铜质量分数进行衡算.
| 表 2 不同阶段污泥中物质含量及性能参数 Table 2 Components and property parameters of the sludge in different phases |
阶段Ⅱ开始前,系统中的铜质量为m1=1.67 mg/g×5.16 g/L×1 L =8.62 mg.
阶段Ⅱ运行中,进入系统中的铜包括纳米铜和微量元素溶液中的铜离子.每个周期换水比90%,反应器容积1 L,该阶段共运行60个周期.则进入系统中的纳米铜质量为m2=1 mg/L×0.9 L×60=54 mg.
进入系统中的铜离子质量为m3=250 mg/L×1 mL/L×0.9 L×60=13.5 mg.
阶段Ⅱ结束时污泥中剩余的铜质量为m4=6.01 mg/g×5.32 g/L×1 L=31.97 mg.
因此,随出水排放的铜质量为m5=m2+m3-m1-m4=54+13.5-8.62-31.97=26.91 mg.
占进入系统铜质量的百分比为m5/(m2+m3)= 26.91/(54+13.5)=39.9%,则被纳米铜的去除率为61.1%.研究表明[20],纳米铜在污水处理系统的去除率为95%左右,本文中去除率较低的原因是每个周期洗泥对污泥中的纳米铜造成了洗脱,导致纳米铜随出水排放量增加.
在纳米铜作用前,污泥中单位SS提取得到的多糖为0.324 mg/g,蛋白质为0.396 mg/g,总EPS为0.72 mg/g.在阶段Ⅱ的污泥中,多糖和蛋白质分别增加为0.42和0.5 mg/g,总EPS增加到0.92 mg/g,增加率为27.8%.纳米铜可以促进EPS的分泌,EPS的分泌有利于与纳米铜结合,阻碍了纳米颗粒直接作用于微生物细胞,这是在不利条件下污泥的一种自我保护机制,分泌更多的EPS以抵御不良环境[16].阶段Ⅲ停止添加纳米铜后,蛋白质质量分数仍有轻微增加,多糖分泌减少,总EPS变化不大.这可能是由于在移除纳米铜后,污泥活性有所恢复,对多糖的利用增多,但由于污泥中仍然存在一部分纳米铜,总体依然处于被抑制状态,导致蛋白质分泌增多.此外,纳米铜长期作用后,由于EPS分泌量增加导致污泥絮体结构松散,污泥沉降性能变差[17],污泥沉降比从26.3%升高为34.7%.停止添加纳米铜后,污泥沉降性能没有完全恢复.
3 结论1) 1 mg/L的纳米铜短期作用可以增强AOB活性,大于3 mg/L之后抑制AOB,且在质量浓度为3~30 mg/L抑制规律相似.高质量浓度的纳米铜(50 mg/L)对亚硝化抑制影响作用不大.
2) 1 mg/L的纳米铜长期作用严重抑制亚硝化污泥,AOB对纳米铜的响应比NOB更敏感,抑制后的亚硝化污泥活性及稳定性在短期内均难以恢复.
3) 纳米铜长期作用于亚硝化污泥后,污泥中铜含量增加,EPS分泌量增加,污泥沉降性能变差.
| [1] |
KARTAL B, KUENEN J G, VAN LOOSDRECHT M C M. Sewage treatment with anammox[J]. Science, 2010, 328: 702-703. DOI:10.1126/science.1185941 |
| [2] |
ZHANG X J, LI D, LIANG Y H, et al. Start-up, influence factors, and the microbial characteristics of partial nitrification in membrane bioreactor[J]. Desalination and Water Treatment, 2015, 54: 581-589. DOI:10.1080/19443994.2014.891081 |
| [3] |
KONG Q. Impact of ammonium and salinity concentrations on nitrous oxide emission in partial nitrification system[J]. Ksce Journal of Civil Engineering, 2014, 19(4): 873-879. DOI:10.1007/s12205-014-0035-z |
| [4] |
ZHANG Z Z, ZHANG Q Q, XU J J, et al. Long-term effects of heavy metals and antibiotics on granule-based anammox process: Granule property and performance evolution[J]. Applied Microbiology and Biotechnolology, 2016, 100(5): 2417-2427. DOI:10.1007/s00253-015-7120-1 |
| [5] |
ZHANG X J, ZHOU Y, ZHANG N, et al. Short-term and long-term effects of Zn (Ⅱ) on the microbial activity and sludge property of partial nitrification process[J]. Bioresource Technology, 2017, 228: 315-321. DOI:10.1016/j.biortech.2016.12.099 |
| [6] |
BRAR S K, VERMA M, TYAGI R D, et al. Engineered nanoparticles in wastewater and wastewater sludge-Evidence and impacts[J]. Waste Management, 2010, 30: 504-520. DOI:10.1016/j.wasman.2009.10.012 |
| [7] |
NOWACK B, BAALOUSHA M, BORNHOFT N, et al. Progress towards the validation of modeled environmental concentrations of engineered nanomaterials by analytical measurements[J]. Environmental Science Nanotechnology, 2015, 2(5): 421-428. DOI:10.1039/c5en00100e |
| [8] |
LUO Z X, QIU Z Z, CHEN Z, et al. Impact of TiO2 and ZnO nanoparticles at predicted environmentally relevant concentrations on ammonia-oxidizing bacteria cultures under ammonia oxidation[J]. Environmental Science and Pollution Research, 2015, 22(4): 2891-2899. DOI:10.1007/s11356-014-3545-9 |
| [9] |
HOU J, YOU G X, XU Y, et al. Effects of CeO2 nanoparticles on biological nitrogen removal in a sequencing batch biofilm reactor and mechanism of toxicity[J]. Bioresource Technology, 2015, 191: 73-78. DOI:10.1016/j.biortech.2015.04.123 |
| [10] |
LUO Z X, CHEN Z, QIU Z Z, et al. Gold and silver nanoparticle effects on ammonia-oxidizing bacteria cultures under ammoxidation[J]. Chemosphere, 2015, 120: 737-742. DOI:10.1016/j.chemosphere.2014.01.075 |
| [11] |
ZHANG Q Q, ZHANG Z Z, GUO Q, et al. Variation in the performance and sludge characteristics of anaerobic ammonium oxidation inhibited by copper[J]. Separation and Purification Technology, 2015, 142: 108-115. DOI:10.1016/j.seppur.2014.11.048 |
| [12] |
OCHOA H V, LEON G, QAIS B, et al. Toxicity of copper(Ⅱ) ions to microorganisms in biological wastewater systems[J]. Science of the Total Environment, 2011(412/413): 380-385. DOI:10.1016/j.scitotenv.2011.09.072 |
| [13] |
ZHANG Z Z, XU J J, HU H Y, et al. Insight into the short-and long-term effects of inorganic phosphate on anammox granule property[J]. Bioresource Technology, 2016, 208: 161-169. DOI:10.1016/j.biortech.2016.02.097 |
| [14] |
NIRANJAN K S, SHIGERU H, TOSHIAKI K, et al. Dinitrogen production from ammonia by Nitrosomonas europaea[J]. Applied Catalysis A: General, 2002, 237: 33-39. DOI:10.1016/s0926-860x(02)00279-x |
| [15] |
WANG S, GAO M C, SHE Z L, et al. Long-term effects of ZnO nanoparticles on nitrogen and phosphorus removal, microbial activity and microbial community of a sequencing batch reactor[J]. Bioresource Technology, 2016, 216: 428-436. DOI:10.1016/j.biortech.2016.05.099 |
| [16] |
ZHANG Z Z, XU J J, SHI Z J, et al. Short-term impacts of Cu, CuO, ZnO and Ag nanoparticles (NPs) on anammox sludge: CuNPs make a difference[J]. Bioresource Technology, 2017, 235: 281-291. DOI:10.1016/j.biortech.2017.03.135 |
| [17] |
WANG L F, HABIBUL N, HE D Q, et al. Copper release from copper nanoparticles in the presence of natural organic matter[J]. Water Research, 2015, 68: 12-23. DOI:10.1016/j.watres.2014.09.031 |
| [18] |
MIAO L Z, WANG C, HOU J, et al. Aggregation and removal of copper oxide (CuO) nanoparticles in wastewater environment and their effects on the microbial activities of wastewater biofilms[J]. Bioresource Technology, 2016, 216: 537-544. DOI:10.1016/j.biortech.2016.05.082 |
| [19] |
CHAI L Y, YAN X, LI Q Z, et al. Enhancement of ZnO particles aggregation and sedimentation using polysaccharide and amino acid: Importance in abiological granular sludge (ABGS) formation[J]. Separation and Purification Technology, 2015, 151: 66-73. DOI:10.1016/j.seppur.2015.07.028 |
| [20] |
GANESH R, SMERALDI J, HOSSEINI T, et al. Evaluation of nanocopper removal and toxicity in municipal wastewaters[J]. Environmental Science & Technology, 2010, 7808-7813. DOI:10.1021/es101355k |
 2018, Vol. 50
2018, Vol. 50


