2. 城市水资源与水环境国家重点实验室 (哈尔滨工业大学),哈尔滨 150090;
3. 淮南首创水务有限责任公司,安徽 淮南 232003
2. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China;
3. Huainan Capital Water Co., Ltd., Huainan 232003, Anhui, China
气浮较沉淀工艺具有混凝剂投加量低、絮凝时间短、水力负荷高等优点,在饮用水处理领域受到广泛关注[1].马军等[2]采用气浮工艺对沿淮某给水厂完成了升级改造.气浮系统运行良好,但对NOM等污染物的去除仍存在提升空间.在常规地表水pH范围内,NOM由于组分内酸性官能团的电离而带负电.同时,气液界面与液相主体氢键网络的构造性差异,造成OH-在微气泡表面选择性积聚,微气泡同样显负电性[3].因此,要有效去除NOM,必须先削弱其与微气泡之间的静电斥力.在常规气浮工艺中,利用混凝预处理来降低NOM与悬浮颗粒物的负电荷密度,以促进絮体尺寸的生长及后续与微气泡的碰撞、黏附[1].另一方面,最新的研究表明可以对微气泡表面进行正电荷改性[4-5].
Han等[4]利用气浮-Al电解系统中原位生成的Al3+对微气泡实现了正电荷改性.Henderson等[5-6]通过在溶气系统中投加阳离子聚合物制得表面带正电荷的微气泡,且改性后的微气泡对藻细胞有很好的分离效果.但是,目前将微气泡改性技术应用于实际水体处理的研究尚少见报道.本文主要研究了壳聚糖用作微气泡表面改性剂与助凝剂时,气浮工艺对低温、低浊淮河原水中不同NOM组分及4种三卤甲烷生成势(four trihalomethanes formation potential,THM4FP)与5种卤乙酸生成势(five haloacetic acids formation potential,HAA5FP)的去除情况,并对NOM与微气泡的相互作用机理进行了分析.
1 实验 1.1 主要试剂壳聚糖(脱乙酰度87.8%,黏均摩尔质量5.11× 105 g/mol)由济南海德贝海洋生物工程有限公司提供.称取0.1 g壳聚糖粉末溶解在100 mL 0.025 mol/L HCl中,搅拌24 h得到0.1%(质量分数)的壳聚糖使用液;聚合氯化铝(PACl, Al2O3质量分数30.5%)由巩义富源净水材料有限公司生产;聚乙烯硫酸钾(PVSK)、十六烷基三甲基溴化铵(CTAB,分析标准品)、甲苯胺蓝(高级纯)购自Aladdin公司;甲基叔丁基醚与甲醇为色谱纯,氢氧化钠、盐酸、硫酸、硫酸钠为分析纯,购买自国药集团化学试剂有限公司.
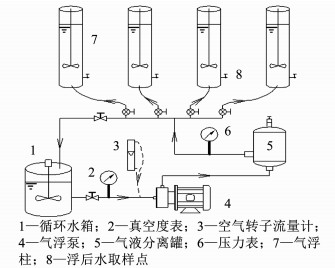
1.2 实验装置与操作流程气浮泵实验装置安放在淮南市沿淮某水厂.该装置主要由4个透明有机玻璃柱(6 L)、一台多相流泵(20FPD05,Nikuni)、一个不锈钢气液分离罐(8 L)和一个循环水箱(20 L)组成(见图 1).每个气浮柱内安装有叶片搅拌装置,并连接有定时调速器.水厂的砂滤后水作为溶气系统的循环水.微气泡具体的产生过程如图 1所示,气浮泵运转时来自循环水箱的循环水在其入口侧形成射流,并产生负压抽吸效应,空气经转子流量计在气浮泵入口自然吸入.气浮泵前端安装有多级叶轮,每级叶轮的额定转速可达2 900 r/min,高速旋转的叶轮可以瞬间将吸入的空气剪碎为微气泡.同时,高度弥散的微气泡在泵内高压的作用下快速溶解在循环水中,形成空气饱和循环水.然后一部分空气饱和循环水经过安装在气浮柱底部释放器的减压作用,将之前溶解的空气以微气泡的形式投加到待处理水样中,这部分进入到气浮柱内的循环水与待处理水样的体积比控制在1:10,而剩余的空气饱和循环水则回到循环水箱中.此外,气浮泵后设有气液分离罐,在促进空气溶解的同时,将未完全溶解的空气从系统中排出,以避免可能出现的大尺寸气泡对气浮效果的影响.
|
图 1 气浮泵系统流程 Figure 1 Schematic diagram of DAF pump system |
根据壳聚糖的功能不同,实验分别按照两种程序开展:1)壳聚糖用作微气泡正电荷改性药剂;首先将4 L淮河原水转移到气浮柱内,将一定体积的水厂滤后水注入循环水箱中,并使用0.2 mol/L的HCl溶液将滤后水pH调节到所需的数值((7±0.1)或(5.5±0.1)).在气浮柱中投加混凝剂(PACl),然后立即开启混凝搅拌装置,500 r/min转速快速搅拌1 min,100 r/min转速搅拌5 min.在上述混凝工序进行的过程中,将壳聚糖使用液加入到循环水箱中,并搅拌均匀.开启气浮泵,溶气系统在0.5 MPa的压力下溶气2 min.同时,混凝工序结束,微气泡通过释放器引入气浮柱内.最后混凝后的原水经过15 min的气浮分离,在采样点取浮后水样进行监测分析.2)壳聚糖用作助凝剂;壳聚糖的投加点转移到气浮柱中,并且先于PACl投加.在原水中投加壳聚糖后,500 r/min转速搅拌1 min之后再投加PACl,其他程序保持不变.
1.3 淮河原水水质实验原水取自淮河,实验开展期间,自2015年11月—2016年1月,淮河处于冬季枯水期,淮河原水表现出低温、低浊的特征.具体水质参数如表 1所示.
| 表 1 淮河原水水质(2015.11—2016.1) Table 1 Basic water quality parameters of Huaihe River water (Nov. 2015-Jan. 2016) |
UV254选用哈希DR5000型分光光度计测定;DOC采用岛津TOC-V CPH型TOC检测仪;浑浊度采用哈希2100P浑浊度分析仪测定;溶液pH选用雷磁PHS-3C酸度计检测;浮后水中剩余颗粒物的Zeta电位利用上海中晨JS94H型微电泳仪测定;壳聚糖分子电荷密度采用胶体滴定法测定,以甲苯胺蓝为指示剂,滴定前PVSK用CTAB进行标定.
水样首先经过0.45 μm玻璃纤维滤膜,滤后水中的溶解性有机物(DOM)分别经过超滤膜与树脂吸附系统,按分子质量与亲、疏水性分离为不同的组分.其中膜分离试验采用上海膜速MSC300型超滤器,有效容积300 mL,内有磁力搅拌装置,驱动压力为高纯氮气,压力为0.2 MPa.超滤膜为美国Millipore公司产品,截留分子质量分别为1 ku、3 ku、10 ku,将水中有机物划分为4个分子质量区间:<1 ku,1~3 ku,3~10 ku和>10 ku.采用西格玛SupeliteTM DAX-8与Amberlite® XAD-4树脂将水样中的DOM按照亲、疏水性的不同分离为3个组分,即亲水性物质(Hi)、过渡亲水性物质(Hs)和疏水性物质(Ho).详细的操作流程可参照文献[7].
THMFP与HAAFP试验方法按照美国APHA Standard Method 5710(1998)进行.4种三卤甲烷(THM4),三氯甲烷(TCM)、一溴二氯甲烷(BDCM)、二溴一氯甲烷(DBCM)、三溴甲烷(TBM),根据USEPA Method 551.1的方法测定.气相色谱为Agilent 7890A(ECD检测器,HP-5 30 m× 0.32 mm硅胶柱).5种卤乙酸(HAA5),一氯乙酸(MCAA)二氯乙酸(DCAA)、三氯乙酸(TCAA)、一溴乙酸(MBAA)、二溴乙酸(DBAA),根据USEPA Method 552.3的方法测定,样品进入GC-ECD检测器之前,需先经过甲基叔丁基醚萃取及酸性甲醇衍生化.具体实验步骤与色谱条件可参照文献[8].所有水质指标重复检查3次,平均误差控制在±5%内.
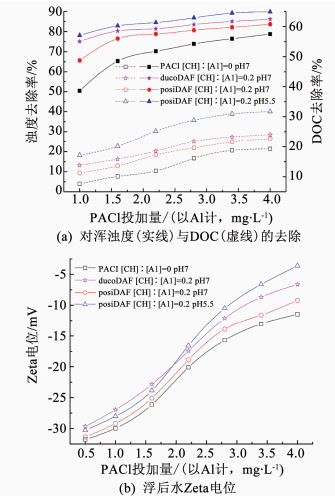
2 结果与讨论 2.1 对浑浊度与有机物的去除淮河原水处于低温低浊时期,具体水质参数:DOC为4.35 mg/L,UV254为0.86 cm-1,浑浊度为7.45 NTU,pH为7.52,水温为6.8 ℃,气浮对原水中污染物的去除情况如图 2所示.与单独采用PACl混凝相比,壳聚糖用作助凝剂或微气泡表面改性剂,均明显提升了气浮对原水中DOC与浑浊度的去除效果(见图 2(a)).由于在壳聚糖双混凝剂气浮体系中(dual coagulant DAF, ducoDAF),当溶气系统循环水pH为7.0或5.5时,壳聚糖的助凝效果接近,因此,图中只给出了ducoDAF在pH为7.0时对污染物的去除情况.与之相对,降低循环水的pH可以明显促进壳聚糖改性气浮(positive modification DAF, posiDAF)对污染物的去除.以DOC为例,壳聚糖与PACl投加比例为0.2([CH]:[Al]=0.2),且循环水pH为5.5时,posiDAF对DOC的平均去除率为25.6%,分别比ducoDAF和posiDAF在循环水pH为7.0时的去除率高出6.1%与8.0%.
|
图 2 不同药剂投加方式时DAF运行影响 Figure 2 Performance of DAF under different dosing schemes |
在ducoDAF中,壳聚糖对致浊颗粒物的助凝效果显著,浑浊度的最优去除率高达86.2%.分析主要絮凝机理为吸附架桥[9].而对于posiDAF,在循环水pH为7.0与5.5的情况下,浑浊度的最优去除率分别为83.6%与89.8%.3种药剂投加方案对应的浮后水剩余浑浊度分别为1.03、1.22和0.76 NTU.
在单独使用PACl混凝时,随着PACl投量的增加,浮后水剩余颗粒物zeta电位逐渐升高(见图 2(b)).循环水pH为7.0时,壳聚糖微气泡改性剂的引入并未对posiDAF浮后水Zeta电位产生明显的提升.循环水pH为5.5,且壳聚糖投加量≤1.6 mg/L时,posiDAF浮后水Zeta电位略低于ducoDAF在pH为7.0的Zeta电位,之后伴随壳聚糖投加量的升高,前者逐渐超过后者.原因可以归结为:在壳聚糖投加量低时,大多数壳聚糖分子黏附在微气泡表面,壳聚糖在浮后水中的残余量及对Zeta电位的影响较小.随着壳聚糖投加量的增大,浮后水中残余壳聚糖的量有所上升,加之壳聚糖在pH为5.5时的正电荷密度要明显高于pH为7.0时,最终导致posiDAF在pH为5.5时的浮后水Zeta电位实现反超.但是posiDAF在循环水pH为5.5,且壳聚糖投加量为0.44~0.8 mg/L时,浮后水Zeta电位的增幅维持在3.51~7.85 mV内.与Rao等[10]在利用正电荷改性微气泡对藻细胞进行分离的研究中所报导的浮后水稳态Zeta电位的增幅接近.这说明降低循环水pH对壳聚糖在微气泡表面的黏附效率影响有限,大多数壳聚糖分子仍紧密地黏附在微气泡表面,仅有少许残留在浮后水中.
此外,当循环水pH为5.5时,浮后水pH由原水初始值7.52降低为7.03.酸性循环水的引入并未造成浮后水pH的明显变化.这主要归功于:一方面,淮河原水较高的酸碱缓冲强度;另一方面,实验过程中进入到气浮柱内的循环水水量较低,仅为原水水量的10%.同时,在生产性气浮工艺中,溶气系统循环水也只占待处理水量的8%~12%.因此,与消耗大量酸碱对原水pH进行调节相比,对气浮溶气系统循环水进行酸度调节更具经济可行性.
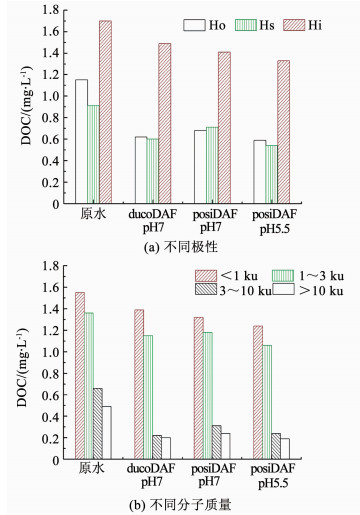
2.2 对不同有机物组分的去除淮河原水水质条件不变,壳聚糖与PACl投加量(以Al计)分别为0.8与4 mg/L时,ducoDAF与posiDAF对不同NOM组分的去除如图 3所示.原水中亲水性有机物(Hi)与低分子质量有机物(<3 ku)质量浓度分别为1.7、2.9 mg/L,均在其各自的分离体系中处于主导地位.马军等[11]在NOM微气泡分离实验中指出,较亲水性有机物,疏水性的腐殖质类物质更容易黏附在微气泡表面.晏明全等[12]在常规混凝-气浮工艺对NOM去除实验中也得到了相似的结论.这一论断似乎也适用于本研究中的气浮工艺.
|
图 3 DAF对溶解性有机物的去除 Figure 3 Removal of DOM fractions by DAF |
当壳聚糖用作助凝剂时,ducoDAF对疏水性有机物(Ho)与中、高分子质量有机物(3~10 ku和>10 ku)的去除率要高于其他有机物组分.当循环水pH为7.0时,posiDAF对各有机物组分的去除仍遵循这一规律.然而在循环水pH由7.0减小为5.5后,posiDAF对小分子质量有机物(<3 ku)的去除率增加了6.9%,对Hi及过渡亲水性有机物(Hs)的去除率也由18.8%提升到28.4%.同时,posiDAF浮后水中大分子质量有机物(>10 ku)与Ho的质量浓度均达到最小值,分别为0.2与0.6 mg/L.因此,循环水pH的降低,在保障大分子、疏水性NOM组分去除的同时,明显促进了posiDAF对小分子、亲水性NOM组分的去除.关于不同NOM组分与微气泡的相互作用机理将在2.4节进行详细讨论.
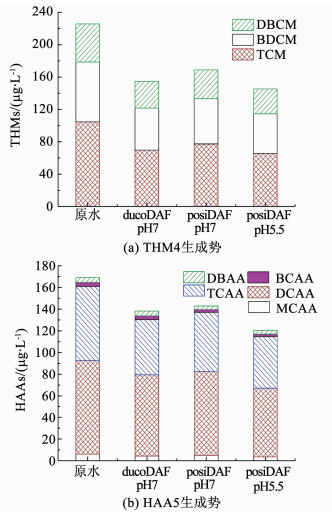
2.3 对THM4FP与HAA5FP的去除为了进一步考察posiDAF在强化有机物去除方面的实际效果,对同一原水水质条件,不同药剂投加方案下,气浮对THM4FP与HAA5FP的去除情况进行了研究,其中壳聚糖与PACl投加量(以Al计)分别为0.8与4 mg/L.如图 4(a)所示,原水中THM4前体物的质量浓度约为225.6 μg/L.当壳聚糖用作助凝剂时,ducoDAF对其去除率为31.4%.而在壳聚糖作为微气泡表面改性剂,循环水pH为7.0与5.5时,posiDAF对THM4前体物的去除率分别为25.2%与35.6%.其中TCM前体物在原水THM4FP中占主导地位,约为104.7 μg/L.在3种药剂投加方案中,posiDAF在循环水pH为5.5时,对TCM前体物的去除率达到最高37.5%.
|
图 4 DAF对THM4与HAA5生成势的去除 Figure 4 Removal of THM4 and HAA5 formation potentials by DAF |
当壳聚糖用作助凝剂时,ducoDAF对HAA5前驱物的去除表现出明显的选择性.例如,作为HAA5FP最主要的两种成份,DCAA与TCAA前体物的质量浓度分别为86.8、67.9 μg/L.ducoDAF对TCAA的去除率约为25.6%,而对DCAA的去除率却仅为13.5%(见图 4(b)).造成这一结果的主要原因是TCAA与DCAA前体物的不同以及ducoDAF对它们的差异性去除.Croue等[13]对比研究了亲、疏水性NOM组分的消毒副产物生成势,指出DCAA的前体物主要由亲水性有机物组成,而TCAA前体物则主要为疏水性腐殖质类物质.Hua与Reckhow[7]在之后的研究中也得到类似结论,发现DCAA与TCAA由不同的前驱物经过不同的反应途径生成,其中疏水性、大分子NOM在氯化反应过程中较易生成TCAA,而亲水性、小分子有机物(<0.5 ku)对DCAA的贡献最大.此外,通过之前2.2节的分析可知ducoDAF对疏水性NOM存在优先去除,这也最终表现为ducoDAF对TCAA生成势的优先控制.然而在posiDAF体系中,将循环水pH由7.0减小为5.5,可以显著增加其对DCAA前体物的去除率,增幅达16.3%.DCAA与TCAA的去除率均达到最高的26.7%与30.2%.同时,由于DCAA与TCAA为HAA5的主要组分,HAA5FP的去除率也得到明显提升,由pH为7.0时的15.6%上升为pH为5.5时的28.8%.此部分实验结果也进一步证实降低溶气系统循环水pH,可以在保证TCAA前体物去除的基础上,促进posiDAF对DCAA前体物中小分子、亲水性有机物的强化去除.
2.4 NOM去除机理分析壳聚糖改性气浮在NOM去除过程中所表现出的对溶气系统循环水pH的依赖性,与pH对壳聚糖分子正电荷密度的影响密切相关.壳聚糖分子中氨基的pKa约为6.3.壳聚糖分子主链上氨基的质子化水平决定着壳聚糖的正电荷密度,也同样左右着壳聚糖改性微气泡的表面特性.如图 5所示,pH越低壳聚糖正电荷密度越高,当pH大于5.5时,随pH增加,壳聚糖分子的正电荷密度迅速减小,当pH为8.2时,其电荷密度接近为零.因此,壳聚糖投加在pH为7.0的循环水中,仅有一小部分氨基处于质子化状态,当循环水pH为5.5时,壳聚糖分子大部分氨基处于质子化状态(-NH3+).
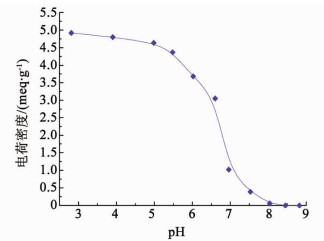
|
图 5 壳聚糖分子正电荷密度随pH的变化 Figure 5 Variation of cationic charge density of chitosan molecule with pH values |
微气泡改性气浮对NOM组分的差异性去除,表明各NOM组分在与微气泡相互作用时遵循不同的机理.在疏水力的作用下,中、高分子质量水平的疏水性有机物易于与微气泡结合[14].在这一过程中微气泡表面的电荷性质并非决定性因素.尽管学术界对疏水力的具体特征了解并不透彻,但是无论通过理论分析,还是利用原子力显微镜直接进行测量,均证实了疏水力的存在[15].而与疏水性有机物相比,亲水性有机物组分的气浮分离机理变得些许复杂.对于亲水酸性有机物,静电引力可能在其与微气泡相互作用的过程中起主导作用.在posiDAF中,当循环水pH由7.0调低为5.5时,附着在微气泡表面的壳聚糖分子正电荷密度明显升高,会促进带负电荷的亲水性有机物向微气泡表面的黏附.此外,有研究指出吸附在蒙脱石颗粒表面的小分子有机物会通过氢键作用与NH4+离子结合,并促进后者向蒙脱石表面的积聚[16].而壳聚糖分子中包含大量质子化的-NH3+.同时,丰富的氢键供体与受体存在于微气泡表面的滑动层中[17].基于此,可以推断氢键结合在壳聚糖改性微气泡对亲水性、小分子有机物的强化去除过程中也发挥了促进作用.广阔的分子间氢键网络在亲水性有机物、壳聚糖分子及微气泡表面之间架设起牢固的纽带,使三者紧密地结合在一起.
3 结论1) 通过在气浮溶气系统中投加壳聚糖对微气泡表面实现了正电荷改性.循环水pH对壳聚糖改性气浮除污效果有直接影响.当循环水pH为5.5时(<壳聚糖pKa),壳聚糖改性气浮对低温、低浊淮河原水中污染物的去除要优于壳聚糖双混凝剂气浮.
2) 壳聚糖用作助凝剂时,气浮对Hi的去除有限.然而,当壳聚糖用作微气泡改性剂时,在溶气系统循环水pH由7.0减小为5.5后,气浮对小分子质量NOM(<3 ku)去除率增加了6.9%,同时Hi与Hs的去除率由18.8%升高为28.4%.此外,THMFP与HAAFP的气浮分离效率也分别增加了约10.4%和13.2%.
3) NOM在与微气泡相互结合的过程中,大分子、疏水性有机物主要由疏水力主导,而小分子、亲水性有机物则受静电引力与氢键的共同作用.壳聚糖微气泡改性技术为气浮工艺在饮用水处理过程中强化NOM的去除提供了新选择.
| [1] |
EDZWALD J K. Dissolved air flotation and me[J]. Water Research, 2010, 44(7): 2077-2106. DOI:10.1016/j.watres.2009.12.040 |
| [2] |
鲁金凤, 杜智, 马军, 等. 高级氧化组合工艺协同净化微污染水的示范生产实验[J]. 哈尔滨工业大学学报, 2017, 49(2): 20-25. LU Jingfeng, DU Zhi, MA Jun, et al. Demonstrative and productive experimental research on synergistic purification of the micro-polluted water by advanced oxidation combined process[J]. Journal of Harbin Institute of Technology, 2017, 49(2): 20-25. DOI:10.11918/j.issn.0367.2017.02.004 |
| [3] |
TAKAHASHI M. zeta potential of microbubbles in aqueous solutions: electrical properties of the gas-water interface[J]. The Journal of Physical Chemistry B, 2005, 109(46): 21858-21864. DOI:10.1021/jp0445270 |
| [4] |
HAN M Y, KIM M K, SHIN M S. Generation of a positively charged bubble and its possible mechanism of formation[J]. Journal of Water Supply: Research and Technology AQUA, 2006, 55(7/8): 471-478. DOI:10.2166/aqua.2006.055 |
| [5] |
HENDERSON R K, PARSONS S A, JEFFERSON B, et al. The potential for using bubble modification chemicals in dissolved air flotation for algae removal[J]. Separation Science and Technology, 2009, 44(9): 1923-1940. DOI:10.1080/01496390902955628 |
| [6] |
YAP R K L, WHITTAKER M R, HENDERSON R K, et al. Hydrophobically-associating cationic polymers as micro-bubble surface modifiers in dissolved air flotation for cyanobacteria cell separation[J]. Water Research, 2014, 61: 253-262. DOI:10.1016/j.watres.2014.05.032 |
| [7] |
HUA G, RECKHOW D A. Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size[J]. Environmental Science & Technology, 2007, 41(9): 3309-3315. DOI:10.1021/es062178c |
| [8] |
SHI Y L, YANG J, MA J, et al. Feasibility of bubble surface modification for natural organic matter removal form river water using dissolved air flotation[J]. Frontier of Environmental Science & Engineering, 2017, 11: 10. DOI:10.1007/s11783-017-0954-2 |
| [9] |
刘秉涛, 姜安玺, 李瑞涛. 给水絮凝处理中壳聚糖的助凝作用和机理[J]. 哈尔滨工业大学学报, 2008, 40(12): 1945-1948. LIU Bingtao, JIANG Anxi, LI Ruitao. Effect and mechanism of chitosan coagulation aid in flocculation treatment of water supply[J]. Journal of Harbin Institute of Technology, 2008, 40(12): 1945-1948. |
| [10] |
RAO N R H, YAP R, HENDERSON R K, et al. Algae flotation using posiDAF: A comparison of polymers as bubble surface modifiers[C]//Proceeding of the 7th International Conference of Flotation in Water and Wastewater Systems. Toulouse, France, 2016: 168-175.
|
| [11] |
MA J, JIANG J, PANG S. Adsorptive fractionation of humic acid at air-water interfaces[J]. Environmental Science & Technology, 2007, 41(14): 4959-4964. DOI:10.1021/es070238o |
| [12] |
YAN M, WANG D, YOU S, et al. Enhanced coagulation in a typical North-China water treatment plant[J]. Water Research, 2006, 40(19): 3621-3627. DOI:10.1016/j.watres.2006.05.044 |
| [13] |
CROUE J P, VIOLLEAU D, LABOUYRIE L. Disinfection by-product formation potentials of hydrophobic and hydrophilic natural organic matter fractions: a comparison between a low-and a high-humic water[J]. ACS Symposium Series, 2000, 761: 139-153. |
| [14] |
LENHART J J, SAIERS J E. Adsorption of natural organic matter to air-water interfaces during transport through unsaturated porous media[J]. Environmental Science & Technology, 2004, 38(1): 120-126. DOI:10.1021/es034409a |
| [15] |
ISHIDA N. Direct measurement of hydrophobic particle-bubble interactions in aqueous solutions by atomic force microscopy: Effect of particle hydrophobicity[J]. Colloids and Surface A: Physicochemical and Engineering Aspects, 2007, 300(3): 293-299. DOI:10.1016/j.colsurfa.2007.02.003 |
| [16] |
ZHANG W, CHEN X, ZHOU J, et al. Influence ofhumic acid on interaction of ammonium and potassium ions on clay minerals[J]. Soil Science Society of China, 2013, 23(4): 493-502. DOI:10.1016/S1002-0160(13)60042-9 |
| [17] |
BEATTIE J K, DJERDJEV A M, WARR G G. The surface of neat water is basic[J]. Faraday Discussions, 2009, 141: 31-39. DOI:10.1039/B805266B |
 2018, Vol. 50
2018, Vol. 50


