乙二胺四乙酸(EDTA)是一种非常重要的络合剂,被广泛应用于印刷电路板工厂的化学镀铜工艺中[1].电镀废水中常含有高质量浓度的铜离子,与EDTA形成一种六配位的八面体结构[2].EDTA络合铜在pH为0~14均能保持相对稳定,给铜离子的去除带来了极大的难度.同时,EDTA还是一种难降解化合物,虽然没有生物毒性,但是能结合水体中的重金属,具有潜在的水环境风险.近年来,废水中的EDTA络合态金属处理引起了广泛关注.常用的处理技术主要有硫化物沉淀法[3]、吸附法[4]、离子交换法[5]、电化学氧化[6]、电混凝[7-8]、光催化降解[9-10]等,但它们对EDTA络合废水的处理存在处理效果差、处理成本高等问题,难以在工业市场普及,因此,需要开发一种低廉有效的络合废水处理技术.
鞠峰等[11]采用铁炭微电解法处理EDTA络合铜溶液,取得了较好的处理效果,Cu2+-EDTA的去除机理可能包括置换-沉淀作用和电混凝作用.鞠峰等的另一项研究[12]采用铁炭微电解生成富含Fe2+的出水用于吸附和共沉淀Cu2+-EDTA,取得了很高的铜离子去除率,但是没有清晰地阐明铜离子的去除过程以及EDTA的变化情况.虽然大量文献[13-15]开展了微电解破络效能的研究,但对于微电解的破络除铜机理还不够清晰,也较少涉及反应过程中EDTA的降解情况与EDTA的络合形态分布研究,本文使用Visual MINTEQ 3.1软件模拟了金属离子与EDTA在不同pH条件下的络合形态分布,并研究了两种不同金属离子对EDTA的竞争关系,为微电解处理Cu2+-EDTA的机理提供了理论依据,该方面的研究将益于指导微电解破络技术的工程应用.
1 实验 1.1 材料与试剂废铁屑取自哈尔滨工业大学金工实习车间,废铜屑购自天津安鑫钢铁加工厂,颗粒活性炭购自天津科密欧化学试剂有限公司,CuSO4·5H2O、FeSO4·7H2O、C10H14N2O8Na2·2H2O、NaOH、盐酸、硝酸、铁粉均为分析纯.
铁屑使用前先用18目和300目筛子进行筛选,然后用10% NaOH浸泡30 min以去除表面油污,再用2% HCl冲洗5 min以去除表面氧化物,风干后密封保存.颗粒活性炭也用18目和300目筛子进行筛选.
1.2 Cu2+-EDTA母液的配制将2.289 g CuSO4·5H2O和5.862 g Na2-EDTA溶解至2 L容量瓶中作为Cu2+-EDTA的母液,此时Cu2+质量浓度为1.0 g/L,静置24 h使Cu2+和EDTA充分络合,使用时稀释适当倍数.
1.3 实验方法采用150 mL锥形瓶作为微电解反应器.将一定质量的铁屑和铜屑加入装有100 mL 50.0 mg/L Cu2+-EDTA溶液的锥形瓶中,置于恒温震荡器中进行反应,震荡速率为170 r/min,在稀释Cu2+-EDTA溶液时使用1 mol/L H2SO4和1 mol/L NaOH溶液调节pH至适当条件.所有批式实验均在(25±1) ℃条件下进行并且暴露在空气中.
Fe(OH)2吸附共沉淀实验在15 mL离心管中进行.向离心管中加入10 mL 50 mg/L Cu2+-EDTA溶液,然后加入一定量FeSO4·7H2O使其溶解,再加入一定量NaOH调节pH为9左右,完全沉淀后取上清液过0.45 μm滤膜测铜离子质量浓度,另取上清液测TOC.
1.4 分析方法反应结束后,用定性滤纸过滤溶液.铜和铁采用(5300V型)原子发射光谱仪测定;亚铁采用邻菲罗啉分光光度法测定;紫外-可见吸收光谱图采用岛津UV-240紫外分光光度计测量,扫描范围190~490 nm,以去离子水为参比.溶液pH采用精密型pH计(雷磁)测定.微电解反应后产生的沉淀物采用傅里叶变换红外光谱仪(FTIR-650)分析,将反应后的沉淀物收集,60 ℃干燥12 h,采用KBr压片法记录沉淀物的红外光谱吸收图谱,扫描范围4 000~ 400 cm-1.
2 结果与讨论 2.1 铁铜微电解处理Cu2+-EDTA溶液图 1为铁铜(炭)微电解法和单独Fe0法处理Cu2+-EDTA溶液中铜离子去除率随时间的变化曲线.相比单独Fe0法,铁炭(铜)微电解法对铜离子去除率的提升相当显著,单独Fe0法对铜离子的去除是基于Fe0在酸性条件下逐渐溶解生成Fe2+,在水中溶解氧作用下,Fe2+被氧化为Fe3+,由于Fe3+-EDTA的络合常数(lgK=25.1)远大于Cu2+-EDTA的络合常数(lgK=18.8),EDTA与Cu2+发生解络反应并与Fe3+重新络合,而游离态的Cu2+被氧化成Cu0和Cu2O而沉淀下来,在存在铜屑或活性炭等阴极时,铁屑与这些阴极形成原电池,从而极大地提高了Fe0的溶解速率;相比铁炭微电解法,铁铜微电解法对铜离子去除率有进一步的提升,铁炭微电解法60 min铜离子去除率稳定在96%以上,铁铜微电解法60 min铜离子去除率稳定在98%以上,这是因为铜屑比活性炭的电子传导效率更高,从而加快了微电解反应的反应速率.

|
反应条件:ρ0=50 mg/L;铁屑(Fe0)用量为30 g/L;铁铜(炭)质量比为1:1(3:1);初始pH为3;r=170 r/min;t=25 ℃ 图 1 铁铜(炭)微电解法和单独Fe0法对Cu2+-EDTA溶液中铜离子去除率的影响 Figure 1 Effect of Fe-Cu (Fe-C) microelectrolysis and Fe0 alone on removal rate of copper ions in Cu2+-EDTA solution |
以反应时间t(min)为横坐标,ln(ρ/ρ0)为纵坐标,对不同初始pH条件下铜离子去除反应速率进行线性拟合.表 1为不同pH条件下铁铜微电解除铜动力学分析.可以看出,ln(ρ/ρ0)呈良好线性关系,相关系数R2均在0.95以上,说明在pH 2~4,铜离子去除反应符合表观一级动力学规律.
| 表 1 不同pH条件下铁铜微电解除铜动力学分析 Table 1 Kinetic analysis of Fe-Cu microelectrolysis in different pH conditions |
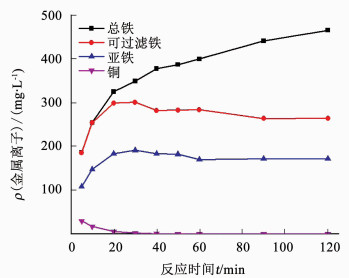
图 2为铁铜微电解反应过程中溶液里总铁、可过滤铁、亚铁和铜离子的质量浓度变化曲线;图 3为铁铜微电解反应过程中溶液pH变化曲线.在0~20 min,由于铁屑溶解和水中溶解氧的氧化作用,总铁、可过滤铁和亚铁质量浓度迅速升高,由于Fe3+对Cu2+-EDTA的解络作用和铁屑的还原作用,铜离子质量浓度快速下降;在20~120 min,总铁质量浓度继续缓慢升高,可过滤铁和亚铁质量浓度稍有下降然后稳定在一定水平.这是因为随着溶液pH升高,大量Fe3+以Fe(OH)3的形式沉淀下来,沉淀覆盖在铁屑表面也使得铁屑溶解速率下降.
|
图 2 铁铜微电解反应过程中金属离子质量浓度变化 Figure 2 Change of metal ion concentration in the process of Fe-Cu microelectrolysis |

|
图 3 铁铜微电解反应过程中pH变化 Figure 3 Change of pH value in the process of Fe-Cu microelectrolysis |
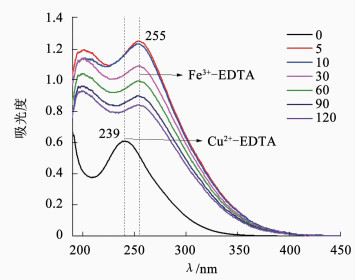
图 4为铁铜微电解反应一段时间(0、5、10、30、60、90、120 min)后溶液紫外吸收光谱图.239 nm附近是Cu2+-EDTA的特征吸收峰,255 nm附近是Fe3+-EDTA的特征吸收峰[15].在反应前溶液的紫外光谱图中只有一个吸收峰,位于239 nm处,表明反应前溶液中只存在Cu2+-EDTA这一种有机物;反应5 min后在255 nm处出现了一个吸收峰,原239 nm处的吸收峰被掩盖;随着反应时间进一步延长,255 nm处的吸收峰峰值逐渐降低,说明反应5 min时Fe3+-EDTA的质量浓度已经达到最大,随着反应时间延长,Fe3+-EDTA得到了部分降解,降解原因可能是铁屑的还原作用.
|
图 4 铁铜微电解过程中EDTA的降解情况 Figure 4 Degradation of EDTA during Fe-Cu microelectrolysis |
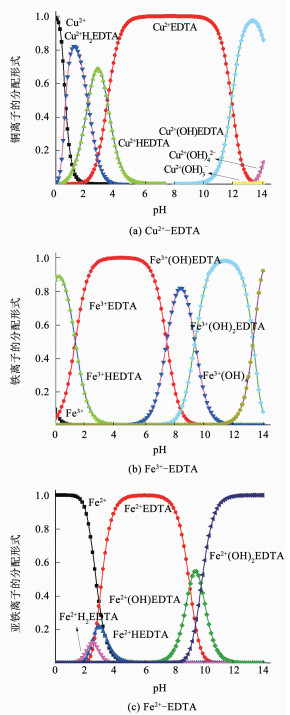
使用Visual MINTEQ 3.1软件可以模拟出等摩尔金属离子与EDTA络合溶液中金属离子和EDTA的络合形态随pH的变化情况,如图 5所示.EDTA与Cu2+、Fe3+、Fe2+这3种金属离子在pH为0~14时均保持相对稳定状态,当pH大于2时,溶液中几乎不存在游离态的Cu2+,当pH大于13时,才开始出现Cu(OH)2沉淀,在pH为6~10时,铜离子主要以Cu2+-EDTA形态存在[16-17].
|
图 5 等摩尔溶液中铜离子的分配形式 Figure 5 Distribution of copper ions in equimolar solution |
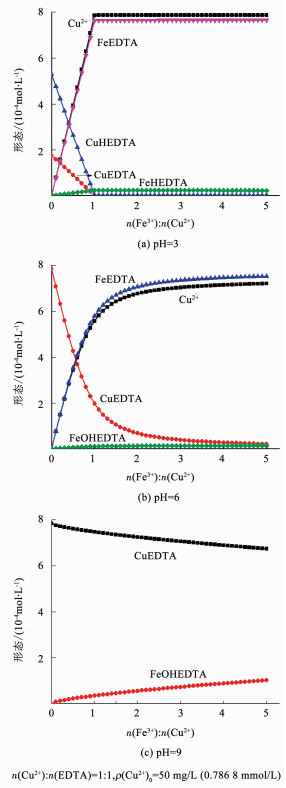
图 6为MINTEQ软件模拟pH为3、6、9时不同Fe3+与Cu2+摩尔比对EDTA与Cu2+解络程度的影响.当pH为3时,Cu2+与EDTA的络合形态主要是CuEDTA2-和CuHEDTA-,随着Fe3+浓度的增加,EDTA立即与Cu2+解络并与Fe3+重新络合,EDTA与Fe3+的络合形态主要是FeEDTA-和FeHEDTA,当Fe3+与Cu2+的摩尔比达到1:1时,铜离子基本与EDTA完全解络,以游离态存在于溶液中.
|
图 6 不同pH条件下Fe3+与Cu2+摩尔比对EDTA与Cu2+解络程度的影响 Figure 6 Effect of Fe3+/Cu2+ on the degree of dispersion of EDTA and Cu2+ under different pH |
当pH为6时,Cu2+与EDTA的络合形态主要是CuEDTA2-,随着Fe3+浓度的增加,EDTA逐渐与Cu2+解络并与Fe3+重新络合,EDTA与Fe3+的络合形态主要是FeEDTA-和FeOHEDTA2-,当Fe3+与Cu2+的摩尔比达到1:1时,铜离子与EDTA的解络度约为75%,当Fe3+与Cu2+的摩尔比达到5:1时,铜离子与EDTA的解络度达到97%以上;当pH为9时,Cu2+与EDTA的络合形态主要是CuEDTA2-,随着Fe3+浓度的增加,EDTA缓慢与Cu2+解络并与Fe3+重新络合,EDTA与Fe3+的络合形态主要是FeOHEDTA2-,当Fe3+与Cu2+的摩尔比达到1:1时,铜离子与EDTA的解络度不足5%,当Fe3+与Cu2+的摩尔比达到5:1时,铜离子与EDTA的解络度约为14%.可以看出Fe3+与Cu2+摩尔比和pH对铜离子与EDTA的解络度有着重要影响,Fe3+与Cu2+摩尔比越大,pH越低,越有利于铜离子与EDTA的解络反应.
图 7为MINTEQ软件模拟n(Fe3+):n(Cu2+):n(EDTA)为1:1:1时溶液中物质形态的分布随pH的变化关系.当pH为0~4时,铜离子基本以游离态存在于溶液中,在pH为1的附近出现部分络合,当pH大于4时,铜离子逐渐与EDTA络合,pH大于8后铜离子几乎完全以络合态存在于溶液中,当pH大于13时,Cu2+的络合态逐渐减少并产生Cu(OH)2沉淀.
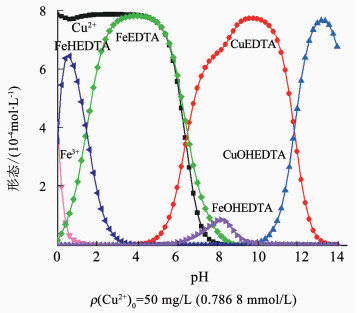
|
图 7 n(Fe3+):n(Cu2+):n(EDTA)=1:1:1时溶液中铜离子的分配形式 Figure 7 Distribution of copper ions in the solution when n(Fe3+):n(Cu2+):n(EDTA)=1:1:1 |
图 8为MINTEQ软件模拟n(Fe2+):n(Cu2+):n(EDTA)为1:1:1时溶液中物质形态的分布随pH的变化关系.Fe2+对Cu2+与EDTA解络的影响从pH大于7时才开始发挥较大作用.当pH为0~7时,Cu2+与EDTA的络合形态基本不受Fe2+影响,当pH大于7时,Fe2+逐渐与EDTA络合,Fe2+与EDTA的络合形态主要是FeEDTA2-和FeOHEDTA3-,图 8与图 5(a)对比可以看出,Fe2+抑制了碱性条件下CuOHEDTA2-的形成,使Cu2+以Cu(OH)2的形式沉淀下来.
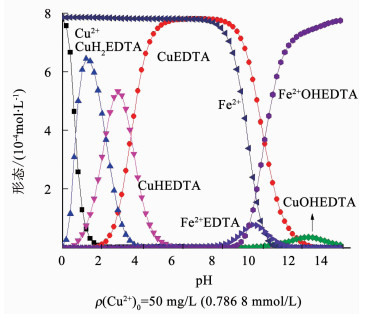
|
图 8 n(Fe2+):n(Cu2+):n(EDTA)=1:1:1时溶液中铜离子的分配形式 Figure 8 Distribution of copper ions in the solution when n(Fe2+):n(Cu2+):n(EDTA)=1:1:1 |
图 9为Fe(OH)2吸附共沉淀Cu2+-EDTA溶液,Fe2+与Cu2+摩尔比为10:1时,铜离子去除率即达到98%以上,而TOC去除率却近乎于零,与软件的模拟结果相符,说明在碱性条件下加入Fe2+能使得络合态铜离子变为Cu(OH)2,并且Fe(OH)2对EDTA没有吸附作用,无法将EDTA从溶液中去除.
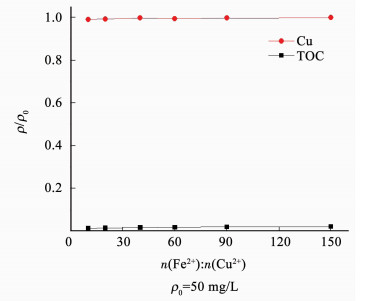
|
图 9 Fe(OH)2吸附共沉淀Cu2+-EDTA溶液 Figure 9 Fe(OH)2 adsorption and coprecipitation of Cu2+-EDTA solution |
1) 利用铁铜微电解可以在pH为2~3条件下几乎完全去除EDTA络合铜离子,去除率达到99%以上.相比单独Fe0法有极大的提高,相比铁炭微电解也有较大提升.
2) 铁铜微电解法去除铜离子的反应过程符合表观一级动力学方程,在酸性条件和微电解作用下,Fe0被溶解生成Fe2+,在溶液中O2作用下Fe2+被氧化成Fe3+,由于Fe3+-EDTA的络合常数(lgK=25.1)远大于Cu2+-EDAT的络合常数(lgK=18.8),EDTA与Cu2+发生解络反应并与Fe3+重新络合,游离态的Cu2+被Fe0还原生成Cu0和Cu2O从而沉淀下来;Fe3+-EDTA也能被铁铜微电解法部分去除.
3) 采用Visual MINTEQ软件模拟了金属离子与EDTA络合物形态分布,在EDTA络合铜溶液中加入Fe3+能够使EDTA与Cu2+发生解络反应,Fe3+与Cu2+摩尔比越大,解络效果越好,pH越低,解络效果越好;在EDTA络合铜溶液中加入Fe2+能够使Cu2+在碱性条件下以Cu(OH)2的形式沉淀下来,Fe2+与Cu2+摩尔比越大,沉淀效果越好.
| [1] |
GUAN Xiaohong, JIANG Xiao, QIAO Junlian, et al. Decomplexation and subsequent reductive removal of EDTA-chelated Cu(Ⅱ) by zero-valent iron coupled with a weak magnetic field: Performances and mechanisms[J]. Journal of Hazardous Materials, 2015, 300: 688-694. DOI:10.1016/j.jhazmat.2015.07.070 |
| [2] |
华南理工大学. 分析化学[M]. 5版. 北京: 高等教育出版社, 2003. South China University of Technology. Analytical chemistry[M]. Fifth edition. Beijing: Higher Education Press, 2003. |
| [3] |
姜玉娟, 陈志强. 电镀废水处理技术的研究进展[J]. 环境科学与管理, 2015, 40(3): 45-48. JIANG Yujuan, CHEN Zhiqiang. Research development of electroplating wastewater treatment[J]. Environmental Science and Management, 2015, 40(3): 45-48. DOI:10.3969/j.issn.1673-1212.2015.03.011 |
| [4] |
NAJAM R, ANDRABI S M A. Removal of Cu(Ⅱ), Zn(Ⅱ) and Cd(Ⅱ) ions from aqueous solutions by adsorption on walnut shell-Equilibrium and thermodynamic studies: treatment of effluents from electroplating industry[J]. Desalination and Water Treatment, 2016, 57: 56. DOI:10.1080/19443994.2016.1166350 |
| [5] |
DOROTA K, HALINA H, ZBIGNIEW H. Sorption of heavy metal ions from aqueous solutions in the presence of EDTA on monodisperse anion exchangers[J]. Desalination, 2008, 227(1): 150-166. DOI:10.1016/j.desal.2007.06.022 |
| [6] |
DURANTE C, CUSCOV M, ISSE A A, et al. Advanced oxidation processes coupled with electrocoagulation for the exhaustive abatement of Cr-EDTA[J]. Water Research, 2011, 45(5): 2122. DOI:10.1016/j.watres.2010.12.022 |
| [7] |
MONEER A A, EL-SHAFEI A A, ELEWA M M, et al. Removal of copper from simulated wastewater by electrocoagulation/floatation technique[J]. Desalination and Water Treatment, 2016, 57(48/49): 22824-22834. DOI:10.1080/19443994.2015.1130917 |
| [8] |
KABDŞLI I, ARSLAN T, OLMEZHANCIT, et al. Complexing agent and heavy metal removals from metal plating effluent by electrocoagulation with stainless steel electrodes[J]. Journal of Hazardous Materials, 2009, 165(165): 838-845. DOI:10.1016/j.jhazmat.2008.10.065 |
| [9] |
XU Z, SHAN C, XI EB, et al. Decomplexation of Cu(Ⅱ)-EDTA by UV/persulfate and UV/H2O2: Efficiency and mechanism[J]. Applied Catalysis B Environmental, 2016, 200: 439-447. DOI:10.1016/j.jhazmat.2008.10.065 |
| [10] |
HUANG X, XU Y, SHANC, et al. Coupled Cu(Ⅱ)-EDTA degradation and Cu(Ⅱ) removal from acidic wastewater by ozonation: Performance, products and pathways[J]. Chemical Engineering Journal, 2016, 299: 23-29. DOI:10.1016/j.cej.2016.04.044 |
| [11] |
JU F, HU Y. Removal of EDTA-chelated copper from aqueous solution by interior microelectrolysis[J]. Separation & Purification Technology, 2011, 78(1): 33-41. DOI:10.1016/j.seppur.2011.01.014 |
| [12] |
FENG J, HU Y, CHENG J. Removal of chelated Cu(Ⅱ) from aqueous solution by adsorption-coprecipitation with iron hydroxides prepared from microelectrolysis process[J]. Desalination, 2011, 274(1/2/3): 130-135. DOI:10.1016/j.desal.2011.02.002 |
| [13] |
彭人勇, 程宝珍. Fe/C微电解-絮凝沉淀法处理电镀废水中铜的研究[J]. 环境工程学报, 2016, 6(2): 501-504. RENYONG P, BAOZHEN C. Treatment of copper from electroplating wastewater by Fe/C micro-electrolysis-flocculation-deposition process[J]. Chinese Journal of Environmental Engineering, 2016, 6(2): 501-504. |
| [14] |
王鹏, 郑宗浩, 毕东苏, 等. 铁碳内电解预处理电镀废水的试验研究[J]. 上海应用技术学院学报(自然科学版), 2013, 13(3): 197-200. PENG W, ZHONGHAO Z, DONGSU B, et al. Experimental study on iron-corbon internal electrolysis pre-processing of electroplating wastewater[J]. Journal of Shanghai Institute of Technology (Natural Science), 2013, 13(3): 197-200. |
| [15] |
GUAN X, JIANG X, QIAO J, et al. Decomplexation and su-bsequent reductive removal of EDTA-chelated Cu Ⅱ, by zero-valent iron coupled with a weak magnetic field: Performances and mechanisms[J]. Journal of Hazardous Materials, 2015, 300: 688-694. DOI:10.1016/j.jhazmat.2015.07.070 |
| [16] |
LIANG C, LIANG C P, CHENC C. pH dependence of persulfate activation by EDTA/Fe(Ⅲ) for degradation of trichloroethylene[J]. Journal of Contaminant Hydrology, 2009, 106(3/4): 173-182. DOI:10.1016/j.jconhyd.2009.02.008 |
| [17] |
KIPPAX S, CAMPBELL D, VENP V D, et al. Cyclic voltammetric and aqueous equilibria model study of the pH dependant iron(Ⅱ/Ⅲ)ethylenediamminetetraacetate complex reduction potential[J]. Journal of Electroanalytical Chemistry, 2007, 603(1): 44-50. DOI:10.1016/j.jelechem.2007.01.027 |
 2018, Vol. 50
2018, Vol. 50


