2. 深圳市水资源利用与 环境污染控制重点实验室(哈尔滨工业大学深圳研究生院),广东 深圳 518055
2. Shenzhen Key Laboratory of Water Resource Utilization and Environmental Pollution Control (Harbin Institute of Technology Shenzhen Graduate School), Shenzhen 518055, Guangdong, China
四溴双酚A(TBBPA)是目前产量和使用量最大的溴代阻燃剂,广泛应用于电子、化工、交通、建材等材料制造中.TBBPA在生产、使用及废物处置过程中会释放到环境中,目前已在水体、沉积物、生物组织、污水厂污泥、大气等多种介质中检出TBBPA[1].毒理学研究证实,TBBPA具有多种急、慢性生物毒性,且具有很高的污染持久性和生物积累性,对水生生物、动植物、人体均会造成不利影响[2].因此,有必要研发TBBPA的高效降解技术.近年来,针对TBBPA的降解技术主要有生物降解技术[3]、物理吸附技术[4]和化学高级氧化技术[5-6].这些技术往往侧重于TBBPA物质本身的脱除,缺乏对反应过程中生物毒性变化、控制的研究及机理分析.相关研究表明,TBBPA在降解过程中,可能生成毒性更强的脱溴产物,如三溴、二溴、一溴类有机中间产物甚至溴酸盐副产物等[7-8].因此,亟需研发更安全稳定的TBBPA降解技术.
高铁酸盐氧化法是一种新型、高效、环保型水处理技术,对微生物、无机污染物、有机难降解物及实际废水均有良好的处理效果,且无臭氧、氯化时的消毒副产物风险[9].本研究将高铁酸盐氧化法应用于TBBPA降解,除研究目标污染物本身的脱除,深入研究反应过程中的急、慢性生物毒性变化及控制情况,并利用气相-质谱联用仪(GC-MS/MS)检测中间产物,分析毒性与中间产物之间的内在联系,在此基础上推测其反应机理.
1 实验 1.1 试剂与仪器试剂:四溴双酚A粉末(色谱纯)、高铁酸钾粉末(纯度97%)、盐酸羟氨(分析纯),发光细菌冻干粉、大型蚤(从华南环境科学研究所水生毒理实验室引种)等.
仪器:Eppendorf 5418离心机、美国Waters Acquity HClass超高效液相色谱(UPLC)、美国SDIX DeltaTox毒性检测仪、恒温培养箱、日本奥林巴斯荧光显微镜、美国Milli-Q超纯水净化系统.
1.2 实验方法实验在500 mL锥形瓶中进行(利用暗箱进行避光处理),TBBPA溶液提前24 h配制(本研究中,pH为7.0、温度为(25±1) ℃时,1 L去离子可溶解TBBPA 0.15 mg).反应开始时,称取一定质量的高铁酸钾粉末投加至锥形瓶中并快速连续搅拌.反应在一定的时间点取样20 mL,并立即用20 μL 0.1 mol/L的盐酸羟氨终止反应.样品经5 000 r/min的转速离心5 min,转移上清液以备后续检测.
1.3 分析方法TBBPA浓度采用UPLC检测,色谱条件:色谱柱为Waters BEHC18(1.7×100 mm);柱温30 ℃;采用等度洗脱,流动相甲醇/水(体积比)70/30;流速0.5 mL/min;进样量1 μL;采用Acquity UPLC TUV检测器,检测波长为210 nm.
生物毒性采用USEPA提出的毒性当量TU值(toxicity unit)来表示,即用原废水浓度(按100%计)除以半致死浓度LC50、半效应浓度EC50或最大无效应浓度NOEC的所得值.其中,急性生物毒性采用发光细菌法测定(GB/T 15441—1995),测定反应过程中水样对发光细菌的发光度,计算发光细菌发光度的相对抑制率T(如式(1)所示),得出水样对于发光细菌的半效应浓度,然后根据毒性当量的计算公式,即可得出水样的急性毒性当量TU值.当原水对于发光细菌的毒性较低,不能产生半数效应,TU值按50%的部分计算.比如,若原水对于发光细菌的发光度衰减率为20%时,20/50=0.4,其毒性当量为0.4 TU.
| $ T/\% = \frac{{{X_0} - {X_t}}}{{{X_0}}} \times 100. $ | (1) |
式中:X0为反应前水样对发光细菌的发光度;Xt为反应t时间水样对发光细菌的发光度.
慢性生物毒性采用大型蚤14 d毒性测试法,参考OECD大型蚤21 d慢性毒性测试标准方法进行,获得实验组中水样对于大型蚤死亡率的14 d最大无效应浓度,然后根据毒性当量的计算公式,得出水样对于大型蚤的慢性毒性当量TU值.
中间产物定性分析采用气相色谱-质谱联用仪(Agilent7890A/GC-5975C MS).预处理方法:将20 mL水样加入分液漏斗,加入5 mL萃取剂二氯甲烷和1 g氯化钠进行振荡萃取,静置分层后取下层萃取液,萃取液经无水硫酸钠脱水及玻璃纤维滤膜过滤后转移至10 mL氮吹管中.同一水样经上述重复萃取两次后,所得萃取液经氮吹浓缩处理,吹至近干后加入1 mL二氯甲烷.气相色谱条件:色谱柱为HP-5型石英毛细管柱(30 m×250 μm×0.25 μm),载气为氦气,流速1 mL/min;进样口温度260 ℃,进样量1 μL,分流比10: 1.升温程序:柱温40 ℃,保持3 min;以15 ℃/min升温速率升至300 ℃,保持10 min;最后升温至325 ℃,保持3 min;升温程序总运行时间为25.67 min.质谱条件:质量扫描区间50~560 m/z,离子源230 ℃,电子轰击源EI为70 eV,四级杆温度150 ℃.
2 结果与讨论 2.1 TBBPA的降解首先考察高铁酸盐氧化法在不同氧化剂投加量和不同pH条件下对TBBPA的降解,结果见图 1.

|
图 1 高铁酸盐氧化法对TBBPA的降解 Figure 1 Degradation of TBBPA by ferrate(Ⅵ) oxidation |
由图 1(a)可知,高铁酸盐氧化法对TBBPA具有很好的降解效果.当高铁酸盐的质量浓度仅为0.15 mg/L时,经30 min接触反应即可将TBBPA彻底降解;当高铁酸盐的质量浓度增加至0.25 mg/L时,完全降解TBBPA所需的反应时间缩短至5 min.高铁酸盐投加质量浓度的增加,使得溶液中高铁酸盐主要反应成分(单质子酸HFeO4-)的浓度增加,从而增加了与目标污染物TBBPA的有效碰撞机率,有利于TBBPA的降解.另外,高浓度TBBPA降解结果显示,当氧化剂质量浓度为0.5 mg/L、TBBPA质量浓度为1.0 mg/L时,经30 min接触氧化,TBBPA的去除率也可达93.0%.
由图 1(b)可知,当高铁酸盐质量浓度为0.15 mg/L时,TBBPA在初始溶液pH为6.0~9.0条件下均能完全脱除,且最佳pH为8.0,此时彻底去除TBBPA所需反应时间最短,仅需5 min.溶液pH增加,高铁酸盐自分解反应减弱,氧化剂更加稳定,能更有效地参与降解反应,因此,完全降解TBBPA所需时间逐渐缩短.但pH大于8.0时,单质子酸HFeO4-的存在比例较低,反应体系的氧化能力降低,不利于TBBPA的降解[10],故TBBPA完全脱除所需时间延长.
综上,高铁酸盐氧化法在较宽范围的TBBPA浓度和溶液pH条件下均可高效降解TBBPA.
2.2 生物毒性的变化及控制在氧化剂和TBBA质量浓度均为0.15 mg/L时,研究不同pH条件下高铁酸盐降解TBBPA反应过程中水样的生物毒性变化及控制情况,包括急性毒性和慢性毒性,结果如图 2所示.由图 2可知,溶液pH对生物毒性的影响与其对TBBPA降解的影响一致,随着溶液pH的增加,急性毒性和慢性毒性均呈先减弱后增强的趋势.当溶液pH从6.0升高至8.0时,由于TBBPA降解速度逐渐加快,完全脱除TBBPA所需时间也随之缩短(如图 1(b)所示),因此,水样的生物毒性控制效果也逐渐增强.当溶液pH为8.0时,生物毒性具有最佳的控制效果,此时急性和慢性毒性当量分别为0.02和10.5 TU.
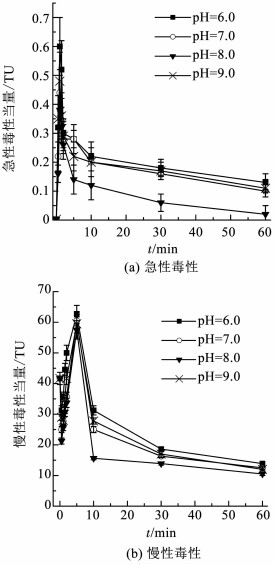
|
图 2 反应过程中生物毒性的变化及控制情况 Figure 2 Variation and controlling of toxicity during the reactions |
由图 2(a)可知,随着TBBPA的降解,急性毒性呈先升高后降低的趋势.反应开始前,毒性当量仅为0.003 TU,说明TBBPA本身的急性毒性很低.反应2 min内,急性毒性迅速升高,最高达0.6 TU.随着反应时间的延长,毒性当量逐渐降低,当反应至60 min时,不同pH反应体系中的急性毒性均被控制在0.15 TU以下.由图 2(b)可知,TBBPA本身具有较高的慢性毒性,其毒性当量高达41.67 TU.反应开始后,慢性毒性先略有降低、继而迅速升高,在5 min时达到最高值,最高可达62.5 TU.随着反应的深入,慢性毒性逐渐减弱,当反应60 min后,毒性当量均可控制在15 TU以下,相对初始毒性,水样的毒性控制率高达74.8%.
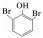
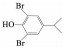
为了解释反应初期毒性升高的现象,利用GC-MS/MS仪器对反应过程中的中间产物进行定性分析,结果如表 1所示.可以看出,反应过程中生成了三溴双酚A、双酚A、多个二溴酚类物质及苯酚类物质,毒理学数据表明,这些中间产物的LD50(大鼠,口径)分别为2 000、2 400、282、270 mg/kg,低于TBBPA的LD50(3 160 mg/kg),表明这些中间产物的毒性均比TBBPA高很多[11-12].正是这些更高毒性中间产物的生成使得反应初期水样的生物毒性升高.以较高毒性的二溴苯酚为例,定量结果显示(图 3),在高铁酸盐降解TBBPA反应初期,2, 6-二溴苯酚的生成量迅速增加,在5 min内达最大值8.30 μg/L;随着反应时间的延长,2, 6-二溴苯酚又逐渐被降解,反应60 min后其质量浓度仅为0.31 μg/L.结果表明,反应过程中2, 6-二溴苯酚的生成情况与水样的生物毒性变化规律一致.
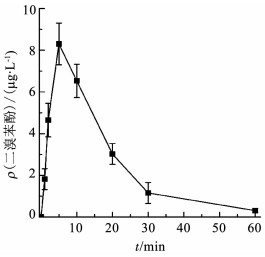
|
图 3 二溴苯酚生成情况 Figure 3 Formation of 2, 6-dibromophenol |
| 表 1 高铁酸盐降解TBBPA过程中的有机中间产物 Table 1 Intermediates of TBBPA degradation by ferrate(Ⅵ) oxidation |
为了进一步说明生物毒性变化原因,对各时间点水样在220~320 nm内进行紫外波谱扫描,结果如图 4所示.可以看出,水样的紫外吸光度在反应10 min内呈升高趋势,说明在反应过程中生成了较多的含苯环类物质或不饱和键,而这些物质的毒性可能更高,导致水样的生物毒性升高;随着反应的进行,水样对紫外的吸光度值逐渐降低,说明中间产物被进一步降解,从而使水样的毒性降低.
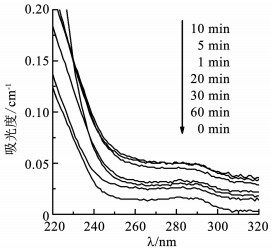
|
图 4 高铁酸盐降解TBBPA过程中紫外吸光度变化 Figure 4 UV absorbance of TBBPA during its degradation by ferrate(Ⅵ) |
综上,高铁酸盐降解TBBPA过程中水样的生物毒性先升高后降低趋势与更高毒性中间产物的积累及进一步降解密切相关.
2.3 降解机理分析基于表 1确定的有机中间产物并结合文献调研,提出了高铁酸盐降解TBBPA的可能性机理,结果如图 5所示.

|
图 5 高铁酸盐降解TBBPA的可能性机理 Figure 5 Possible mechanism of TBBPA degradation by ferrate(Ⅵ) |
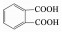
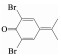
一方面,由表 1可知二溴类有机物是主要检出中间产物,其主要反应过程包括加成反应、β位断裂反应和去质子化反应[13].六价态的HFeO4-分子将一个e-转移给TBBPA使其形成自由基态中间体,而HFeO4-还原成五价态的H2FeO4-,中间体通过分子振动并断裂生成2, 6-二溴-4-(1, 1-二甲基乙基)苯酚和2, 6-二溴对-(2-叔丁醇)苯酚,再通过去质子化反应可生成2, 6-二溴苯酚和2, 6-二溴对异丙烯基苯醌.然后,二溴类有机中间产物经脱溴反应和氧化反应生成邻苯二甲酸,并经深度降解最终被矿化.
另一方面,本研究确定了脱一个溴元素的三溴双酚A和完全脱溴产物双酚A,可以推测在高铁酸盐降解TBBPA过程中存在逐级脱溴过程,此反应途径与其他降解技术相似[14-15].四面体结构的高铁酸盐分子中O—H键与TBBPA分子中Br元素以氢键形式结合,并与3个H2O分子反应,反应脱一个溴元素生成HBr,TBBPA本身生成三溴双酚A,六价态的HFeO4-还原生成四价态的H3FeO4-;然后经过逐级脱溴反应直至生成完全脱溴产物双酚A.双酚A经β位断裂反应和高铁酸盐氧化反应生成邻苯二甲酸,并进一步被降解甚至矿化.
3 结论1) 高铁酸盐氧化法对TBBPA具有良好的降解效果.当氧化剂投加量为0.15 mg/L时,经30 min接触氧化反应,在较宽的pH范围内(6.0~9.0)高铁酸盐氧化法均能将TBBPA(质量浓度为0.15 mg/L)完全脱除.
2) 在高铁酸盐降解TBBPA反应过程中,水样的急性毒性和慢性毒性均呈先增强后减弱的趋势.该趋势与更高毒性中间产物的生成及进一步降解有密切联系.
3) 高铁酸盐氧化法对TBBPA降解过程中的生物毒性具有显著的控制效果.当溶液pH为8.0时,反应60 min后水样的急性毒性可控制至0.02 TU,慢性毒性的控制率也高达74.8%.
4) 高铁酸盐氧化降解TBBPA可分为两条主要路径,主要包括加成反应、β位断裂反应、去质子化反应和脱溴反应.
| [1] |
ZHONG Yin, PENG Ping'an, HUANG Weilin. Transformation of tetrabromobisphenol A in the presence of different solvents and metals[J]. Chemosphere, 2012, 87(10): 1141-1148. DOI:10.1016/j.chemosphere.2012.02.019 |
| [2] |
DEBENEST T, GAGNÉ F, PETIT A N, et al. Ecotoxicity of a brominated flame retardant (tetrabromobisphenol A) and its derivatives to aquatic organisms[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2010, 152(4): 407-412. DOI:10.1016/j.cbpc.2010.06.009 |
| [3] |
UHNÁKOVÁ B, LUDWIG R, PÊKNICOVÁ J, et al. Biodegradation of tetrabromobisphenol A by oxidases in basidiomycetous fungi and estrogenic activity of the biotransformation products[J]. Bioresource Technology, 2011, 102(20): 9409-9415. DOI:10.1016/j.biortech.2011.07.036 |
| [4] |
SUN Zhaohai, YU Yijun, MAO Li, et al. Sorption behavior of tetrabromobisphenol A in two soils with different characteristics[J]. Journal of Hazardous Materials, 2008, 160(2/3): 456-461. DOI:10.1016/j.jhazmat.2008.03.019 |
| [5] |
HAN S K, YAMASAKI T, YAMADA K I. Photodecomposition of tetrabromobisphenol A in aqueous humic acid suspension by irradiation with light of various wavelengths[J]. Chemosphere, 2016, 147: 124-130. DOI:10.1016/j.chemosphere.2015.12.072 |
| [6] |
PANG Suyan, JIANG Jin, GAO Yuan, et al. Oxidation of flame retardant tetrabromobisphenol A by aqueous permanganate: reaction kinetics, brominated products, and pathways[J]. Environmental Science & Technology, 2014, 48(1): 615-623. DOI:10.1021/es4041094 |
| [7] |
XU Jian, MENG Wei, ZHANG Yuan, et al. Photocatalytic degradation of tetrabromobisphenol A by mesoporous BiOBr: Efficacy, products and pathway[J]. Applied Catalysis B: Environmental, 2011, 107(3/4): 355-362. DOI:10.1016/j.apcatb.2011.07.036 |
| [8] |
张丹丹, 于鑫, 何士龙. 臭氧氧化四溴双酚A过程中溴离子和溴酸盐生成的影响因素[J]. 化工进展, 2012, 31(6): 1368-1372. ZHANG Dandan, YU Xin, HE Shilong. Effect of different influence factors on Br- and BrO3- generation during ozonation of TBBPA[J]. Chemical Industry and Engineering Progress, 2012, 31: 1368-1372. |
| [9] |
MURA S, MALFATTI L, GREPPI G, et al. Ferrates for water remediation[J]. Reviews in Environmental Science and Bio/Technology, 2017, 16(1): 15-35. DOI:10.1007/s11157-016-9416-8 |
| [10] |
SHARMA V K, CHEN Long, ZBORIL R. Correction to review on high valent FeⅥ (Ferrate): A sustainable green oxidant in organic chemistry and transformation of pharmaceuticals[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(1): 18-34. DOI:10.1021/acssuschemeng.7b00010 |
| [11] |
SHARMA V K. Oxidation of inorganic contaminants by ferrates (Ⅵ, Ⅴ, and Ⅳ)-kinetics and mechanisms: A review[J]. Journal of Environmental Management, 2011, 92(4): 1051-1073. DOI:10.1016/j.jenvman.2010.11.026 |
| [12] |
DEBENEST T, GAGNÉ F, PETIT A N, et al. Ecotoxicity of a brominated flame retardant (tetrabromobisphenol A) and its derivatives to aquatic organisms[J]. Comparative Biochemistry & Physiology Part C: Toxicology & Pharmacology, 2010, 152(4): 407-412. DOI:10.1016/j.cbpc.2010.06.009 |
| [13] |
ZHONG Yuanhong, LIANG Xiaoliang, ZHONG Yin, et al. Heterogeneous UV/Fenton degradation of TBBPA catalyzed by titanomagnetite: Catalyst characterization, performance and degradation products[J]. Water Research, 2012, 46(15): 4633-4644. DOI:10.1016/j.watres.2012.06.025 |
| [14] |
GUO Yingna, CHEN Ling, YANG Xia, et al. Visible light-driven degradation of tetrabromobisphenol A over heterostructured Ag/Bi5Nb3O15 materials[J]. Royal Society of Chemistry Advances, 2012, 2(11): 4656-4663. DOI:10.1039/c2ra01278b |
| [15] |
LIU Jie, WANG Yongfeng, JIANG Bingqi, et al. Degradation, metabolism, and bound-residue formation and release of tetrabromobisphenol A in soil during sequential anoxic-oxic Incubation[J]. Environmental Science & Technology, 2013, 47(15): 8348-8354. DOI:10.1021/es4014322 |
 2018, Vol. 50
2018, Vol. 50