2. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090
2. State Key Laboratory of Urban Water Resource and Environment (Harbin Institute of Technology), Harbin 150090, China
邻苯二甲酸二甲酯(DMP)常用作塑胶类产品的增塑剂,以及润滑剂、去污剂和化妆品等的生产[1],其对人体健康的危害是一个慢性过程,可导致人体的生殖机能受损并使内分泌系统紊乱[2].此外,DMP在自然环境中性质稳定、存留时间长且有较强的生物富集毒性,其水解半衰期可达20年左右[3].因此,中国已将DMP列入环境优先控制污染物名单.
与粉末型光催化剂和固载型光催化剂相比,TiO2纳米管具有更大的比表面积、更好的电子传输通道和对污染物分子的吸附能力,并被逐步应用到难降解有机污染物的处理中[4].由于TiO2的禁带宽度(E=3.2 eV)较宽,只有在紫外光(λ < 387 nm)下才能表现出光催化活性.需要对TiO2进行改性研究以拓宽其光谱响应范围.目前,对TiO2的改性研究主要集中在非金属掺杂方面,其中,研究最为广泛的是N掺杂改性[5].TiO2中掺杂N后,N 2p轨道和O 2p轨道的杂化能有效地窄化TiO2的禁带从而引起可见光催化活性.由于N和O的原子半径相近且电离能较小,N掺杂引起的晶格畸变小,也不会产生大量的电子复合中心[6-7].与钛板上生成的二维结构TiO2纳米管不同,钛网基底表面的TiO2纳米管可以垂直钛丝呈各向生长,从而收集来自不同方向的光辐射[8].有研究报道,在钛网上生长的TiO2纳米管的光催化活性优于钛板[9].
近年来,随着LED技术的不断发展,其发光效率进一步提高,且LED属于冷光源,具有较长的使用寿命[10].与光催化中常用的氙灯[11]和荧光灯[12-13]相比,LED的能量损耗小,响应速度快,光能转换率高且有较好的光谱纯度,具有非常良好的应用前景[14].此外,LED尺寸小、结构紧密的特点也为设计节省空间的光催化设备提供了可能[15].
本文制备了具有可见光催化活性的N-TiO2/Ti网状光催化剂,并在光催化反应器内建立了三维叠加的N-TiO2/Ti网状光催化体系,在Vis-LED辐照下实现了对DMP的降解,研究了N-TiO2/Ti网状光催化体系的光催化活性.
1 实验 1.1 材料与试剂钛网(开孔1 mm×2 mm,梗宽0.1 mm,厚度0.1 mm)购自河北安平县匡瑞金属丝制品有限公司;Vis-LEDs(中心波长430 nm,额定功率20 W)购自中山市光圣半导体科技有限公司.邻苯二甲酸二甲酯(DMP)、尿素(CO(NH2)2)、乙二醇(C2H6O2)、氟化铵(NH4F)、氢氟酸(HF)、硝酸(HNO3)等试剂均为分析纯.
1.2 催化剂的制备一步阳极氧化法制备N-TiO2/Ti网的流程见图 1.将面积为100 mm×200 mm的钛网先分别用丙酮和去离子水超声清洗10 min,之后用酸洗液(V(HF): V(HNO3): V(H2O)=1: 4: 5)化学抛光10 s.使用“尿素/NH4F/乙二醇/H2O”的有机电解液体系,其中尿素和NH4F质量分数分别为0.4%和0.2%,含水量为2%(体积分数).以钛网为阳极,不锈钢板作阴极,在40 V的恒电压下氧化60 min.将制得的N-TiO2/Ti网放入马弗炉中,在500 ℃下恒温煅烧2 h,得到相应相转变的N-TiO2/Ti网.作为对比,TiO2/Ti网在不含尿素且其他因素相同的条件下制备,N-TiO2/Ti板与N-TiO2/Ti网的制备条件一致.
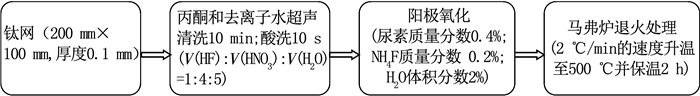
|
图 1 N-TiO2/Ti网的制备流程 Fig. 1 Flow chart of preparation of N-TiO2/Ti mesh |
采用场发射扫描电子显微镜(MERLIN Compact,德国Zeiss公司)、X射线衍射仪(D/max 2700,丹东浩元公司)、X射线光电子能谱仪(ESCALAB 250 XI,美国Thermo Fisher公司)以及紫外-可见漫反射吸收光谱仪(UV-2550,日本岛津公司)等对TiO2/Ti网和N-TiO2/Ti网进行表征分析.N-TiO2/Ti网的瞬态光电流通过电化学工作站(CHI660,上海辰华仪器有限公司)在三电极体系中进行测试,以铂丝作对电极、Ag/AgCl电极为参比电极,采用0.1 mol/L的Na2SO4做电解质溶液.
1.4 光催化降解实验在图 2光催化反应器中进行DMP的光催化降解实验,反应溶液总量为500 mL.反应开始前将放入N-TiO2/Ti网(单层面积20 mm×100 mm)的DMP溶液置于黑暗环境中30 min以实现吸附/解吸平衡.反应器两侧的石英窗尺寸为20 mm×100 mm,石英玻璃窗外部5 mm处安置Vis-LEDs光源.DMP溶液的pH通过1 mol/L的H2SO4或NaOH调节.通过加入1 mmol/L H2O2研究其对DMP降解的影响.此外,其他实验均在pH为7、DMP初始质量浓度为1 mg/L且未加入H2O2的条件下进行.通过高效液相色谱仪(UltiMate-3000,美国Thermo Fisher公司)对DMP的残余质量浓度进行分析,使用Agilent-C18型色谱柱(150 mm×4.6 mm, 5 μm),检测波长230 nm,柱温30 ℃,以V(乙腈): V(水)=65: 35为流动相,进样量20 μL,检测时间15 min,平均出峰时间4.674 min.
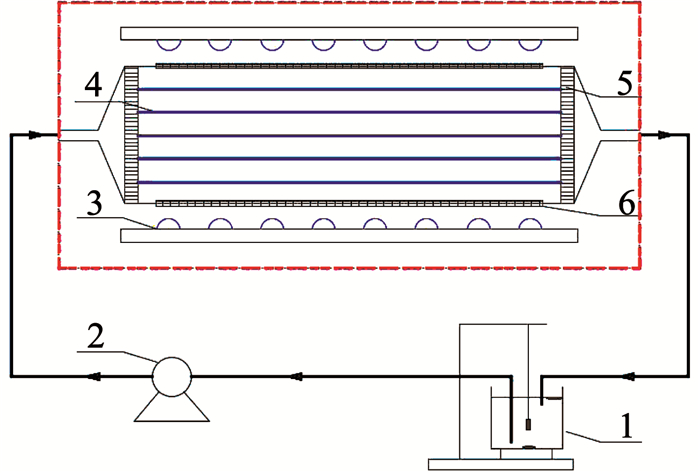
|
1—外循环槽(含磁力搅拌装置);2—蠕动泵;3—LED灯板;4—N-TiO2/Ti网;5—布水装置;6—石英玻璃窗 图 2 光催化反应器设计图 Fig. 2 Design of photocatalytic reactor |
图 3(a)为N-TiO2/Ti网的钛丝结构.可以看出,阳极氧化后的钛丝表面存在明显的沟槽,这是干燥时范德华力与毛细管力共同作用造成的[16].此外,图 3(a)插图中显示的N-TiO2纳米管垂直钛基底生长且排列整齐,管长达4.5 μm.图 3(b)、(c)分别为TiO2纳米管和N-TiO2纳米管.可以看出,二者直径均在40~50 nm,说明N掺杂并未对TiO2纳米管的表面形貌产生破坏.

|
图 3 TiO2/Ti网和N-TiO2/Ti网的FESEM图及EDX谱图 Fig. 3 FESEM images and EDX spectra of TiO2/Ti mesh and N-TiO2/Ti mesh |
图 3(d)为N-TiO2/Ti网的EDX分析结果.可以看出,N-TiO2/Ti网的表面存在Ti、O、N、C 4种元素,其中N元素平均质量分数和平均原子百分数分别达3.76%和5.75%,说明非金属元素N成功掺杂进了TiO2纳米管中.由于氮前体为尿素,在阳极氧化过程中存在C元素掺杂[17].由EDX分析也可以看出,N和C的谱峰并不能完全分开,为排除测试样品中C元素的干扰,还需对N-TiO2/Ti网作进一步XPS分析.
2.1.2 组成元素及价态分析由图 4(a)的TiO2/Ti网和N-TiO2/Ti网的XPS全谱图可以看出,制得的样品中含有Ti、O、N、C 4种元素,这说明N元素成功掺杂进入TiO2纳米管.图 4(b)、(c)、(d)分别为Ti 2p、O 1s、N 1s的高分辨XPS谱图.图 4(b)、(c)显示N-TiO2/Ti网中Ti和O的结合能相比TiO2/Ti网分别提高了0.39和0.45 eV,这是因为N的电负性较大,引起了Ti和O周围电子云密度变化[18].密度泛函数理论研究证实了N元素掺杂包含间隙氮和取代氮两种形式,在可见光下取代氮比间隙氮更易产生光电子跃迁,因此,可见光催化活性更高[19].由图 4(d)可以看出,N 1s的拟合峰为399.22 eV,且无其他拟合峰的出现,说明N元素在TiO2纳米管以N3-形态存在[20],即N元素取代了TiO2晶格中的O元素,形成了N-Ti-O的晶格结构.由图 4(d)也可以看出,在未加入尿素的电解液中制备所得的TiO2/Ti网仍有N元素检出,这是由电解液中NH4F引起的少量N元素掺杂导致的[21].
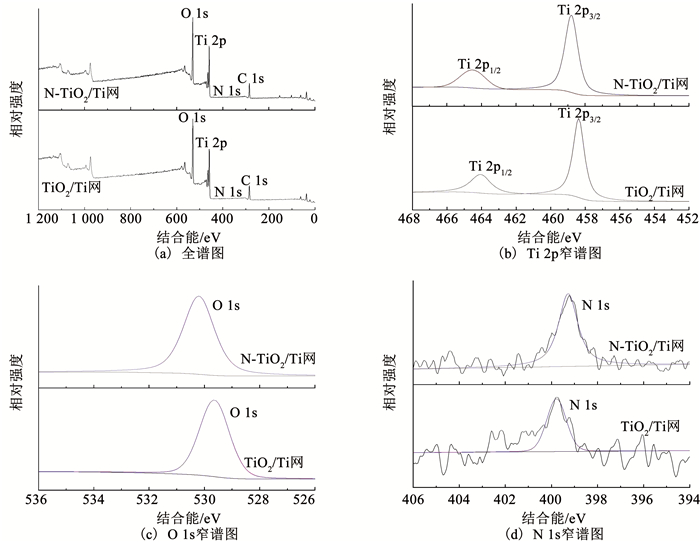
|
图 4 TiO2/Ti网和N-TiO2/Ti网的XPS谱图 Fig. 4 XPS spectra of TiO2/Ti mesh and N-TiO2/Ti mesh |
图 5为TiO2/Ti网和N-TiO2/Ti网的XRD谱图.可以看出,TiO2/Ti网和N-TiO2/Ti网在相应位置的特征衍射峰对比基本一致,无其他类型的衍射峰出现,说明N掺杂并未明显改变TiO2纳米管的晶型结构[22].值得注意的是,图 5中2θ=25.3°的101晶面的衍射峰强度有一定程度的提高,这可能是由N元素参与晶格组成后使锐钛矿相在101晶面更加暴露导致的[23].此外,图 5中出现少量具有金红石晶相的特征峰,说明在500 ℃热处理温度下制备所得N-TiO2/Ti网是以锐钛矿为主并掺杂有少量金红石结构,由于金红石的禁带宽度低于锐钛矿,二者的混晶结构具有更高的光催化活性[24].
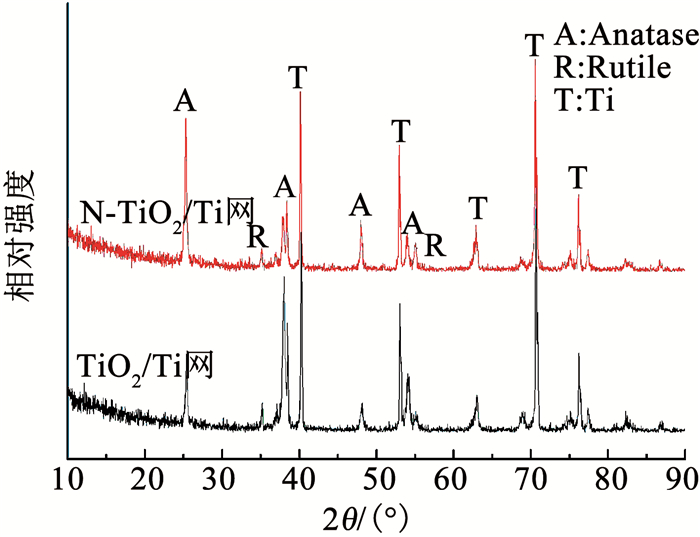
|
图 5 TiO2/Ti网和N-TiO2/Ti网的XRD谱图 Fig. 5 XRD spectra of TiO2/Ti mesh and N-TiO2/Ti mesh |
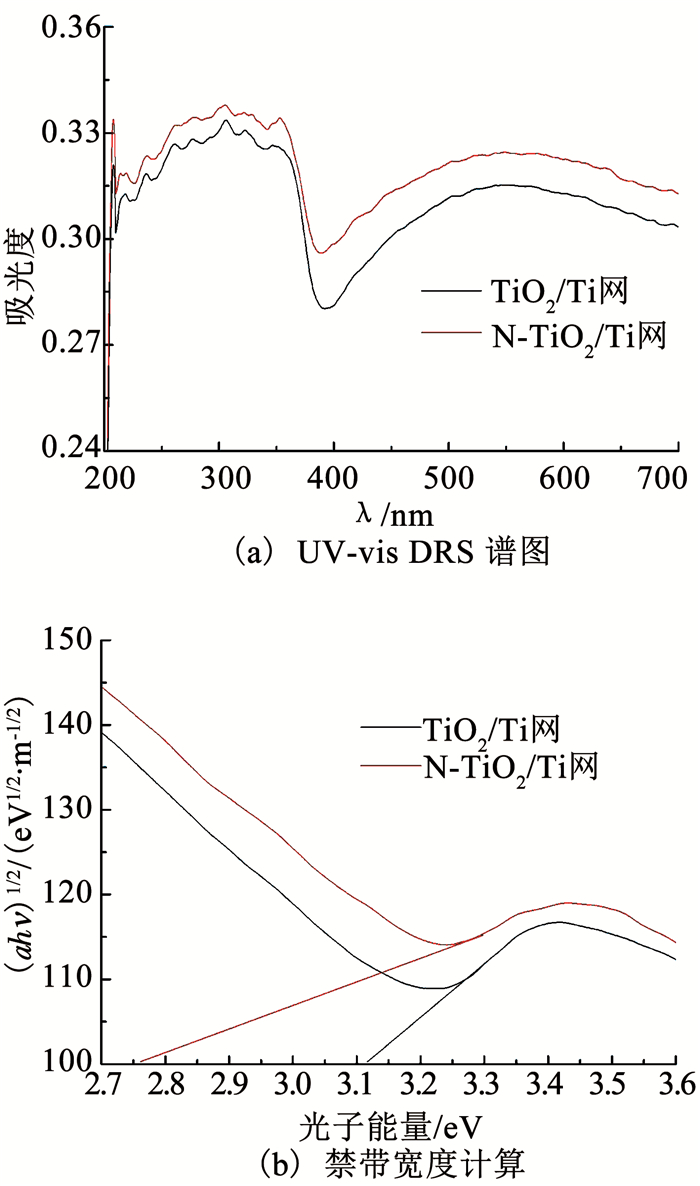
图 6(a)为TiO2/Ti网和N-TiO2/Ti网的UV-vis DRS谱图.可以看出,TiO2/Ti网和N-TiO2/Ti网都有明显且陡峭的吸收带边,且N-TiO2/Ti网的吸收带边发生了明显的红移,向更高波长处发生偏移.此外,在200~380 nm的紫外光区,二者的吸收强度基本相同,说明N掺杂对TiO2在紫外光区的吸收影响不大.利用式(1)所示Tauc/David-Mott公式[25]计算TiO2/Ti网和N-TiO2/Ti网的禁带宽度,即
| $ {\left( {ahv} \right)^{\frac{1}{n}}} = A\left( {hv - {E_{\rm{g}}}} \right). $ | (1) |
|
图 6 TiO2/Ti网和N-TiO2/Ti网的UV-vis DRS谱图和禁带宽度计算 Fig. 6 DRS spectra of TiO2/Ti mesh and N-TiO2/Ti mesh as well as the calculation of forbidden band width |
式中:h为普朗克常数,υ为振动频率,α为吸收系数,Eg为能带带隙,A为比例常数,指数n取0.5[26].计算结果如图 6(b)所示,经过N掺杂后的TiO2纳米管的禁带宽度从3.12 eV缩小到2.76 eV,对应光响应波长从397 nm红移至449 nm,这是由于TiO2经N掺杂后,N 2p和O 2p轨道发生交叠形成新的价带,价带位置移向导带,导致禁带宽度减小,电子在光激发下由价带跃迁到导带的能量降低,从而使N-TiO2/Ti网的吸收边向可见光方向红移[27].
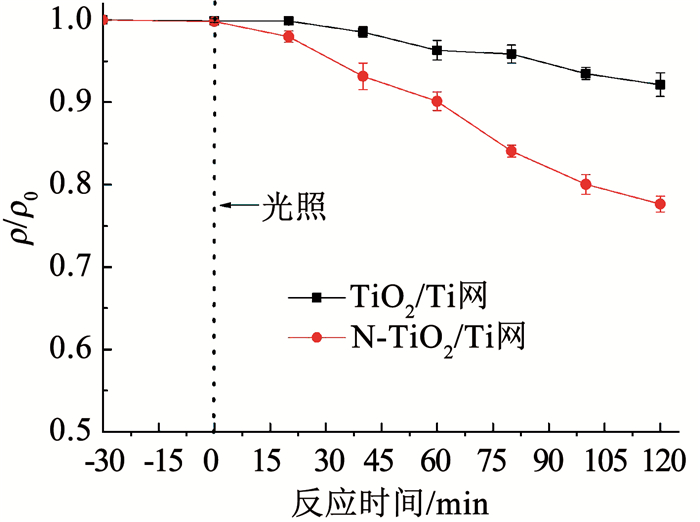
2.1.5 可见光催化性能测试图 7对比了3层叠加时TiO2/Ti网和N-TiO2/Ti网在可见光下的光催化活性.可以看出,N-TiO2/Ti网的可见光催化活性明显高于TiO2/Ti网,在可见光下TiO2/Ti网和N-TiO2/Ti网对DMP的降解率分别为7.9%和22.4%.由图 6也可以看出,N-TiO2/Ti网的禁带宽度更窄,对可见光的吸收能力更强,因而可见光催化活性明显提高.
|
图 7 TiO2/Ti网和N-TiO2/Ti网的可见光催化活性对比 Fig. 7 Comparison of visible light catalytic activity between TiO2/Ti mesh and N-TiO2/Ti mesh |
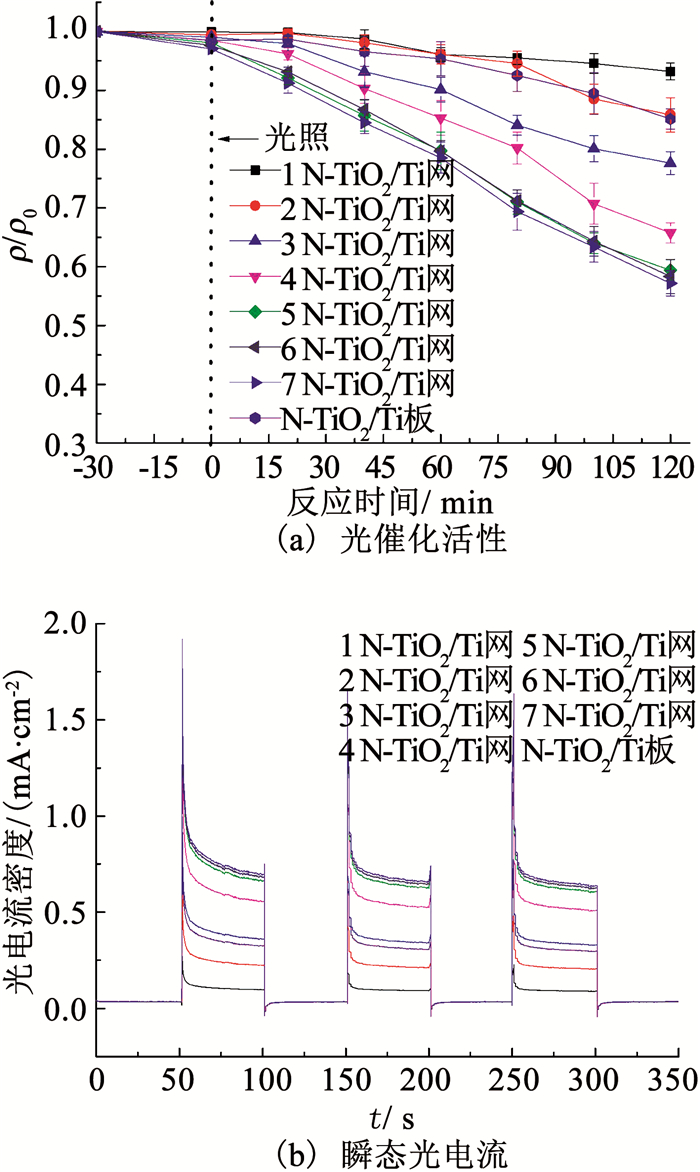
经计算得出,钛网的开孔面积约占总面积的70%,即同尺寸的钛板可拉伸成至少3层钛网.由图 8(a)可以看出,3层叠加的N-TiO2/Ti网对DMP的降解率相比N-TiO2/Ti板提升了7.5%.这是因为钛网在拉伸过程中形成的网格结构相比钛板增加了内侧面积,其宏观受光表面积增大.此外,钛网自身的网格结构也允许光子可以透过并在反应体系内部发生反射、折射和散射等作用,将未利用的光子传递到远离光源的反应区,使光子-催化剂-污染物三者充分接触,进而使反应体系内的光捕集效率和污染物传质效率得到提升.由图 8(a)也可以看出,当N-TiO2/Ti网叠加至5层时,DMP的降解率从7.0 %提高到39.6 %,相比N-TiO2/Ti板提高了25.7 %.但当N-TiO2/Ti网的叠加层次由5层增加到7层时,DMP的降解率仅提升约2 %.这是因为随着叠加层次的提高,N-TiO2/Ti网之间的屏蔽效应增大,光辐射透过率也无法提高.
|
图 8 叠加层次对N-TiO2/Ti网的光催化活性和瞬态光电流的影响 Fig. 8 Effect of stacking level on photocatalytic activity and photocurrent of N-TiO2/Ti mesh |
为了进一步理解N-TiO2/Ti网的叠加对DMP降解效果的提升作用.图 8(b)比较了不同叠加层次下N-TiO2/Ti网瞬态光电流值.光电测试结果显示,随着叠加层次的增加,N-TiO2/Ti网的瞬态光电流逐渐增加,5层叠加后的瞬态光电流基本稳定,且N-TiO2/Ti板的瞬态光电流低于3层叠加的N-TiO2/Ti网,这与图 8(a)中N-TiO2/Ti网光催化降解DMP的结果一致.且在多次光源开闭状态下,N-TiO2/Ti网的瞬态光电流显示出了很好的重复性.因此,后续实验中以5层叠加的N-TiO2/Ti网对DMP进行光催化降解研究.
2.2.2 pH的影响pH与催化剂的表面电荷及污染物吸附性能相关,是影响光催化降解速率的重要因素[28].TiO2的等电点为pH=6.4,其电离状态见式(2)和(3)[29-30]:
| $ {\rm{TiOH + }}{{\rm{H}}^{\rm{ + }}} \leftrightarrow {\rm{TiOH}}_2^ + , $ | (2) |
| $ {\rm{TiOH + O}}{{\rm{H}}^{\rm{ - }}} \leftrightarrow {\rm{Ti}}{{\rm{O}}^ - } + {\rm{H_2}O}. $ | (3) |
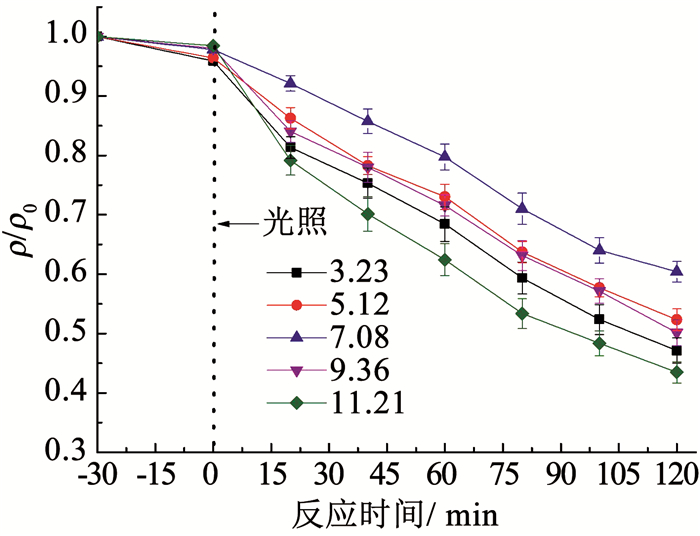
由图 9可以看出,当pH由7.08降至3.23时,DMP的降解率从39.6 %提高到52.9 %;当pH升至11.21时,DMP的降解率提高到56.5 %,这说明在偏酸或偏碱性条件均有利于DMP的降解.在酸性条件下,DMP被电离并形成带负电的物质,从而增强了在N-TiO2/Ti网表面的吸附作用,加快了光催化降解速率;而在碱性条件下降解率提高的原因是在高pH体系中,OH-与光生空穴会发生如下反应[31]:
| $ {\rm{O}}{{\rm{H}}^{\rm{ - }}} + {{\rm{h}}^ + } = \cdot {\rm{OH}}. $ | (31) |
|
图 9 初始pH对DMP降解效果的影响 Fig. 9 Effect of initial pH on the degradation of DMP |
使反应体系内产生了更多的·OH,因而DMP的降解率也得到提高.
2.2.3 外加H2O2的影响由图 10可以看出,单独的H2O2无法降解DMP,且Vis-LEDs + H2O2的体系也无法对DMP实现有效降解,这是因为H2O2只有在紫外光辐照下才会活化生成·OH[32].在H2O2加入前后的Vis-LEDs + N-TiO2/Ti网体系中,DMP的降解率从39.6 %提高到60.9 %.根据TiO2多相光催化反应机理可知,H2O2是比O2更好的电子受体[33].加入H2O2的光催化体系会发生如下反应[34]:
| $ {\rm{H_2}{O_2}} + {{\rm{e}}^ - } \to \cdot {\rm{OH}} + {\rm{OH}}. $ | (5) |
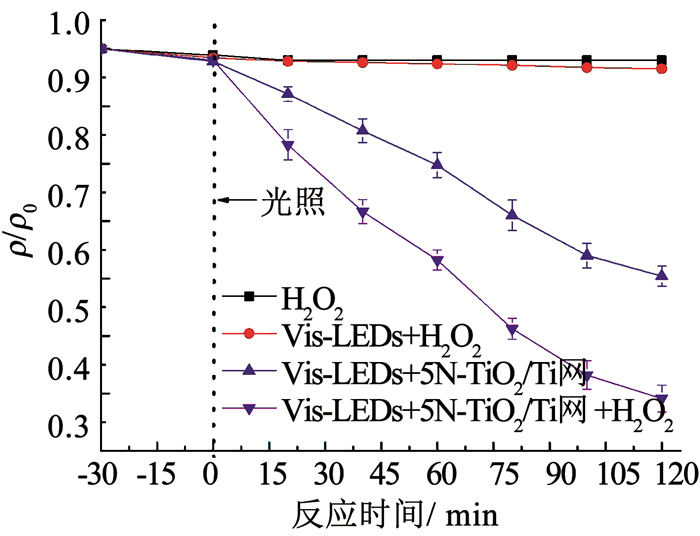
|
图 10 外加H2O2对DMP降解效果的影响 Fig. 10 Effect of H2O2 addition on the degradation of DMP |
H2O2作为电子受体不仅会减少电荷重组效应,而且自身接受电子后也会生成具有强氧化性的·OH,从而增强体系的光催化活性,加快对DMP的降解效率.
3 结论1) 采用一步阳极氧化法制备了N-TiO2/Ti网状光催化剂.N掺杂未引起TiO2纳米管表面形貌和晶型结构的显著改变;由Tauc/David-Mott公式计算得N-TiO2/Ti网的禁带宽度为2.76 eV,吸收带边红移至449 nm,相比未掺杂N元素TiO2/Ti网的可见光吸收性能明显增强.
2) 首次在光催化反应器内建立了三维叠加的N-TiO2/Ti网状光催化体系,并将Vis-LEDs应用于可见光催化降解研究中.N-TiO2/Ti板等价拉伸成3层叠加的N-TiO2/Ti网后,由于光捕集效率和污染物传质效率的增加,DMP的降解率提高了7.5%;当叠加5层N-TiO2/Ti网时,降解率趋于稳定,相比N-TiO2/Ti板对DMP的降解率提升了25.7%.
3) 偏酸或偏碱性条件下,均有利于DMP的降解;外加H2O2可以明显促进DMP的降解,表明H2O2是更好的电子受体,并分解产生羟基自由基.
| [1] |
JING W W, LI D Q, LI J, et al. Photodegradation of dimethyl phthalate (DMP) by UV-TiO2 in aqueous solution: Operational parameters and kinetic analysis[J]. International Journal of Environmental Science and Technology, 2018, 15(5): 969. DOI:10.1007/s13762-017-1471-3 |
| [2] |
FERGUSON K K, MCELRATH T F, CHEN Y, et al. Urinary phthalate metabolites and biomarkers of oxidative stress in pregnant women: A repeated measures analysis[J]. Environmental Health Perspectives, 2015, 123(3): 210. DOI:10.1289/ehp.1307996 |
| [3] |
JING Y, LI L, ZHANG Q, et al. Photocatalytic ozonation of dimethyl phthalate with TiO2 prepared by a hydrothermal method[J]. Journal of Hazardous Materials, 2011, 189(1/2): 40. DOI:10.1016/j.jhazmat.2011.01.132 |
| [4] |
PADIYAN D P, RAJA D H. Synthesis of various generations titania nanotube arrays by electrochemical anodization for H2 production[J]. Energy Procedia, 2012, 22: 88. DOI:10.1016/j.egypro.2012.05.215 |
| [5] |
ETACHERI V, SEERY M K, HINDER S J, et al. Highly visible light active TiO2-xNx heterojunction photocatalysts[J]. Chemistry of Materials, 2010, 22(13): 3843. DOI:10.1021/cm903260f |
| [6] |
ASAHI R, MORIKAWA T, IRIE H, et al. Nitrogen-doped titanium dioxide as visible-light-sensitive photocatalyst: Designs, developments, and prospects[J]. Chemical Reviews, 2014, 114(19): 9824. DOI:10.1021/cr5000738 |
| [7] |
DEVI L G, KAVITHA R. A review onnon metal ion doped titania for the photocatalytic degradation of organic pollutants under UV/solar light: Role of photogenerated charge carrier dynamics in enhancing the activity[J]. Applied Catalysis B: Environmental, 2013, 140: 559. DOI:10.1016/j.apcatb.2013.04.035 |
| [8] |
LIU Z, ZHANG Q, ZHAO T, et al. 3-D vertical arrays of TiO2 nanotubes on Ti meshes: Efficient photoanodes for water photoelectrolysis[J]. Journal of Materials Chemistry, 2011, 21(28): 10354. DOI:10.1039/c1jm11072a |
| [9] |
LIAO J, LIN S, ZHANG L, et al. Photocatalytic degradation of methyl orange using a TiO2/Ti mesh electrode with 3D nanotube arrays[J]. ACS Applied Materials & Interfaces, 2012, 4(1): 171. DOI:10.1021/am201220e |
| [10] |
KIM H G, CUONG T V, NA M G, et al. Improved GaN-based LED light extraction efficiencies via selective MOCVD using peripheral microhole arrays[J]. IEEE Photonics Technology Letters, 2008, 20(13-16): 1284. DOI:10.1109/LPT.2008.926870 |
| [11] |
DENG X, LIU J, LI X, et al. Kinetic study on visible-light photocatalytic removal of formaldehyde from air overplasmonic Au/TiO2[J]. Catalysis Today, 2017, 281(3): 630. DOI:10.1016/j.cattod.2016.05.014 |
| [12] |
ZHANG X, LIU Q. Visible-light-induced degradation of formaldehyde over titania photocatalyst co-doped with nitrogen and nickel[J]. Applied Surface Science, 2008, 254(15): 4780. DOI:10.1016/j.apsusc.2008.01.094 |
| [13] |
SONG K, MOHSENI M, TAGHIPOUR F. Application of ultraviolet light-emitting diodes (UV-LEDs) for water disinfection: A review[J]. Water Research, 2016, 94: 341. DOI:10.1016/j.watres.2016.03.003 |
| [14] |
IBRAHIM M A S, MACADAM J, AUTIN O, et al. Evaluating the impact of LED bulb development on the economic viability of ultraviolet technology for disinfection[J]. Environmental Technology, 2014, 35(4): 400. DOI:10.1080/09593330.2013.829858 |
| [15] |
JULKAPLI N, BAGHERI S, ABD HAMID S B. Recent advances in heterogeneous photocatalytic decolorization of synthetic dyes[J]. Scientific World Journal, 2014(692307). DOI:10.1155/2014/692307 |
| [16] |
RUSTOMJI C S, FRANDSEN C J, JIN S, et al. Dye-sensitized solar cell constructed with titanium mesh and 3-D array of TiO2 nanotubes[J]. American Chemical Society, 2010, 114: 14537. DOI:10.1021/jp102299g |
| [17] |
李向清, 康诗钊, 唐韵秋, 等. 碳掺杂的二氧化钛纳米管的制备及其可见光催化性能[J]. 应用化学, 2013(2): 178. LI X, KANG S, TANG Y, et al. Preparation and visible light photocatalytic activity of carbon doped titanium dioxide nanotubes[J]. Chinese Journal of Applied Chemistry, 2013(2): 178. |
| [18] |
ANTONY R P, MATHEWS T, AJIKUMAR P K, et al. Electrochemically synthesized visible light absorbing vertically aligned N-doped TiO2 nanotube array films[J]. Materials Research Bulletin, 2012, 47(12): 4491. DOI:10.1016/j.materresbull.2012.09.061 |
| [19] |
BISWAS S, SHAHJAHAN M, HOSSAIN M F, et al. Synthesis of thick TiO2 nanotube arrays on transparent substrate by anodization technique[J]. Electrochemistry Communications, 2010, 12(5): 668. DOI:10.1016/j.elecom.2010.03.002 |
| [20] |
SATHISH M, VISWANATHAN B, VISWANATH R P, et al. Synthesis, characterization, electronic structure, and photocatalytic activity of nitrogen-doped TiO2 nanocatalyst[J]. Chemistry of Materials, 2005, 17(25): 6349. DOI:10.1021/cm052047v |
| [21] |
WANG C, WANG M, XIE K, et al. Room temperature one-step synthesis of microarrays of N-doped flower-like anatase TiO2 composed of well-defined multilayer nanoflakes by Ti anodization[J]. Nanotechnology, 2011, 22(30560730). DOI:10.1088/0957-4484/22/30/305607 |
| [22] |
MAZIERSKI P, NISCHK M, GOLKOWSKA M, et al. Photocatalytic activity of nitrogen doped TiO2 nanotubes prepared by anodic oxidation: The effect of applied voltage, anodization time and amount of nitrogen dopant[J]. Applied Catalysis B: Environmental, 2016, 196: 77. DOI:10.1016/j.apcatb.2016.05.006 |
| [23] |
徐英操, 尤宏. 阳极氧化与化学放氮气结合的一步法N掺杂TiO2纳米管的制备、表征及光催化活性[J]. 功能材料, 2015(10): 10110. XU Y, YOU H. Preparation, characterization and photocatalytic activity of N doped TiO2 by nodic oxidation combination with chemical reaction release N2[J]. Journal of Functional Materials, 2015(10): 10110. |
| [24] |
AUGUSTYNSKI J. The role of the surface intermediates in the photoelectrochemical behaviour of anatase and rutile TiO2[J]. Electrochimica Acta, 1993, 38(1): 43. DOI:10.1016/0013-4686(93)80008-N |
| [25] |
MURPHY A. Band-gap determination from diffuse reflectance measurements of semiconductor films, and application to photoelectrochemical water-splitting[J]. Solar Energy Materials and Solar Cells, 2007, 91(14): 1326. DOI:10.1016/j.solmat.2007.05.005 |
| [26] |
SENTHIL R A, THEERTHAGIRI J, SELVI A, et al. Synthesis and characterization of low-cost g-C3N4/TiO2 composite with enhanced photocatalytic performance under visible-light irradiation[J]. Optical Materials, 2017, 64: 533. DOI:10.1016/j.optmat.2017.01.025 |
| [27] |
ASAHI R, MORIKAWA T, OHWAKI T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293(5528): 269. DOI:10.1126/science.1061051 |
| [28] |
WANG Y Z. Solar photocatalytic degradation of eight commercial dyes in TiO2 suspension[J]. Water Research, 2000, 34(3): 990. DOI:10.1016/S0043-1354(99)00210-9 |
| [29] |
LI X Z, LI F B, FAN C M, et al. Photoelectrocatalytic degradation of humic acid in aqueous solution using a Ti/TiO2 mesh photoelectrode[J]. Water Research, 2002, 36(9): 2215. DOI:10.1016/S0043-1354(01)00440-7 |
| [30] |
NATARAJAN T S, THOMAS M, NATARAJIAN K, et al. Study on UV-LED/TiO2 process for degradation of Rhodamine B dye[J]. Chemical Engineering Journal, 2011, 169(1-3): 126. DOI:10.1016/j.cej.2011.02.066 |
| [31] |
PULIDO M E, GONZALEZ D O, DONA R J M, et al. Adsorption and photocatalytic degradation of 2, 4-dichlorophenol in TiO2 suspensions. Effect of hydrogen peroxide, sodium peroxodisulphate and ozone[J]. Applied Catalysis A-General, 2013, 455: 227. DOI:10.1016/j.apcata.2013.02.007 |
| [32] |
MOUSSET E, HUANG W V, FOONG Y K B, et al. A new 3D-printed photoelectrocatalytic reactor combining the benefits of a transparent electrode and the Fenton reaction for advanced wastewater treatment[J]. Journal of Materials Chemistry A, 2017, 5(47): 24951. DOI:10.1039/C7TA08182K |
| [33] |
MURUGANANDHAM M, SWAMINATHAN M. Solar photocatalytic degradation of a reactive azo dye in TiO2-suspension[J]. Solar Energy Materials and Solar Cells, 2004, 81(4): 439. DOI:10.1016/j.solmat.2003.11.022 |
| [34] |
COLEMAN H M, VIMONSES V, LESLIE G, et al. Degradation of 1, 4-dioxane in water using TiO2 based photocatalytic and H2O2/UV processes[J]. Journal of Hazardous Materials, 2007, 146(3SI): 496. DOI:10.1016/j.jhazmat.2007.04.049 |
 2019, Vol. 51
2019, Vol. 51


