硝基芳香烃类化合物中硝基的存在使其具有较强的生物降解抗性[1].对硝基苯酚(p-nitrophenol,PNP)可能是其中最重要的单硝基酚,每年的用量很大[2],常被用作农药、医药、染料等精细化学品的中间体,对植物、动物和人类都有毒害,由于其具有三致作用而成为优先处理污染物[3],因此,含PNP废水在排放之前需要被处理.利用生物电化学系统(bioelectrochemical system,BES)处理PNP在目前处理技术中具有很大的潜力[4].BES技术是利用具有电化学活性的微生物催化在阳极或阴极上的氧化或还原反应,近十年来获得了广泛的关注[5-6].目前,BES被认为是一种有效且低成本的去除各种污染物的技术[7].相对于物理化学和生物学方法,生物阴极BES应用于PNP处理具有高效率、低成本等优点引起关注[8-9].
很多环境因素影响BES的性能,外加电压能够改变BES中阴极电势,目前在BES降解PNP的研究中,电极电势通常设定为固定值[4].已有研究表明,在MEC生物合成磷化氢过程中,适宜的电势可提高相关酶的活性,促进生物合成[10].一定强度的电流有利于生物膜的生成,但过高电流会导致细胞膜的破裂[11].外加电压对促进BES降解PNP起着重要的作用[12].磷酸盐缓冲液(phosphate buffer solution, PBS)在BES中能够提供导电性并保证pH稳定,在双室反应器中更加重要[13-14].外电阻改变能够改变BES中平均电流[15].目前PBS浓度和外电阻对Bioc-BES降解PNP的研究仍然缺乏.
为了提高生物阴极BES对PNP的降解,需要进一步优化运行参数.本研究中利用葡萄糖作为共基质,在双室反应器中考察外加电压、PBS浓度和外电阻对PNP去除的影响,找到PNP去除率和外加电压、PBS浓度和外电阻之间的关系,为生物阴极BES在PNP处理实际工程应用中的高效运行提供理论依据.
1 实验 1.1 反应器构型及实验设计双室BES系统(Bioc-BES)由H型有机玻璃反应器构成,以阳离子交换膜分隔(CMI7000, Membranes International Inc., USA).碳刷作为电极,由铜导线连接10 Ω电阻形成闭合电路,外加电压0.5 V,接种生活污水(哈尔滨文昌污水处理厂)于阳极室和阴极室启动反应器.参比电极(0.247 V VS SHE,上海雷磁,中国)固定于阴极室记录阴极电势变化.
反应器以fed-batch模式启动,阳极以乙酸钠为碳源,阴极以葡萄糖为碳源并加入20 mg/L PNP为目标物,以生活污水为菌源同时启动反应器阴极和阳极.每3 d更换阳极和阴极培养液.所有的测试都是用1个batch循环来操作的,两次更换PNP模拟废水之间的运行过程为1个batch,阳极和阴极培养液同时更换.接种3周后,当反应器阴极电势达到-0.9 V、电流达到1 mA时表示启动成功,PNP在BES系统被还原成对氨基苯酚(p-aminophenol,PAP)[12].使用HPLC-MS对PNP降解产物进行分析,降解产物为对氨基苯酚(PAP).
在PNP质量浓度为50 mg/L、PBS浓度为50 mmol/L、外电阻为10 Ω条件下,外加电压调整为0.2, 0.3, 0.4, 0.5, 0.6 V,测定PNP质量浓度和PAP质量浓度.每个设定稳定运行12 h后开始实验.PBS浓度对PNP去除影响实验设定PBS浓度为10, 25, 50, 100, 200 mmol/L,测定PNP质量浓度和PAP质量浓度,PNP初始质量浓度30 mg/L,外电阻为10 Ω.外电阻对PNP去除影响设定外电阻为1, 50和100 Ω.PNP初始质量浓度为30 mg/L,PBS浓度为50 mmol/L.每个设定稳定运行12 h后开始实验.每组实验重复3次,培养温度为(25±2)℃.
1.2 模拟PNP废水阴极培养液采用PNP模拟废水,将PNP、葡萄糖(1 g/L)溶于50 mmol/L PBS(KCl 0.13 g/L,NH4Cl 0.31 g/L,Na2HPO4 4.58 g/L,NaH2PO4 2.45 g/L)中,加入维生素母液5 mL/L,微量元素母液12.5 mL/L;阳极室营养液为1.68 g/L乙酸钠、维生素母液和微量元素母液溶于50 mmol/L PBS中.
1.3 分析方法PNP质量浓度测定和PAP质量浓度测定采用高效液相色谱法(model-e2695, Waters Co., USA)[12].PNP降解速率方程为ρ=ρ0e-kt.PAP生成速率方程为ρ=ρ0(1-e-kt).其中ρ(mg/L)代表PNP或PAP随时间(h)的质量浓度,ρ0(mg/L)是初始PNP质量浓度或者能够转化的PAP理论值,PNP降解速率常数和PAP生成速率常数k(h-1)计算通过软件Origin 9.0完成.
阴极电势和外电阻两端电压由数据记录仪自动采集保存(Keithley Co., Ltd.,USA),间隔时间10 min.电流密度计算通过欧姆定律以300 mL体积计算获得.PNP去除率通过进水和出水浓度的差值进行计算,PAP生成率通过理论最大值和实际值进行计算.
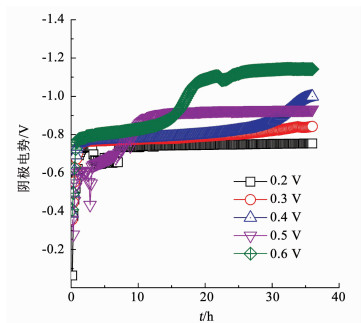
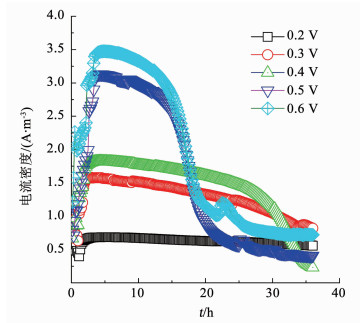
2 结果及讨论 2.1 外加电压对Bioc-BES降解PNP的影响外加电压由0.2 V升高到0.6 V,稳定阴极电势由-0.75 V降低至-1.14 V(图 1),这表明阴极还原PNP能力增强.外加电压为0.6 V时的阴势电势出现了波动,说明阴极生物膜在0.6 V电压下,其生物活性受到了电压的影响.电流密度随着外加电压的升高而升高(图 2),在反应结束时达到稳定,外加电压为0.6 V时,生物阴极电流密度达到最高值3.47 A/m3.阳极室中基质乙酸钠的转化率差别不大.
|
图 1 不同外加电压(0.2~0.6 V)时BES阴极电势 Fig. 1 Cathode potential under different applied voltages(0.2-0.6 V) |
|
图 2 不同外加电压(0.2~0.6 V)时BES电流密度 Fig. 2 Current density under different applied voltages(0.2-0.6 V) |
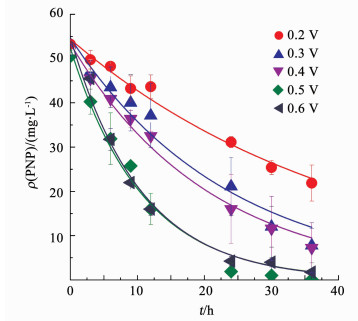
PNP降解速率常数随着外加电压的增加而增加(图 3).外加电压由0.2 V升高到0.6 V时,PNP降解速率常数由(0.024±0.005)h-1升高到(0.098± 0.001)h-1,36 h时其PNP去除率由58.9%升高到96.6%.尤其注意的是外加电压为0.5 V时PNP降解速率常数为(0.096±0.002)h-1,与0.6 V((0.098±0.001)h-1)时无显著差别.已有研究表明,在高电压下微生物的细胞膜受到破坏,导致生长和新陈代谢缓慢,抑制了生物阴极的效率[16],因此,0.5 V是本研究中PNP降解最佳的运行电压.
|
图 3 不同外加电压下Bioc-BES对PNP降解 Fig. 3 PNP degradation under different applied voltages |
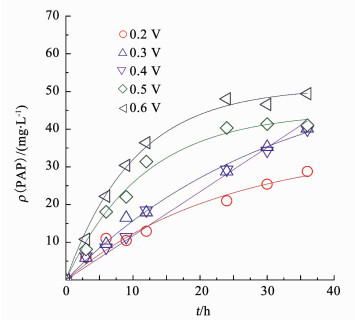
PAP的生成也符合一级反应动力学方程.随着外加电压由0.2 V升高到0.6 V,还原产物PAP的生成速率常数由(0.023±0.001)h-1升高到(0.098± 0.007)h-1(图 4),0.5 V时PAP的生成速率常数为(0.086±0.009)h-1,比PNP降解速率常数低,这说明外加电压的升高有利于PAP的生成.考虑到阴极电势变化趋势,可以推测出在生物阴极BES中,合适的外加电压能够提高PNP的处理效率,过高的外加电压会抑制阴极微生物的活性.外加电压的增加导致了阴极电位的降低,不同的阴极电位影响阴极生物电化学效率并形成了不同阴极生物群落结构[6].而在较低的阴极电位下(外加电压0.6 V)PNP还原反应速率较快,产生的原因可能为高的外加电压提高了系统中电子转移速率,因而促进了PNP还原速率.
|
图 4 不同外加电压下Bioc-BES PAP生成 Fig. 4 PAP formation under different applied voltages |
PBS缓冲溶液对BES系统的稳定运行发挥了重要的作用,不仅稳定pH,并且提供足够的电导率保证氢质子的交换,实现电极之间的氧化还原反应.此BES系统在PNP质量浓度为35 mg/L、葡萄糖质量浓度为0.5 g/L条件下,PBS浓度由10 mmol/L增加到200 mmol/L时,阴极电势呈下降趋势,PBS浓度越高,阴极电势越低(图 5).阴极电势改变说明阴极生物膜活性受到了PBS浓度的影响.
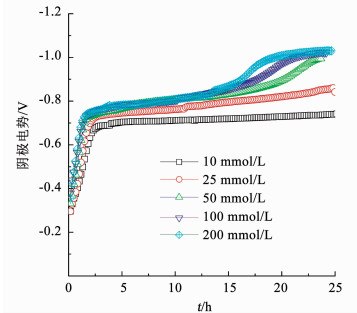
|
图 5 PBS浓度对Bioc-BES阴极电势的影响 Fig. 5 Effects of PBS concentration on cathode potential |
PNP去除率与PAP生成率均随PBS浓度的升高而分别由(65.2±7.2)%和(73.1±8.4)%提高到(93.6±1.6)%和(93.5±5.6)%.PNP降解速率常数由(0.039±0.004)h-1增加到(0.071±0.011)h-1 (图 6).PNP的降解速率在10与25 mmol/L PBS条件下统计学上无明显差异(P>0.05),PAP的生成率在50,100及200 mmol/L PBS条件下统计学上无明显差异(P>0.05).而10,25 mmol/L PBS时的PNP生成率与50,100, 200 mmol/L PBS条件下的PNP生成率两两比较均有显著差异(P < 0.05).这些结果表明,过高或过低的电导率或限制BES性能[17],本研究中最适PBS浓度为50 mmol/L.
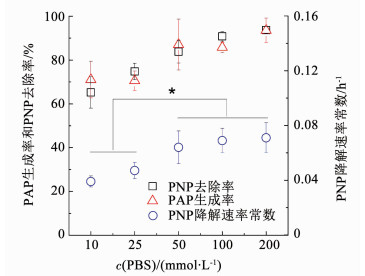
|
图 6 PBS浓度对Bioc-BES PNP降解的影响 Fig. 6 Effects of PBS concentration on PNP removal |
图 7表明外电阻在1, 50和100 Ω时,阴极电势几乎没有变化,而电流密度则随着外电阻增加而减小,且在外电阻较大时(100 Ω),电流比较平稳.而PNP降解速率常数分别为(0.068±0.008), (0.066± 0.009)和(0.071±0.011) h-1,24 h时PAP生成率为(97.9±0.6)%, (97.0±1.0)%和(96.5±1.1)%(图 8).这表明外电阻在1~100 Ω范围内对PNP去除速率常数和PAP生成率几乎无显著影响.
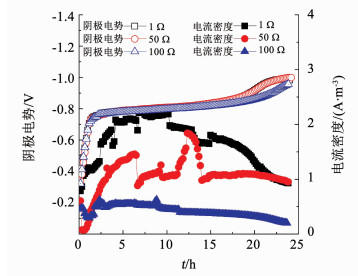
|
图 7 外电阻对阴极电势和电流密度的影响 Fig. 7 Effects of external resistance on cathode potential and current density |
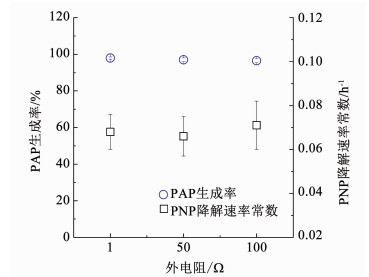
|
图 8 外电阻对PNP降解的影响 Fig. 8 Effects of external resistance on PNP removal |
在以前研究中,以碳酸氢钠作为碳源时(0.5 V外加电压,50 mg/L PNP)PNP降解速率常数为(0.029 78±0.003 39)h-1[12].本研究中以葡萄糖为碳源时(0.5 V外加电压,50 mg/L PNP)PNP降解速率常数升高了约3倍.这表明葡萄糖能够促进PNP的降解.葡萄糖的存在不仅作为碳源为阴极生物膜生长代谢提供足够的能量,更能产生更多的电子以供PNP还原.碳源不同导致阴极生物膜的不同,葡萄糖为碳源时比以碳酸氢钠为碳源时能富集到更多的有利于硝基芳香烃类还原的微生物群落[5],因此,葡萄糖的存在促进了PNP在生物阴极BES中的还原.
3 结论1) 外加电压影响了生物阴极对PNP的生物电化学还原和产物PAP的生成效率.随着外加电压的升高,PNP降解速率和PAP生成速率随着升高.生物阴极BES去除PNP的最佳运行参数为外加电压0.5 V.
2) PBS浓度影响PNP在BES中还原,最佳PBS浓度为50 mmol/L.葡萄糖的存在促进了PNP的还原.
| [1] |
SUJA E, NANCHARAIAH E Y V, VENUGOPALAN V P. p-Nitrophenol biodegradation by aerobic microbial granules[J]. Applied Biochemistry and Biotechnology, 2012, 167: 1569. DOI:10.1007/s12010-012-9594-y |
| [2] |
SAHOO N K, PAKSHIRAJAN K, GHOSH P K. Biodegradation of p-nitrophenol using arthrobacter chlorophenolicus A6 in a novel upflow packed bed reactor[J]. Journal of Hazardous Materials, 2011, 190: 729. DOI:10.1016/j.jhazmat.2011.03.106 |
| [3] |
KUSCUÖ S, SPONZA D T. Performance of anaerobic baffled reactor (ABR) treating synthetic wastewater containing p-nitrophenol[J]. Enzyme and Microbial Technology, 2005, 36(7): 888. DOI:10.1016/j.enzmictec.2005.01.001 |
| [4] |
SHEN J Y, FENG C C, ZHANG Y Y, et al. Bioelectrochemical system for recalcitrant p-nitrophenol removal[J]. Journal of Hazardous Materials, 2011, 209/210: 516. DOI:10.1016/j.jhazmat.2011.12.065 |
| [5] |
LIANG B, CHENG H Y, NOSTRAND J D V, et al. Microbial commol/Lunity structure and function of nitrobenzene reduction biocathode in response to carbon source switchover[J]. Water Research, 2014, 54: 137. DOI:10.1016/j.watres.2014.01.052 |
| [6] |
KONG D Y, YUN H, CUI D, et al. Response of antimicrobial nitrofurazone-degrading biocathode commol/Lunities to different cathode potentials[J]. Bioresource Technology, 2017, 241: 951. DOI:10.1016/j.biortech.2017.06.056 |
| [7] |
YUN H, KONG D Y, LIANG B, et al. Response of anodic bacterial commol/Lunity to the polarity inversion for chloramphenicol reduction[J]. Bioresource Technology, 2016, 221: 666. DOI:10.1016/j.biortech.2016.09.047 |
| [8] |
SHEN J Y, XU X P, JIANG X B, et al. Coupling of a bioelectrochemical system for p-nitrophenol removal in an upflow anaerobic sludge blanket reactor[J]. Water Research, 2014, 67: 11. DOI:10.1016/j.watres.2014.09.003 |
| [9] |
LOU S, JIANG X B, CHEN D, et al. Enhanced p-nitrophenol removal in a membrane-free bio-contact coupled bioelectrochemical system[J]. Rsc Advances, 2015, 5(34): 27052. DOI:10.1039/C4RA17218C |
| [10] |
LIU W, NIU X J, CHEN W Y, et al. Effects of applied potential on phosphine formation in synthetic wastewater treatment by microbial electrolysis cell (MEC)[J]. Chemosphere, 2017, 173: 172. DOI:10.1016/j.chemosphere.2017.01.006 |
| [11] |
WANG K, SHENG Y X, CAO H B, et al. Impact of applied current on sulfate-rich wastewater treatment and microbial biodiversity in the cathode chamber of microbial electrolysis cell (MEC) reactor[J]. Chemical Engineering Journal, 2017, 307: 150. DOI:10.1016/j.cej.2016.07.106 |
| [12] |
WANG X Y, XING D F, REN N Q. p-Nitrophenol degradation and microbial commol/Lunity structure in a biocathode bioelectrochemical system[J]. RSC Advances, 2016, 6: 89821. DOI:10.1039/c6ra17446a |
| [13] |
ROZENDAL R A, HAMELERS H V M, BUISMAN C J N. Effects of membrane cation transport on pH and microbial fuel cell performance[J]. Environmental Science & Technology, 2006, 40: 5206. DOI:10.1021/es060387 |
| [14] |
SLEUTELS T H J A, LODDER R, HAMELERS H V M, et al. Improved performance of porous bio-anodes in microbial electrolysis cells by enhancing mass and charge transport[J]. International Joural of Hydrogen Energy, 2009, 34: 9655. DOI:10.1016/j.ijhydene.2009.09.089 |
| [15] |
LIANG P, WU W L, WEI J C, et al. Alernate charging and discharging of capacitor to enhance the electron production of bioelectrochemical systems[J]. Environmental Science & Technology, 2011, 45(15): 6647. DOI:10.1021/es200759v |
| [16] |
DING A Q, YANG Y, SUN G D, et al. Impact of applied voltage on methane generation and microbial activities in an anaerobic microbial electrolysis cell (MEC)[J]. Chemical Engineering Journal, 2016, 283: 260. DOI:10.1016/j.cej.2015.07.054 |
| [17] |
GU Y, FENG H J, YING X B, et al. Effects of electrolyte conductivity on power generation in bio-electrochemical systems[J]. Ionics, 2017, 23: 2069. DOI:10.1007/s11581-017-2047-4 |
 2019, Vol. 51
2019, Vol. 51


