2. 三峡库区生态环境教育部重点实验室(重庆大学),重庆 400045;
3. 济南历下控股集团有限公司,济南 250102
2. Key laboratory of the Three Gorges Reservoir Region's Environment, Ministry of Education (Chongqing University), Chongqing 400045, China;
3. Jinan Holding Group of Lixia Distract Co., Ltd., Jinan 250102, China
卡马西平(C15H12N2O)是一种二苯并二氮杂衍生物,结构式如图 1,作为一种典型的抗癫痫和精神类有机药物,在全球范围内被广泛使用.但是,卡马西平需要通过芳环的羟基化和氨甲酰基部分的N-葡糖醛酸化才能失活[1],且相对极性的卡马西平分子难以吸附到土壤和沉积物上[2],因此,卡马西平及其代谢产物性质稳定、具有持久性.据统计,卡马西平的全球年均消耗量约1 014 t,其中约28%通过排泄的方式未经分解直接排入环境.污水处理厂中传统工艺对卡马西平去除率通常低于10%[3],污水处理厂出水(< 6.3 μg/L)、地表水(< 1.1 μg/L)甚至饮用水(< 30 ng/L)中已经频频检测出卡马西平的存在[4].随着卡马西平及其代谢产物不断地进入水环境并形成普遍性累积,长时间作用于水生生态系统,会对水生物和人类健康造成持久性的危害[5].因此,探究可以与常规工艺相配合、高效且经济的水处理工艺将其彻底降解尤为重要.
|
图 1 卡马西平结构式 Fig. 1 Structural graph of carbamazepine |
基于硫酸根自由基的新型高级氧化技术在水处理领域得到大量的研究应用,对水中难降解有机物质的去除展现出巨大的潜力[6].与传统高级氧化技术中的羟基自由基相比,硫酸根自由基半衰期为30~40 μs,远大于羟基自由基的半衰期[7-8],具有优质的传质效率.目前,对于活化过硫酸盐产生硫酸根自由基展开了大量研究,活化方式包括:热[9]、紫外[10]、过渡金属[11]、矿石[12]、超声波[13]、活性炭[14]以及电化学活化[15].其中活性炭活化和电化学活化是两种具有很好前景的活化方式,但都存在一些限制因素.电化学活化过硫酸盐技术存在对水中低浓度难降解有机污染物的去除效果不够理想、电极和过硫酸盐的传质面积有限、容易发生将H+还原为H2的副反应等问题.而活性炭活化过硫酸盐虽然具有一定成效,但许多研究显示其作为产生强氧化剂的催化剂在长期使用中出现表面催化基团会被氧化破坏、催化活性降低、活性炭使用寿命短等问题[16-18].两者结合的外加电流阴极保护强化ACF激活过硫酸盐有可能实现互补作用,ACF能增大电极与过硫酸盐的接触面积,同时对低浓度有机物的吸附聚集作用有利于提高对低浓度有机物的氧化效率;而外加电流阴极电子补偿能够保护ACF表面催化基团免受氧化破坏,同时实现电和ACF激活过硫酸盐降解有机污染物.
本研究以外加电流阴极保护强化ACF激活PDS体系去除水中卡马西平,对比了其与不同处理工艺的降解过程,探索PDS初始浓度、电压、初始pH等对体系的影响,并分析其降解机制.
1 实验实验中卡马西平、过硫酸钠、乙醇、叔丁醇均为分析纯级,溶液采用超纯水配制;高效液相色谱仪(Waters2487),美国Waters公司;双束场发射扫描电子显微镜系统(AURIGA),德国Zeiss公司.
实验在无隔膜电化学反应器中进行,实验装置如图 2所示,圆柱形反应器,高12 cm,直径10 cm,底部有磁子搅拌.阳极采用钛镀铂材料,阴极为活性炭纤维材料,用钛丝固定在钛镀铂电极上;电极尺寸均为5 cm×3.5 cm×0.1 cm,阴阳极的间距为1 cm.

|
图 2 反应器示意 Fig. 2 Schematic diagram of reactor |
采用超纯水配制卡马西平溶液,在无特殊说明的情况下,温度为25 ℃,卡马西平质量浓度为10 mg/L,过硫酸钠浓度为0.1 mol/L,pH为3,电压为6 V.
卡马西平质量浓度通过高效液相色谱仪测定,使用C18色谱柱,流动相为体积比6: 4的乙腈/水混合液,流速1.0 mL/min,色谱柱温度35 ℃,进样量为10 μL,检测波长286 nm.活性炭纤维电极的表面形貌通过扫描电镜表征,采用CuKα射线,加速电流为30 mA,电压为20 kV.
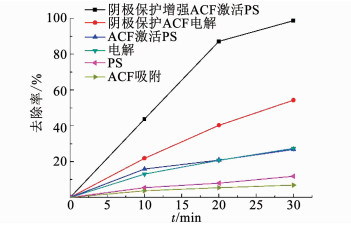
2 结果与讨论 2.1 外加电流阴极保护强化ACF激活PDS体系的促进效果考察了阴极保护强化ACF激活PDS体系、ACF激活PDS体系、阴极保护ACF电解体系、PDS体系、ACF吸附体系及电解体系对水中卡马西平的去除情况.如图 3所示,单独PDS、ACF吸附体系对卡马西平的降解率非常低,在反应30 min后降解率分别为11.6%, 6.9%,电解体系对卡马西平降解率达27.4%,而阴极保护强化ACF激活PDS体系中卡马西平的降解率高达98.8%,远高于ACF吸附体系、PDS体系以及电解体系等.其高效降解率可能是由于电、ACF与PDS共同作用增强了体系中硫酸根自由基和羟基自由基的产生.Saputra等[14]提出的ACF表面基团能够通过不定域π电子传递,将PDS激发生成氧化能力更强的硫酸根自由基,如式(1)、(2):
| $ \text{Carbon- }\pi\text{ +}{{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}\to \text{Carbon- }\pi^+{+\text{SO}_{4}^{-}\cdot}\text{ +SO}_{4}^{2-}, $ | (1) |
| $ {{\text{S}}_{2}}\text{O}_{8}^{2-}+{{\text{e}}^{\text{-}}}\to \text{SO}_{4}^{-}\cdot +\text{SO}_{4}^{2-}. $ | (2) |
|
图 3 不同工艺对卡马西平的去除效果 Fig. 3 Removal of carbamazepine by different processes |
本研究中ACF激活PDS体系的降解率为26.9%,高于两者单独效果的累加,可能是ACF一定程度上激发了PDS产生硫酸根自由基.而当在ACF激活PDS体系中ACF表面外加阴极电场时,电场和ACF可以同时促进羟基自由基和硫酸根自由基产生,实现自由基路径的氧化.根据已有研究,在电解体系中,有机污染物的氧化去除可以通过阳极直接氧化或者产生羟基自由基间接氧化实现,如式(3)[19]:
| $ {{\text{H}}_{2}}\text{O}\to \text{HO}\cdot \text{+}{{\text{H}}^{\text{+}}}+{{\text{e}}^{\text{-}}}. $ | (3) |
同时,在电场作用下,PDS在阴极获得电子激发硫酸根自由基,而且有可能在阳极实现PDS的再生,如式(4)[20]:
| $ 2\text{SO}_{4}^{2-}\to {{\text{S}}_{2}}\text{O}_{8}^{2-}+2{{\text{e}}^{\text{-}}}. $ | (4) |
此外,Song等[21]采用钛镀铂电极电激活PDS降解卡马西平发现,PDS在阳极的激活氧化作用比其在阴极产生自由基氧化作用更明显.PDS在阳极被激活为一种特殊的过渡态结构,从而充当电子供体实现对卡马西平的非自由基氧化,如式(5)、(6):
| $ \text{M-}{{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}\to \text{M*}{{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}, $ | (5) |
| $ \text{M*}{{\text{S}}_{\text{2}}}\text{O}_{8}^{2-}+\text{R+2}{{\text{e}}^{\text{-}}}\to \text{中间产物+2SO}_{4}^{2-}. $ | (6) |
M为阳极表面.这也可能是体系降解有机物的重要途径之一.此外,相比普通电极电解,阴极保护ACF电解体系对卡马西平的去除速率得到一定程度的提高,体现ACF吸附作用对较低浓度下卡马西平去除的促进作用.因此,外加电流阴极保护强化ACF激活PDS体系具有复杂的自由基和非自由基氧化路径,具有很好的研究应用前景.
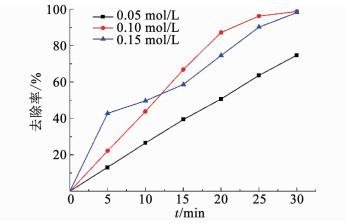
2.2 外加电流阴极保护强化ACF激活PDS体系的影响因素 2.2.1 PDS初始浓度对卡马西平降解的影响控制其他条件不变,考察了0.05, 0.10, 0.15 mol/L的PDS浓度对阴极保护强化ACF激活PDS体系氧化去除卡马西平的影响.如图 4所示,当PDS浓度由0.05 mol/L提升至0.10 mol/L,体系对卡马西平的降解效果有了明显提升,反应30 min时的降解率由74.8%提升至98.8%.然而当PDS浓度由0.10 mol/L提升至0.15 mol/L时,前5 min体系的卡马西平降解速率提高了近1倍,但是5 min后降解速率变缓,最终30 min时其对卡马西平的降解率没有显著变化.原因可能是PDS浓度达到一定程度时,过多的过硫酸盐离子和硫酸根自由基之间产生副反应,如式(7)、(8)[22]:
| $ \text{SO}_{4}^{-}\cdot +{{\text{S}}_{2}}\text{O}_{8}^{2-}\to {{\text{S}}_{2}}\text{O}_{8}^{-}\cdot +\text{SO}_{4}^{2-}, $ | (7) |
| $ \text{SO}_{4}^{-}\cdot +\text{SO}_{4}^{-}\cdot \to {{\text{S}}_{2}}\text{O}_{8}^{2-}, $ | (8) |
|
图 4 PDS初始浓度对去除卡马西平的影响 Fig. 4 Effect of initial PDS concentration on the removal of carbamazepine |
减弱了对卡马西平的氧化效率.Liu等[23]在电激发PDS体系降解四环素盐酸盐中也发现了类似的现象.
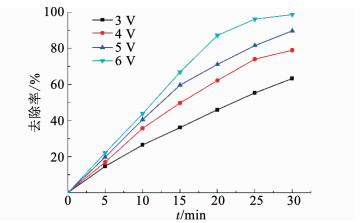
2.2.2 电压对卡马西平降解的影响在电化学过程中,电压一直被作为一个重要的影响变量,当电极电位大于6 V,阴极易发生析氢副反应.本次考察了在低于析氢电位下电压对阴极保护强化ACF激活PDS体系去除卡马西平的影响.如图 5所示,随着电压由4 V提升至6 V,卡马西平降解率由63.4%提高到98.8%.一方面,随着电压升高,电极两端的势能越大,电子密度越大,促进PDS在阴极通过电子转移发生氧化还原反应产生硫酸根自由基,如式(1)、(2);另一方面,电压的升高也有利于阳极直接氧化和PDS在阳极激发的过渡态结构的非自由基氧化.
|
图 5 电压对去除卡马西平的影响 Fig. 5 Effect of voltage on the removal of carbamazepine |
将溶液初始pH分别调节至3.0, 5.0, 7.0, 9.0, 11.0,探究其对阴极保护强化ACF激活PDS降解卡马西平的影响.结果如图 6所示,在pH=3的强酸性条件在,卡马西平去除效果最好,30 min降解率达98.78%;而在pH=11的强碱条件下,卡马西平的降解率最低.
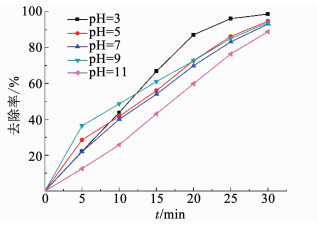
|
图 6 初始pH对去除卡马西平的影响 Fig. 6 Effect of pH on the removal of carbamazepine |
pH对体系的影响非常复杂,既能影响体系中自由基氧化剂的产生和转化同时影响污染物卡马西平的电荷性和活性炭纤维吸附作用.而由于阳极表面pH受溶液pH影响很小,pH对在阳极表面发生的氧化作用影响不明显[21].
卡马西平具有两级解离常数,在pH < 5时,呈现带正电态和分子态;而5 < pH < 12,呈分子态[24].在酸性条件下,卡马西平更倾向于带正电,有利于其在阴极活性炭纤维上吸附;同时酸性条件下PDS中的非对称O—O键断裂活化能降低[25],进而有利于其在阴极形成更多的硫酸根自由基,提高氧化效率.但有研究显示,在酸性条件下也有副反应发生, 如式(9)~(11)[26].
酸性条件:
| $ \text{SO}_{4}^{-}\cdot +{{\text{H}}_{2}}\text{S}{{\text{O}}_{\text{4}}}\to \text{HS}{{\text{O}}_{\text{4}}}\cdot +\text{HSO}_{4}^{-}, $ | (9) |
| $ {{\text{S}}_{2}}\text{O}_{8}^{2-}+{{\text{H}}^{+}}\to \text{H}{{\text{S}}_{2}}\text{O}_{8}^{-}, $ | (10) |
| $ \text{H}{{\text{S}}_{2}}\text{O}_{8}^{-}+{{\text{e}}^{\text{-}}}\to \text{SO}_{4}^{-}\cdot +{{\text{H}}^{+}}+\text{SO}_{4}^{2-}, $ | (11) |
影响自由基氧化,本实验结果与其不符,可能是由于其他有利因素抵消,或者硫酸根自由基与卡马西平快速反应.
在碱性条件下,一方面活性炭纤维对卡马西平的吸附能力减弱;另一方面,部分硫酸根自由基反应生成羟基自由基,如式(12)、(13).
中性及碱性条件:
| $ \text{SO}_{4}^{-}\cdot +{{\text{H}}_{2}}\text{O}\to \text{OH}\cdot \text{+SO}_{4}^{2-}+{{\text{H}}^{+}}, $ | (12) |
| $ \text{SO}_{4}^{-}\cdot +\text{O}{{\text{H}}^{-}}\to \text{OH}\cdot \text{+SO}_{4}^{2-}. $ | (13) |
羟基自由基和硫酸根自由基发生一系列中间自由基副反应, 如式(14)~(17).
间接自由基反应:
| $ \text{SO}_{4}^{-}\cdot +\text{OH}\cdot \to \text{HSO}_{5}^{-}, $ | (14) |
| $ \text{SO}_{4}^{-}\cdot +\text{HSO}_{5}^{-}\to \text{SO}_{5}^{-}\cdot +\text{HSO}_{4}^{-}, $ | (15) |
| $ \text{OH}\cdot +\text{HSO}_{5}^{-}\to \text{SO}_{5}^{-}\cdot +{{\text{H}}_{2}}\text{O, } $ | (16) |
| $ \text{OH}\cdot +{{\text{S}}_{2}}\text{O}_{8}^{2-}\to {{\text{S}}_{2}}\text{O}_{8}^{-}\cdot +\text{O}{{\text{H}}^{-}}. $ | (17) |
氧化卡马西平的硫酸根自由基和羟基自由基减少,同时,羟基自由基存在时间短于硫酸根自由基[8],传质效果不如硫酸根自由基.因此,碱性条件下卡马西平去除效果较差.
2.3 外加电流阴极保护增强ACF激活PDS体系的作用机制 2.3.1 外加电流对ACF激活PDS体系中ACF的影响活性炭作为一种绿色、高效的吸附剂和催化剂,被广泛地关注和研究.许多研究已经证实,活性炭能够催化臭氧、PDS等产生强氧化性的羟基自由基和硫酸自由基[14, 16, 27-29],但同时在反应过程中,活性炭容易遭到氧化破坏,导致其催化活性降低.Ania等[30]发现阴极电场对活性炭具有保护作用,在活性炭阴极的石墨层存在着一层网状电子,当含氧活性物质靠近时,活性物质获得电子变成氧化性较弱或者无氧化性的物质.因此,外加电场电流有可能实现对ACF的保护作用.研究对比了ACF激活PDS体系和阴极保护强化ACF激活PDS体系在ACF重复使用下降解能力变化.结果显示,当反应50次后,ACF激活PDS体系对卡马西平的氧化降解率从26.9%降低至11.7%,去除能力大幅下降;而经过100次反应后的阴极保护强化ACF激活PDS体系的氧化降解率由98.8%降低至97.3%%,与初次的氧化降解率相差甚微.
为了进一步说明两种体系在运行过程中对ACF性质影响的差异,对原始ACF(样品a)、在阴极保护强化ACF激活PDS体系重复反应100次的ACF(样品b)、在ACF激活PDS体系中重复反应50次的ACF(样品c)进行电镜扫描和酸碱官能团滴定.如图 7所示,ACF样品b表面依旧光滑,几乎没有破坏;但是样品c表面凹凸不平,说明其有可能在活化PDS产生硫酸根自由基的过程中被破坏.

|
图 7 ACF电镜扫描 Fig. 7 SEM of ACF |
对活性炭纤维样品a、b、c进行酸碱官能团滴定结果如图 8,相比原始ACF,样品b酸碱官能团没有发生显著的变化;而样品c酸性官能增加31%,碱性官能团减少到30%.
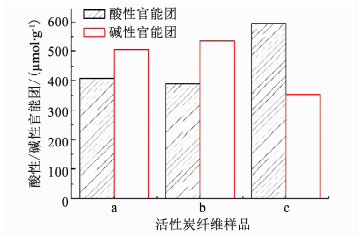
|
图 8 原始ACF、在阴极保护强化ACF激活PDS体系重复反应100次的ACF及在ACF激活PDS体系中重复反应50次的ACF的酸碱官能团 Fig. 8 Functional groups of the original ACF, ACF reacted in electrically protected and enhanced ACF activating PDS system for 100 times, and ACF reacted in ACF activating PDS system for 50 times |
上述结果表明,在多次重复反应后ACF激活PDS体系的ACF表面遭到破坏,酸碱官能团发生变化,催化能力降低;而在阴极保护增强ACF激活PDS体系中的ACF受到保护,经过多次重复利用,仍然保持较好的催化活性.因此,在ACF上施加阴极电场时使得ACF从一种促进剂转化为另一种催化剂[31],提高了反应体系中有机污染物的降解效率.
2.3.2 自由基捕获剂对降解卡马西平的影响前期许多研究表明,在阴极保护强化ACF激活PDS体系去除卡马西平过程中,可能是由硫酸根自由基或羟基自由基起主要作用的自由基氧化,也可能遵循非自由基氧化,需要进一步验证.自由基难以直接检测,但可以通过自由基捕获剂间接检测体系中自由基的存在.选择叔丁醇、甲醇两种自由基捕获剂进行实验研究,当反应溶液中分别加入5.0,10 mmol/L的叔丁醇时,阴极保护增强ACF激活PDS体系对卡马西平的降解率分别降低了0.9%和6.1%;而向反应溶液中分别加入5.0,10 mmol/L的甲醇时,体系对卡马西平的降解率分别降低了21.4%和26.2%,能够显著抑制该体系对卡马西平的去除.
甲醇能够同时与羟基自由基和硫酸根自由基快速反应,而叔丁醇与羟基自由基快速反应,但与硫酸根自由基的反应速度相对较慢[32-33].根据实验结果,甲醇对该体系降解卡马西平抑制作用明显,说明体系中可能存在硫酸根自由基或者羟基自由基;而叔丁醇的抑制程度很小,叔丁醇可以快速淬灭羟基自由基而不能快速淬灭硫酸根自由基,由此可以推测,在阴极保护增强ACF激发PDS体系中,硫酸根自由基起主导作用.本研究结果与Song等[22]提出的电激活PDS体系氧化卡马西平是以PDS在阳极的特殊过渡态结构非自由基氧化为主要途径的结论不同.这可能由于本研究采用了活性炭纤维阴极对卡马西平的吸附聚集和对PDS转化硫酸根自由基过程的增强作用,最终强化了卡马西平在阴极的降解效果(见图 9).因此,外加电流阴极保护强化ACF激活PDS技术结合了增强的阴极硫酸根自由基氧化和阳极PDS非自由基氧化,具有很好的应用前景.
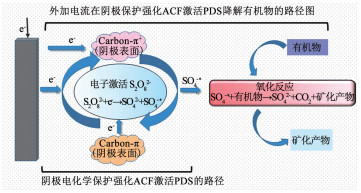
|
图 9 外加电流阴极保护强化ACF激活PDS氧化的主要路径 Fig. 9 Main oxidation route of electrically protected and enhanced ACF activating PDS system in cathode |
1) 阴极保护强化ACF激活PDS体系对卡马西平的降解率明显高于ACF激活PDS、电解等体系,具有明显的协同作用.
2) 在阴极保护强化ACF激活PDS体系中,存在一个适宜的PDS浓度,过高的PDS浓度反而对体系降解有机污染物起到抑制作用;电压的提高有利于激活PDS,提高体系对有机物的降解率;初始pH为碱性时不利于体系对污染物的降解.
3) 阴极保护强化ACF激活PDS体系中ACF经过上百次的重复使用后,依然保持性质稳定,体系去除效果稳定.阴极电场对ACF具有保护作用,可以避免PDS对其表面的氧化或破坏,从而大大延长其使用寿命.
4) 在阴极保护强化ACF激活PDS体系氧化降解有机物过程中,自由基氧化在体系中起着重要作用,而硫酸根自由基起主导作用.
| [1] |
KOSJEK T, ANDERSEN H R, KOMPARE B, et al. Fate of carbamazepine during water treatment[J]. Environmental Science & Technology, 2009, 43(16): 6256. |
| [2] |
SCHEYTT T, MERSMANN P, LINDSTÄDT R, et al. Determination of sorption coefficients of pharmaceutically active substances carbamazepine, diclofenac, and ibuprofen, in sandy sediments[J]. Chemosphere, 2005, 60(2): 245. DOI:10.1016/j.chemosphere.2004.12.042 |
| [3] |
ZHANG Yuqing, GEISSEN S, GAL C. Carbamazepine and diclofenac: Removal in wastewater treatment plants and occurrence in water bodies[J]. Chemosphere, 2008, 73(8): 1151. DOI:10.1016/j.chemosphere.2008.07.086 |
| [4] |
TERNES T A. Occurrence of drugs in German sewage treatment plants and rivers[J]. Water Research, 1998, 32(11): 3245. DOI:10.1016/S0043-1354(98)00099-2 |
| [5] |
PAXÉUS N. Removal of selected non-steroidal anti-inflammatory drugs (NSAIDs), gemfibrozil, carbamazepine, beta-blockers, trimethoprim and triclosan in conventional wastewater treatment plants in five EU countries and their discharge to the aquatic environment[J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 2004, 50(5): 253. DOI:10.2166/wst.2004.0335 |
| [6] |
陈晓旸, 薛智勇, 吴丹, 等. 基于硫酸自由基的高级氧化技术及其在水处理中的应用[J]. 水处理技术, 2009, 35(5): 16. CHEN Xiaoyang, XUE Zhiyong, WU Dan, et al. Advanced oxidation technology based on sulfuric acid free radicals and its application in water treatment[J]. Technology Water Treatment, 2009, 35(5): 16. DOI:10.16796/j.cnki.1000-3770.2009.05.005 |
| [7] |
MATTA R, TLILI S, CHIRON S, et al. Removal of carbamazepine from urban wastewater by sulfate radical oxidation[J]. Environmental Chemistry Letters, 2011, 9(3): 347. DOI:10.1007/s10311-010-0285-z |
| [8] |
OLMEZ-HANCI T, ARSLAN-ALATON I. Comparison of sulfate and hydroxyl radical based advanced oxidation of phenol[J]. Chemical Engineering Journal, 2013, 224(1): 10. |
| [9] |
马京帅, 吕文英, 刘国光, 等. 吉非罗齐在热活化过硫酸盐体系中的降解机制研究[J]. 环境科学学报, 2016, 36(10): 3774. MA Jingshuai, LV Wenying, LIU Guoguang, et al. Degradation mechanism of gemfibrozil in heat-activated persulfate oxidation process[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3774. DOI:10.13671/j.hjkxxb.2016.0064 |
| [10] |
SHU Hungyee, CHANG Mingchin, HUANG Shiwei. UV irradiation catalyzed persulfate advanced oxidation process for decolorization of Acid Blue 113 wastewater[J]. Desalination and Water Treatment, 2015, 54(4/5): 1013. |
| [11] |
高金龙, 马玉琳, 孟庆来, 等. 二价铁活化过硫酸盐降解土壤中十溴联苯醚[J]. 环境工程学报, 2016(12): 7339. GAO Jinlong, MA Yulin, MENG Qinglai, et al. Degradation of decabromodiphenyl ether in soil by sulfate activated with ferrous ions[J]. Chinese Journal of Environmental Engineering, 2016(12): 7339. DOI:10.12030/j.cjee.201507210 |
| [12] |
TEEL A L, AHMAD M, WATTS R J. Persulfate activation by naturally occurring trace minerals[J]. Journal of Hazardous Materials, 2011, 196(1): 153. |
| [13] |
QI Chengdu, LIU Xitao, LIN Chunye, et al. Degradation of sulfamethoxazole by microwave-activated persulfate: Kinetics, mechanism and acute toxicity[J]. Chemical Engineering Journal, 2014, 249: 6. DOI:10.1016/j.cej.2014.03.086 |
| [14] |
SAPUTRA E, MUHAMMAD S, SUN H, et al. Activated carbons as green and effective catalysts for generation of reactive radicals in degradation of aqueous phenol[J]. RSC Advances, 2013, 3(44): 21905. DOI:10.1039/c3ra42455c |
| [15] |
施周, 毕晨, 周石庆, 等. 铁电极活化过硫酸盐对金橙G的降解[J]. 环境工程学报, 2017, 11(3): 1335. SHI Zhou, BI Chen, ZHOU Shiqing, et al. Degradation of iron electrode as sodium persulfate activator for orange G[J]. Chinese Journal of Environmental Engineering, 2017, 11(3): 1335. DOI:10.12030/j.cjee.201511172 |
| [16] |
YANG Shiying, YANG Xin, SHAO Xueting, et al. Activated carbon catalyzed persulfate oxidation of Azo dye acid orange 7 at ambient temperature[J]. Journal of Hazardous Materials, 2011, 186(1): 659. DOI:10.1016/j.jhazmat.2010.11.057 |
| [17] |
SÁNCHEZ-POLO M, VON G U, RIVERA-UTRILLA J. Efficiency of activated carbon to transform ozone into *OH radicals: Influence of operational parameters[J]. Water Research, 2005, 39(14): 3189. DOI:10.1016/j.watres.2005.05.026 |
| [18] |
FARIA P C C, ÓRFÃO J J M, PEREIRA M F R. Ozone decomposition in water catalyzed by activated carbon: Influence of chemical and textural properties[J]. Industrial & Engineering Chemistry Research, 2006, 45(8): 2715. DOI:10.1021/ie060056n |
| [19] |
ZHAO Huazhang, SUN Yan, XU Lina, et al. Removal of Acid Orange 7 in simulated wastewater using a three-dimensional electrode reactor: Removal mechanisms and dye degradation pathway[J]. Chemosphere, 2010, 78(1): 46. DOI:10.1016/j.chemosphere.2009.10.034 |
| [20] |
LUO Haijian, LI Chaolin, SUN Xue, et al. Cathodic indirect oxidation of organic pollutant paired to anodic persulfate production[J]. Journal of Electroanalytical Chemistry, 2017, 792: 110. DOI:10.1016/j.jelechem.2017.03.040 |
| [21] |
SONG Haoran, YAN Linxia, MA Jun, et al. Nonradical oxidation from electrochemical activation of peroxydisulfate at Ti/Pt anode: Efficiency, mechanism and influencing factors[J]. Water Res, 2017, 116: 182. DOI:10.1016/j.watres.2017.03.035 |
| [22] |
HORI H, YAMAMOTO A, HAYAKAWA E, et al. Efficient decomposition of environmentally persistent perfluorocarboxylic acids by use of persulfate as a photochemical oxidant[J]. Environmental Science & Technology, 2005, 39(7): 2383. |
| [23] |
LIU Jialu, ZHONG Shuang, SONG Yunpeng, et al. Degradation of tetracycline hydrochloride by electro-activated persulfate oxidation[J]. Journal of Electroanalytical Chemistry, 2018, 809: 74. DOI:10.1016/j.jelechem.2017.12.033 |
| [24] |
SONGLIN W, NING Z. Removal of carbamazepine from aqueous solution using sono-activated persulfate process[J]. Ultrasonics Sonochemistry, 2016, 29: 156. DOI:10.1016/j.ultsonch.2015.09.008 |
| [25] |
KOLTHOFF I M, MILLER I K. The chemistry of persulfate.1. The kinetics and mechanism of the decomposition of the persulfate ions in aqueous medium[J]. Journal of the American Chemical Society, 1951, 73(7): 3055. DOI:10.1021/ja01151a024 |
| [26] |
朱思瑞, 高乃云, 鲁仙, 等. 热激活过硫酸盐氧化降解水中双酚A[J]. 中国环境科学, 2017, 37(1): 188. ZHU Sirui, GAO Naiyun, LU Xian, et al. Degradation of bisphenol A in aqueous solution by thermally activated sulfate oxidation[J]. China Environmental Science, 2017, 37(1): 188. DOI:10.3969/j.issn.1000-6923.2017.01.024 |
| [27] |
史宸菲, 薛瑞杰, 李雨濛, 等. 不同活性炭活化过硫酸盐的效能及机理的规律研究[J]. 环境科学学报, 2018, 38(4): 1501. SHI Chenfei, XUE Ruijie, LI Yumeng, et al. Efficiency and mechanism of persulfate activation using different activated carbons[J]. Acta Scientiae Circumstantiae, 2018, 38(4): 1501. DOI:10.13671/j.hjkxxb.2017.0494 |
| [28] |
冯玥, 石文静, 谭德俊, 等. 活性炭催化臭氧氧化处理染料废水生化出水研究[J]. 环境科学学报, 2013, 33(10): 2724. FENG Yue, SHI Wenjing, TAN Dejun, et al. Tertiary purification of biologically-treated effluent of dye-making wastewater by activated carbon catalytic ozonation[J]. Acta Scientiae Circunstantae, 2013, 33(10): 2724. DOI:10.13671/j.hjkxxb.2013.10.019 |
| [29] |
MORENO-CASTILLA C, FONTECHA-CAMARA M A, ALVAREZ-MERINO M A, et al. Activated carbon cloth as adsorbent and oxidation catalyst for the removal of amitrole from aqueous solution[J]. Adsorpation-Journal of the International Adsorption Society, 2011, 17(3): 413. DOI:10.1007/s10450-010-9270-x |
| [30] |
ANIA C O, BÉGUIN F. Electrochemical regeneration of activated carbon cloth exhausted with bentazone[J]. Environmental Science & Technology, 2008, 42(12): 4500. |
| [31] |
LIU Zhen, ZHAO Chun, WANG Pu, et al. Removal of carbamazepine in water by electro-activated carbon fiber-peroxydisulfate: Comparison, optimization, recycle, and mechanism study[J]. Chemical Engineering Journal, 2018, 343: 28. DOI:10.1016/j.cej.2018.02.114 |
| [32] |
BUXTON GEORGE V, GREENSTOCK CLIVE L, HELMAN W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (· OH/· O-)in aqueous solution[J]. Journal of Physical & Chemical Reference Data, 1988, 17(2): 513. |
| [33] |
NETA P, HUIE R E, ROSS A B. Rate constants for reactions of inorganic radicals in aqueous-solution[J]. Journal of Physics and Chemical Refference Data, 1988, 17(3): 1027. DOI:10.1063/1.555808 |
 2019, Vol. 51
2019, Vol. 51


