2. 中国建筑设计研究院有限公司,北京 100044
2. China Architecture Design & Research Group, Beijing 100044, China
建筑生活热水是城市二次供水系统的重要组成部分,其水质安全问题已经开始得到重视.中国规定生活热水的水质标准应满足《生活饮用水卫生标准》(GB5749—2006).自来水在生活热水的加热设备和热水管道系统中的水力停留时间长,余氯含量会消耗殆尽,会出现水中微生物再生、管壁生物膜增长的现象,导致热水中的微生物含量大幅度增加,很多情况下微生物指标已不能满足饮用水国标.生活热水系统水温较高,一些耐热性致病微生物易于在热水系统中生长与繁殖[1];在低于50 ℃的条件下,热水温度越高嗜肺军团菌存在的可能性越大,且微生物群落组成会发生较明显的变化[2],使得热水中的微生物种群和病原微生物种类都与常规给水系统存在较大差异,热水中异养菌(HPC)繁殖再生长可能性比自来水的更高[3].另外,在生活热水的使用过程中如淋浴时还存在雾化水汽现象,在这种环境下极易滋生军团菌[4],这为病原微生物对人体的感染和传播提供了一个新的途径.在对中国生活热水系统的水质监测和调研中发现,10个集中热水加热循环系统中有6个的微生物指标不达标[5],某市部分宾馆饭店的621份生活热水水样中有67份检出了嗜肺军团菌[6],在某建筑14个采样点的水质检测中发现,生活热水中的细菌总数和HPC明显高于生活给水[7].综上所述,生活热水系统的水质普遍存在生物安全性问题.
现阶段中国的生活热水系统均未采取消毒措施,因此,亟需研发和采用安全、高效的生活热水消毒技术来控制和解决该系统中的生物安全性.氯和二氧化氯是城市供水和二次供水系统中经常采用的消毒剂,也是生活热水系统中最易于采用的消毒技术.对生活热水系统进行消毒剂补投可以有效控制微生物指标.补投0.5 mg/L次氯酸钠或0.3 mg/L二氧化氯均可对生活热水中的微生物有很好的抑制作用,且CT值越大微生物的抑制效果越好[7];补投0.34 mg/L次氯酸钠对生活热水管壁生物膜的微生物有一定的灭活效果,且会使生物膜出现少部分脱落的现象,次氯酸钠的质量浓度越高,对微生物的灭活效果越显著[8].在生活热水系统中,较高的水温和管壁生物膜都会造成消毒剂的加速消耗,而且长时间投加高质量浓度的消毒剂会造成生活热水的刺激性气味较大,还存在消毒副产物生成量增加的风险[9].因此,在补充投加消毒剂维持生活热水剩余消毒剂含量的前提下,可采用短时间、高质量浓度的投加方式对热水管道进行消毒.
本文依据建筑生活热水中管壁生物膜的形成特性,选取氯和二氧化氯作为消毒剂,对比研究两类消毒剂对管壁生物膜中微生物的灭活效果,并探究了消毒剂作用前后管壁生物膜中微生物群落组成及生物膜表观特征的差异,为生活热水系统冲击消毒技术的适用性提供支持.
1 实验 1.1 实验装置与过程实验采用环状生物膜反应器(BAR)模拟实际建筑生活热水管道系统.BAR材质为聚氯乙烯,内部设有18个卡槽,卡槽内放有可拆卸的三型聚丙烯(PPR)材质挂片,每个挂片的有效面积约为17.0 cm2. BAR的有效容积为800 mL,转子的转速设置为50 r/min,水力停留时间为4 h.
实验装置运行前先用次氯酸钠对BAR、挂片、管道等进行消毒和冲洗.二次供水由水浴锅换热盘管加热,通过蠕动泵进到BAR内.挂片上的生物膜采用自然挂膜方式进行培养,在BAR连续运行100 d左右,生物膜的微生物量达到了稳定状态;在实验时将挂片从BAR顶部端口取出,分别置于装有BAR出水的烧杯中,用恒温水浴锅维持水温,并投加不同质量浓度消毒剂,消毒一定时间后将挂片取出,用灭菌的棉签分别擦拭消毒前后的生物膜置于灭菌超纯水中进行微生物检测.实验装置如图 1所示.
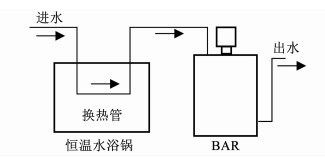
|
图 1 实验装置流程 Fig. 1 Experimental flow diagram |
考虑到建筑生活热水是定期进行冲击消毒,为便于在实际应用中消毒剂的快速配制和投加,采用8%有效氯的固体二氧化氯配制20 mg/L消毒液,采用市售的分析纯次氯酸钠配制20 mg/L氯消毒液.配置好的消毒剂置于4 ℃的冰箱保存,实验前根据所需投量配制到一定质量浓度.
1.2.2 水质指标检测浊度采用美国HACH2100N型台式浊度仪测定,量程为0~4 000 NTU,精度为0.001 NTU.pH采用德国Sartorius Professional Meter PP-20型pH计测定,量程为0~14,精度为0.01.DOC采用德国Elementar vario型TOC分析仪测定,量程为0.002~60.000 mg/L.氯和二氧化氯采用中国清时捷S-CL501型便携式余氯、二氧化氯多参数快速测定仪测定,氯和二氧化氯量程分别为0.01~5.00和0.02~10.00 mg/L,平均偏差≤3%.
1.2.3 微生物检测先用无菌水冲洗挂片表面的生物膜,再用2~3根灭菌棉签先后擦拭挂片表面数次,放在盛有10 mL灭菌后的超纯水中,用超声波清洗器作用20 min,然后取样检测超纯水中的微生物[10].
细菌总数采用平板菌落计数法测定;总大肠菌群采用滤膜法测定;异养菌(HPC)采用平板菌落计数法测定.
1.2.4 DNA提取与高通量分析取消毒前后挂片上的生物膜置于灭菌的超纯水中,取4 mL富集后的生物膜液体进行离心,并提取基因组DNA.利用Illumima MiSeq平台进行测序分析.测序数据经过筛选去除低质量序列和嵌合体后,得到有效的序列进行后续物种注释,进而分析生物膜的物种多样性和群落组成.
1.2.5 生物膜表面形态检测用荷兰FEI nova nano450扫描电子显微镜(SEM)对挂片的生物膜表面形态进行观察.将消毒前后的生物膜挂片进行固定、喷金处理,并置于SEM下观察,选择合适的放大倍数进行拍照分析.
1.3 实验水质实验用水为二次供水通过水浴锅加热的生活热水,DOC为2.116~2.977 mg/L,高锰酸盐指数为1.38~2.20 mg/L,浊度为0.473~0.918 NTU,pH为7.21~8.34,余氯为0.01~0.13 mg/L,水温为41~43 ℃.
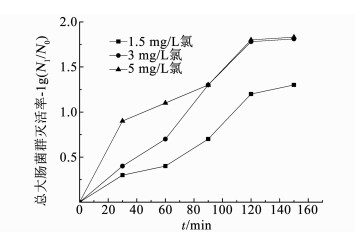
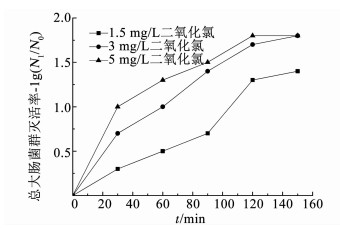
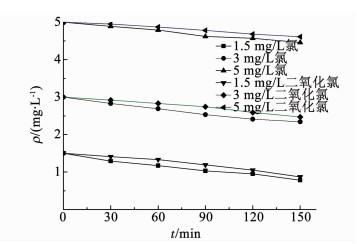
2 结果与讨论 2.1 微生物灭活效果 2.1.1 总大肠菌群灭活效果图 2、3分别为不同质量浓度的氯或二氧化氯进行冲击消毒时生物膜中总大肠菌群的灭活效果,图 4为冲击消毒过程中氯和二氧化氯的衰减情况.消毒前管壁生物膜中总大肠菌群为2.4×103 cfu/cm2.
|
图 2 氯对总大肠菌群的灭活 Fig. 2 Inactivation of Escherichia coli by chlorine |
|
图 3 二氧化氯对总大肠菌群的灭活 Fig. 3 Inactivation of Escherichia coli by chlorine dioxide |
|
图 4 氯和二氧化氯的衰减 Fig. 4 Decay of chlorine and chlorine dioxide |
由图 2、3可知,随着消毒剂投量的增加,总大肠菌群灭活率不断提高,但1.5 mg/L氯或二氧化氯的灭活效果总体上明显低于3和5 mg/L的水平.一方面是因为消毒剂投加质量浓度较低,另一方面可能是由于消毒过程中消毒剂质量浓度不断降低.3~5 mg/L氯和二氧化氯在0~60 min消毒期间的灭活率有较大差异,平均相差0.5lg和0.3lg,而在90~150 min消毒期间的灭活率几乎相同,而且在消毒120 min后灭活率达到了约1.7lg和1.8lg的稳定状态.这说明消毒剂投量达到3 mg/L后,继续增加消毒剂投量对消毒效果已经没有明显影响,仅是消毒速率提高了,而且均在约120 min后达到了稳定的接近完全灭活状态.从上述结果可以看出,保持一定的消毒剂质量浓度是确保高效消毒的必要条件,提高消毒剂质量浓度可以加快微生物灭活速率.
对比图 2、3可知,在1.5 mg/L低质量浓度消毒条件下,二氧化氯消毒效果总体上优于氯,平均高出了0.2lg,这可能是由于二氧化氯对生物膜的渗透能力强于氯,在低质量浓度条件下会导致微生物更快地灭活[11].在3~5 mg/L高质量浓度消毒条件下,不同消毒剂对生物膜的渗透能力差异已经显现不出来,使得总体灭活率相差不大.因此,采用高质量浓度消毒剂进行冲击消毒时,氯和二氧化氯对总大肠菌群的消毒效果没有显著差异,都可达到极佳的消毒效果.
由图 4可知,氯投加质量浓度为1.5~5 mg/L条件下,随着消毒时间的延续,氯质量浓度均呈持续下降的趋势,各投加质量浓度的衰减速率基本相同,而且氯和二氧化氯质量浓度的衰减速率也非常接近.从图 2、3的总大肠菌群灭活变化规律可以看到,消毒0~120 min期间的灭活率持续快速增加,消毒120 min后的灭活率基本趋于稳定,此时1.5,3和5 mg/L氯和二氧化氯的剩余质量浓度分别为0.95,2.41和4.57 mg/L,以及1.05,2.59和4.68 mg/L.可见,随着消毒时间的延长,1.5 mg/L投量的氯或二氧化氯消毒能力已显著减弱,最终灭活率仅达到了约1.2lg和1.3lg;而3和5 mg/L投量的氯或二氧化氯消毒能力仍较强,最终灭活率分别达到了约1.7lg, 1.8lg和1.8lg,1.8lg,可见较高的消毒剂质量浓度充分保障了消毒后期的消毒能力和消毒效果.
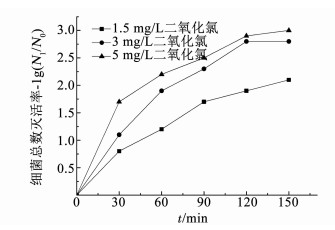
2.1.2 细菌总数灭活效果图 5, 6分别为不同质量浓度的氯或二氧化氯进行冲击消毒时生物膜中细菌总数的灭活效果.消毒前管壁生物膜细菌总数为3.6×104 cfu/cm2.可以看出,随着消毒剂投量的增加,细菌总数的灭活率也不断提高,与总大肠菌群灭活率非常类似.1.5 mg/L氯或二氧化氯的灭活效果总体上明显低于3和5 mg/L的水平.3和5 mg/L的氯在0~90 min消毒期间灭活率有较大的差异,平均相差约0.4lg,而在120~150 min消毒期间灭活率非常接近,消毒120 min后灭活率分别达到了2.6lg和2.7lg的稳定状态,这说明氯达到3 mg/L后继续增加投量对消毒效果已经没有明显影响,仅是消毒速率提高了.3和5 mg/L的二氧化氯在0~150 min消毒期间,灭活率的差异逐渐减小,在消毒120 min时分别达到2.7lg和2.8lg,仅差0.1lg,在消毒120 min后均达到了稳定的接近完全灭活状态.

|
图 5 氯对细菌总数的灭活 Fig. 5 Inactivation of total bacterial count by chlorine |
|
图 6 二氧化氯对细菌总数的灭活 Fig. 6 Inactivation of total bacterial count by chlorine dioxide |
对比图 5, 6可知,3~5 mg/L消毒剂在0~90 min消毒期间,二氧化氯消毒效果总体上优于氯,平均高出了0.3lg,而在消毒120 min后,总体灭活率相差不大,细菌总数均达到了几乎完全灭活的程度.可见,采用高质量浓度消毒剂进行冲击消毒时,氯和二氧化氯的细菌总数灭活率也没有显著差异,都可达到极佳的消毒效果.
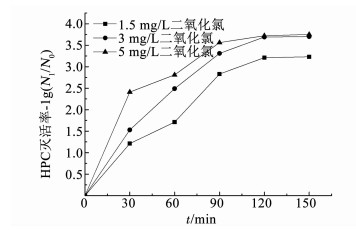
2.1.3 HPC的灭活效果图 7, 8分别为不同质量浓度的氯或二氧化氯进行冲击消毒时生物膜中HPC的灭活效果.消毒前管壁生物膜中HPC为3.3×105 cfu/cm2.可以看出,和总大肠菌群、细菌总数一样,随着消毒剂投量的增加,HPC的灭活率不断提高.在90~150 min消毒期间,1.5 mg/L二氧化氯的HPC灭活率比氯平均高出了约0.5lg,但总体上灭活效果不佳.在0~120 min消毒期间,3和5 mg/L氯灭活率差异逐渐减小,在消毒120 min后灭活率分别达到了3.5lg和3.6lg稳定的接近完全灭活的状态;在0~90 min消毒期间,3和5 mg/L二氧化氯的HPC灭活率平均相差约0.3lg;而在消毒90 min后均逐渐达到了3.7lg左右的稳定状态.从上述结果可以看出,在到达一定的消毒剂质量浓度后,提高消毒剂质量浓度也仅加快了HPC的灭活速率.

|
图 7 氯对HPC的灭活 Fig. 7 HPC inactivation by chlorine |
|
图 8 二氧化氯对HPC的灭活 Fig. 8 HPC inactivation by chlorine dioxide |
对比图 7、8可知,在1.5 mg/L低质量浓度冲击消毒条件下,二氧化氯的HPC灭活率比氯的平均高出了约0.5lg.3~5 mg/L高质量浓度二氧化氯的HPC灭活速率尽管高于氯,但随消毒时间的延长均能达到几乎完全灭活的效果.可见,高质量浓度氯或二氧化氯消毒时,HPC的灭活效果均能达到极佳的水平.
2.2 生物膜菌群特征 2.2.1 稳定状态的生物膜优势菌群图 9所示是生活热水管壁生物膜微生物达到稳定状态时进行的宏基因组16S测序分析结果.可以看出,生物膜微生物的多样性丰富,其中异常球菌-栖热菌门(Deinococcus-Thermus)和变形菌门(Proteobacteria)是生物膜的优势门,所占的比例分别为48.30%和19.96%;异常球菌-栖热菌门主要包括一些能抵抗严酷环境的细菌,如属于栖热菌门的耐热菌属,有较厚的细胞壁,具有较强的耐热性和稳定的结构,在42 ℃热水中为优势菌属;变形菌门包括大肠杆菌、霍乱弧菌、沙氏弧菌等病原菌,会对生活热水的生物安全性造成一定威胁[12].厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)所占的比例分别为7.42%, 7.10%和7.32%.厚壁菌是可影响人体健康的肠道菌[13],产生的芽孢可抵抗脱水和极端环境.疣微菌主要在水和土壤中,是一种肠道菌.浮霉菌门中的一部分为厌氧氨氧化菌,在水处理中起着重要的作用.广古菌门(Euryarchaeota)和衣原体门(Chlamydiae)所占的比例分别为4.29%和3.66%,广古菌门包括了产甲烷菌和一些超嗜热的好氧和厌氧菌;衣原体门可引起人体感染,对人体健康造成威胁.在其他菌门中还检测到了可引发人体呼吸道疾病的军团菌,虽然所占的比例不到1%,但仍增加了生活热水生物膜的生物安全性风险.Revetta等[14]在研究市政管网的管壁生物膜微生物群落组成时发现,90%的微生物属于变形菌门、放线菌门和拟杆菌门,其中包括大肠杆菌、幽门螺杆菌和肠道病原菌等.王帅等[9]的研究表明,二次供水管壁生物膜中厚壁菌门、变形菌门和拟杆菌门为优势门,其中包括大肠杆菌、霍乱弧菌等致病菌和抗氯性菌种.这说明生活热水管壁生物膜的优势菌群与市政供水和二次供水管道系统的有很大差异,可能主要是水温差异、剩余消毒剂含量不同等因素造成的.综上所述,生活热水管壁生物膜微生物存在的病原微生物可对人体健康产生较大的威胁.因此,生活热水的生物安全性是亟需解决的水质安全问题.

|
图 9 生物膜优势微生物分布(门水平) Fig. 9 Distribution of dominant bacteria in biofilm (at phylum level) |
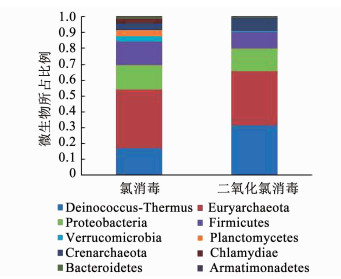
图 10为3 mg/L氯或二氧化氯冲击消毒后管壁生物膜的菌群变化.氯消毒后,异常球菌-栖热菌门、变形菌门、浮霉菌门和疣微菌门所占的比例分别降低了29.05,2.53,3.13和3.41个百分点,说明氯对这些菌门均有较好的灭活效果;广古菌门和厚壁菌门分别增加了35.09和8.50个百分点,说明厚壁菌门产生的芽孢对氯有一定的抗性,这与祝泽兵等的研究结果一致[15].二氧化氯消毒后,异常球菌-栖热菌门和变形菌门的比例分别减少了12.76和4.69个百分点,广古菌门和厚壁菌门的比例分别增加了31.78和3.82个百分点.二氧化氯消毒后变形菌门和厚壁菌门的比例分别比氯消毒时减少了2.16和4.68个百分点,浮霉菌门、疣微菌门和衣原体门几乎完全灭活,说明二氧化氯对致病菌的灭活效果优于氯;结果表明,氯和二氧化氯可在不同程度上杀灭管壁生物膜的微生物,二氧化氯对管壁微生膜中致病菌的灭活效果更佳.
|
图 10 消毒后生物膜优势微生物的变化 Fig. 10 Changes of dominant bacteria in biofilm after disinfection |
图 11为3 mg/L氯或二氧化氯对生活热水管壁生物膜消毒前后的SEM照片(放大倍数为2 000倍).可以看出,消毒前生物膜表面为紧实稳固的块状结构,表面呈现凹凸不平的形态.这些块状结构为细菌产生的胞外多糖等物质,其形成相对致密的网状结构为微生物附着和营养物质的传递提供了有利条件,易于微生物的附着和生长[16-17].氯和二氧化氯消毒均对生物膜造成了不同程度的破坏,使其表面结构变疏松且部分脱落.氯消毒后生物膜表面紧实的块状变小且少部分脱落,结构变得较为疏松,表面萎缩形成较多的空隙.二氧化氯消毒后的生物膜脱落严重,表面结构严重萎缩,变得更为松散,空隙更多,形成黏结在一起的网状形态,表面呈离散的小块状结构.对比可看出,二氧化氯消毒对生物膜的破坏作用更明显.

|
图 11 消毒前后生物膜的SEM图 Fig. 11 SEM of biofilm before and after disinfection |
1) 氯或二氧化氯冲击消毒对管壁生物膜的微生物均有很好的灭活效果,消毒剂质量浓度越高、消毒时间越长,微生物的灭活率越高.1.5 mg/L氯或二氧化氯在消毒150 min时仍无法高效灭活微生物,3和5 mg/L氯或二氧化氯消毒120 min后可基本完全灭活总大肠菌群、细菌总数和HPC;在消毒0~120 min期间,氯和二氧化氯的HPC灭活效果比总大肠菌群和细菌总数的更佳.继续提高消毒剂质量浓度可以加快微生物的灭活速率,但已无法进一步改善微生物灭活率,3 mg/L氯或二氧化氯冲击消毒120 min时可以确保达到高效的消毒效果.在低质量浓度消毒剂的冲击消毒时,二氧化氯消毒效果更佳,高质量浓度消毒剂冲击消毒时,氯和二氧化氯的消毒效果没有显著差异.
2) 生活热水管壁生物膜微生物的多样性丰富,异常球菌-栖热菌门和变形菌门为优势门,并含有多种致病菌,与市政供水和二次供水管道系统的优势菌群有很大差异.氯或二氧化氯冲击消毒对各种菌门的灭活程度有显著差异,均可使异常球菌-栖热菌门、变形菌门、浮霉菌门和疣微菌门的比例降低、广古菌门和厚壁菌门的比例增加,而二氧化氯对耐氯性致病菌、变形菌门和衣原体门等致病菌的灭活效果更佳.
3) 生活热水管壁生物膜表面呈现紧实稳固的块状结构,表面呈现凹凸不平的形态,易于微生物的附着和生长.氯或二氧化氯冲击消毒能够有效破坏生物膜的表面结构,使生物膜表面发生萎缩、结构疏松,出现明显的空隙和网状形态,且有不同程度的脱落现象;二氧化氯对生物膜的破坏作用更显著,表面形态变化程度更大.
| [1] |
许萍, 龙袁虎, 吴俊奇, 等. 生活热水水质微生物学指标试验研究[J]. 给水排水, 2008, 34(s1): 90. XU Ping, LONG Yuanhu, WU Junqi, et al. Study on the microbiology of water quality of living hot water[J]. Water & Wastewater, 2008, 34(s1): 90. DOI:10.369/j.issn.1002-8471.2008.z1.030 |
| [2] |
PROCTOR C R, DAI D, EDWARDS M A, et al. Interactive effects of temperature, organic carbon, and pipe material on microbiota composition and Legionella pneumophila in hot water plumbing systems[J]. Microbiome, 2017, 5(1): 130. DOI:10.1186/s40168-017-0348-5 |
| [3] |
沈晨.生活热水银离子消毒技术研究[D].昆明: 昆明理工大学, 2013 SHEN Chen. Research on silver ion disinfection technology of living hot water[D]. Kunming: Kunming University of Technology, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10674-1013347032.htm |
| [4] |
MATHYS W, STANKE J, HARMUTH M, et al. Occurrence of Legionella in hot water systems of single-family residences in suburbs of two German cities with special reference to solar and district heating[J]. Int J Hyg Environ Health, 2008, 211(1/2): 179. DOI:10.1016/j.ijheh.2007.02.004 |
| [5] |
赵锂, 刘振印, 傅文华, 等. 热水供应系统水质问题的探讨[J]. 给水排水, 2011, 37(7): 56. ZHAO Li, LIU Zhenyin, FU Wenhua, et al. Probe into water quality problems in hot water supply system[J]. Water & Wastewater Engineering, 2011, 37(7): 56. DOI:10.13789/j.cnki.wwe1964.2011.07.029 |
| [6] |
钱城, 赵锐, 刘玉敏. 2006—2010年北京市宾馆饭店生活热水中嗜肺军团菌污染现状研究[C]//中国建筑学会建筑给水排水研究分会第二次会员大会暨学术交流会.杭州, 2010: 145 QIAN Cheng, ZHAO Rui, LIU Yumin. Study on Legionella pneumophila contamination of hot system at hotels in Beijing from 2006 to 2010[C]//The 2nd General Meeting and Academic Exchange Meeting of China Architecture Society Building Water Supply and Drainage Research Branch. Hangzhou, 2010: 145. DOI: 10.13789/j.cnki.wwe1964.2011.07.029 |
| [7] |
李雨婷.建筑生活热水安全消毒技术研究[D].北京: 北京工业大学, 2016 LI Yuting. Research on the safety and disinfection of hot water in building[D]. Beijing: Beijing University of Technology, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10005-1016785661.htm |
| [8] |
尚思宏.生活热水消毒技术的微生物灭活效能研究[D].北京: 北京工业大学, 2017 SHANG Sihong. Research on microbial inactivation of living hot water disinfection technology[D]. Beijing: Beijing University of Technology, 2017 |
| [9] |
王帅, 杨艳玲, 李星, 等. 氯和氯胺冲击消毒对二次供水管道生物膜的控制作用[J]. 哈尔滨工业大学学报, 2017, 49(8): 71. WANG Shuai, YANG Yanling, LI Xing, et al. Effect of shock chlorine and chloramine disinfection on biofilm disinfection in pipe system of secondary water supply[J]. Journal of Harbin Institute of Technology, 2017, 49(8): 71. DOI:10.11918/j.issn.0367-6234.201607073 |
| [10] |
鲁巍, 王云, 张晓健. BAR反应器中生物膜的分离及定量[J]. 中国给水排水, 2005, 21(2): 91. LU Wei, WANG Yun, ZHANG Xiaojian. Biofilm separation and biomass quantification method in biological annular reactor[J]. China Water & Wastewater, 2005, 21(2): 91. DOI:10.3321/j.issn:1000-4602.2005.02.029 |
| [11] |
张晓煜.二氧化氯对细菌杀灭机理的研究[D].武汉: 中国科学院研究生院(武汉病毒研究所), 2006 ZHANG Xiaoyu. Study on the mechanism of killing bacteria by chlorine dioxide[D]. Wuhan: Graduate School of Chinese Academy of Sciences (Wuhan Virus Research Institute), 2006 http://cdmd.cnki.com.cn/Article/CDMD-80124-2006148180.htm |
| [12] |
GHAFOOR A, HAY I D, REHM B H A. Role of exopolysaccharides in Pseudomonas aeruginosa biofilm formation and architecture[J]. Applied & Environmental Microbiology, 2011, 77(15): 5238. DOI:10.1128/aem.00637-11 |
| [13] |
WOLF M, MULLER T, DANDEKAR T, et al. Phylogeny of Firmicutes with special reference to Mycoplasma (Mollicutes) as inferred from phosphoglycerate kinase amino acid sequence data[J]. International Journal of Systematic & Evolutionary Microbiology, 2004, 54(Pt 3): 871. DOI:10.1099/ijs.0.02868-0 |
| [14] |
REVETTA R P, GOMEZALVAREZ V, GERKE T L, et al. Establishment and early succession of bacterial communities in monochloramine-treated drinking water biofilms[J]. Fems Microbiology Ecology, 2013, 86(3): 404. DOI:10.1111/1574-6941.12170 |
| [15] |
祝泽兵.供水管网中的耐氯菌群及其耐氯机制研究[D].哈尔滨: 哈尔滨工业大学, 2015 ZHU Zebing. The chlorine-resistant bacteria in the water supply network and its chlorine resistance mechanism[D]. Harbin: Harbin Institute of Technology, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10213-1015957407.htm |
| [16] |
林文芳, 余志晟, 陈曦, 等. 给水管网生物膜反应器及分子生物学研究方法进展[J]. 环境科学与技术, 2012, 35(6): 76. LIN Wenfang, YU Zhisheng, CHEN Xi, et al. Progress on research methods of biofilm reactor and molecular biology in drinking water distribution[J]. Environmental Science and Technology, 2012, 35(6): 76. DOI:10.3969/j.issn.1003-6504.2012.06.016 |
| [17] |
相坤.氧化剂对原水输水管道生物作用的影响研究[D].北京: 北京工业大学, 2015 XIANG Kun. Effects of oxidants on the biological effects of the water pipeline[D]. Beijing: Beijing University of Technology, 2015 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2960621 |
 2019, Vol. 51
2019, Vol. 51


