2. 青岛理工大学 环境与市政工程学院, 山东 青岛 266000;
3. 深圳职业技术学院 建筑与环境工程学院, 广东 深圳 518055
2. College of Environmental and Municipal Engineering, Qingdao Technological University, Qingdao 266000, Shandong, China;
3. College of Architecture and Environment, Shenzhen Polytechnic, Shenzhen 518055, Guangdong, China
伪鱼腥藻,属于蓝藻门,颤藻目,是一种常见的淡水水华蓝藻,在国内外的一些湖泊、河流以及水库水华暴发时已逐渐成为次优势种[1-5].有关研究表明[6-7],该藻不仅是典型嗅味物质2-甲基异莰醇(2-MIB)的主要生产者,还有可能释放肝毒素、神经毒素等蓝藻毒素,需要引起足够的关注和重视.Teneva等[8]研究了伪鱼腥藻(Pseudoanabaena galeata)提取物的毒性,证实了其能够产生肝毒素和神经毒素.Blahoslav等[9]于2002年在捷克的水库中监测到了伪鱼腥藻水华,同时发现其能够产生大量的蓝藻毒素和微囊藻毒素.
光照是限制浮游植物生长的最重要环境因子之一,同时影响着藻类的生长繁殖、光合作用、生化组成、形态结构和物质代谢等[10-12].Wang Zhongjie等[13]研究了光照对伪鱼腥藻(Pseudanabaena sp.dqh15)生长的影响,结果表明,光照强度560~3 300 lx时,其在560 lx下生长速率最高;Lu Xuetang[1]和Tian Chang等[14]分别在中国的东平湖和南四湖发现伪鱼腥藻占优势,Zhao Haijiang等[15]在西安的丰庆湖中发现伪鱼腥藻常年占优势,三者均提出该藻能够在低光照条件下生长;Chomérat N等[16]在法国南部的湖中发现伪鱼腥藻在夏季占据优势,较为适应低光照和高扰动;Ute Mischke在德国的Melangsee发现伪鱼腥藻为优势藻,同时表明其所属的颤藻目能够在低光照条件下较好地生长.目前,关于光照强度对伪鱼腥藻生长和光合活性影响的系统研究尚未见报道,本实验研究了5个光照强度对伪鱼腥藻生长及光合活性的影响,对地表水体中伪鱼腥藻暴发的预测预警和控制具有重要意义.
1 实验 1.1 材料实验所需伪鱼腥藻(FACHB-1277)购自中科院水生生物研究所淡水藻种库,用BG11培养基培养,经实验室扩大培养7 d后用于实验.实验前分别取一定体积的藻液以5 000 r/min的速度离心10 min,弃掉上清液,用15 mg/L的碳酸氢钠溶液洗涤后离心,重复3次,用无菌水稀释接种于BG11培养基内,以BG11培养基为参比,初始接种浓度为OD665≈0.02[17].
1.2 实验设置实验采用一次性培养法,在500 mL锥形瓶中加入300 mL伪鱼腥藻藻液,在5个不同光照培养箱中培养,光照强度依次为500,1 000,1 500,2 000,2 500 lx,每个实验组设置3个平行样,光暗比为12 h: 12 h,温度为25 ℃.为保证每个实验组光照均匀,每天定时手动摇瓶3次,并随机交换锥形瓶位置.实验所用所有玻璃器皿均经121 ℃高温灭菌30 min后使用.
1.3 参数测定以18 d为实验周期,每天采集5 mL样品用分光光度法测定OD665,用浮游植物分类荧光仪(PHYTO-PAM WALZ)测定叶绿素a含量(Chl a)及光合活性参数,具体包括最大光系统Ⅱ(PSⅡ)的光能转换效率Fv/Fm,最大相对电子传递速率rETRmax,快速光曲线初始斜率α,半饱合光强Ik.按下式计算藻类比增长速率:
| $ \mu=\ln \left(N_{1} / N_{18}\right) / T. $ |
式中:N1和N18分别为第1天和第18天的OD665,T为培养时间.
实验结束时按照文献[18]方法测定类胡萝卜素质量浓度.取藻液5 mL,以9 000 r/min转速离心15 min,去掉上清液,加入80%丙酮在4 ℃暗处提取24 h,再次离心后用紫外可见分光光度计在663,645和450 nm 3个波长下测定上清液的吸光值,利用如下公式计算得出类胡萝卜素的质量浓度.定义类胡萝卜素质量浓度与叶绿素a含量的比值为类胡萝卜素相对质量分数.
ρCarotenoids(mg/L)=4.1×A450-0.553×A663+0.118×A645.
1.4 统计分析采用SPSS 22.0进行单因子方差分析、Pearson相关分析和Dunnett多重比较.采用Excel 2010绘制图形.
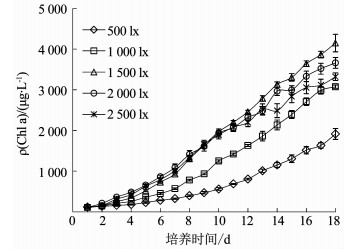
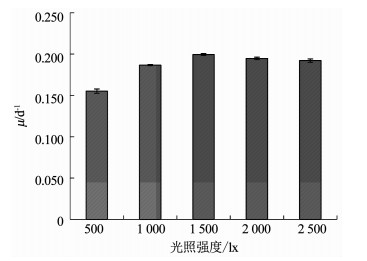
2 结果分析 2.1 光照强度对伪鱼腥藻生长的影响不同光照强度下伪鱼腥藻Chl a的质量浓度变化如图 1所示,可以看出,在光照强度为1 500 lx时,伪鱼腥藻的生长状况最好,第18天时Chl a质量浓度可达4 151.16 μg/L;当光照强度低于1 500 lx时,伪鱼腥藻的生长趋势随光照强度下降而逐渐减慢,1 000和500 lx光强组第18天伪鱼腥藻的Chl a质量浓度分别为3 076.13和1 914.37 μg/L;当光照强度高于1 500 lx时,随着光照强度的升高,伪鱼腥藻的生长趋势也会减缓,2 000和2 500 lx光强组第18天伪鱼腥藻的Chl a质量浓度分别为3 661.82和3 321.88 μg/L.5个光强组应用OD665计算得到的藻类生长比增长速率如图 2所示.将光照强度按照伪鱼腥藻比增长速率从高到低排列依次为:1 500 lx,1 000 lx,2 000 lx,2 500 lx和500 lx.最高比增长速率为0.199 d-1,最低比增长速率为0.154 d-1.
|
图 1 不同光照强度下伪鱼腥藻叶绿素a质量浓度变化 Fig. 1 Variation of Chl a of Pseudanabaena sp. under different light intensities |
|
图 2 不同光照强度下第18天伪鱼腥藻比增长速率 Fig. 2 Specific growth rates of Pseudanabaena sp. under different light intensities |
对Chl a质量浓度和OD665进行单因子方差分析发现,各光强组间存在显著差异(P < 0.01),但进一步进行Dunnett多重比较,发现只有500 lx光强组显著低于其他各光强组,其他光强组之间差异不显著(P>0.05).
将Chl a质量浓度和OD665与光照强度进行Pearson相关分析,结果如表 1所示.第3~9天,Chl a质量浓度与光照强度呈现了显著正相关关系(P < 0.05),相关系数为0.891~0.955,第11天开始,Chl a质量浓度与光照强度不再显著相关;OD665同样在第3~9天与光照强度呈现了显著正相关关系,且第3~7天为极显著正相关(P < 0.01).
| 表 1 伪鱼腥藻生长及光合活性参数与光照强度的相关关系 Tab. 1 Correlation coefficients between growth and photosynthesis characteristic factors of Pseudanabaena sp. and light intensity |
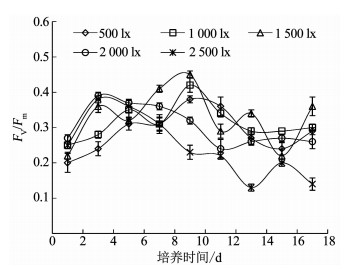
图 3为不同光照条件下伪鱼腥藻最大光能转换效率Fv/Fm的变化,可以看出,Fv/Fm总体上呈先上升后下降的趋势,1 500 lx、2 000 lx和2 500 lx 3组在开始第1~3天的上升趋势基本一致,之后在第4~5天同时出现了下降趋势,但1 500 lx组在第5天之后继续上升至第9天达到了峰值0.45,第10~18天呈现波动下降和上升的趋势;2 000和2 500 lx组则在第3天后总体呈现持续下降趋势,2 500 lx组在第13天下降至最低0.13,低于初始值0.25;500和1 000 lx组Fv/Fm的变化趋势较为类似,开始的上升速度慢于高光强组,但始终保持上升趋势至第9天,500和1 000 lx组Fv/Fm值分别达0.38和0.42,随后缓慢下降,至第18天仍高于2 000和2 500 lx光强组.对比而言,低光强组(500,1 000 lx)伪鱼腥藻Fv/Fm值的波动比高光强组(2 000,2 500 lx)小.表 1中的相关分析结果显示伪鱼腥藻的Fv/Fm值仅在第3天与光照强度呈显著正相关(P < 0.05),第11天与光照强度呈极显著负相关(P < 0.01),其余时间无明显相关性.
|
图 3 不同光照强度下伪鱼腥藻最大光能转换效率变化 Fig. 3 Variation of Fv/Fm of Pseudanabaena sp. under different light intensities |
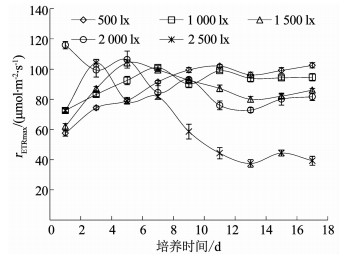
图 4为不同光照条件下伪鱼腥藻最大相对电子传递速率rETRmax的变化.低光强组(500, 1 000 lx)伪鱼腥藻的rETRmax总体呈缓慢上升趋势,变化较为平稳;1 500 lx组伪鱼腥藻的rETRmax第1~5天快速上升至峰值,随后缓慢下降;高光强组(2 000,2 500 lx)伪鱼腥藻的rETRmax则呈现波动下降趋势,特别是2 500 lx组,自第3天开始持续下降;第9天后,各光强组伪鱼腥藻的rETRmax值相对差异保持稳定,从高到低排列依次为500 lx,1 000 lx,1 500 lx,2 000 lx,2 500 lx.相关分析结果显示伪鱼腥藻的rETRmax在第3天与光照强度呈极显著正相关(P < 0.01),第11~17天呈显著负相关(P < 0.05),其余时间无明显相关性.
|
图 4 不同光照强度下伪鱼腥藻最大相对电子传递速率变化 Fig. 4 Variation of rETRmax of Pseudanabaena sp. under different light intensities |
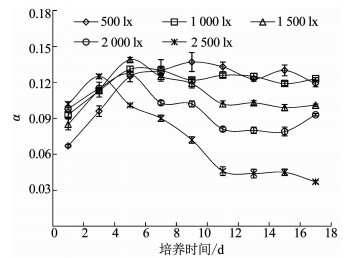
各光照强度下,伪鱼腥藻快速光曲线的初始斜率α变化如图 5所示.与rETRmax的变化趋势相似,2 500 lx光强组伪鱼腥藻的α值在初始第1~3天高于其他组,之后开始下降,降幅明显;其余4组伪鱼腥藻的α值均在第1~5天呈现快速上升趋势,峰值高于2 500 lx光强组,之后下降,下降幅度随光照强度的增加而增大.相关分析结果显示,伪鱼腥藻的α值在第3天与光照强度呈显著正相关(P < 0.05),在第7~17天与光照强度呈显著负相关,其中第11和15天为极显著负相关(P < 0.01).
|
图 5 不同光照强度下伪鱼腥藻快速光曲线初始斜率变化 Fig. 5 Variation of α of Pseudanabaena sp. under different light intensities |
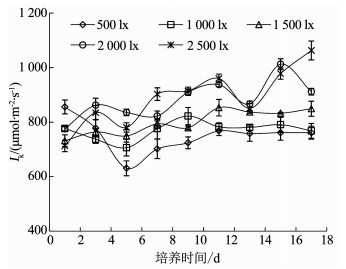
伪鱼腥藻在各光照强度下的半饱和光强Ik基本在600~1 000 μmol/(m2 · s)波动,总体上随光照强度的升高而增大,如图 6所示.相关分析结果显示,伪鱼腥藻的Ik值从第7天开始与光照强度显著正相关,其中第7和11天为极显著正相关(P < 0.01).
|
图 6 不同光照强度下伪鱼腥藻半饱和光强变化 Fig. 6 Variation of Ik of Pseudanabaena sp. under different light intensities |
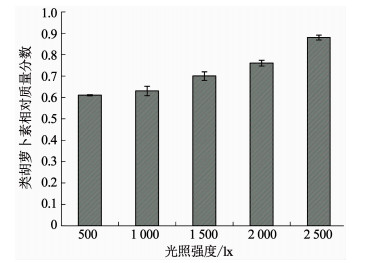
图 7为培养结束时不同光照强度下伪鱼腥藻类胡萝卜素与叶绿素相比的相对质量分数.该值随光照强度的升高而逐渐增大,2 500 lx光强组伪鱼腥藻类胡萝卜素的相对质量分数是500 lx光强组的1.44倍.
|
图 7 不同光照强度伪鱼腥藻类胡萝卜素相对质量分数(第18天) Fig. 7 Relative carotenoid content of Pseudanabaena sp. under different light intensities (18th day) |
光照强度是影响藻类生长和光合作用的最重要环境因子之一,有研究表明,对于每种藻类都存在一个光饱和点,当光照强度低于光饱和点时,藻类光合速率会随光照强度增加而升高,当光照强度超过光饱和点后,藻类的光合速率反而会随光照强度增加而下降,生长速率变慢[19-20].实验结果表明,伪鱼腥藻的最适光照强度为1 500 lx,较为适合生长的光强范围为1 000~2 000 lx.根据单因子方差分析和Dunnett多重比较结果,500 lx光强组的生长差异较其他组更为显著,说明低光照强度对伪鱼腥藻生长的限制作用大于高光强产生的抑制作用.但在低光强500 lx下,伪鱼腥藻也能达到0.15 d-1以上的比增长速率.对比塔玛亚历山大藻的最适光强6 000 lx[21],铜绿微囊藻的最适光强4 000 lx[22],三角褐指藻的最适光强7 200 lx[23],单细胞绿藻的最适光强范围6 000~10 000 lx[24],伪鱼腥藻属于典型的低光强耐受藻类,其所属的颤藻目生长所需光强也曾多次被报道显著低于微囊藻[14, 25].课题组前期研究发现[26],伪鱼腥藻常年在南方某梯级水库群中占据优势,且垂向分层不明显,与透明度无明显相关关系,该水库群属于调水型水库群,水位波动明显,垂向光强变化显著,伪鱼腥藻对低光强的耐受性是其在该水库群的各水层均有分布,且常年占据优势地位的主要原因之一.由此可以推断,伪鱼腥藻的暴发相对不易受水深和光照强度的限制,不宜采用垂向扰动或遮光的抑藻措施对其进行控制.
光合活性参数是光合作用的有效探针.最大光系统Ⅱ(PSⅡ)的光能转换效率Fv/Fm,反应藻类潜在最大光合能力,在藻类受到胁迫时才会显著下降;最大相对电子传递速率rETRmax反映了藻类的最大光合速率;快速光曲线初始斜率α反映了光能的利用效率;半饱合光强Ik则反映了藻类对强光的耐受能力.不同光照条件下,伪鱼腥藻的光合活性参数变化明显.首先,伪鱼腥藻的Fv/Fm、rETRmax和α 3项参数在第3天时均与光照强度呈显著正相关或极显著正相关,随后变化差异较为明显.其次,第3天之后,1 500,2 000,2 500 lx光强组的Fv/Fm开始下降,2 500 lx光强组的rETRmax和α也开始下降,证明伪鱼腥藻的光合能力、光合速率和光能利用效率都在不同程度上受到了高光强的抑制.再次,第5天时,1 500 lx光强组rETRmax达到了峰值,Fv/Fm重新开始上升,并于第9天也达到了峰值;2 000和2 500 lx光强组的Fv/Fm则持续下降,最终低于其他光强组.第四,第7天开始,伪鱼腥藻的α和光照强度呈现了稳定的显著负相关或极显著负相关趋势,Ik则出现了显著正相关或极显著正相关趋势,第9天之后rETRmaxx值也与光照强度呈现了显著负相关关系.
有关研究表明[27-28],植物光合作用系统在高光强抑制作用下会启动保护机制,同时,光抑制的效果在一定范围内是可逆的.因此,根据上述研究结果推测不同光照强度下,伪鱼腥藻的生长周期中,第1~3天为高光强光抑制的作用时期,这一阶段伪鱼腥藻光合活性与光照强度成正比;第5~7天为伪鱼腥藻应对不同光照强度的反应期,1 500 lx光强组的伪鱼腥藻在该光强下受到光抑制后通过自身调整光合能力仍可恢复;第7~18天则是伪鱼腥藻的稳定生长时期,1 500 lx以下光强组的光合速率和光能利用效率基本保持稳定,2 000和2 500 lx的半饱和光强还在持续增加,证明伪鱼腥藻对高光强的耐受力在不断增强.
光照强度在影响藻类光合活性的同时还会影响藻类的色素组成.藻类色素分为捕光色素和光保护色素两类[29].伪鱼腥藻中,叶绿素a为捕光色素,类胡萝卜素则为光保护色素.当光照强度不足时,捕光色素的含量升高,光合速率和光能利用效率也发挥到最大;随着光照强度的增强,伪鱼腥藻中的类胡萝卜素相对质量分数随之升高,光合速率和光能利用效率反而降低.由此反映了伪鱼腥藻针对光照强度变化的应对机制.
4 结论1) 伪鱼腥藻的最适生长光照强度为1 500 lx,较为适应的光照强度范围为1 000~2 000 lx,将光强组按比增长速率从高到低顺序排列依次为1 500 lx,1 000 lx,2 000 lx,2 500 lx和500 lx.
2) 伪鱼腥藻的光合活性受光照强度影响显著,培养一段时间后,光合速率和光能利用效率与光照强度显著负相关,第11天相关系数分别为-0.939(P < 0.05)和-0.978(P < 0.01),半饱和光强与光照强度显著正相关,第11天相关系数为0.976(P < 0.01).
3) 与其他藻类相比,伪鱼腥藻属于低光照强度耐受型蓝藻,且具备自身调节机制应对光照不足或光照过强,易于在光照不足或光强波动较大的水体中占据优势.
4) 伪鱼腥藻的暴发相对不易受水深和光强的限制,不宜采用垂向扰动或遮光的抑藻措施对其进行控制.
| [1] |
LU Xuetang, TIAN Chang, PEI Haiyan, et al. Environmental factors influencing cyanobacteria community structure in Dongping Lake, China[J]. Journal of Environmental Sciences, 2013, 25(11): 2196. DOI:10.1016/S1001-0742(12)60297-6 |
| [2] |
ACINAS S G, HAVERKAMP T H, HUISMAN J, et al. Phenotypic and genetic diversification of Pseudanabaena spp. (cyanobacteria)[J]. The ISME Journal, 2009, 3(1): 31. DOI:10.1038/ismej.2008.78 |
| [3] |
IZAGUIRRE G, TAYLOR W D. A Pseudanabaena species from Castaic Lake, California, that produces 2-methylisoborneol[J]. Water Research, 1998, 32(5): 1673. DOI:10.1016/S0043-1354(97)00379-5 |
| [4] |
VASCONCELOS V M, PEREIRA E. Rapid communication cyanobacteria diversity and toxicity in a wastewater treatment plant (Portugal)[J]. Water Research, 2001, 35(5): 1354. DOI:10.1016/S0043-1354(00)00512-1 |
| [5] |
STAL L J, ALBERTANO P, BERGMAN B, et al. BASIC: Baltic Sea cyanobacteria. An investigation of the structure and dynamics of water blooms of cyanobacteria in the Baltic Sea: responses to a changing environment[J]. Continental Shelf Research, 2003, 23(17/18/19): 1695. DOI:10.1016/j.csr.2003.06.001 |
| [6] |
ROXANA O R, CARL C R, FERNANDO M J. Toxic effects of Pseudanabaena tenuis (Cyanobacteria) on the cladocerans Daphnia magna and Ceriodaphnia dubia[J]. Hidrobiológica, 2010, 20(3): 203. |
| [7] |
WANG Zhongjie, LI Renhui. Effects of light and temperature on the odor production of 2-methylisoborneol-producing Pseudanabaena sp. and geosmin-producing Anabaena ucrainica (cyanobacteria)[J]. Biochemical Systematics and Ecology, 2015, 58: 219. DOI:10.1016/j.bse.2014.12.013 |
| [8] |
TENEVA I, MLADENOV R, DZHAMBAZOV B. Toxic effects of extracts from Pseudoanabaena Galeata (Cynaoprokaryota) in mice and cell cultures in vitro[J]. Scientific Researches of the Union of Scientists in Bulgaria-Plovdiv, Series B, 2009(5/6): 237. |
| [9] |
MARSALEK B, BLAHA L, BABICA P. Analyses of microcystins in the biomass of Pseudanabaena linmnetica collected in Znojmo reservoir[J]. Czech Phycology, Olomouc, 2003(3): 195. |
| [10] |
HAVENS K E, PHLIPS E J, CICHRA M F, et al. Light availability as a possible regulator of cyanobacteria species composition in a shallow subtropical lake[J]. Freshwater Biology, 1998, 39(3): 547. DOI:10.1046/j.1365-2427.1998.00308.x |
| [11] |
WAHIDIN S, IDRIS A, SHALEH S R M. The influence of light intensity and photoperiod on the growth and lipid content of microalgae Nannochloropsis sp.[J]. Bioresource Technology, 2013, 129: 7. DOI:10.1016/j.biortech.2012.11.032 |
| [12] |
陈雪初, 孙扬才, 曾晓文, 等. 低光照度对源水中铜绿微囊藻增殖的抑制作用[J]. 中国环境科学, 2007(3): 352. CHEN Xuechu, SUN Yangcai, ZENG Xiaowen, et al. The inhibition of low light intensity on the growth of Microcystis aeruginosa in raw water[J]. China Environmental Science, 2007(3): 352. DOI:10.3321/j.issn:1000-6923.2007.03.013 |
| [13] |
WANG Zhongjie, LI Renhui. Effects of light and temperature on the odor production of 2-methylisoborneol-producing Pseudanabaena sp. and geosmin-producing Anabaena ucrainica (cyanobacteria)[J]. Biochemical Systematics and Ecology, 2015, 58: 219. DOI:10.1016/j.bse.2014.12.013 |
| [14] |
TIAN Chang, PEI Haiyan, HU Wenrong, et al. Variation of cyanobacteria with different environmental conditions in Nansi Lake, China[J]. Journal of Environmental Sciences, 2012, 24(8): 1394. DOI:10.1016/S1001-0742(11)60964-9 |
| [15] |
ZHAO Haijiang, WANG Yi, YANG Liangliang, et al. Relationship between phytoplankton and environmental factors in landscape water supplemented with reclaimed water[J]. Ecological Indicators, 2015, 58: 113. DOI:10.1016/j.ecolind.2015.03.033 |
| [16] |
CHOMÉRAT N, GARNIER R, BERTRAND C, et al. Seasonal succession of cyanoprokaryotes in a hypereutrophic oligo-mesohaline lagoon from the South of France[J]. Estuarine Coastal and Shelf Science, 2007, 72(4): 591. DOI:10.1016/j.ecss.2006.11.008 |
| [17] |
王英英.不同氮磷质量浓度对太浦河四种优势藻类生长影响的研究[D].上海: 上海师范大学, 2016 WANG Yingying. Study on influence of nitrogen and phosphorus concentrations on the growth of four dominant species of algae in Taipu River[D]. Shanghai: Shanghai Normal University, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10270-1016126207.htm |
| [18] |
廖兴盛. UV-C照射下纳米TiO2光催化对蓝藻生长影响的研究及其应用[D].武汉: 华中科技大学, 2009 LIAO Xingsheng. Study on the photocatalytic influence of cyanobacterial growth using Nanocrystalline TiO2 under UV-C light and its application[D]. Wuhan: Huazhong University of Science & Technology, 2009 http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_D088225 |
| [19] |
尚帅.温度、光照对长江口几种优势藻类生长的影响研究[D].上海: 上海师范大学, 2017 SHANG Shuai. Study on influence of temperature and light on the growth of several dominant algae in Yangtze river estuary[D]. Shanghai: Shanghai Normal University, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10270-1017163083.htm |
| [20] |
许珍.温度和光强对四种藻类生理生态学特性的影响研究[D].武汉: 长江科学院, 2017 XU Zhen. Effects of temperature and light intensity on physiological and ecological characteristics of four alga[D]. Wuhan: Changjiang River Scientific Research Institute, 2017 http://cdmd.cnki.com.cn/Article/CDMD-82305-1017834142.htm |
| [21] |
刘青, 刘冰莉, 王仁锋, 等. 光照强度和盐度对塔玛亚历山大藻生长的影响[J]. 海洋环境科学, 2015, 34(2): 199. LIU Qing, LIU Bingli, WANG Renfeng, et al. Effect of salinity and illumination on the growth of Alexandrium tamarense[J]. Marine Environmental Science, 2015, 34(2): 199. DOI:10.13634/j.cnki.mes.2015.02.008 |
| [22] |
张青田, 王新华, 林超, 等. 温度和光照对铜绿微囊藻生长的影响[J]. 天津科技大学学报, 2011, 26(2): 24. ZHANG Qingtian, WANG Xinhua, LIN Chao, et al. Effects of temperature and illumination on the cell proliferation of Microcystis aeruginosa[J]. Journal of Tianjin University of Science & Technology, 2011, 26(2): 24. DOI:10.13364/j.issn.1672-6510.2011.02.003 |
| [23] |
臧正蓉, 解修俊, 赵佩佩, 等. 温度和光照对三角褐指藻的生长及岩藻黄素含量的影响[J]. 海洋科学, 2015, 39(7): 1. ZANG Zhengrong, XIE Xiujun, ZHAO Peipei, et al. Effect of different temperatures and light conditions on the growth and fucoxanthin content of Phaeodactylum tricornutum[J]. Marine Sciences, 2015, 39(7): 1. DOI:10.11759/hykx20140403002 |
| [24] |
袁著涛, 董晓煜, 刘升平. 温度和光照对单细胞绿藻1102生长影响的研究[J]. 水产科学, 2014, 33(2): 123. YUAN Zhutao, DONG Xiaoyu, LIU Shengping. Effects of temperature and light on growth of single-celled green alga No. 1102[J]. Fisheries Science, 2014, 33(2): 123. DOI:10.16378/j.cnki.1003-1111.2014.02.012 |
| [25] |
MISCHKE U. Cyanobacteria associations in shallow polytrophic lakes: Influence of environmental factors[J]. Acta Oecologica, 2003, 24: S11. DOI:10.1016/S1146-609X(03)00003-1 |
| [26] |
赵静静, 张可方, 高静思, 等. 梯级水库输水线路伪鱼腥藻属时空分布特征及影响因子分析[J]. 水资源保护, 2016, 32(3): 111. ZHAO Jingjing, ZHANG Kefang, GAO Jingsi, et al. Characteristics of temporal and spatial distribution of Pseudoanabaena sp. in water transfer route of cascade reservoirs and analysis of influencing factors[J]. Water Resources Protection, 2016, 32(3): 111. DOI:10.3880/j.issn.1004-6933.2016.03.021 |
| [27] |
CLOOT A. Effect of light intensity variations on the rate of photosynthesis of algae: A dynamical approach[J]. Mathematical and Computer Modelling, 1994, 19(9): 23. DOI:10.1016/0895-7177(94)90038-8 |
| [28] |
郭连旺, 沈允钢. 高等植物光合机构避免强光破坏的保护机制[J]. 植物生理学通讯, 1996(1): 1. GUO Lianwang, SHEN Yungang. Protective mechanisms against photodamage in photosynthetic apparatus of higher plants[J]. Plant Physiology Communications, 1996(1): 1. DOI:10.13592/j.cnki.ppj.1996.01.001 |
| [29] |
ZHOU Qin, ZHANG Panyue, ZHANG Guangming. Biomass and carotenoid production in photosynthetic bacteria wastewater treatment: Effects of light intensity[J]. Bioresource Technology, 2014, 171: 330. DOI:10.1016/j.biortech.2014.08.088 |
 2019, Vol. 51
2019, Vol. 51


