在过去的近30年中,膜生物反应器(membrane bioreactor,MBR)已成为污水处理技术中最高效的工艺之一[1],与其他传统的污水处理技术相比,MBR具有出水水质好、污泥产量低、容积负荷高、占地面积小和污泥持留能力强等明显优势[2-3].然而,膜污染始终是该技术在应用中不可避免的问题,大幅增加了MBR在运行和维护过程的额外能源消耗和运行成本,严重限制了该工艺的稳定性和经济性[4].例如,在污水好氧处理过程中,常采用气体冲刷以减轻MBR反应器中膜材料表面的膜污染,该方法所产生的费用占总运行成本的35%~50%[5].可见,膜污染问题仍是制约MBR广泛应用的关键因素,寻求更科学、有效、经济的途径以解决膜污染问题也是当前该领域的研究热点之一[6].
传统的膜污染控制研究主要围绕膜材料的选择和改性、调整反应器运行条件、改善污泥混合液性质等方面开展.例如,采用物理化学方法清洗或改性膜材料、制备亲水型膜材料、添加化学絮凝剂等[7-9].此类膜污染控制方法虽然取得了一定效果,却未从根本上解决膜污染问题,由于生物膜的形成是造成膜表面泥饼层阻力的主要原因[10],如何抑制膜表面生物膜的形成是解决膜污染的关键问题.近年来,随着群体感应(quorum sensing,QS)理论及群体猝灭(quorum quenching,QQ)技术的提出,从源头上抑制细菌生物膜的形成并从根本上减少膜污染物的产生成为解决膜污染问题的新研究方向[10-11].
自Yeon等[12]首次将群体感应猝灭技术应用于膜污染控制以来,该新型技术经历了近十年的发展,各种基于群体感应理论的新型膜污染控制方法层出不穷,并在实验室和中试规模的MBR工艺中获得了良好抗污染效果.本文综述了近年来基于群体感应猝灭理论提出的MBR膜污染控制的思路、方法及应用手段,并对该新型膜污染控制技术在未来的发展方向进行了展望.
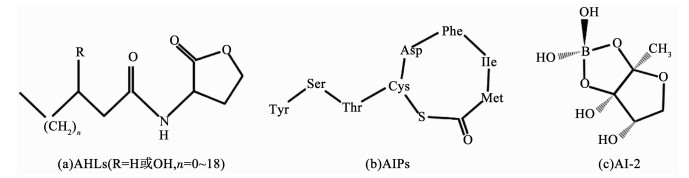
1 细菌的群体感应(QS)系统细菌可自主产生、释放特定的信号分子,并感知其浓度变化,与邻近的细菌(相同或不同种属)发生协同效应,这种调节微生物群体行为的调控系统称为群体感应(quorum sensing)[13].有研究表明,各种生物系统(包括污水生物处理系统)中细菌生物膜的形成都由QS系统调控[12].在该系统中,细菌信号分子扩散到胞外并不断累积,当达到一定阈值时可被细胞膜上的感应系统识别,从而引起受体蛋白的构象或基因变化,最终激活靶细胞的表达,使细菌适应外界环境刺激[14].根据作用对象和分子组成的差异,可将信号分子分为3类(图 1):革兰氏阴性菌的酰基高丝氨酸内酯(N-acylhomoserine lactones,AHLs);革兰氏阳性菌的寡肽类(Autoinducer peptides,AIPs)信号分子;自诱导因子Ⅱ(autoinducer-2,AI-2)[15].
|
图 1 AHLs、AIPs和AI-2 3种信号分子的化学结构式 Fig. 1 Chemical structures of three signal molecules: AHLs, AIPs, and AI-2 |
AHLs型QS是对细菌之间沟通研究最为广泛和深入的感应系统,已发现超过200种革兰氏阴性细菌均使用AHLs作为信号分子.AHLs分子由一个酰胺链和高丝氨酸内酯环组成(图 1),其中高丝氨酸内酯环是其特征结构,而酰胺链的结构则决定了AHLs对细菌的调控功能.该系统需要3个关键因素来实现其功能:AHLs信号分子、AHLs的合成蛋白(LuxI)和回应AHLs局部浓度的受体蛋白(LuxR)[16].AHLs是具有亲水性和膜透过性的两亲性化合物,可作为信使分子自由穿越或通过特定通道进入细胞的周围环境,当胞外AHLs浓度达到一定阈值时,LuxR型受体蛋白可感知AHLs局部浓度并与之结合,启动相关基因的转录表达,引发相应的协调反应,如形成生物膜、分泌胞外聚合物(extracellular polymeric substance,EPS)和种间竞争等[17].
1.2 AIPs型QSAIPs是革兰氏阳性菌主要的QS信号分子,是由5~26个氨基酸组成的既有线状又有环状化学结构的寡肽类物质(图 1),由细菌体内产生的前导肽蛋白经膜通道蛋白加工而成.AIPs的QS机理与AHLs相似,都是细胞感知胞外信号分子的浓度信息并对其进行回应,启动相关基因的转录表达[18].而与AHLs不同的是,AIPs无法自由穿过细胞膜,其传输需要ABC(ATP binding cassette)转运蛋白或其他膜通道蛋白的协助才能进入胞外环境中[19].由于污水处理生物反应器中的革兰氏阴性菌明显多于革兰氏阳性菌,导致关于革兰氏阳性菌中AIPs型QS对污水处理系统影响机理的研究尚不够深入.
1.3 AI-2型QSAI-2是一种呋喃基硼酸二酯类化合物,其在种间交流的作用首次报道于哈氏弧菌的生物发光研究.与具有特异性的AHLs和AIPs信号分子不同,AI-2是异种细胞间交流的通用信号分子,通过这类信号分子诱导基因表达的系统则被称为混合型QS系统.AI-2由LuxS酶合成,LuxS酶首先合成4, 5-二羟基-2, 3-乙酰基丙酮(4, 5-dihydroxy-2, 3-pentanedione,DPD),再通过自发重排形成不同的DPD衍生物,最终得到不同的AI-2(图 1)[20-21].LuxS酶广泛存在于大量的革兰氏阴性菌及阳性菌中,因此,许多种的革兰氏阴性和阳性菌都可以产生AI-2.此外,对AI-2信号分子的调控比AHLs具有更高的抗膜污染效率,而具有AI-2灭活功能的具体物质目前尚未明确[21].
1.4 QS在生物膜形成与分解中的作用生物膜定义为附着于物体表面被细菌自分泌的胞外聚合物包裹的有组织的细菌聚集体.生物膜的形成通常包含4个阶段:1)单个微生物细胞在膜表面自由移动并黏附,该过程发生的时间很短;2)微生物细胞分泌出EPS以提供更牢固的黏附,该不可逆过程是生物膜结构的早期发展;3)微生物在特定的区域增殖形成微菌落并最终成为成熟的生物膜,该过程较为漫长;4)微生物细胞或细胞群从微菌落中心缓慢分散,造成生物膜的溶解,该过程所需时间很长,可达几天甚至几个月.由于生物膜中的细胞密度高于浮游状态,生物膜中的细胞将接触更多的微生物副产物及次级代谢物,如QS信号分子[22].
细菌的QS系统可在不同水平对某些影响生物膜结构的因素进行调控:首先,当细菌受到外界环境因子(如温度、pH变化或有毒物质)刺激时,细胞的信号应答机制将被激活,细胞中相关基因的表达转录将被启动或改变,进而影响胞外多糖及蛋白分泌的变化,或造成鞭毛及菌毛等组成蛋白的变化,使细菌胞外代谢物的结构及细胞附属物的结构易于向物体表面黏附;当黏附的细菌细胞超过一定数量时即产生信号分子,随后当信号分子量达到一定阈值时可被细胞膜上的感应系统识别,从而启动相关基因的转录和表达以调控合成胞外聚合物等物质,最终使细胞大量聚集并形成成熟的生物膜结构[23].QS系统在生物膜形成中扮演重要角色,但其作用仍决定于细菌的种类及生物膜的形成阶段,因此,采用以QS系统为基础的技术手段控制复杂的生物膜形成过程仍需深入和系统的研究.
2 QQ技术的实现途径生物膜中QS信号分子的存在以及已证实的QS系统与细菌生物膜产生的潜在关系,为基于QS技术手段来实现膜污染控制提供了可能.QS系统虽然可调控细菌群体之间的交流沟通,却并非细菌生存、生长所必须.因此,对细菌QS系统进行干扰可能引起对某些细菌行为的抑制(如生物膜的形成),从而为膜污染的控制带来有利效果[24].群体感应猝灭(QQ)技术是一种通过对微生物细胞间的QS系统产生干扰,阻止QS依赖性基因的表达,破坏其参与细菌生物学功能的调控技术.由于QS系统依赖于各种信号分子及其受体蛋白的共同作用,能够影响信号分子与其受体蛋白识别或结合过程的方法都能够有效破坏QS系统.目前,群体感应猝灭技术主要有3种实现形式(图 2):抑制信号分子的产生;灭活或降解已产生的信号分子;干扰信号分子与受体蛋白的结合.此外,刺激系统中具有QQ功能的细菌活性或生长也可对QS系统产生干扰作用[25].

|
图 2 细菌的QS系统及QQ技术的3种实现途径 Fig. 2 Bacterial QS system and three approaches of realizing QQ technology |
抑制信号分子的产生,理论上可直接抑制细菌QS系统,即没有信号分子的产生,QS系统便不会被激活(图 2).信号分子的合成蛋白LuxI以S-腺苷甲硫氨酸(SAM)和酰基载体蛋白(acyl-ACP)为前体物合成信号分子,某些化合物由于与自诱导物前体物具有类似的结构,可实现对信号分子合成过程的体外抑制.例如,L/D-S-腺苷高半胱氨酸、全酰基载体蛋白、西奈芬净、丁酰-S腺苷甲硫氨酸等可以在细胞体外抑制AHLs的产生[26],然而,这些类似物易于影响细菌脂肪酸及氨基酸中心代谢途径.此外,呋喃酮也是一种潜在的群体感应抑制剂,Ponnusamy等[27]使用呋喃酮成功抑制了AHLs信号分子的产生,并显著减少了反渗透(reverse osmosis,RO)膜表面膜污染的形成,然而呋喃酮是一种有毒的化合物且具有不稳定性,因此,该化合物并不适合应用于水处理过程.
2.2 灭活或降解信号分子灭活信号分子,使其不能与受体蛋白结合被认为是抑制QS系统最有效的方式(图 2),这主要是因为该过程可在细菌胞外实现,从而可最大程度地避免对细胞其他功能造成影响.在已知的QS系统控制策略中,采用酶灭活信号分子的研究和应用最为广泛.大部分革兰氏阴性菌的自诱导物都是AHLs类化合物,由长度为4~18个碳的乙酰基链尾部和一个高丝氨酸内酯头部相连,一些细菌能够产生内酯酶和酰基转移酶,该类酶能够水解AHLs自诱导物,导致生成的酰基高丝氨酸的生物活性明显降低[28].例如,内酯酶主要作用于高丝氨酸内酯环,从五环中酯键碳与氧之间打开内酯环,破坏其结构;酰基转移酶则作用于内酯五环相连的酰基侧链,切断酰胺键,将信号分子分解为脂肪酸和高丝氨酸内酯环.除了这两种主要的感应猝灭酶,氧化还原酶也有灭活和改变AHLs信号分子的作用.此外,一种更加简便的灭活AHLs信号分子的方式是提高系统溶液的pH,即当pH大于7时,AHLs分子便会开环降解,许多高等生物常采用该策略对抗QS调控细菌的入侵[29].
2.3 干扰信号分子与受体蛋白的结合除了抑制或灭活信号分子,通过合成一些信号分子的化学结构类似物,与相应的受体蛋白竞争性结合,从而阻断信号分子与细胞内受体蛋白的正常结合,或使信号分子结合的有效性降低,最终也可干扰与生物膜形成相关的基因的表达和转录,达到抑制生物膜形成的目的(图 2).该类信号分子模拟化合物可从真菌、藻类和植物中分离提取得到.例如,从海洋红藻(Ddlisea pulchra)中可提取一种AHLs结构类似物卤化呋喃酮,该物质可促进费氏弧菌中LuxR的降解,破坏其QS系统[30];从香草豆中提取得到的香草醛,可有效干扰嗜水气单胞菌中AHLs的结合蛋白(C4, 6, 8-HSL和3-oxo-C8-HSL)[31].该类QS抑制剂也可通过化学合成得到,如对AHLs的侧链或内酯环进行化学修饰、增加AI-2的碳链长度或对AIPs分子进行截断等.此外,革兰氏阳性菌中的一些抑制剂,如克罗散泰(closantel)可改变激酶受体结构,从而阻碍信号分子与受体蛋白的结合[32].
3 QQ技术在膜污染控制中的应用 3.1 基于QQ技术的膜污染控制方法生物膜在许多水处理系统中发挥着有益作用,但其在膜滤系统(如MBR、超滤、纳滤、反渗透)中会黏附在滤膜表面,不利于工艺的长期稳定运行[33].若采用化学抗菌处理法(如杀菌剂或抗生素)来去除膜表面生物膜,容易引起系统中微生物的抗性.由于群体感应猝灭技术可在不影响细菌正常生长前提下,实现抑制生物膜形成的同时,使微生物产生抗性的几率最小化,因此,QQ技术在膜污染控制领域中具有良好的应用前景.自Yeon等[12]在2009年证明QS信号与膜污染之间的关系以来,众多学者试图将QQ技术应用于膜滤过程,并对各种基于QQ技术的群体猝灭剂,如QQ化合物、QQ酶、QQ细菌等,开展了广泛研究,以期获得更高效、更有前景的膜污染控制方法并在工程中获得应用.
3.1.1 群体猝灭化合物经证实,许多植物中含有QS猝灭化合物,从植物中提取的某些天然化合物能在不影响细菌生长的同时有效抑制细菌的QS系统.这类天然化合物在结构上与QS信号分子类似,可代替信号分子与受体蛋白结合,有些天然猝灭化合物还对LuxR/LasR信号分子受体有降解能力,从而达到干扰QS系统的效果[34].Ponnusamy等[31]发现,从香草豆中提取的香草醛可减少嗜水气单胞菌(A. hydrophila)AHLs信号分子的产生并干扰短链和长链AHL型群体感应,从而减少反渗透膜上生物膜的形成.Kappachery等[35]将香草醛作为QQ猝灭剂应用于反应器中,成功抑制了反渗透膜上生物膜的生长(抑制率达97%),从而证明了香草醛是能够在膜滤系统中有效减轻膜污染的天然QQ猝灭化合物.Xu等[36]考察了D-酪氨酸对细菌QS系统及生物膜形成的影响;研究发现,D-酪氨酸显著降低了细菌信号分子(AI-2)的产生,促进了生物膜剥离并减轻了膜污染.此外,从罗萨玫瑰中提取的茶多酚[37]、蒌叶提取物BFR[38]、牛至精油中提取的香芹酚[39]等都对细菌QS系统具有干扰作用,可有效缓解膜材料表面生物膜的形成.然而,植物中提取QS猝灭化合物需要更多的操作步骤,在实际工程中不具有经济性,这限制了其在膜污染控制过程中的应用.
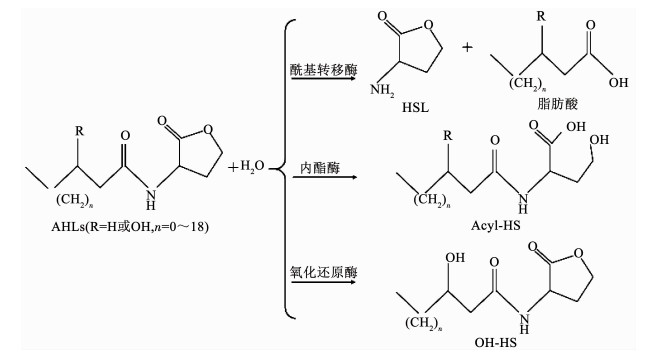
3.1.2 群体猝灭酶群体猝灭酶可降解或灭活QS信号分子(如AHLs),QQ酶以AHLs分子化学结构中许多切割位点作为靶向目标,破坏AHLs中的内酯环或侧链,从而降解或灭活信号分子.例如,内酯酶可使内酯环开环,使之成为酰化高丝氨酸(Acyl-HS)[40];酰基转移酶可使AHLs的酰基侧链断裂,生成高丝氨酸内酯环(HSL)和脂肪酸[41];氧化还原酶可催化还原酰基侧链,改变其结构,使之成为羟基高丝氨酸(OH-HS)[42],从而实现对QS系统的干扰,具体信号分子灭活原理如图 3所示.
|
图 3 3种QQ酶对AHLs信号分子的灭活原理 Fig. 3 Inactivation mechanism of AHLs signal molecules by three QQ enzymes |
在各种QQ酶中,酰基转移酶和内酯酶是效果最为显著且研究最为广泛的两种.Kim等[28]将酰基转移酶固定到纳滤膜表面,明显减少了膜表面EPS的含量,减缓了膜通量的降低.最近,Yu等[43]将酰基转移酶应用于MBR的膜污染控制中,并系统考察了不同因素(如HRT、硝化抑制剂、温度等)对QQ酶减缓膜污染效果的影响.结果表明,酰基转移酶在各试验条件下均实现了良好的膜污染控制效果.此外,为了进一步提高膜的抗污染性能,Zhu等[44]采用氧化石墨烯及酰基转移酶对PVDF膜进行改性,结果表明,改性得到的膜材料表面生物量仅为改性前的16%,该材料对生物膜的形成具有良好的抑制效果.
综上,使用QQ酶控制膜污染的优势在于,其引起细菌抗性的风险较低,且不会对细菌的正常生长造成影响.然而,当酶灭活后则会丧失QQ能力,因此,如何维持QQ酶的长期有效性并降低其处理成本是此技术需要解决的关键问题.
3.1.3 群体猝灭细菌为克服QQ酶易失活、成本高等缺点,采用群体猝灭细菌(QQ细菌)进行膜污染控制成为近年的研究热点.QQ细菌可分泌QQ酶以降解信号分子,或以各种信号分子为生长底物,致使系统中信号分子减少,从而达到群体感应猝灭效果[45].虽然QQ细菌的活性弱于直接添加QQ酶,但其具有成本低、稳定性好、易处理等优点,从而保证了其在实际应用中的可行性.目前,多种QQ细菌已成功从活性污泥中分离并已在MBR膜污染控制中应用.红球菌属(Rhodococcus sp. BH4)和甲基营养性芽孢杆菌(Bacillus methylotrophicus sp. WY)可分泌内酯酶,而内酯酶对大部分的AHLs具有分解作用[45];从韩国污水处理厂活性污泥中分离的假单胞菌(Pseudomonas sp. 1A1)可产生具有QQ效果的酰基转移酶[46].最近,各种新型QQ细菌不断被发现并分离,例如,Kampouris等[47]从市政污水污泥中分离了一种新型乳酸菌(Lactobacillus sp. SBR04MA)并考察了其减轻膜污染的性能,结果表明,该新型QQ细菌明显减少了SMP和EPS的产生,且未对系统COD的去除效率产生影响.Ham等[48]从MBR中分离得到一种肠球菌(Enterococcus species)HEMM-1,发现该新型QQ细菌能够有效降解AHLs并可减少膜表面细菌及活性污泥生物膜.新QQ细菌的分离证明了该类细菌在污水环境中的广泛存在,寻求更高效、更稳定的QQ细菌也是该领域研究的热点之一.此外,学者们还对QQ细菌在膜污染控制中的实际应用做了进一步的探索,例如,Lee等[49]将载有QQ细菌(红球菌属)的玻璃珠应用于中试规模的MBR反应器中,并用该反应器处理实际污水,结果显示,随着QQ细菌的加入,反应器的EPS浓度明显降低,且其QQ细菌活性及玻璃珠的稳定性维持了4个月以上,表明了QQ细菌具有在实际水处理过程中的应用潜力.Weerasekara等[50]将QQ细菌与氯化技术相结合研究在MBR中的膜污染控制,结果发现,将两种结合的技术相较单一技术具有显著提高的抗膜污染效果且能够节约大量的过滤能耗.将QQ细菌的膜污染控制效果应用于实际MBR系统中是该技术研究的目标,对QQ细菌在实际应用中抗膜污染效果的优化也是具有重要意义的研究方向.
除向系统中投加分离培养的QQ细菌以外,生物刺激法也是应用QQ细菌进行膜污染控制的有效手段.生物刺激,即向环境中添加特定的营养物质或电子受体以刺激系统中原有具有QQ活性的细菌增殖,对QQ细菌进行原位培养,从而增加系统中QQ细菌的数量.Yu等[51]将与AHLs结构类似的γ-己内酯(Gamma-caprolactone,GCL)用于刺激MBR中QQ细菌,随着γ-己内酯的加入,系统中EPS产量降低且膜污染得到有效控制;定量PCR结果显示,系统中AHL-内酯酶生成基因qsdA增多,从而导致了C6-HSL和C8-HSL的降解.
3.1.4 其他群体猝灭方法除细菌外,活性污泥中的有些真菌也具有QQ活性,例如,Lee等[52]将可产生法尼醇的真菌白色念珠菌(Candida albicans)负载于聚合物微珠中并应用于MBR的膜污染控制.定量PCR结果表明,该真菌分泌的法尼醇抑制了细菌AI-2信号分子的合成,从而干扰了QS系统并减轻了膜污染.此外,光催化技术也是干扰QS系统的有效途径,光催化产生的活性氧簇(reactive oxygen species,ROS)对细菌信号分子具有良好的降解作用.例如,经紫外光照射的TiO2产生大量ROS,可有效降解大肠杆菌(Escherichia coli K12)分泌的AI-2信号分子并有效缓解其生物膜的形成[53].然而,光催化技术对紫外光的需求是限制其应用的主要因素,关于光催化技术在膜污染控制领域的经济及技术可行性仍有待进一步研究.
3.2 基于QQ理论控制膜污染的猝灭剂固定化技术在感应猝灭化合物、酶及细菌等物质的实际应用过程中,往往需要配合合适的固定化技术,将感应猝灭剂固定于某种媒质,以实现其稳定的膜污染控制效果.固定化技术带来的优势有:减少感应猝灭剂的损失;保护感应猝灭剂不受系统中其他微生物的损害;其微孔结构可为QQ细菌的生长提供良好的溶解氧、营养和基质等的传输效果;具有良好的物理、化学、生物稳定性;与滤膜表面有更多的接触机会.下面对近年来常用的固定化载体作简要介绍.
3.2.1 QQ微球固定了感应猝灭剂的藻酸盐微球可在系统中随微生物絮体或颗粒一起自由流动,更充分地与滤膜表面的生物膜接触,并可更有效地捕获生物膜中的信号分子(图 4(a)).Kim等[54]将红球菌属(Rhodococcus sp. BH4)固定于藻酸盐微球上并研究了QQ细菌与物理冲刷联合作用对膜污染的影响.结果显示,加入载有QQ细菌的藻酸盐微球后,膜材料达到相同跨膜压差所用的时间延长了10倍.Waheed等[55]比较了QQ细菌固定于藻酸盐微球和悬浮QQ细菌两种情况下的MBR膜材料污染情况,并考察了有机负荷变化对膜污染的影响,结果表明,固定于藻酸盐微球上的QQ细菌表现出更强的膜污染控制能力,膜材料的污染速率随着有机负荷的提高而增加.藻酸盐微球在处理合成污水的MBR中取得了良好的膜污染缓解效果,然而在处理实际污水的MBR中的应用仍存在缺陷,主要是因为实际污水中含有大量的盐分和表面活性剂,藻酸盐微球在其中很容易破损分解.Kim等[56]采用相转化法将各种合成聚合物(如聚砜、聚醚砜、聚氟乙烯等)覆盖在藻酸盐微球表面,从而使微球成为一种微胶囊;改性后的微球显示出更好的机械强度和稳定性,然而其制备过程较为复杂,制备过程也可能导致微球中QQ细菌的部分死亡.

|
图 4 用于固定群体感应猝灭剂的载体材料 Fig. 4 Carrier materials for immobilizing QQ reagents |
虽然上述藻酸盐微球已具有良好的抗膜污染性能,但微球的内部核心部分无法发挥QQ活性,因此,研究者又基于藻酸盐微球提出了效率更高的圆筒或空心圆筒型媒介(图 4(b)).与藻酸盐微球相比,圆管的设计更有利于猝灭剂通过QQ媒介向外传输,且更容易对膜表面产生碰撞,从而具有更高的QQ活性.Lee等[57]将QQ圆筒与微球从形状及大小的角度对其抗膜污染效果进行了比较,结果表明,具有更细更长几何学外形的QQ圆筒因其更好的QQ活性和物理清洁效应,在膜污染控制中具有更高效率.此外,猝灭剂对信号分子的降解往往发生在QQ媒介表面而非内部,因此,在固定相同量猝灭剂的前提下,具有更高比表面积的媒介将具有更高的QQ效率.就此,Lee等[58]在圆筒基础上开展了进一步优化,设计出具有更高比表面积的QQ空心圆筒,该材料在MBR中具有更好的QQ活性并表现出更高的抗膜污染效率.
3.2.3 QQ管束将QQ细菌密封于聚合的或陶瓷的微孔中空纤维膜中的固定化方法称为QQ管束(图 4 (c)).Oh等[45]将基因重组的QQ大肠杆菌和红球菌属密封于微孔中空纤维膜内部制得QQ管束,该管束在MBR中显示出良好的抗膜污染性能,其QQ活性可稳定维持在80 d以上,且管束的加入并未影响MBR对有机物的去除.Jahangir等[59]进一步研究发现,在浸没式MBR系统中,QQ管束与滤膜的距离越近,混合液循环速率越高时,膜污染减缓效果越好.为进一步提高密封的QQ细菌活性,Cheong等[60]采用陶瓷膜制备了一种高密度QQ管束,虽然这种高密度的材料降低了QQ细菌(假单胞菌,Pseudomonas sp. 1A1)获得基质的速率,但通过向管束内部直接提供QQ细菌所需的新鲜营养液,管束的QQ活性得到显著提高,其抗膜污染性能也得到明显提升.
3.2.4 QQ磁性载体Yeon等[61]通过将聚合物和酰基转移酶在磁性媒介上逐层沉积的方法制得新型磁性QQ材料,与未负载的自由酶相比,该磁性酶载体在MBR中显示出更好的膜污染抑制效果及酶的稳定性,且仅需一块磁铁便可将水中的磁性酶载体回收;经过14 d的稳定性测试,该材料始终保持较高的QQ活性,未有明显的酶稳定性的损失.Lee等[62]将QQ酰基转移酶固定于磁性的介孔氧化硅上,应用于膜滤系统后,有效减轻了绿脓杆菌(Pseudomonas aeruginosa PAO1)在膜表面的污染,在实现良好的膜污染控制效果的同时,还能保证QQ酶的高度稳定性和磁性可分离性(图 4(d)).然而,在实际污水中对该磁性载体的完全分离回收存在的技术难点仍待解决.
3.2.5 QQ薄片3.2.1所述的QQ微球在装载平板膜组件的MBR中具有较好的应用效果,然而,其在中空纤维膜MBR中的应用却由于无法穿过浓密的膜束而受到了限制.为解决该难题,Nahm等[63]制备了一种称为QQ薄片的新型QQ固定化媒介,并应用于装载中空纤维膜组件的MBR反应器中(图 4(e)).该QQ薄片约1 cm×1 cm,厚度约0.5 mm,可在中空纤维膜表面自由滑动,对膜表面具有良好的洗刷效果.在加入相同体积QQ媒介的前提下,QQ薄片的总表面积明显大于QQ微球,且其QQ活性达到了QQ微球(直径约3.5 mm)的2.5倍.
3.2.6 QQ旋转式框架为进一步提高QQ技术的膜污染控制效果,Ergön-Can等[64]将QQ细菌(红球菌属)固定于覆盖有PVDF微孔滤膜的聚碳酸酯框架,制备了一种新型的旋转式QQ细菌载体框架(RMCF)(图 4(f)),将其与机械搅拌装置相连,并应用于MBR反应器中.对RMCF的抗膜污染性能进行检测发现,MBR中膜材料的跨膜压差增长速率降低了65%,该框架的物理(水力)和生物(QQ)作用共同实现了其膜污染缓解效果,且经过长期运行其QQ活性未见明显衰退.
3.2.7 QQ改性膜材料使用感应猝灭剂(QQ化合物或QQ酶)对膜材料进行原位改性也是提高膜抗污染性能的有效方法之一.Kim等[28]将酰基转移酶直接负载于纳滤膜表面来缓解纳滤过程中的膜污染,结果显示,带有QQ活性的膜材料减少了膜表面细菌的EPS分泌,并抑制了蘑菇状生物膜的形成;经超过20次反应和清洗的循环,该膜材料的酶活性仍能保持在其初始时的90%以上.最近,Kim等[65]首先通过酶吸附、沉淀、交联法(EAPC)将酰基转移酶固定于碳纳米管(CNTs)上,然后采用聚多巴胺覆盖法将该材料负载于PVDF膜上进行膜改性;改性后膜材料的透水性显著提高,跨膜压差增长率降低,膜表面生物膜的形成得到有效抑制.此外,Katebian等[66]采用物理沉积法将香草醛(vanillin)和肉桂醛(cinnamaldehyde)两种QQ化合物负载于反渗透膜表面来提高膜材料的原位抗污染性能,改性后膜材料表面的多糖、活细菌及死细菌显著减少,表明对膜材料进行QQ化合物改性也是缓解膜污染的有效方法.
4 结论及展望膜污染是影响MBR工艺广泛应用及其经济性、稳定性的关键问题.由于MBR中存在大量不断生长的微生物,膜表面的生物污染不可避免.对细菌群体感应(QS)系统和群体猝灭(QQ)机理的研究引发了人们对膜污染问题的新思考,而从抑制信号分子、干扰QS系统的角度抑制膜表面生物膜的形成成为膜污染控制领域的研究热点之一.采用QQ化合物、酶及细菌等方式抑制MBR中生物膜的产生从而缓解膜污染的方法已得到证实,将猝灭剂固定于不同载体以提高QQ活性、材料稳定性和抗污染性能的研究也不断被提出.经历了不到10年的发展,基于QQ理论的膜污染控制技术已从理论逐步走向试验阶段,相信其在未来膜污染控制的实际工程应用中具有良好前景.
根据近年来的研究现状,基于QQ理论的膜污染控制技术研究仍需在以下方面进行深入探索.
1) 将QQ技术应用于不同的水处理工艺后续可能存在各种问题,就MBR而言,大部分QQ技术均是通过产生猝灭剂实现抑制整个系统中细菌生物膜的形成,而细菌分泌的EPS等物质对细菌生长具有潜在有益作用,对细菌生物膜的长期抑制很可能对整个系统的水处理效果带来不利影响,如造成系统中污泥絮体或颗粒污泥的解絮等,因此,如何将QQ抑制生物膜的作用精确控制于膜材料表面也是今后研究的重点.
2) MBR中细菌群落的QS系统非常复杂,无法仅依赖一种猝灭剂实现对整个群落QS系统的干扰,如何将多种猝灭剂联用以获得更高效的膜污染抑制效果仍有待进一步研究,且猝灭剂对群落QS系统的影响机理仍需深入考察.
3) 采用QQ技术控制膜污染虽然具有较好的应用前景,但很难取代传统的膜污染控制方法(如曝气、反冲洗等),将QQ技术与传统膜污染控制方法相结合可能会获得更加理想的效果.
4) QQ猝灭剂的成本是决定QQ技术在实际MBR系统中应用的基本因素,只有保证猝灭剂的低成本才能使该技术的实际应用成为可能,而复杂水环境中的污染物对猝灭剂(如QQ细菌)效果的影响也是QQ技术在实际应用中需要解决的关键问题.
| [1] |
KRAUME M, DREWS A. Membrane bioreactors in waste water treatment: Status and trends[J]. Chemical Engineering Technology, 2010, 33(8): 1251. DOI:10.1002/ceat.201000104 |
| [2] |
ZHU Yijing, WANG Yayi, ZHOU Shuai, et al. Robust performance of a membrane bioreactor for removing antibiotic resistance genes exposed to antibiotics: Role of membrane foulants[J]. Water Research, 2018, 130: 139. DOI:10.1016/j.watres.2017.11.067 |
| [3] |
NEOH C H, NOOR Z Z, MUTAMIM N S A, et al. Green technology in wastewater treatment technologies: Integration of membrane bioreactor with various wastewater treatment systems[J]. Chemical Engineering Journal, 2016, 283: 582. DOI:10.1016/j.cej.2015.07.060 |
| [4] |
HWANG B K, LEE W N, YEON K M, et al. Correlating TMP increases with microbial characteristics in the bio-cake on the membrane surface in a membrane bioreactor[J]. Environmental Science Technology, 2008, 42(11): 3963. DOI:10.1021/es7029784 |
| [5] |
MONCLU Ú S H, DALMAU M, GABARRÓN S, et al. Full-scale validation of an air scour control system for energy savings in membrane bioreactors[J]. Water Research, 2015, 79: 1. DOI:10.1016/j.watres.2015.03.032 |
| [6] |
DREWS A. Membrane fouling in membrane bioreactors: Characterisation, contradictions, cause and cures[J]. Journal of Membrane Science, 2010, 363(1/2): 1. DOI:10.1016/j.memsci.2010.06.046 |
| [7] |
MENG Fangang, ZHANG Shaoqing, OH Y, et al. Fouling in membrane bioreactors: An updated review[J]. Water Research, 2017, 114: 151. DOI:10.1016/j.watres.2017.02.006 |
| [8] |
LE-CLECH P, CHEN V, FANE T A G. Fouling in membrane bioreactors used in wastewater treatment[J]. Journal of Membrane Science, 2006, 284(1/2): 17. DOI:10.1016/j.memsci.2006.08.019 |
| [9] |
XIONG Yanghui, LIU Yu. Biological control of microbial attachment: A promising alternative for mitigating membrane biofouling[J]. Applied Microbiology Biotechnology, 2010, 86(3): 825. DOI:10.1007/s00253-010-2463-0 |
| [10] |
YUN M A, YEON K M, PARK J S, et al. Characterization of biofilm structure and its effect on membrane permeability in MBR for dye wastewater treatment[J]. Water Research, 2006, 40(1): 45. DOI:10.1016/j.watres.2005.10.035 |
| [11] |
邱健, 贾振华, 李承光, 等. 细菌群体感应淬灭酶的研究进展[J]. 微生物学通报, 2006, 33(4): 139. QIU Jian, JIA Zhenhua, LI Chengguang, et al. Advance on bacterial quorum-quenching enzymes[J]. Microbiology China, 2006, 33(4): 139. DOI:10.3969/j.issn.0253-2654.2006.04.027 |
| [12] |
YEON K M, CHEONG W S, OH H S, et al. Quorum sensing: A new biofouling control paradigm in a membrane bioreactor for advanced wastewater treatment[J]. Environmental Science & Technology, 2009, 43(2): 380. DOI:10.1021/es8019275 |
| [13] |
LADE H, PAUL D, KWEON J H. N-Acyl homoserine lactone-mediated quorum sensing with special reference to use of quorum quenching bacteria in membrane biofouling control[J]. BioMed Research International, 2014, 162584. DOI:10.1155/2014/162584 |
| [14] |
CHOUDHARY S, SCHMIDT-DANNERT C. Applications of quorum sensing in biotechnology[J]. Applied Microbiology and Biotechnology, 2010, 86(5): 1267. DOI:10.1007/s00253-010-2521-7 |
| [15] |
RUTHERFORD S T, BASSLER B L. Bacterial quorum sensing: Its role in virulence and possibilities for its control[J]. Cold Spring Harbor Perspectives in Medicine, 2012, 2(11). DOI:10.1101/cshperspect.a012427 |
| [16] |
张海丰, 孙明媛, 于海欢. AHL-QS减缓膜生物反应器膜污染研究进展[J]. 化工进展, 2014, 33(5): 1300. ZHANG Haifeng, SUN Mingyuan, YU Haihuan. Research progress of the AHL-QS mitigation membrane fouling in membrane bioreactor[J]. Chemical Industry and Engineering Progress, 2014, 33(5): 1300. |
| [17] |
TAN C H, KOH K S, XIE C, et al. The role of quorum sensing signalling in EPS production and the assembly of a sludge community into aerobic granules[J]. The ISME Journal, 2014, 8(6): 1186. DOI:10.1038/ismej.2013.240 |
| [18] |
MILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annual Review of Microbiology, 2001, 55: 165. DOI:10.1146/annurev.micro.55.1.165 |
| [19] |
王楠, 魏云林, 唐兵, 等. 群体感应及其介导的抗噬菌体研究进展[J]. 中国微生态学杂志, 2014, 26(1): 114. WANG Nan, WEI Yunlin, TANG Bing, et al. Research advances on quorum sensing and its mediated anti-phage infection[J]. Chinese Journal of Microecology, 2014, 26(1): 114. |
| [20] |
姜黎明, 唐子腾, 柳陈坚, 等. AI-2/LuxS群体感应系统介导乳酸杆菌益生特性研究进展[J]. 生命科学, 2014, 26(4): 414. JIANG Liming, TANG Ziteng, LIU Chenjian, et al. The research advances of AI-2/LuxS quorum sensing system mediating lactobacillus probiotic properties[J]. Chinese Bulletin of Life Sciences, 2014, 26(4): 414. |
| [21] |
LEE K, KIM Y W, LEE S, et al. Stopping autoinducer-2 chatter by means of an indigenous bacterium (Acinetobacter sp. DKY-1): A new antibiofouling strategy in a membrane bioreactor for wastewater treatment[J]. Environmental Science & Technology, 2018, 52(11): 6237. DOI:10.1021/acs.est.7b05824 |
| [22] |
STOODLEY P, SAUER K, DAVIES D G, et al. Biofilms as complex differentiated communities[J]. Annual Review Microbiology, 2002, 56: 187. DOI:10.1146/annurev.micro.56.012302.160705 |
| [23] |
PARSEK M R, GREENBERG E P. Sociomicrobiology: The connections between quorum sensing and biofilms[J]. Trends Microbiol, 2005, 13(1): 27. DOI:10.1016/j.tim.2004.11.007 |
| [24] |
DONG Yihu, WANG Lianhui, ZHANG Lianhui. Quorum-quenching microbial infections: Mechanisms and implications[J]. Philosophical Transactions of the Royal Society B, 2007, 362(1483): 1201. DOI:10.1098/rstb.2007.2045 |
| [25] |
RASMUSSEN T B, GIVSKOV M. Quorum sensing inhibitors: A bargain of effects[J]. Microbiology, 2006, 152: 895. DOI:10.1099/mic.0.28601-0 |
| [26] |
PARSEK M R, VAL D L, HANZELKA B L, et al. Acyl homoserine-lactone quorum-sensing signal generation[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(8): 4360. DOI:10.1073/pnas.96.8.4360 |
| [27] |
PONNUSAMY K, PAUL D, KIM Y S, et al. 2(5H)-Furanone: A prospective strategy for biofouling-control in membrane biofilm bacteria by quorum sensing inhibition[J]. Brazilian Journal of Microbiology, 2010, 41(1): 227. DOI:10.1590/S1517-83822010000100032 |
| [28] |
KIM J H, CHOI D C, YEON K M, et al. Enzyme-immobilized nanofiltration membrane to mitigate biofouling based on quorum quenching[J]. Environmental Science & Technology, 2011, 45(4): 1601. DOI:10.1021/es103483j |
| [29] |
YATES E A, PHILIPP B, BUCKLEY C, et al. N-acylhomoserine lactones undergo lactonolysis in a pH-, temperature-, and acyl chain length-dependent manner during growth of Yersinia pseudotuberculosis and Pseudomonas aeruginosa[J]. Infection and Immunity, 2002, 70(10): 5635. DOI:10.1128/IAI.70.10.5635-5646.2002 |
| [30] |
刘佳, 郭继强, 李宪臻. 群体感应与群体淬灭及其在抗微生物感染中的潜在应用[J]. 生物技术通讯, 2010, 21(3): 428. LIU Jia, GUO Jiqiang, LI Xianzhen. Quorum sensing or quorum quenching and its potential application in protection against disease[J]. Letters in Biotechnology, 2010, 21(3): 428. DOI:10.3969/j.issn.1009-0002.2010.03.030 |
| [31] |
PONNUSAMY K, PAUL D, KWEON J H. Inhibition of quorum sensing mechanism and aeromonas hydrophila biofilm formation by vanillin[J]. Environmental Engineering Science, 2009, 26(8): 1359. DOI:10.1089/ees.2008.0415 |
| [32] |
STEPHENSON K, YAMAGUCHI Y, HOCH J A. The mechanism of action of inhibitors of bacterial two-component signal transduction systems[J]. Journal of Biological Chemistry, 2000, 275(49): 38900. DOI:10.1074/jbc.M006633200 |
| [33] |
WOODFORD N, ELLINGTON M J. The emergence of antibiotic resistance by mutation[J]. Clinical Microbiology and Infection, 2007, 13(1): 5. DOI:10.1111/j.1469-0691.2006.01492.x |
| [34] |
TEPLITSKI M, MATHESIUS U, RUMBAUGH K P. Perception and degradation of N-Acyl homoserine lactone quorum sensing signals by mammalian and plant cells[J]. Chemical Reviews, 2011, 111(1): 100. DOI:10.1021/cr100045m |
| [35] |
KAPPACHERY S, PAUL D, YOON J, et al. Vanillin, a potential agent to prevent biofouling of reverse osmosis membrane[J]. Biofouling, 2010, 26(6): 667. DOI:10.1080/08927014.2010.506573 |
| [36] |
XU Huijuan, LIU Yu. Reduced microbial attachment by D-amino acid-inhibited AI-2 and EPS production[J]. Water Research, 2011, 45(17): 5796. DOI:10.1016/j.watres.2011.08.061 |
| [37] |
ZHANG Juanmei, RUI Xin, WANG Li, et al. Polyphenolic extract from Rosa rugosa tea inhibits bacterial quorum sensing and biofilm formation[J]. Food Control, 2014, 42: 125. DOI:10.1016/j.foodcont.2014.02.001 |
| [38] |
SIDDIQUI M F, SAKINAH M, SINGH L, et al. Targeting N-acyl-homoserine-lactones to mitigate membrane biofouling based on quorum sensing using a biofouling reducer[J]. Journal of Biotechnology, 2012, 161(3): 190. DOI:10.1016/j.jbiotec.2012.06.029 |
| [39] |
GUTIERREZ-PACHECO M M, GONZALEZ-AGUILAR G A, MARTINEZ-TELLEZ M A, et al. Carvacrol inhibits biofilm formation and production of extracellular polymeric substances of Pectobacterium carotovorum subsp. carotovorum[J]. Food Control, 2018, 89: 210. DOI:10.1016/j.foodcont.2018.02.007 |
| [40] |
DONG Y H, XU J L, LI X Z, et al. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(7): 3526. DOI:10.1073/pnas.060023897 |
| [41] |
LIN Y H, XU J L, HU J Y, et al. Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes[J]. Molecular Microbiology, 2003, 47(3): 849. DOI:10.1046/j.1365-2958.2003.03351.x |
| [42] |
UROZ S, CHHABRA S R, CÁMARA M, et al. N-Acylhomoserine lactone quorum-sensing molecules are modified and degraded by Rhodococcus erythropolis W2 by both amidolytic and novel oxidoreductase activities[J]. Microbiology, 2005, 151: 3313. DOI:10.1099/mic.0.27961-0 |
| [43] |
YU Huarong, QU Fangshu, ZHANG Xiaolei, et al. Effect of quorum quenching on biofouling and ammonia removal in membrane bioreactor under stressful conditions[J]. Chemosphere, 2018, 199: 114. DOI:10.1016/j.chemosphere.2018.02.022 |
| [44] |
ZHU Zhenya, WANG Lei, LI Qingqing. A bioactive poly (vinylidene fluoride)/graphene oxide@acylase nanohybrid membrane: Enhanced anti-biofouling based on quorum quenching[J]. Journal of Membrane Science, 2018, 547: 110. DOI:10.1016/j.memsci.2017.10.041 |
| [45] |
OH H S, YEON K M, YANG C S, et al. Control of membrane biofouling in MBR for wastewater treatment by quorum quenching bacteria encapsulated in microporous membrane[J]. Environmental Science & Technology, 2012, 46(9): 4877. DOI:10.1021/es204312u |
| [46] |
CHEONG W S, LEE C H, MOON Y H, et al. Isolation and identification of indigenous quorum quenching bacteria, Pseudomonas sp. 1A1, for biofouling control in MBR[J]. Industrial & Engineering Chemistry Research, 2013, 52(31): 10554. DOI:10.1021/ie303146f |
| [47] |
KAMPOURIS I D, KARAYANNAKIDIS P D, BANTI D C, et al. Evaluation of a novel quorum quenching strain for MBR biofouling mitigation[J]. Water Research, 2018, 143: 56. DOI:10.1016/j.watres.2018.06.030 |
| [48] |
HAM S Y, KIM H S, CHA E, et al. Mitigation of membrane biofouling by a quorum quenching bacterium for membrane bioreactors[J]. Bioresource Technology, 2018, 258: 220. DOI:10.1016/j.biortech.2018.03.007 |
| [49] |
LEE S, PARK S K, KWON H, et al. Crossing the border between laboratory and field: Bacterial quorum quenching for anti-biofouling strategy in an MBR[J]. Environmental Science & Technology, 2016, 50(4): 1788. DOI:10.1021/acs.est.5b04795 |
| [50] |
WEERASEKARA N A, CHOO K H, LEE C H. Biofouling control: Bacterial quorum quenching versus chlorination in membrane bioreactors[J]. Water Research, 2016, 103: 293. DOI:10.1016/j.watres.2016.07.049 |
| [51] |
YU Huarong, LIANG Heng, QU Fangshu, et al. Biofouling control by biostimulation of quorum-quenching bacteria in a membrane bioreactor for wastewater treatment[J]. Biotechnology Bioengineering, 2016, 113(12): 2624. DOI:10.1002/bit.26039 |
| [52] |
LEE K, LEE S, LEE S H, et al. Fungal quorum quenching: A paradigm shift for energy savings in membrane bioreactor (MBR) for wastewater treatment[J]. Environmental Science & Technology, 2016, 50(20): 10914. DOI:10.1021/acs.est.6b00313 |
| [53] |
XIAO Xiang, ZHU Wenwen, LIU Qiuyue, et al. Impairment of biofilm formation by TiO2 photocatalysis through quorum quenching[J]. Environmental Science & Technology, 2016, 50(21): 11895. DOI:10.1021/acs.est.6b03134 |
| [54] |
KIM S R, OH H S, JO S J, et al. Biofouling control with bead-entrapped quorum quenching bacteria in membrane bioreactors: Physical and biological effects[J]. Environmental Science & Technology, 2013, 47(2): 836. DOI:10.1021/es303995s |
| [55] |
WAHEED H, XIAO Y Y, HASHMI I, et al. Insights into quorum quenching mechanisms to control membrane biofouling under changing organic loading rates[J]. Chemosphere, 2017, 182: 40. DOI:10.1016/j.chemosphere.2017.04.151 |
| [56] |
KIM S R, LEE K B, KIM J E, et al. Macroencapsulation of quorum quenching bacteria by polymeric membrane layer and its application to MBR for biofouling control[J]. Journal of Membrane Science, 2015, 473: 109. DOI:10.1016/j.memsci.2014.09.009 |
| [57] |
LEE S, LEE S H, LEE K, et al. Effect of the shape and size of quorum-quenching media on biofouling control in membrane bioreactors for wastewater treatment[J]. Journal of Microbiology Biotechnology, 2016, 26(10): 1746. DOI:10.4014/jmb.1605.05021 |
| [58] |
LEE S H, LEE S, LEE K, et al. More efficient media design for enhanced biofouling control in a membrane bioreactor: Quorum quenching bacteria entrapping hollow cylinder[J]. Environmental Science & Technology, 2016, 50(16): 8596. DOI:10.1021/acs.est.6b01221 |
| [59] |
JAHANGIR D, OH H S, KIM S R, et al. Specific location of encapsulated quorum quenching bacteria for biofouling control in an external submerged membrane bioreactor[J]. Journal of Membrane Science, 2012, 411: 130. DOI:10.1016/j.memsci.2012.04.022 |
| [60] |
CHEONG W S, KIM S R, OH H S, et al. Design of quorum quenching microbial vessel to enhance cell viability for biofouling control in membrane bioreactor[J]. Journal of Microbiology and Biotechnology, 2014, 24(1): 97. DOI:10.4014/jmb.1311.11008 |
| [61] |
YEON K M, LEE C H, KIM J. Magnetic enzyme carrier for effective biofouling control in the membrane bioreactor based on enzymatic quorum quenching[J]. Environmental Science & Technology, 2009, 43(19): 7403. DOI:10.1021/es901323k |
| [62] |
LEE B, YEON K M, SHIM J, et al. Effective antifouling using quorum-quenching acylase stabilized in magnetically-separable mesoporous silica[J]. Biomacromolecules, 2014, 15(4): 1153. DOI:10.1021/bm401595q |
| [63] |
NAHM C H, CHOI D C, KWON H, et al. Application of quorum quenching bacteria entrapping sheets to enhance biofouling control in a membrane bioreactor with a hollow fiber module[J]. Journal of Membrane Science, 2017, 526: 264. DOI:10.1016/j.memsci.2016.12.046 |
| [64] |
ERGÖN-CAN T, KÖSE-MUTLU B, KOYUNCU I, et al. Biofouling control based on bacterial quorum quenching with a new application: Rotary microbial carrier frame[J]. Journal of Membrane Science, 2017, 525: 116. DOI:10.1016/j.memsci.2016.10.036 |
| [65] |
KIM T H, LEE I, YEON K M, et al. Biocatalytic membrane with acylase stabilized on intact carbon nanotubes for effective antifouling via quorum quenching[J]. Journal of Membrane Science, 2018, 554: 357. DOI:10.1016/j.memsci.2018.03.020 |
| [66] |
KATEBIAN L, HOFFMANN M R, JIANG S C. Incorporation of quorum sensing inhibitors onto reverse osmosis membranes for biofouling prevention in seawater desalination[J]. Environmental Engineering Science, 2018, 35(4): 261. DOI:10.1089/ees.2017.0129 |
 2019, Vol. 51
2019, Vol. 51


