2. 上海市政工程设计研究总院(集团)有限公司, 上海 200092
2. Shanghai Municipal Engineering Design Institute (Group) Co., Ltd., Shanghai 200092, China
目前,中国城镇污水处理厂普遍采用活性污泥法去除污水中的氮、磷.传统生物脱氮除磷过程需要消耗碳源,然而,城市生活污水碳源含量普遍较低,导致BNR脱氮除磷效率很低.为了提高脱氮除磷效率,往往要投加外碳源,如甲醇、乙酸钠等[1].此外,采用活性污泥法时微生物的不断生长导致大量剩余污泥的产生.为避免这些污泥对环境造成危害,需要进行减量化、稳定化处理.厌氧消化技术是污泥减量化、稳定化的有效技术之一.该技术包括3个阶段:水解、酸化、产甲烷,只进行前2个阶段时称为厌氧发酵.污泥厌氧发酵生成的短链脂肪酸(SCFAs)是生物脱氮除磷所需的优质碳源[2-4],可以用来提高污水脱氮除磷效率,并且碱性pH可以强化SCFAs的生成量[5-6].
然而,已有研究在使用污泥发酵物作碳源时,大多将发酵液和发酵污泥进行了分离,且用于处理配水.发酵后的污泥粒度变小且含有大量的黏性物质,如蛋白质和多糖,会导致污泥的脱水性变差[7-8],要想短时间内分离发酵液和发酵污泥,仅靠自然沉淀是无法完成的,需要使用离心机,这无疑增加了运行成本.此外,污泥碱性厌氧发酵过程中伴随有氮、磷的释放[4, 9-10],Tong等[11-12]认为发酵液中的氮磷会增加BNR系统的负荷,在使用发酵液做碳源之前,需要将其中的氮磷去除.但是,Yuan等[6]对未去除氮磷的污泥碱性发酵液作碳源的实用性进行了评价,表明当污泥发酵液引入到待处理的污水中时,待处理污水的化学需氧量(COD)增加了31.65 mg/L,相当于原来COD的20%,而氮磷只增加了原来的2.7%,显然,引入的COD可以用来除去引入的氮磷,还可以用来去除待处理污水中的氮磷.
基于已有研究利用污泥发酵物做碳源的缺点,提出了一种新的污泥发酵物的使用方法,即污泥发酵物(指既不进行发酵液与污泥的分离,也不去除副产物氮和磷)直接做生活污水脱氮除磷的碳源,旨在简化使用步骤,降低使用成本,同时强化生活污水脱氮除磷效果.在传统生物脱氮除磷中,反硝化和厌氧释磷是消耗碳源的两个主要过程,因此,以实际生活污水为处理对象,通过以上两个过程来探讨污泥碱性厌氧发酵物做碳源的可行性.此外,对污泥碱性厌氧发酵物中主要细菌的活性进行测定,考察发酵物的引入对污水脱氮除磷系统菌群结构的影响.
1 实验 1.1 实验材料实验用污泥源于北京市高碑店污水处理厂的二沉池回流污泥,经过一段时间驯化,具有很好的脱氮除磷性能,污泥质量浓度MLSS在(6 000±100)mg/L.实验用污水为实际生活污水,取自北京工业大学西校区家属院化粪池出水,具体参数见表 1.实验用污泥厌氧发酵物取自稳定运行的半连续碱性厌氧发酵系统,SRT为6,具体参数见表 2.
| 表 1 实验用污水基本特性 Tab. 1 Characteristics of municipal waste water |
| 表 2 污泥碱性厌氧发酵物基本特性 Tab. 2 Characteristics of sludge alkaline anaerobic fermentation products |
将0.5 L污泥和0.5 L生活污水混合均匀置于反应器中,共设置5组反应器,反应器体积均为1.5 L,有效体积为1 L,编号依次为1#、2#、3#、4#、5#,分别置于磁力搅拌器上,转速为120 r/min,温度在(25±2)℃,各反应器分别投加NaNO3,使得NO3--N质量浓度在20~25 mg/L,同时向2#、3#、4#、5#反应器依次投加20,50,100,200 mL的碱性厌氧发酵物.实验前,每组反应器曝氮气3 min,去除反应器中的溶解氧,维持缺氧环境,5组反应器均进行60 min的反硝化过程.
1.2.2 硝化过程由于投加的发酵物未去除副产物氮(主要以NH4+-N的形式存在),在反硝化结束后又进行了硝化过程实验,考察发酵物的不同投加量对硝化过程的影响.即将反硝化结束后的1#、2#、3#、4#、5#进行硝化过程,溶解氧DO在(1.0±0.2)mg/L.
1.2.3 厌氧释磷过程将0.5 L污泥和0.5 L生活污水混合均匀置于反应器中,共设置5组反应器,反应器体积均为1.5 L,有效体积为1 L,编号依次为6#、7#、8#、9#、10#,分别放在磁力搅拌器上,转速为120 r/min,温度在(25±2)℃,向7#、8#、9#、10#反应器依次投加20,50,100,200 mL的碱性厌氧发酵物.实验前,每组反应器曝氮气3 min,去除反应器中的溶解氧,维持厌氧环境,整个实验运行时间为120 min.
1.2.4 细菌活性一方面半连续碱性厌氧发酵系统的污泥取自除碳脱氮SBR中试系统,且该系统长期稳定实现短程硝化;另一方面污水处理系统中发挥脱氮的功能菌是硝化菌和反硝化菌,因此,对发酵物中的硝化菌和反硝化菌的活性进行了测定.分别取新鲜污泥和碱性厌氧发酵污泥,离心弃上清液,再用蒸馏水清洗离心2次,然后用蒸馏水调配2种污泥的MLSS在(3 000±100)mg/L.本实验设有4组反应器,有效体积为1.5 L,其中2组反应器的接种污泥是新鲜污泥(1组用于硝化活性实验、另1组用于反硝化活性实验),另2组是发酵后的污泥(1组用于硝化活性实验、另1组用于反硝化活性实验).将4组反应器置于磁力搅拌器上,转速为120 r/min.
硝化活性实验:反应初始,向各反应器投加NH4Cl,使得NH4+-N质量浓度在20~25 mg/L,DO在2~5 mg/L,取样周期为0.5 h(反应后期改为1 h).反硝化活性实验:每组反应器曝氮气3 min,去除反应器中的溶解氧,维持缺氧环境,反应初期,向各反应器投加NaNO2和乙酸钠,使得NO2--N质量浓度在20~25 mg/L,SCOD质量浓度在200 mg/L左右,取样周期为10 min.此外,取新鲜污泥和发酵后的污泥进行死活细胞形态的鉴定.
1.3 分析方法MLSS、MLVSS采用重量法测定;COD采用快速测定仪5B-3型检测;NH4+-N、NO2--N、NO3--N和PO43--P采用流动注射分析仪测定(LachatQuikChem 8500 series 2).SCFAs采用Agilent 6890N气相色谱仪测定,采用Agilent DB-WAXetr(30 m×0.53 mm×0.001 mm)色谱柱,氮气(N2)作载气,流速为20 mL/min;检测器为氢火焰检测器(FID);进样口温度为220 ℃;检测器温度控制在250 ℃.采用程序升温,起始炉温80 ℃运行1 min,然后以20 ℃/min的速度升温到180 ℃,运行1 min,最后以10 ℃/min的速度升温到220 ℃,运行2 min,1个样品的整个运行时间为12 min.进样体积为2.0 μL;每个样品测定2次,取平均值进行分析.
细胞的形态采用LIVE/DEAD BacLight染色试剂盒进行鉴定,该试剂盒包括SYTO®9和碘化丙啶(PI)2种染色剂.鉴定原理:这2种染色剂均能与细胞核酸结合,只是SYTO®9染色剂结合所有细胞的核酸并将其染成绿色,而PI只能进入细胞膜受损的细胞,与核酸结合并将其染成红色,具体操作步骤如下:
1) 取样.取1.5 mL待测污泥混合液(MLSS约为1 000 mg/L)于2 mL Eppendorf管中;
2) 配制染色剂.等体积混合SYTO®9和PI 2种染色剂,摇匀;
3) 染色.向每个样品中加入10 μL染色剂混合液;然后置于黑暗环境15 min,使染色剂与细胞核酸充分结合染色;
4) 拍照.将样品涂在载玻片上,自然风干,涂松油,采用OLYMPUS_DP72型荧光显微镜观察每个泥样,最终选取30张拍摄清晰的照片,通过Image-Pro® Plus软件进行统计.
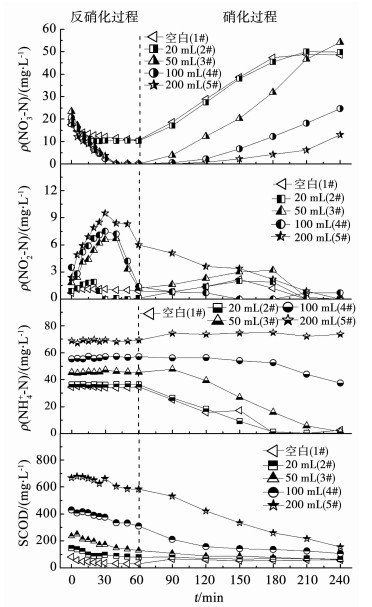
2 结果与讨论 2.1 反硝化脱氮过程图 1为不同投加量的发酵物作为外加碳源时,反硝化过程中NO3--N、NO2--N和SCOD的变化.反应初期,由于易被生物利用的有机物浓度较高,NO3--N质量浓度通过反硝化作用下降较快,随着反应不断进行,可利用有机物浓度降低,NO3--N被还原的速率逐渐减缓.当投加量为50,100,200 mL时,NO3--N在60 min内被全部还原;然而,当投加量减少至20,0 mL时,反应结束时仍有部分NO3--N未被去除,质量浓度分别为10.3,10.6 mg/L.尽管3#~5#反应器在反硝化结束时NO3--N被反硝化完全,但是积累部分NO2--N,质量浓度分别为1.2,1.4,6.0 mg/L,同样地,1#也有NO2--N的积累(0.9 mg/L).后者NO2--N积累是由可利用有机物的缺乏造成的,图 1所示的SCOD质量浓度变化可以佐证.而前者出现NO2--N积累是因为其反应器的pH较高,本实验投加的发酵物是从碱性发酵系统排出,其pH在10±0.2,当发酵物投加量越多,反硝化过程的pH也越高,已有研究表明[13], 在较高pH条件下易实现短程反硝化,即NO2--N的积累.无论NO3--N是以N2的形式去除,还是转化生成NO2--N,反应结束时以氮氧化合物(NOx--N)质量浓度高低表征反硝化效果.当发酵物投加量为50 mL时,NOx--N质量浓度最低,仅为1.2 mg/L,根据式(1)计算得出反硝化效率为94.9%.
|
图 1 不同投加量碱性污泥厌氧发酵物作外加碳源的反硝化和硝化情况 Fig. 1 Denitrification and nitrification by adding different dosages of sludge alkaline anaerobic fermentation products as carbon source |
| $ 反硝化效率=\\ \frac { \rho _ { \mathrm { 始 } } \left( \mathrm { NO } _ { 3 } ^ { - } - \mathrm { N } \right) - \rho _ { 末 } \left( \mathrm { NO } _ { 3 } ^ { - } - \mathrm { N } \right) - \rho _ { 末 } \left( \mathrm { NO } _ { 2 } ^ { - } - \mathrm { N } \right) } { \rho _ { \mathrm { 始 } } \left( \mathrm { NO } _ { 3 } ^ { - } - \mathrm { N } \right) } $ | (1) |
式中:ρ始(NO3--N)为初始NO3--N质量浓度,ρ末(NO3--N)为反应结束时NO3--N质量浓度,ρ末(NO2--N)为反应结束时NO2--N质量浓度.
2.2 硝化过程硝化过程可用NH4+-N质量浓度的变化表征,如图 1所示.随着发酵物投加量的增加,硝化反应的初始NH4+-N质量浓度也不断增加,从34.6 mg/L增加至69.3 mg/L,同时,SCOD质量浓度从30 mg/L增加至583 mg/L.随着硝化反应的不断进行,SCOD质量浓度不断减小并趋于稳定,NH4+-N质量浓度在1~4#反应器中也逐渐减少,而5#中的NH4+-N质量浓度基本不变.这是因为5#反应器在反硝化末仍然有较高质量浓度的SCOD,异养菌优先利用这些SCOD进行代谢生长,待其降解这些SCOD后,硝化菌才能开始硝化反应[14],而5#在180 min内一直处于异养菌降解SCOD的过程,导致硝化过程几乎没有发生.同样,这也是3#和4#硝化反应滞后于1#和2#的原因.经过180 min的硝化反应,1~5#的最终SCOD质量浓度依次为59,63,61,106,154 mg/L,氨氮质量浓度分别为2.6,0.3,1.5,37.4,73.6 mg/L.当发酵物投加量为20和50 mL时,几乎不会增加硝化过程有机负荷和氮负荷.
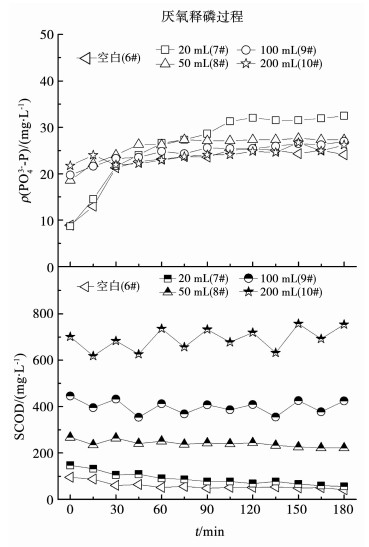
2.3 厌氧释磷过程如图 2所示,厌氧释磷过程的PO43--P质量浓度随着发酵物投加量的不同而不同.反应初始,由于发酵物未除去副产物磷,随着其投加量的增加,PO43--P质量浓度随之增加,随着反应的不断进行,5组反应器中最终PO43--P质量浓度均增大.在0~30 min内,6#~9#反应器的释磷速率呈现直线上升趋势,只是投加量为0, 20 mL的释磷速率大于投加量为50,100 mL的;在30~180 min,其释磷速率逐渐变慢.投加量为200 mL的释磷速率在整个过程均表现缓慢增加的趋势,由初始的21.7 mg/L变为26.2 mg/L,净释磷量只有4.5 mg/L,而6~9#的净释磷量分别为15.2,23.8,8.7,7.3 mg/L,得出净释磷量的大小顺序为10# < 9# < 8# < 6# < 7#.然而各反应器中初始SCOD质量浓度的大小顺序为6# < 7# < 8# < 9# < 10#,这是因为当污泥质量浓度一定时,微生物体内的糖原也是一定的,当其耗尽时,即便有过量的SCOD,聚磷菌也不再释磷[15].
|
图 2 不同投加量的碱性污泥厌氧发酵物作外加碳源的释磷情况 Fig. 2 Phosphorus release by adding different dosages of sludge alkaline anaerobic fermentation products as carbon source |
在硝化过程中,碱性厌氧发酵前的新鲜污泥表现出了硝化活性,如图 3,经过6 h的硝化反应,NH4+-N质量浓度从23.4 mg/L降低到1.5 mg/L,且NH4+-N转化为NO2--N,只有少量的NO3--N生成,这是因为该污泥取自除碳脱氮SBR中试系统,具有短程硝化的特性.然而,污泥经过碱性厌氧发酵后,其硝化活性基本消失,表现为NO2--N和NO3--N质量浓度与初始质量浓度基本一样,NH4+-N质量浓度不仅没有降低反而从24.9 mg/L增加到35.7 mg/L.这是由于污泥发酵后释放了NH4+-N,虽然污泥被淘洗,依然有部分NH4+-N附着在污泥中,经过不断地搅拌和曝气后,这部分NH4+-N又脱落到反应器中,导致NH4+-N质量浓度增加.

|
图 3 污泥碱性厌氧发酵前后的硝化细菌活性和反硝化菌活性 Fig. 3 Activities of nitrifying and denitrifying bacteria involved in sludge before and after alkaline anaerobic fermentation |
同样地,在反硝化过程中,碱性厌氧发酵前的新鲜污泥表现出了反硝化活性,反硝化细菌利用SCOD中可生物降解的有机物,将NO2--N还原成N2,经过60 min的缺氧搅拌,NO2--N质量浓度从19.7 mg/L降低到0.9 mg/L;而碱性厌氧发酵后的污泥没有反硝化活性,NO2--N质量浓度维持在20.0 mg/L,SCOD质量浓度呈现略微上升的的趋势,这同硝化过程中NH4+-N质量浓度上升的原因一样.
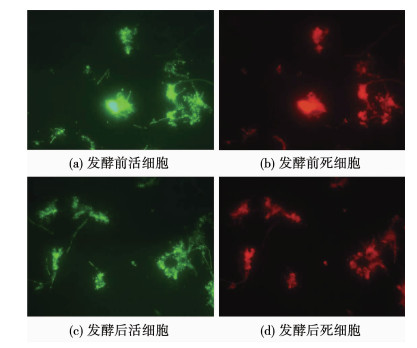
污泥经过碱性厌氧发酵后既没有硝化活性也没有反硝化活性,有两种可能性:一种是污泥中微生物的细胞结构破坏,另一种是污泥中微生物的细胞结构完整而活性被抑制.图 4为通过LIVE/DEAD技术观察的污泥碱性厌氧发酵前后的细胞死活情况,根据Image-Pro® Plus统计数据得出碱性厌氧发酵前新鲜污泥里的活细胞:死细胞为2.98,碱性厌氧发酵后污泥里的活细胞:死细胞为1.67,这表明发酵后的污泥部分细胞结构破坏,不过仍有部分细胞结构依然完整.硝化菌是自养好氧菌,反硝化菌是异养厌氧菌,它们生长的最适pH分别在7.5~8.2和7.0~8.0,而污泥发酵系统属于厌氧环境,且pH在10±0.2,显然超出了2种细菌的最佳生活环境范围,它们的活性受到抑制可能是其细胞结构遭到破坏.而细胞结构依然完整的可能属于水解酸化菌等能适应碱性厌氧环境的微生物.
|
图 4 污泥碱性厌氧发酵前后的细胞死活情况 Fig. 4 Fate of cells involved in sludge before and after alkaline anaerobic fermentation |
1) 污泥厌氧发酵物直接做反硝化脱氮的碳源是可行的,当向初始SCOD质量浓度为114 mg/L、NO3--N质量浓度为20~25 mg/L、PO43--P质量浓度为3.5 mg/L的污水中投加50 mL污泥发酵物(SCOD质量为198 mg、氮质量为12.9 mg、碳氮比为15.3)时,反硝化脱氮效果最好,反硝化末仅剩1.2 mg/L的NO2--N,对应硝化过程结束时的SCOD质量浓度为61 mg/L,氨氮质量浓度1.5 mg/L.
2) 污泥厌氧发酵物直接做厌氧释磷的碳源是可行的,当向初始SCOD质量浓度为114 mg/L、PO43--P质量浓度为3.5 mg/L、NO3--N质量浓度为0.2 mg/L的污水中投加20 mL污泥发酵物(SCOD质量为79 mg、氮质量为5.2 mg、磷质量为1.6 mg、碳氮比为15.3、碳磷比为49.5)时,释磷量最多,高达23.8 mg/L;随着投加量的增多,释磷量不仅没有升高,反而会降低.
3) 污泥发酵物中硝化菌和反硝化菌的细胞结构遭到破坏,其活性均被抑制,因此,发酵物的引入不影响污水脱氮除磷处理系统主要菌群结构的稳定性.
| [1] |
HWANG B, LU Qihong, DE TOLEDO R A, et al. Enhanced nitrogen removal from sludge reject water by methanol addition using sequencing batch biofilm reactor[J]. Desalination and Water Treatment, 2016, 57(19): 8730. DOI:10.1080/19443994.2015.1022800 |
| [2] |
JI Zhouying, CHEN Yinguang. Using sludge fermentation liquid to improve wastewater short-cut nitrification-denitrification and denitrifying phosphorus removal via nitrite[J]. Environmental Science and Technology, 2010, 44(23): 8957. DOI:10.1021/es102547n |
| [3] |
LI Xiang, CHEN Hong, HU Lanfang, et al. Pilot-scale waste activated sludge alkaline fermentation, fermentation liquid separation, and application of fermentation liquid to improve biological nutrient removal[J]. Environmental Science and Technology, 2011, 45(5): 1834. DOI:10.1021/es1031882 |
| [4] |
AHN Y H, SPEECE R E. Elutriated acid fermentation of municipal primary sludge[J]. Water Research, 2006, 40(11): 2210. DOI:10.1016/j.watres.2006.03.022 |
| [5] |
CHEN Yinguang, JIANG Su, YUAN Hongying, et al. Hydrolysis and acidification of waste activated sludge at different pHs[J]. Water Research, 2007, 41(3): 683. DOI:10.1016/j.watres.2006.07.030 |
| [6] |
YUAN Yue, WANG Shuying, LIU Ye, et al. Long-term effect of pH on short-chain fatty acids accumulation and microbial community in sludge fermentation systems[J]. Bioresource Technology, 2015, 197: 56. DOI:10.1016/j.biortech.2015.08.025 |
| [7] |
KARR P R, KEINATH T M. Influence of particle size on sludge dewaterability[J]. Journal Water Pollution Control Federation, 1978, 50(8): 1911. |
| [8] |
NEYENS E, BAEYENS J. A review of thermal sludge pre-treatment processes to improve dewaterability[J]. Journal of Hazardous Materials, 2003, 98(1/2/3): 51. DOI:10.1016/S0304-3894(02)00320-5 |
| [9] |
YUAN Hongying, CHEN Yinguang, ZHANG Huaxing, et al. Improved bioproduction of short-chain fatty acids (SCFAs) from excess sludge under alkaline conditions[J]. Environmental Science and Technology, 2006, 40(6): 2025. DOI:10.1021/es052252b |
| [10] |
JIANG Su, CHEN Yinguang, ZHOU Qi, et al. Biological short-chain fatty acids (SCFAs) production from waste-activated sludge affected by surfactant[J]. Water Research, 2007, 41(14): 3112. DOI:10.1016/j.watres.2007.03.039 |
| [11] |
TONG Juan, CHEN Yinguang. Enhanced biological phosphorus removal driven by short-chain fatty acids produced from waste activated sludge alkaline fermentation[J]. Environmental Science and Technology, 2007, 41(20): 7126. DOI:10.1021/es071002n |
| [12] |
TONG Juan, CHEN Yinguang. Recovery of nitrogen and phosphorus from alkaline fermentation liquid of waste activated sludge and application of the fermentation liquid to promote biological municipal wastewater treatment[J]. Water Research, 2009, 43(12): 2969. DOI:10.1016/j.watres.2009.04.015 |
| [13] |
鲍方博.反硝化耦合厌氧氨脱氮研究[D].北京: 北京工业大学, 2016 BAO Fangbo. The research of denitrification coupling anaerobic ammonia oxidation for nitrogen removal[D]. Beijing: Beijing University of Technology, 2016 |
| [14] |
BRDJANOVIC D, VAN LOOSDRECHT M C M, HOOIJMANS C M, et al. Bioassay for glycogen determination in biological phosphorus removal systems[J]. Water Science and Technology, 1998, 37(4/5): 541. DOI:10.1016/S0273-1223(98)00157-7 |
| [15] |
LIAO B Q, ALLEN D G, DROPPO I G, et al. Surface properties of sludge and their role in bioflocculation and settleability[J]. Water Research, 2001, 35(2): 339. DOI:10.1016/S0043-1354(00)00277-3 |
 2019, Vol. 51
2019, Vol. 51


