纳米抗菌材料由于其高效的抗菌作用及无消毒副产物生成风险,近年来在水处理消毒领域受到关注[1].其中,纳米银(nAg)由于其高灭菌活性和对人体无害的特点,尤其受到关注和广泛研究[2-3].Dankovich等[4]报道nAg可以高效地灭活水中的大肠杆菌(E.coli)和粪肠球菌;Guzman等[5]发现小尺寸的nAg颗粒相比大尺寸的对于革兰氏阴性菌(E.coli、绿脓杆菌)和革兰氏阳性菌(金黄色葡萄球菌)均具有更好的抗菌效果.
对于金属类纳米抗菌材料,一般认为金属离子的溶出及与细菌细胞的作用是其抗菌机理之一,但是,对于纳米材料抗菌消毒体系,纳米材料与细菌细胞的接触是其发挥抗菌能力更重要的环节.Ma等[6]报道纳米银/氧化石墨烯复合材料能够通过氢键和电荷作用加速其与细菌的接触而使该材料具有高效灭菌能力;黄天地等[7]发现纳米铜/多壁碳纳米管高效的抗菌原因在于多壁碳纳米管大大促进了纳米铜和目标细菌的接触.因此,强化纳米抗菌材料与细菌的接触是提高其抗菌性能的关键因素.水体中细菌表面往往带有负电荷,因此,表面呈正电性的纳米抗菌材料应能够更快地通过静电作用接触细菌以达到杀菌的效果.
本研究拟利用壳聚糖季铵盐对纳米银进行表面修饰,以制备出表面呈正电性的抗菌材料.高相对分子质量的聚合季铵盐(QCS)一般对人体无毒,除具正电性外,本身也为一种抗菌材料,被广泛应用于个人护理品和农业中.本研究中所制备QCS/nAg因表面呈正电性,且兼具QCS和nAg的抗菌能力,预期具有高效的抗菌活性.以E.coli为主要目标细菌,以表面接近中性的聚乙烯吡咯烷酮/纳米银(PVP/nAg)和负电性的柠檬酸盐/纳米银(Citrate/nAg)为参比纳米抗菌材料,对QCS/nAg灭活水中细菌活性进行了研究,并对QCS/nAg抗菌消毒体系影响因素、抗菌机理进行了讨论.
1 实验 1.1 实验材料壳聚糖季铵盐(相对分子质量10万)购自Cool Chemistry;硝酸银(AgNO3)购于Sigma-aldrich西格玛奥德里奇(上海)贸易有限公司;葡萄糖、硼氢化钠、氨水、无水乙醇均购于国药集团化学试剂有限公司.以上所有药品均为分析纯.大肠杆菌冻干粉(ATCC 53338)和枯草杆菌冻干粉(B.sub,ATCC 6633)均购自美国ATCC公司.E.coli和B.sub均在营养肉汤培养基中有氧、37 ℃条件下过夜培养.
1.2 抗菌材料制备与表征首先配置一定浓度的溶液.AgNO3溶液:25 mmol/L;硼氢化钠:6.25 mmol/L;QCS溶液:10 mg/mL;葡萄糖溶液:1 000 mmol/L.所有溶液现用现配.将AgNO3溶液和QCS溶液按照1: 5(体积比)混合并搅拌,得到有白色浑浊的溶液(有氯化银沉淀生成),向浑浊溶液中逐滴滴加氨水至沉淀刚好消失,得到银氨溶液.向银氨溶液中按照V(AgNO3): V(硼氢化钠)=6: 1缓慢均匀地加入硼氢化钠溶液,将溶液转移至三口烧瓶于95 ℃条件下加热反应1 h,冷凝回流,获得纳米银晶核,尺寸在5 nm左右.向所得晶核溶液中加入AgNO3和葡萄糖混合溶液(体积比1: 1),在80 ℃条件下反应.当加入的AgNO3体积与初始加入的AgNO3体积比为1: 4时,得到的纳米银尺寸为40 nm左右.30 min后结束反应.将所得纳米银溶液离心分离,由于溶液黏度较大,采用大转速10 000 r/min,离心时间40 min.除去上清液,用去离子水和无水乙醇反复清洗离心后的纳米银各3次,即得到一种纯化的壳聚糖季铵盐/纳米银复合材料(QCS/nAg).实验参比用抗菌材料:直径为40 nm的聚乙烯吡咯烷酮纳米银(PVP/nAg)购于sigma公司;直径为40 nm柠檬酸盐/纳米银(Citrate/nAg)根据文献[8]制备方法,于实验室制得.
采用紫外分光光度计(756PC,上海洪纪仪器有限公司)对nAg溶液进行300~700 nm的全波程扫描,确定nAg溶液的波峰处吸收波长.使用Zeta电位仪表征nAg颗粒表面电位(ZS 90,马尔文公司).采用透射电镜(TEM,JEM2011,日本Jeol公司)表征nAg的微观结构和尺寸.采用ICP-MS(Agilent7700,美国Agilent公司)测定制备的nAg浓度(以银离子表征nAg浓度).
1.3 实验方法进行预实验,培养大肠杆菌和枯草杆菌,确定其对数生长期.选取处于对数生长期的细菌用2.0 mmol/L的碳酸氢钠溶液水洗3遍后(10 000 r/min,60 s),重悬于2.0 mmol/L的碳酸氢钠溶液中.将一定量的抗菌材料与细菌悬浮液均匀混合;培养一段时间后,取30 μL混合液于平板培养基,用涂布棒涂抹均匀,为准确计数,可将混合液按梯度稀释并用涂布棒涂抹均匀;对照组仅加入与实验组抗菌材料等量的2.0 mmol/L碳酸氢钠溶液,其他操作与实验组相同.
细菌形貌变化分析实验中取10 mL 1.0×109 cfu/mL E.coli的培养液,离心3次(10 000 r/min,5 min).分别加入QCS/nAg和PVP/nAg,通过控制投加量,使菌液体积为10 mL,并且两种纳米银复合材料的质量浓度均为50.0 mg/L.反应3 h后,离心去掉上清液,加入质量分数2.5%的戊二醛溶液进行固定24 h,用磷酸缓冲液漂洗样品3次.胞内/胞外三磷酸腺苷(ATP)变化实验中分别采用不同质量浓度的QCS/nAg和PVP/nAg(1.0,2.0,5.0,10.0 mg/L)处理1.0×106 CFU/mL E.coli和B.sub,接触时间为15 min.
采用0.1 mol/L的NaOH和HNO3用于调节纳米银溶液的pH(METTLER TOLEDO,瑞士).本实验中除了研究pH影响的样品,其余样品的pH均为7.0.
1.4 分析方法采用传统平板计数法测定活细胞的数量.平板培养基于37 ℃恒温培养箱中培养24 h后,对平板培养基上的菌落进行计数.为了确保数据的准确性,所有实验重复3次,实验结果以平均值和标准偏差的形式表示.灭活率计算方法如下:
灭活率(lg(N0/N))=lg(控制组活细胞数N0 (不加抗菌材料)/样品中活细胞数量N(加抗菌材料)).
测定溶液中的银离子质量浓度时,采用离心超滤技术实现纳米银颗粒与Ag+的分离,选用Amicon Ultra-410K离心超滤管,可以实现颗粒与离子的分离.然后采用ICP-MS测试滤液中的银离子质量浓度,根据所取体积即可推知原液中银离子质量浓度.
细菌细胞形貌采用扫描电镜(SEM,Hitachi TM-1000, 日本)测定.首先用梯度浓度(包括30%,50%,70%,80%,90%和95% 5种)的乙醇溶液对固定后的样品进行脱水处理,每种浓度处理15 min,再用100%的乙醇处理两次,每次20 min.用乙醇与醋酸异戊酯的混合液(体积比1: 1)处理样品30 min,再用纯醋酸异戊酯处理样品1 h,临界点干燥、镀膜.利用酶标仪(Multiskan FC, Thermo Fisher Scientific, 美国)测定胞内/胞外ATP.用BacTiter-Glo reagent (G8230, Promega, 美国)对细菌细胞进行染色,通过酶标仪的信号值测试胞内外ATP变化情况.细胞总ATP含量直接用酶标仪测得;胞外ATP含量通过将样品过0.22 μm的滤膜后,取滤出液进行测试分析.胞内ATP含量通过总ATP减胞外ATP而得.
2 结果与讨论 2.1 QCS/nAg的物化性质QCS/nAg的光学特性、形貌和尺寸如图 1所示.图 1(a)显示出所制备材料在418 nm的波长处有单一的吸收峰.根据Li等的研究[9],该峰为纳米银特征吸收峰;吸收峰陡峭可以反映出纳米颗粒分散性好,由此表明纳米银材料已成功合成.纳米银形态见图 1(b),可发现生成的纳米银形状近似球形,颗粒分散性良好且尺寸较为均一.在纳米银颗粒表面可见一层亮膜包覆,说明QCS已经成功包覆到纳米银的表面.有文献表明[10], nAg的表面修饰剂主要是靠材料中的N、O等元素中孤对电子与Ag采用配位键连接,在QCS中,存在着大量的氨基、羟基等基团,因此,QCS可以与nAg牢固地结合.采用尺寸测量软件Nanomeasure对图片进行处理,随机选取图中80个颗粒量取颗粒半径,颗粒分布结果如图 1(c)所示,粒径主要分布在26~54 nm,通过计算得出平均半径为40 nm.表面电位通过Zeta电位仪测定,QCS/nAg表面电位为+30.7 mV.作为参比,相同尺寸(40 nm)和质量浓度的PVP/nAg和Citrate/nAg的表面电位分别为-9.3和-26.3 mV.溶液浓度通过采用ICP-MS测定QCS/nAg消解后的银离子质量浓度确定,母液质量浓度为1 000 mg/L(以银离子质量浓度表达).

|
图 1 QCS/nAg的表征 Fig. 1 Characterization of QCS/nAg |
以E.coli和B.sub为目标菌种,通过对比考察QCS/nAg、PVP/nAg和Citrate/nAg的抗菌能力,研究QCS/nAg的抗菌活性;结果如图 2所示.对于两种目标菌种,3种抗菌材料的抗菌能力均为QCS/nAg>PVP/nAg>Citrate/nAg.如图 2(a)所示,10.0 mg/L的QCS/nAg、5 min的接触时间条件下,E.coli灭活率达2log以上;PVP/nAg和Citrate/nAg在相同实验条件下对E.coli的灭活率则分别为0.89log和0.25log,明显低于QCS/nAg的抗菌活性.如图 2(b)所示,对于B.sub,5 min的接触时间条件下,QCS/nAg、PVP/nAg和Citrate/nAg的灭活率分别为1.21log、0.42log和0.21log;延长接触时间利于抗菌材料的灭活能力,而QCS/nAg仍呈现出明显优于PVP/nAg和Citrate/nAg的抗菌能力,接触20 min后,QCS/nAg、PVP/nAg和Citrate/nAg对E.coli的灭活率分别为4.31log、2.54log和1.61log.由图 2还可知,采用抗菌材料消毒时,B.sub较E.coli更难被灭活.相同的投加量,3种抗菌材料对B.sub的灭活率均分别低于对E.coli的灭活率.对于此灭活差异性推测可能与B.sub较E.coli结构有关[11].革兰氏阴性菌和阳性菌的重要区别之一在于细胞外壁的成分不同.革兰氏阴性菌细胞壁的肽聚糖层是由脂质和多糖共价连接而形成的网状结构,细胞壁较薄,整体强度较低;而革兰氏阳性菌的细胞壁较厚,由肽聚糖和磷壁酸交联而成,强度也较高.相比而言,纳米抗菌材料可能更易于破坏和透过革兰氏阴性菌.
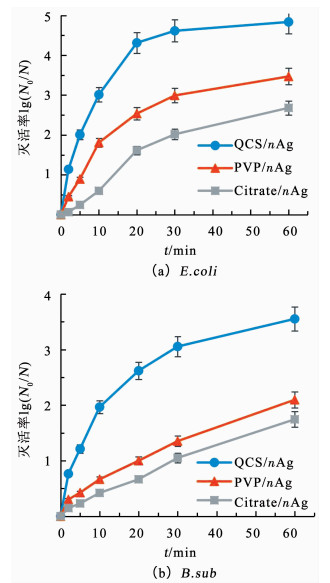
|
抗菌材料用量:10.0 mg/L,pH=7.0,t=25 ℃,初始细菌浓度1.0×106 CFU/mL 图 2 QCS/nAg、PVP/nAg和Citrate/nAg对E.coli和B.sub的灭活效果 Fig. 2 Inactivated efficacy of E.coli and B.sub by QCS/nAg, PVP/nAg, and Citrate/nAg |
QCS/nAg优于PVP/nAg和Citrate/nAg的抗菌能力应与其表面电性和QCS/nAg复合了QCS和nAg的抗菌活性有关.QCS/nAg的表面呈正电(Zeta电位为+30.7 mV);而水中的细菌表面电位为负;自然水体中细菌的等电点在pH 2~5,自然水体的pH多为中性或弱碱性,因此,水中的细菌表面电位为负电.本实验条件下测得E.coli与B.sub在pH=7.1下的Zeta电位分别为-21.7和-40.5 mV.和具有负表面电位的PVP/nAg和Citrate/nAg相比,显然QCS/nAg更易于接近细菌表面.El Badawy等[12]曾对几种不同表面修饰剂的纳米银抗菌能力进行研究,包括未包覆的nAg、PVP/nAg、Citrate/nAg和支化聚乙烯亚胺包覆的纳米银(BPEI/nAg),其结果表明正电性表面的BPEI/nAg有着最强的杀菌效果;此外,QCS自身的抗菌效能也应对QCS/nAg的抗菌性能有所贡献.对于QCS的抗菌能力,有学者进行了讨论研究.Chen等[13]研究发现季铵盐可以明显地提高抗菌效果,对于E.coli和金黄葡萄球菌均具有强灭活作用.Huang等[14]通过在纳滤膜上加入壳聚糖季铵盐,可使滤膜在过滤的同时有着较好的抗菌性能.
2.2.2 QCS和nAg在QCS/nAg抗菌活性中的作用QCS/nAg复合了QCS与nAg的抗菌效能,对于QCS/nAg的抗菌效能是否为QCS和nAg抗菌能力的简单加和作用进行了考察.从本实验起,仅以E.coli为目标菌种考察QCS/nAg的抗菌性能.选取4组抗菌材料进行实验,分别为1.0 mg/L QCS/nAg、1.0 mg/L PVP/nAg(从分散性角度考虑,采用PVP/nAg代替nAg)、0.1 mg/L QCS和1.0 mg/L PVP/nAg+0.1 mg/L QCS.其中,选择较低的纳米银投加量(1.0 mg/L)进行本实验是为了区分出各抗菌材料抗菌效能差异性;0.1 mg/L QCS溶液是为了模拟纳米银表面的包覆量,QCS/nAg中QCS质量浓度远低于0.1 mg/L,选取此质量浓度是为了更好地体现QCS/nAg的效果;实验结果见图 3.可以看出,QCS/nAg的抗菌效果明显强于PVP/nAg和单独的QCS.更重要的是,1.0 mg/L的QCS/nAg效果强于1.0 mg/L PVP/nAg+0.1 mg/L QCS的效果.由此可见,QCS和nAg之间具有协同抗菌作用.推测可能是因为正电荷的QCS对抗菌材料与细菌接触的强化作用提高了其整体的抗菌性能.QCS/nAg复合材料中,nAg及其可能释放的Ag+与细菌的接触程度应大于单独使用nAg进行抗菌,进而产生协同的抗菌效应.
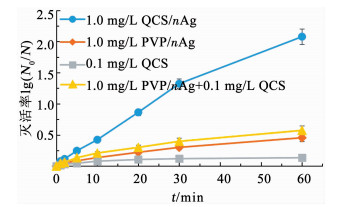
|
pH=7.0,t=25 ℃,初始细菌浓度1.0×106 CFU/mL 图 3 QCS和nAg在QCS/nAg抗菌活性中的作用 Fig. 3 Function of QCS and nAg in composite materials |
QCS/nAg投加量对抗菌效果影响结果如图 4(a)所示.在所研究的QCS/nAg投加量条件下(1.0,2.0,5.0和10.0 mg/L),随着QCS/nAg投加量的增加,对E.coli的灭活率提高.本实验中,纳米银的灭活细菌反应基本遵循一级动力学.当灭活率较高时,灭活率的增长趋于平缓是由于平板计数法的检测方法对于1.0×106 CFU/mL细菌所能检测到的最大灭活率为4log左右,导致某些高灭活率的控制点不符合一级动力学规律.对灭活率3log以下的灭活反应进行研究,发现均较好地符合一级动力学模型,R2能达到0.98以上.为了定量体现杀菌效率,引入CT值(min · mg/L)的概念,CT值越小,表明杀菌效率越高.通过计算,为灭活2log的106 CFU/mL E.coli,QCS/nAg所需的CT值为50~60 min · mg/L.以PVP/nAg为参比,相同反应条件下,PVP/nAg为达到2log的杀菌率,所需CT值约为150 min · mg/L以上(图 4(b)),明显高于QCS/nAg.此实验结果进一步反映出QCS/Ag优良的抗菌性能.
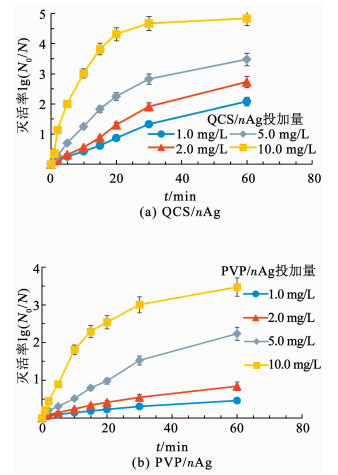
|
反应条件:pH=7.0,t=25 ℃,细菌初始浓度1.0×106 CFU/mL 图 4 纳米抗菌材料投加量对E.coli抗菌效能的影响 Fig. 4 Effect of nAg dosage on antibacterial efficiency to E.coli |
pH可能对QCS/nAg的表面电性及其银离子的释放产生影响,进而可能影响其抗菌性能[15].因此,就pH对QCS/nAg抗菌效果的影响进行了研究.考虑到pH对细菌活性的影响,仅在pH=5.0~9.0进行研究.控制实验表明,该pH条件下,E.coli活性稳定.不同pH条件下QCS/nAg灭活E.coli的效果如图 5所示.可以看出,QCS/nAg抗菌效果受pH变化影响,在所研究的pH范围下,其抗菌率为pH=5.1>pH=7.0>pH=9.1,即QCS/nAg在较低的pH下有着较高细菌灭活率.
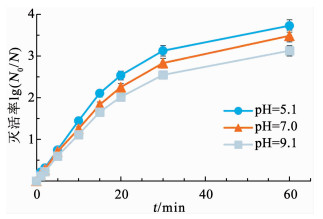
|
反应条件:QCS/nAg质量浓度5.0 mg/L,t=25 ℃,细菌初始浓度1.0×106 CFU/mL 图 5 QCS/nAg在不同pH下的抗菌率 Fig. 5 Inactivated rate under different pH values by QCS/nAg |
对不同pH条件下QCS/nAg的表面电位和银离子的溶出变化进行了分析.pH 5.1,7.0和9.1下QCS/nAg的Zeta电位分别为+30.1,+30.7和+21.9 mV,即在中性和弱酸性环境中,QCS/nAg的Zeta电位基本一致;但是在弱碱性环境中,其表面电位下降,原因可能是在弱碱性条件下,溶液中的OH-会吸附在QCS/nAg颗粒的表面.不同pH下银离子的溶出通过初始质量浓度相同的QCS/nAg紫外吸收光谱强度变化定性表达.如图 6所示,不同pH条件下,QCS/nAg的紫外吸收峰峰值呈现出了较大差异.在pH=7.0和9.1的情况下,二者的在418 nm左右的峰值基本相同,表明QCS/nAg会较稳定地存在于中性和弱碱性环境中.同时发现,在pH=5.1的条件下吸收峰值显著降低,表明QCS/nAg在弱酸性环境中发生了部分溶解.对于QCS/nAg抗菌消毒过程,较高的表面电位和银离子的溶出利于其抗菌活性.低pH条件与高pH条件相比,QCS/nAg具有更高的表面电位和更多的银离子溶出,因此,低pH下QCS/nAg呈现出较高的抗菌能力.
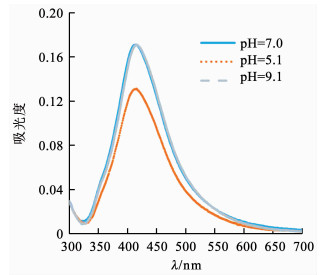
|
图 6 QCS/nAg在不同pH下溶出情况 Fig. 6 Dissolution of QCS/nAg under different pH values |
银离子的释放及对细菌的灭活作用一般被认为是纳米银发挥其抗菌效能的途径之一[15].自然水体中广泛存在氯离子,氯离子会结合银离子生成氯化银沉淀,甚至包覆在纳米银颗粒的表面阻止银离子的释放,进而影响纳米银的抗菌能力.Levard等[16]也报道过水中氯离子的存在降低了PVP/nAg灭活E.coli效能.本实验对水中氯离子存在下QCS/nAg灭活细菌效能进行了研究.根据中国饮用水卫生标准的规定,饮用水中氯离子的质量浓度不得超过250 mg/L,即氯离子的浓度必须低于7.0 mmol/L,自然水体中的氯离子浓度也一般低于此值[17].实验中选取0.5, 2.0和7.0 mmol/L 3个氯离子浓度水平.结果如图 7所示.

|
反应时间15 min,pH=7.0,t=25 ℃,细菌初始浓度1.0×106 CFU/mL 图 7 氯离子对纳米抗菌材料灭活E.coli效果的影响 Fig. 7 Effect of chloride ion on antibacterial efficacy to E.coli |
由图 7可知,对于QCS/nAg和PVP/nAg,氯离子的存在均削弱了其抗菌效果;且随着氯离子浓度升高,抑制效果越明显.对比发现,QCS/nAg被抑制的程度较PVP/nAg要小得多.即使在7.0 mmol/L的氯离子浓度下,QCS/nAg对E.coli的灭活率由3.82log降为2.83log,抗菌效果下降了25%.而该条件下,PVP/nAg对E.coli的灭活率由2.29log降为0.64log,抗菌活性下降了72%.以上结果表明,氯离子对QCS/nAg的抑制程度低,QCS/nAg较PVP/nAg具有抗氯离子干扰的优越性.推测QCS/nAg更能够抵抗水中氯离子干扰主要有以下原因:1)QCS/nAg表面呈现正电荷,纳米银颗粒能够快速和细菌吸附接触进而灭活细菌,而不仅仅依赖银离子的释放及抗菌作用;2)QCS/nAg表面的壳聚糖季铵盐自身具有一定的抗菌能力,而季铵盐的抗菌活性并不受氯离子影响.
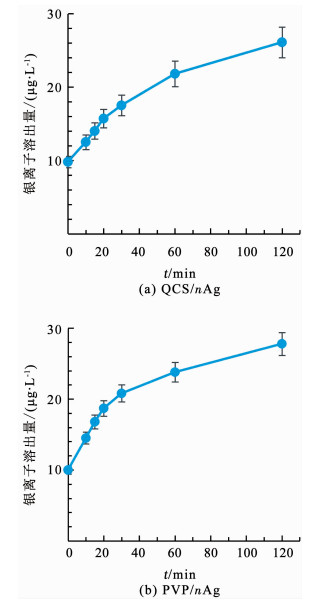
2.4 抗菌机理分析 2.4.1 银离子的抗菌作用金属离子的溶出往往是纳米材料发挥抗菌效果的重要机理之一,而对于纳米银材料的抗菌机理,许多学者提出银离子的释放是其发挥抗菌作用的关键[15].本实验对于纳米银材料中银离子的释放情况进行研究.由图 8(a)可知,将5.0 mg/L的QCS/nAg溶于水中120 min后,银离子有少量溶出,质量浓度约为26.1 μg/L.而银离子具有抗菌效能已被证实.因此,可以表明银离子的释放的确是QCS/nAg抗菌机理的一部分.
|
nAg质量浓度5.0 mg/L,pH=7.0,t=25 ℃ 图 8 nAg溶液中银离子释放量变化 Fig. 8 Dissolution of silver ions in nAg |
通过比较QCS/nAg和PVP/nAg两种纳米银抗菌材料的溶出情况(图 8(a)、(b),发现相同条件下,在120 min内QCS/nAg和PVP/nAg的银离子溶出趋势基本一致,银离子释放上升趋势减缓,且释放量差异较小,表明两种材料中银离子的释放情况基本一致,甚至PVP/nAg中的银离子质量浓度还要稍高于QCS/nAg溶液.而抗菌实验发现QCS/nAg的抗菌效能明显强于PVP/nAg.由此可以说明银离子的溶出速率不是QCS/nAg发挥高效灭菌能力的关键因素.
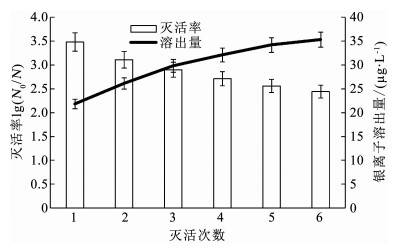
QCS/nAg溶液中,虽然银离子的释放量较小,依然对QCS/nAg的重复利用率及安全性进行了简单测试.通过用5.0 mg/L的QCS/nAg共灭活6批1.0×106 CFU/mL浓度细菌,每批的接触时间为1 h,考察其重复利用率,并对体系中的银离子质量浓度进行多次测定以评价其安全性.具体操作过程为,首先将5.0 mg/L的QCS/nAg与1.0×106 CFU/mL浓度的细菌接触反应1 h,取样培养计算灭活率,并取出少部分溶液测定其中的银离子质量浓度;然后加入少量高浓度的菌液,使得灭活体系中的细菌浓度仍近似为1.0×106 CFU/mL,QCS/nAg的质量浓度也近似为5.0 mg/L,再进行1 h的灭活;以此类推,共进行6批灭活实验.不同批次灭活率与银离子释放情况如图 9所示.
|
nAg质量浓度5.0 mg/L,pH=7.0,t=25 ℃,每次接触时间60 min 图 9 多次灭活实验中灭活率与银离子释放量变化 Fig. 9 Variation of inactivated rate and dissolution of silver ions when treated with several times |
由图 9可知,随着灭活次数的增加,每一次的灭活率呈现出了下降的趋势,说明多次使用后QCS/nAg的灭活能力有所下降.造成此现象的主要原因可能是一部分纳米银附着在细胞上或者在细胞内部发挥抗菌作用,在细菌完全裂解之前,此部分纳米银无法回归溶液中继续发挥抗菌作用.即使如此,在6次灭活后,QCS/nAg的灭活率仅从3.48log降为2.44log,依然保持着较强的灭活能力,说明QCS/nAg具有一定的重复利用能力.检测其中的银离子可以发现,银离子质量浓度在多次灭菌过程中有所增加但增长的速率也趋于平缓.本实验中采用的QCS/nAg质量浓度为5.0 mg/L,已属于高浓度投加量,即使如此在6次用于灭活实验后,银离子质量浓度依然不超过40 μg/L,仍低于中国生活饮用水卫生标准中对银离子限值的规定值0.05 mg/L,且在实际水体中,由于氯离子的存在,会适当地降低银离子质量浓度,综上表明QCS/nAg释放出的银离子质量浓度有安全性保证.
2.4.2 纳米抗菌材料对细菌细胞的吸附SEM可以直观地反映E.coli的细胞形貌.图 10(a)、(b)为未加抑菌材料的E.coli菌落,其形态为饱满的圆柱状,表而光滑无破损;如图 10(c)、(d)所示,加入QCS/nAg后,E.coli的细胞明显皱缩,能看到较明显的破损情况.QCS/nAg (图 10(c)、(d))对E.coli细胞的破坏与PVP/nAg (图 10(e)、(f))有所区别.QCS/nAg存在时,E.coli细胞表面较PVP/nAg抗菌出现了更大范围孔洞,即QCS/nAg对E.coli细胞的破损程度也更加严重.此外,由图 10(c)、(d)可知,在E.coli表面有颗粒的附着(图 10(c)、(d)中的白色点),推测应为QCS/nAg颗粒.Ivask等[18]通过原子力显微镜观察也曾发现,具正电性表面的BPEI/nAg能够吸附在E.coli的表面,进而发挥抗菌效能.图 10(c)、(d)的测试结果证实了带有表面正电荷的QCS/nAg可以吸附在E.coli表面,也说明了QCS/nAg通过提高与细菌的接触机会进而呈现出抗菌性能优势.

|
图 10 纳米抗菌材料作用下的E.coli的细胞形貌 Fig. 10 Morphology of E.coli after treated by nAg |
ATP是一个重要的能量载体,ATP水平可以在一定程度体现细菌的浓度,是一项细胞活性的指标[19].同时, ATP作为一种胞内物质,检测其在胞外的出现可以反映胞内物质流失及细胞膜的功能完整性.当细胞膜完好时,ATP主要存在细胞内部,胞内ATP占绝大多数;当细胞膜受损时,胞内的ATP会泄露流出,使胞内的ATP总量减少,胞外的ATP增加.文刚等[20]曾通过胞内外ATP水平的测试研究二氧化氯对地下水中主要存在的真菌细胞壁的破坏情况.本实验通过测试胞内和胞外ATP的比例,探究QCS/nAg作用下E.coli的活性情况、胞内物质的泄露情况和细胞壁(膜)的受损程度.
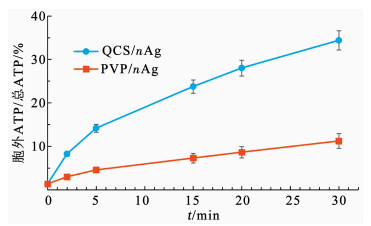
由图 11可以发现,QCS/nAg和PVP/nAg灭活细菌均破坏了细菌的细胞壁(膜).随着QCS/nAg和PVP/nAg投加量的增加,E.coli的ATP呈现一致的变化趋势.细胞ATP总量显示出下降的趋势,主要是由于纳米银破坏了细胞的呼吸链,减少了ATP的合成[21-22],也表明了细菌的活性降低;胞外ATP比例呈现出了增加的趋势,胞内ATP比例呈现出了下降趋势,表明胞内物质发生泄露,细胞壁(膜)的功能遭受破坏.比较QCS/nAg和PVP/nAg处理后E.coli的ATP,发现相同质量浓度的QCS/nAg处理后胞外ATP/胞内ATP的比值明显高于用PVP/nAg处理的E.coli.用10.0 mg/L的QCS/nAg处理甚至出现了胞外ATP含量是胞内ATP含量的125%的情况,而PVP/nAg的此值仅为21%,说明QCS/nAg处理使得细菌的胞内物质泄露更加严重,对于细胞壁(膜)结构的破坏更加严重.为了更直观地观察两种抗菌材料对于细菌ATP的影响以及ATP泄露随时间的变化.对相同QCS/nAg和PVP/nAg投加量下胞外ATP/总ATP值随时间变化规律也进行了考察(图 12).显然,相同投加量的QCS/nAg在同一时间下对E.coli细胞壁(膜)的破坏程度明显大于PVP/nAg.而且,随着时间进行,此差距更加明显,30 min后,QCS/nAg灭活下的E.coli胞外ATP/总ATP值为PVP/nAg存在下的3.07倍.

|
反应时间15 min,pH=7,t=25 ℃,初始浓度1.0×106 CFU/mL 图 11 两种纳米银材料处理E.coli后的胞内外ATP Fig. 11 Changes of intracellular and extracellular ATP after treated by nAg |
|
抗菌材料质量浓度1.0 mg/L,pH=7.0,t=25 ℃,初始浓度1.0×106 CFU/mL 图 12 胞外ATP/总ATP的值随时间变化 Fig. 12 Variation of extracellular ATP/total ATP ratio over time |
1) 以壳聚糖季铵盐为表面修饰剂,通过化学还原法成功合成尺寸均一、表面带正电的QCS/nAg.
2) QCS/nAg具有优良的水处理抗菌消毒能力.以大肠杆菌和枯草杆菌为目标细菌,QCS/nAg的灭活能力强于参比抗菌材料PVP/nAg和Citrate/nAg.
3) 所具有的正电性表面和QCS与nAg之间的协同抗菌作用是QCS/nAg具有抗菌消毒优势的原因.研究结果也进一步表明与细菌的接触为纳米抗菌材料灭活水中细菌的关键过程.
4) QCS/nAg抗菌材料通过强化和加速对细菌细胞壁(膜)的破坏,进而破坏细胞的活性,其对细菌细胞壁(膜)的破坏程度明显大于参比材料PVP/nAg.
5) QCS/nAg在灭活过程中具有较好的重复利用性及释放银离子的安全性.QCS/nAg的投加量、水体pH条件、水中典型无机离子均对QCS/nAg抗菌效能有所影响,对于水质背景的影响后续将进行系统研究.
| [1] |
LAM S J, WONG E H H, BOYER C, et al. Antimicrobial polymeric nanoparticles[J]. Progress in Polymer Science, 2018, 76: 40. DOI:10.1016/j.progpolymsci.2017.07.007 |
| [2] |
REIDY B, HAASE A, LUCH A, et al. Mechanisms of silver nanoparticle release, transformation and toxicity:A critical review of current knowledge and recommendations for future studies and applications[J]. Materials, 2013, 6(6): 2295. DOI:10.3390/ma6062295 |
| [3] |
WIJNHOVEN S W P, PEIJNENBURG W J G M, HERBERTS C A, et al. Nano-silver:A review of available data and knowledge gaps in human and environmental risk assessment[J]. Nanotoxicology, 2009, 3(2): 109. DOI:10.1080/17435390902725914 |
| [4] |
DANKOVICH T A, GRAY D G. Bactericidal paper impregnated with silver nanoparticles for point-of-use water treatment[J]. Environmental Science & Technology, 2011, 45(5): 1992. DOI:10.1021/es103302t |
| [5] |
GUZMAN M, DILLE J, GODET S. Synthesis and antibacterial activity of silver nanoparticles against gram-positive and gram-negative bacteria[J]. Nanomedicine-Nanotechnology Biology and Medicine, 2012, 8(1): 37. DOI:10.1016/j.nano.2011.05.007 |
| [6] |
MA Jizhen, ZHANG Jintao, XIONG Zhigang, et al. Preparation, characterization and antibacterial properties of silver-modified graphene oxide+[J]. Journal of Materials Chemistry, 2011, 21(10): 3350. DOI:10.1039/c0jm02806a |
| [7] |
HUANG Tiandi, SUI Minghao, LI Jiayi. Inactivation of E. coli by nano-Cu_MWCNTs combined with hydrogen peroxide[J]. Science of the Total Environment, 2017, 574(818). DOI:10.1016/j.scitotenv.2016.09.077 |
| [8] |
BASTUS N G, MERKOCI F, PIELLA J. Synthesis of highly monodisperse citrate-stabilized silver nanoparticles of up to 200 nm:Kinetic control and catalytic properties[J]. Chemistry of Materials, 2014, 26(9): 2836. DOI:10.1021/cm500316k |
| [9] |
LI Lun, SUN Jie, LI Xiaoran, et al. Controllable synthesis of monodispersed silver nanoparticles as standards for quantitative assessment of their cytotoxicity[J]. Biomaterials, 2012, 33(6): 1714. DOI:10.1016/j.biomaterials.2011.11.030 |
| [10] |
WANG Hongshui, QIAO Xueliang, CHEN Jianguo, et al. Mechanisms of PVP in the preparation of silver nanoparticles[J]. Materials Chemistry and Physics, 2005, 94(2/3): 449. DOI:10.1016/j.matchemphys.2005.05.005 |
| [11] |
UMADEVI M, RANI T, BALAKRISHNAN T, et al. Antimicrobial activity of silver nanoparticles prepared under an ultrasonic field[J]. International Journal of Pharmaceutical Sciences and Nanotechnology, 2011, 4(3): 1490. |
| [12] |
EL BADAWY A M, SILVA R G, MORRIS B, et al. Surface charge-dependent toxicity of silver nanoparticles[J]. Environmental Science & Technology, 2011, 45(1): 283. DOI:10.1021/es1034188 |
| [13] |
CHEN Yuxiang, LI Jianna, LI Qingqing, et al. Enhanced water-solubility, antibacterial activity and biocompatibility upon introducing sulfobetaine and quaternary ammonium to chitosan[J]. Carbohydrate Polymers, 2016, 143: 246. DOI:10.1016/j.carbpol.2016.01.073 |
| [14] |
HUANG Ruihua, CHEN Guohua, SUN Mingkun, et al. Studies on nanofiltration membrane formed by diisocyanate cross-linking of quaternized chitosan on poly (acrylonitrile) (PAN) support[J]. Journal of Membrane Science, 2006, 286(1/2): 237. DOI:10.1016/j.memsci.2006.09.045 |
| [15] |
LI Wenru, XIE Xiaobao, SHI Qingshan, et al. Antibacterial activity and mechanism of silver nanoparticles on Escherichia coli[J]. Applied Microbiology and Biotechnology, 2010, 85(4): 1115. DOI:10.1007/s00253-009-2159-5 |
| [16] |
LEVARD C, MITRA S, YANG T, et al. Effect of chloride on the dissolution rate of silver nanoparticles and toxicity to E. coli[J]. Environmental Science & Technology, 2013, 47(11): 5738. DOI:10.1021/es400396f |
| [17] |
LI Xuan, LENHART J J. Aggregation and dissolution of silver nanoparticles in natural surface water[J]. Environmental Science & Technology, 2012, 46(10): 5378. DOI:10.1021/es204531y |
| [18] |
IVASK A, ELBADAWY A, KAWEETEERAWAT C, et al. Toxicity mechanisms in Escherichia coli vary for silver nanoparticles and differ from ionic silver[J]. ACS Nano, 2014, 8(1): 374. DOI:10.1021/nn4044047 |
| [19] |
HAMMES F, GOLDSCHMIDT F, VITAL M, et al. Measurement and interpretation of microbial adenosine tri-phosphate (ATP) in aquatic environments[J]. Water Research, 2010, 44(13): 3915. DOI:10.1016/j.watres.2010.04.015 |
| [20] |
WEN Gang, XU Xiangqian, HUANG Tinglin, et al. Inactivation of three genera of dominant fungal spores in groundwater using chlorine dioxide:Effectiveness, influencing factors, and mechanisms[J]. Water Research, 2017, 125: 132. DOI:10.1016/j.watres.2017.08.038 |
| [21] |
LOK C N, HO C M, CHEN R, et al. Proteomic analysis of the mode of antibacterial action of silver nanoparticles[J]. Journal of Proteome Research, 2006, 5(4): 916. DOI:10.1021/pr0504079 |
| [22] |
ASHARANI P V, MUN G L K, HANDE M P, et al. Cytotoxicity and genotoxicity of silver nanoparticles in human cells[J]. ACS Nano, 2009, 3(2): 279. DOI:10.1021/nn800596w |
 2019, Vol. 51
2019, Vol. 51


