目前,电芬顿(Fenton)技术作为电化学工艺的一种,在氧化难降解、高盐、高毒性污水等方面具有广泛应用前景[1-2],但仍存在原料运输不便、pH适用范围较窄、铁污泥产量多等问题[3].O2在阴极电还原生成H2O2是电Fenton技术最重要的一个特点.因此,H2O2产率决定了电Fenton系统降解污染物的效果[4].碳材料具有较好的稳定性、导电性、无毒、析氢电位高,其作为阴极材料时,对H2O2的分解催化活性较低,有助于O2在阴极高效地原位生成H2O2[5-10],避免了H2O2在运输、储存时可能产生的危险[11-13].活性炭纤维(ACF)由于比表面积大、微孔丰富、吸附量大、吸附速度快且容易再生等优势,在生活及工业废水处理方面应用较广[14-15].
电Fenton技术在除藻方面的应用鲜有报道.王爱民、曲久辉等[10, 15]以RuO2/Ti阳极,缚在钛网表面的ACF为阴极,在阴极表面连续通入氧气,调节溶液pH至3,考察了电流密度、pH和Fe2+浓度等因素对电Fenton降解水中微囊藻毒素的影响.但该研究未对其反应机理进行验证,反应前需通入氧气以及调节pH至偏酸性.此外,RuO2/Ti电极在阳极析出氧气时涂层会急剧损坏[16],使用寿命较Pt/Ti阳极短[17].Long等[8]以掺硼金刚石薄膜BDD电极为阳极,碳毡为阴极,通过添加少量的Fe2+构建非均相电Fenton体系去除铜绿微囊藻,但BDD阳极表面可造性差、电极材料制造成本较高且薄膜与基底结合力较差[18].
本文在接近中性条件下,以钛基铂电极(Pt/Ti)为阳极,活性炭纤维/泡沫镍(ACF/Ni)阴极,通过考察阴极材料(ACF/Ni和不锈钢)、铁投加浓度及价态对电化学除藻的影响,探究Pt/Ti-ACF/Ni-Fe2+电化学体系对藻类的去除效果和机制.其中,ACF/Ni阴极以价格低廉、导电性良好的泡沫镍作为ACF的支撑骨架和导电基体,提高了H2O2与·OH产生效率[19].
1 实验 1.1 实验装置及实验方法实验所采用的藻种为水华期间的优势藻种铜绿微囊藻,购于中国科学院水生生物研究所.实验装置如图 1所示,整个反应系统由电源、磁力搅拌器、电解槽、电极板组成.实验装置采用250 mL烧杯,每次实验有效容积为250 mL,电极夹竖直置于反应器中间.电极采用板状电极,阳极材料为Pt/Ti,阴极材料为活性炭纤维/泡沫镍(ACF/Ni),对比实验阴极材料有不锈钢(SS),电极的有效工作面积均为12 cm2.

|
图 1 实验装置 Fig. 1 Diagram of experimental apparatus |
ACF与泡沫镍采用粘合剂涂覆粘合后真空干燥制备而成,黏合剂成分为1: 1的导电炭黑和聚偏氟乙烯PVDF,再加入适量的N -甲基吡咯烷酮.实验开始前先用0.45 μm醋酸纤维滤膜将处于对数生长期的藻样过滤,然后用纯水稀释藻样至1.2×109~1.4×109个/ L(OD680为0.065~0.072)并投加20 mmol/L的硫酸钠.实验过程中保持其电流密度为50 mA/cm2,电极间距为1.0 cm.实验中所需电流由美尔诺M8872型直流电源提供,电解时间为15 min.采用78-1型恒定转速的磁力搅拌器对实验藻液进行搅拌,保持转速为250 r/min.
藻细胞及阴极材料表征的实验条件为:Fe2+投加浓度为0.05 mmol/L,电流密度为50 mA/cm2,极板间距为1.0 cm, 初始pH为6.0,初始藻细胞密度为1.2×109~1.4×109个/L,电解时间为15 min.
1.2 分析方法实验中藻细胞生物量采用细胞密度以及光密度表示.细胞密度通过光学显微镜(BA310,Motic有限公司)采用血球计数法测定,光密度通过紫外分光光度计(DR6000,哈西水质分析仪器公司)采用紫外分光光度计法测定.H2O2浓度采用碘试剂法[20]测试.Fe2+与溶液中总铁采用邻菲罗啉比色法测定.藻细胞及电极材料形态通过扫描电子显微镜(S-3400N,日本日立公司)观察,ACF的比表面积通过比表面积及微孔分析仪(ASAP 2020M,美国麦克仪器公司)采用氮气吸附法测定,ACF红外光谱分析通过傅里叶变换红外光谱仪(IRP restige-21,日本岛津公司)采用溴化钾压片法进行.
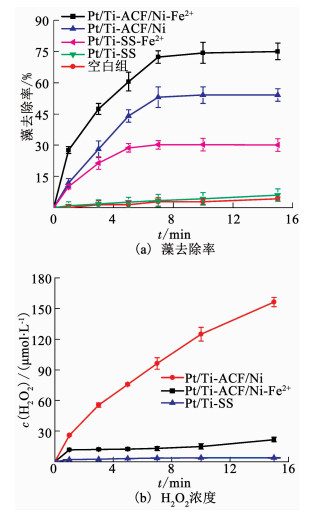
2 结果与讨论 2.1 Pt/Ti-ACF/Ni-Fe2+电化学体系除藻效果以Pt/Ti为阳极,分别以ACF/Ni和SS电极为阴极,在初始pH为6.0的实验条件下考察Fe2+对各电化学体系除藻率的影响.如图 2(a)所示,以ACF/Ni作为阴极时,不通电(即图中的空白组)时除藻率最低接近于5%,故不通电时ACF/Ni电极对铜绿微囊藻基本没有吸附作用,其余各电化学体系除藻率的顺序为:Pt/Ti-ACF/Ni-Fe2+>Pt/Ti-ACF/Ni>Pt/Ti-SS-Fe2+>Pt/Ti-SS.
|
图 2 不同电化学体系藻去除率和H2O2浓度随时间的变化 Fig. 2 Variations of algae removal efficiency and H2O2 concentration over time in different electrochemical systems |
当ACF/Ni作为阴极时,在溶液中可观察到藻附着于ACF表面,由此推测ACF/Ni阴极体系除藻率较高有可能与ACF较强的吸附性有关[10].Pt/Ti-SS电化学体系对铜绿微囊藻的去除率最低仅为6%,说明该体系电解生成的羟基自由基去除藻细胞的活性较低,这与Martinez-Huitle等[21]的研究相符.因此,在以ACF/Ni作为阴极的电化学除藻体系中,ACF/Ni发挥了重要作用.当向上述Pt/Ti-SS体系投加0.2 mmol/L Fe2+时,去除率有所提高,达30%.此时在显微镜下可观察到絮体,故推测其去除率的提高是由于Fe2+起到了电絮凝的作用.
Pt/Ti-ACF/Ni-Fe2+及Pt/Ti-ACF/Ni电化学体系在15 min时的除藻率分别为75%、54%,说明在以Pt/Ti为阳极,ACF/Ni为阴极的电化学体系中,Fe2+显著提高了该体系的除藻率.因Fe2+可以起到电絮凝作用,而反应过程中阴极可能产生H2O2,推测其反应机理可能是电絮凝、电Fenton反应.为进一步探究Pt/Ti-ACF-Fe2+体系除藻机理,考察了不同阴极材料对H2O2生成量的影响以及Pt/Ti-ACF-Fe2+电化学体系除藻过程中铁浓度和pH的变化.
2.1.1 阴极材料对H2O2生成量的影响如图 2(b)所示,Pt/Ti-SS电化学除藻体系15 min内几乎没有生成H2O2,而Pt/Ti-ACF/Ni体系电生成的H2O2浓度随电解时间呈线性增加(R2为0.961 4)且在15 min时达156 μmol/L.这说明ACF/Ni有助于O2在阴极还原生成H2O2,这与Hu等[19, 22-23]的研究相符.然而,Pt/Ti-ACF/Ni-Fe2+电化学体系15 min生成的H2O2浓度仅为22 μmol/L,减少至Pt/Ti-ACF/Ni体系的15%,很可能是因为投加的Fe2+与ACF/Ni阴极电生成的H2O2产生电Fenton反应生成羟基自由基除藻,故推测该反应以电Fenton反应为主.
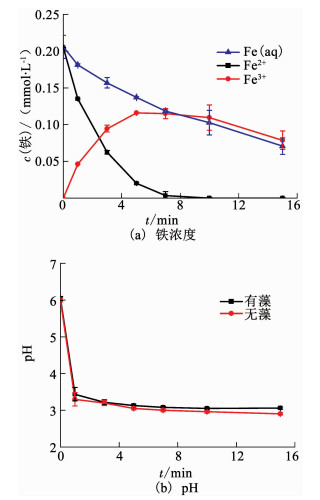
2.1.2 除藻过程中铁和pH的变化如图 3(a)所示,溶液中的Fe2+浓度在反应1 min时减少至原始浓度的65%,7 min后无法检测到.Fe3+浓度随电解时间先从0开始增大到原始浓度的58%(反应5 min时),再逐渐减小至39%(反应15 min时).溶液中的总铁浓度逐渐减小至原始浓度的35%(反应15 min时).待反应结束后,将ACF/Ni用1%HCl浸泡24 h后测得吸附在阴极上的总铁为原始浓度的40%.故推测反应中Fe2+逐渐氧化成Fe3+,且溶液中有部分铁逐渐生成沉淀并附着于阴极上.溶液中的铁及阴极上的固相铁与H2O2分别产生均相与非均相电Fenton反应除藻,反应主要方程式如下
|
图 3 Pt/Ti-ACF/Ni-Fe2+电化学体系溶液中的铁浓度和pH随时间的变化 Fig. 3 Variations of dissolved Fe concentrations and pH values over time in the Pt/Ti-ACF/Ni-Fe2+ electrochemical system |
| $ \mathrm{O}_{2}+2 \mathrm{H}^{+}+2 \mathrm{e}^{-} \rightarrow \mathrm{H}_{2} \mathrm{O}_{2}, $ | (1) |
| $ \mathrm{H}_{2} \mathrm{O}_{2}+\mathrm{Fe}^{2+} \rightarrow \cdot \mathrm{OH}+\mathrm{Fe}^{3+}+\mathrm{OH}^{-}. $ | (2) |
同时,Fe2+与Fe3+在固相和液相中分别发生氧化、还原反应,使电Fenton反应得以持续作用.
由于在实验过程中观察到电气浮及电吸附现象并且通过显微镜观察到极少部分的絮体,且15 min时检测到的总铁浓度(含吸附在阴极部分)为原始浓度的75%,因此,Pt/Ti-ACF/Ni-Fe2+电化学体系也伴随着电吸附、电絮凝和电气浮作用.
由图 3(b)可知,在Pt/Ti-ACF/Ni-Fe2+电化学体系中,溶液中pH由6.04在1 min内降到3.43,继而在反应后续过程中维持在3.10左右.当溶液中没有藻细胞时,实验发现其pH变化趋势及变化值与有藻细胞时类似.因此,电Fenton反应过程中pH的降低与藻细胞无关,这可能是由于反应刚开始生成的Fe3+的水解使得电解初期pH骤然降低,而后O2电解生成H2O2消耗H+的反应与Fe3+的水解达到平衡,使其pH维持在3.10左右.
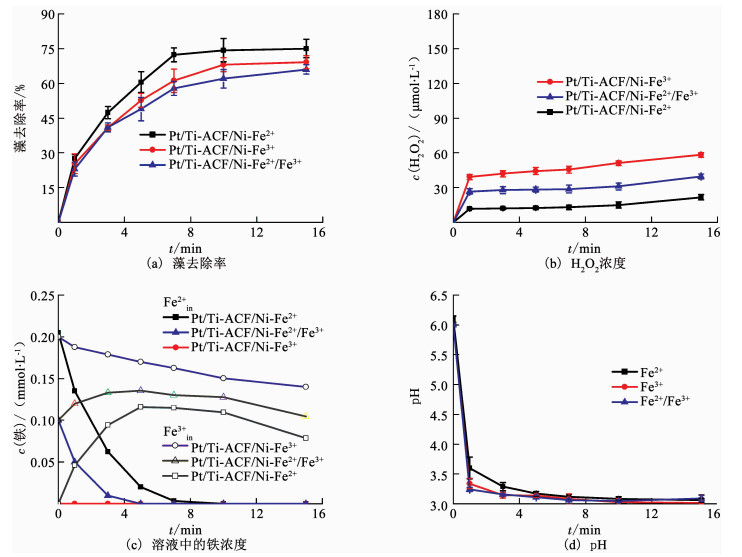
2.2 铁初始价态对除藻效果的影响为进一步探究Pt/Ti-ACF/Ni-Fe2+体系电化学除藻的机理,考察了Pt/Ti-ACF/Ni-Fe2+、Pt/Ti-ACF/Ni-Fe3+及Pt/Ti-ACF/Ni-Fe2+/Fe3+(1: 1)体系电化学除藻过程中藻去除率、H2O2浓度、溶液中的铁浓度及pH的变化,其中铁初始浓度取0.2 mmol/L,如图 4所示.藻去除率、H2O2浓度及pH在这3个体系中的变化趋势基本一致,表明铁初始价态对该体系电化学除藻几乎没有影响.在Pt/Ti-ACF/Ni-Fe3+体系中检测不到Fe2+,说明Fe3+在还原成Fe2+前便很快沉淀在阴极上,Fe3+与Fe2+的转换发生在阴极的固相铁上,因此,反应中发生了非均相电Fenton反应.
|
图 4 Pt/Ti-ACF/Ni-Fe2+、Pt/Ti-ACF/Ni-Fe3+及Pt/Ti-ACF/Ni-Fe2+/Fe3+电化学体系藻去除率、H2O2浓度、溶液中的铁浓度和pH随时间的变化 Fig. 4 Variations of the algae removal efficiency, H2O2 concentration, concentration of Fe in solution, and pH with electrolysis time in Pt/Ti-ACF/Ni-Fe2+, Pt/Ti-ACF/Ni-Fe3+, and Pt/Ti-ACF/Ni-Fe2+/Fe3+ electrochemical systems |
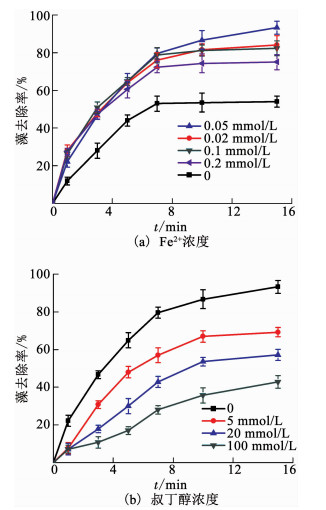
铁浓度是影响电Fenton反应的一个重要因素,维持上述Pt/Ti-ACF/Ni-Fe2+电化学除藻体系其他实验条件不变,改变铁初始投加浓度,探究其对该体系电化学除藻的影响.如图 5(a)所示,当Fe2+浓度从0增加至0.05 mmol/L时,除藻率随Fe2+浓度递增,但Fe2+浓度从0.05 mmol/L进一步增加至0.2 mmol/L时,除藻率随Fe2+浓度递减.这可能是因为当Fe2+过量时,会消耗溶液中的·OH从而降低除藻率,反应方程如下
|
图 5 Fe2+和叔丁醇浓度对Pt/Ti-ACF/Ni-Fe2+电化学除藻的影响 Fig. 5 Effect of Fe2+ and tertiary butanol dosage on the electrochemical removal of algae in the Pt/Ti-ACF/Ni-Fe2+ system |
| $ \mathrm{Fe}^{2+}+\cdot \mathrm{OH} \rightarrow \mathrm{Fe}^{3+}+\mathrm{OH}^{-}. $ | (3) |
这与曲久辉等的研究结果相符[15],间接证明其反应机理为电Fenton除藻,故铁初始投加浓度在0~0.2 mmol/L时的最佳浓度为0.05 mmol/L,15 min去除率达93%,且藻去除率符合一级动力学特征,R2为0.985 2.因此,在电Fenton反应过程中选择合适的Fe2+浓度非常重要.Long等[8]以BDD为阳极,碳毡为阴极,在最佳Fe2+浓度0.2 mmol/L条件下建立非均相电Fenton体系去除铜绿微囊藻,电流密度为50 mA/cm2,电极间距为1.0 cm,电解质为20 mmol/L的硫酸钠,电解液pH为6.2,电解60 min时藻细胞去除率达99.9%,电解40 min时藻细胞去除率达93%.与之相比,本实验在与该研究的电流密度、酸碱条件、电极间距、电解质种类及浓度等重要参数均相同的条件下,当藻去除率同为93%时,电解时间节省了62.5%,Fe2+药剂消耗量减少了75%.
2.4 羟基自由基对除藻效果的影响由于实验室条件限制,无法直接检测羟基自由基的生成,只能通过自由基捕获剂叔丁醇[13]间接检测.保持上述Pt/Ti-ACF/Ni-Fe2+电化学除藻体系实验条件不变,向反应液中添加叔丁醇猝灭羟基自由基,检测其藻去除率的变化,如图 5(b)所示.当向溶液中分别加入0,5,20,100 mmol/L的叔丁醇时,15 min藻去除率分别为93%,69%,57%和43%,藻去除率随叔丁醇浓度增加而减小,说明反应体系中有羟基自由基的产生,进一步验证该体系除藻的机理为电Fenton反应.
为进一步探究Pt/Ti-ACF/Ni-Fe2+电化学除藻体系中Fe2+的主要作用是与H2O2反应产生羟基自由基,保持Pt/Ti-ACF/Ni电化学除藻体系实验条件不变,向反应液中添加100 mmol/L的叔丁醇猝灭羟基自由基,获得其平均藻去除率为60%.结果发现其藻去除率与未添加叔丁醇(54%)相比并未发生实质变化,因此,Pt/Ti-ACF/Ni电化学体系主要不是通过羟基自由基氧化除藻,这与Pt/Ti-ACF/Ni-Fe2+电化学除藻体系中Fe2+的主要作用是与H2O2反应产生羟基自由基的推测相符.
2.5 藻细胞及阴极材料表征 2.5.1 藻细胞形态的变化藻细胞的完整性是保证其能正常生长繁殖的重要因素.为了考察Pt/Ti-ACF/Ni-Fe2+体系电化学除藻对藻细胞形态的影响,使用扫描电镜对细胞形态进行观察.取反应前后的藻细胞作为观察对象,结果如图 6所示.由图 6(a)可以看出,电解前藻细胞形态饱满,结构完整,细胞呈球形或椭球形;电解后藻细胞形态发生了显著变化,细胞表面出现凹陷,细胞周围有大量物质溶出,表明细胞已破裂,因此,Pt/Ti-ACF/Ni-Fe2+体系电化学除藻破坏了藻细胞的结构及其完整性,进一步导致藻细胞的死亡.

|
图 6 电解前后藻细胞扫描电子显微镜观测图 Fig. 6 SEM images of algae before and after electrochemical treatment |
通过扫描电镜观察材料表面形态,以进一步验证在Pt/Ti-ACF/Ni-Fe2+体系电化学除藻中,阴极材料的稳定性及其将藻细胞吸附在表面以提高了羟基自由基的氧化效率.
如图 7(a)和(d)所示,原始活性炭纤维表面光滑呈纤维状,原始泡沫镍表面光滑且呈现出清晰的骨架结构,表层结构出现断裂现象但内部联通性较好.阴极材料电解后不同放大倍数的SEM图像如图 7(b)、(c)和(e)、(f)所示.通过对比可知,材料本身几乎没有发生明显变化,说明电极材料具有较好的稳定性,且可观察到藻细胞及细胞内溶物附着于阴极材料上,进一步间接证明了藻细胞被吸附在阴极表面提高了羟基自由基的氧化效率.

|
图 7 电解前后电极材料扫描电子显微镜观测图 Fig. 7 SEM images of electrode materials before and after electrochemical treatment |
通过活性炭纤维的比表面积分析,以进一步分析该体系电化学除藻过程中的阴极材料.取实验前、后ACF电极材料作为研究对象.
实验发现,反应后ACF比表面积有所降低,由反应前的891.235 m2/g降为635.732 m2/g,进一步验证ACF在反应过程中对电解液中的藻具有吸附去除作用,这与SEM表征结果及上述对该体系除藻机理的分析相符.反应后ACF仍具有较大比表面积,具有一定的重复利用性.
2.5.4 ACF红外光谱分析通过对电解反应前后的ACF进行分析,以进一步探究Pt/Ti-ACF/Ni-Fe2+体系电化学除藻机理.实验设置两组,一组不添加叔丁醇,另一组加入100 mmol/L的叔丁醇,取两组实验反应前、后ACF电极材料作为研究对象.
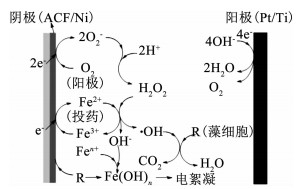
如图 8所示,反应前后除了峰的强度发生少量变化外,峰位置的改变以及新特征峰的出现均较少,推断在ACF分子键上新的官能团产生较少,因此,ACF具有一定的稳定性,可重复使用.其中,投加叔丁醇组,可能因为投加叔丁醇抑制了羟基自由基的产生,阻止电化学除藻反应的进行,因而ACF红外光谱图变化较未投加叔丁醇少.未投加叔丁醇组,反应后ACF红外光谱图波数3 448 cm-1对应的—OH伸缩振动吸收峰[24-26]的宽度增强,强度发生变化,推测该基团参与了反应中的吸附过程,可能由于形成氢键而移至3 175 cm-1处,因此,氢键作用力很可能是反应过程中重要的吸附机理;1 636 cm-1处含氧官能团—C═O—的伸缩振动峰[24-25]强度减弱,说明ACF吸附能力有所降低,这与实验过程中观察到的藻细胞吸附现象、电镜分析及BET分析的结果相吻合.650 cm-1对应的是铁氧化物Fe—O键的吸收峰[27],未投加叔丁醇时反应后ACF该峰强度和宽度明显增强,很可能是由于未加入叔丁醇时发生的非均相电Fenton除藻反应使得固相铁附着于ACF表面.图 8中,1 023和1 087 cm-1的峰归结于—C—O—的伸缩振动[24-25],1 400 cm-1处出现N═O振动峰可能是O2在ACF表面生成H2O2的过程中ACF的含氮官能团被氧化所致[26].2 345和2 362 cm-1对应的是CO2反对称伸缩峰,这很可能是由测试过程中CO2环境的变化所引起的[25].上述实验结果与机理推测中的非均相电Fenton及电吸附相符,也间接说明ACF具有一定的稳定性可重复使用.综上,本实验条件下Pt/Ti-ACF/Ni-Fe2+电化学除藻体系的反应机理如图 9所示.

|
图 8 电解前后ACF侧电极材料红外光谱图 Fig. 8 FTIR spectra of ACF before and after electrochemical treatment |
|
电芬顿(主要)、电吸附、电气浮、电絮凝协同除藻 图 9 Pt/Ti-ACF/Ni-Fe2+电化学体系除藻机理 Fig. 9 Mechanism diagram of algae removal in the Pt/Ti-ACF/Ni-Fe2+ electrochemical system |
1) 在接近中性条件下,在Pt/Ti-ACF/Ni体系中只要投加少量Fe2+便可取得较为显著的除藻效果,电解反应符合一级动力学特征,主要反应机理是均相电Fenton和非均相电Fenton作用,同时伴随着电絮凝、电吸附及电气浮作用.实验中投加的铁较少,其中40%的铁被吸附在阴极上,故几乎不产生铁泥沉淀.在一定程度上解决了电Fenton反应中H2O2原料的运输储存难及产生大量的铁污泥等问题.
2) 铁初始投加浓度对Pt/Ti-ACF/Ni-Fe2+体系电化学除藻效果影响显著.该体系除藻率随铁投加浓度的增加先增大后减小,因此,选择合适的Fe2+浓度非常重要.铁初始价态的改变对Pt/Ti-ACF/Ni-Fe2+体系电化学除藻没有显著影响且除藻机理相同.
3) 在Pt/Ti-ACF/Ni-Fe2+电化学除藻体系中,藻细胞电解后表面形态发生了显著变化且有胞内物质溶出,从而影响藻细胞的正常生长繁殖;ACF分子键上几乎不产生新的官能团,电极材料本身具有一定的重复利用性、较好的稳定性和吸附性.
| [1] |
El-GHENYMY A, CENTELLAS F, RODRÍGUEZ R M, et al. Comparative use of anodic oxidation, electro-Fenton and photoelectro-Fenton with Pt or boron-doped diamond anode to decolorize and mineralize Malachite Green oxalate dye[J]. Electrochimica Acta, 2015, 182: 247. DOI:10.1016/j.electacta.2015.09.078 |
| [2] |
BRILLAS E, BAN  OS M Á, SKOUMAL M, et al. Degradation of the herbicide 2, 4-DP by anodic oxidation, electro-Fenton and photoelectro-Fenton using platinum and boron-doped diamond anodes[J]. Chemosphere, 2007, 68(2): 199. DOI:10.1016/j.chemosphere.2007.01.038 OS M Á, SKOUMAL M, et al. Degradation of the herbicide 2, 4-DP by anodic oxidation, electro-Fenton and photoelectro-Fenton using platinum and boron-doped diamond anodes[J]. Chemosphere, 2007, 68(2): 199. DOI:10.1016/j.chemosphere.2007.01.038 |
| [3] |
WANG Yujing, ZHAO Hongying, CHAI Shouning, et al. Electrosorption enhanced electro-Fenton process for efficient mineralization of imidacloprid based on mixed-valence iron oxide composite cathode at neutral pH[J]. Chemical Engineering Journal, 2013, 223(5): 524. DOI:10.1016/j.cej.2013.03.016 |
| [4] |
曾海燕, 李华亮, 雷恒毅, 等. 活性炭纤维电极电还原产H2O2的实验研究[J]. 环境科学, 2011, 32(3): 711. ZENG Haiyan, LI Hualiang, LEI Hengyi, et al. Study on the electro-generation of H2O2 using an activated carbon fiber[J]. Environmental Science, 2011, 32(3): 711. |
| [5] |
ZHANG Xingwang, FU Jianliang, ZHANG Yi, et al. A nitrogen functionalized carbon nanotube cathode for highly efficient electrocatalytic generation of H2O2 in Electro-Fenton system[J]. Separation & Purification Technology, 2008, 64(1): 116. DOI:10.1016/j.seppur.2008.07.020 |
| [6] |
PANIZZA M, OTURAN M A. Degradation of Alizarin Red by electro-Fenton process using a graphite-felt cathode[J]. Electrochimica Acta, 2011, 56(20): 7084. DOI:10.1016/j.electacta.2011.05.105 |
| [7] |
YAMADA N, YAGUCHI T, OTSUKA H, et al. Development of trickle-bed electrolyzer for on-site electrochemical production of hydrogen peroxide[J]. Journal of the Electrochemical Society, 1999, 146(7): 2587. DOI:10.1149/1.1391976 |
| [8] |
LONG Yujiao, LI Hongna, XING Xuan, et al. Enhanced removal of Microcystis aeruginosa, in BDD-CF electrochemical system by simple addition of Fe2+[J]. Chemical Engineering Journal, 2017, 325: 360. DOI:10.1016/j.cej.2017.05.067 |
| [9] |
GUINEA E, ARIAS C, CABOT P L, et al. Mineralization of salicylic acid in acidic aqueous medium by electrochemical advanced oxidation processes using platinum and boron-doped diamond as anode and cathodically generated hydrogen peroxide[J]. Water Research, 2008, 42(1): 499. DOI:10.1016/j.watres.2007.07.046 |
| [10] |
王爱民, 曲久辉, 史红星, 等. 活性碳纤维阴极电芬顿反应降解微囊藻毒素研究[J]. 高等学校化学学报, 2005, 26(9): 1665. WANG Aimin, QU Jiuhui, SHI Hongxing, et al. Degradation of microcystotoxin by electro-Fenton reaction using an activated carbon fiber cathode[J]. Chemical Journal of Chinese Universities, 2005, 26(9): 1665. DOI:10.3321/j.issn:0251-0790.2005.09.013 |
| [11] |
WANG Huijiao, YUAN Shi, ZHAN Juhong, et al. Mechanisms of enhanced total organic carbon elimination from oxalic acid solutions by electro-peroxone process[J]. Water Research, 2015, 80: 20. DOI:10.1016/j.watres.2015.05.024 |
| [12] |
XIA Guangsen, WANG Yujue, WANG Bin, et al. The competition between cathodic oxygen and ozone reduction and its role in dictating the reaction mechanisms of an electro-peroxone process[J]. Water Research, 2017, 118: 26. DOI:10.1016/j.watres.2017.04.005 |
| [13] |
赵纯, 张帅, 周宇, 等. 阴极电场增强活性炭纤维-臭氧体系去除水中硝基苯[J]. 环境科学, 2017, 38(1): 212. ZHAO Chun, ZHANG Shuai, ZHOU Yu, et al. Cathode electric field enhanced removal of nitrobenzene from aqueous solution based on activated carbon fibers (ACF)-ozone technique[J]. Environmental Science, 2017, 38(1): 212. DOI:10.13227/j.hjkx.201607054 |
| [14] |
郑西强, 刘群, 陈云峰. 活性炭纤维对水中微囊藻毒素的吸附性能[J]. 环境工程学报, 2013, 7(10): 3802. ZHENG Xiqiang, LIU Qun, CHEN Yunfeng. Adsorption performance of activated carbon fiber to microcystins in water[J]. Chinese Journal of Environmental Engineering, 2013, 7(10): 3802. |
| [15] |
曲久辉, 刘会娟. 水处理电化学原理与技术[M]. 北京: 科学出版社, 2007. QU Jiuhui, LIU Huijuan. Principles and techniques of water treatment electrochemistry[M]. Beijing: Science Press, 2007. |
| [16] |
卢强.涂层钛电极的制备及其降解废水中硝基苯的研究[D].南京: 南京理工大学, 2011 LU Qiang. Study on preparation of Ti-coated electrode and its application in degradation of nitrobenzene in wastewater[D]. Nanjing : Nanjing University of Science & Technology, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10288-1012320960.htm |
| [17] |
张建华. 镀铂钛电极的研究[J]. 广东有色金属学报, 2000, 10(2): 108. ZHANG Jianhua. Study on platinum-coated titanium electrode[J]. Journal of Guangdong Non-Ferrous Metals, 2000, 10(2): 108. |
| [18] |
李彩霞, 张素素, 何平, 等. 掺杂金刚石电极及电化学应用研究进展[J]. 功能材料, 2017, 48(8): 7. LI Caixia, ZHANG Susu, HE Ping, et al. Research progress on doped diamond electrode and electrochemical application[J]. Journal of Functional Materials, 2017, 48(8): 7. |
| [19] |
陈聪.新型镍电极电芬顿法预处理印染废水效能研究[D].哈尔滨: 哈尔滨工业大学, 2015 CHEN Cong. Effectiveness research on using E-Fenton with new type of Ni electrode to pretreat dyeing printing wasterwater[D]. Harbin: Harbin Institute of Technology, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10213-1015982818.htm |
| [20] |
ISHIBASHI K I, FUJISHIMA A, WATANABE T, et al. Detection of active oxidative species in TiO2, photocatalysis using the fluorescence technique[J]. Electrochemistry Communications, 2000, 2(3): 207. DOI:10.1016/S1388-2481(00)00006-0 |
| [21] |
MARTÍNEZ-HUITLE C A, BRILLAS E. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods: A general review[J]. Applied Catalysis B Environmental, 2015, 166/167(3/4): 603. DOI:10.1016/j.apcatb.2008.09.017 |
| [22] |
HU Jingjing, SUN Jie, YAN Junkun, et al. A novel efficient electrode material: Activated carbon fibers grafted by ordered mesoporous carbon[J]. Electrochemistry Communications, 2013, 28(1): 67. DOI:10.1016/j.elecom.2012.11.034 |
| [23] |
WANG Aimin, QU Jiuhui, LIU Huijuan, et al. Mineralization of an azo dye Acid Red 14 by photoelectro-fenton process using an activated carbon fiber cathode[J]. Applied Catalysis B Environmental, 2008, 84(3): 393. DOI:10.1016/j.apcatb.2008.04.016 |
| [24] |
王丽平. ACF/CNT复合材料的制备、表征及其吸附特性研究[D].长沙: 中南大学, 2012 WANG Liping. Investigation on preparation, characterization and adsorption properties of ACF/CNT composites[D]. Hunan: Central South University, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10533-1013358356.htm |
| [25] |
中西香尔, 索罗曼.红外光谱分析100例[M].王绪明, 译.北京: 科学出版社, 1984 NAKANISHI K, SOLOMON P H. 100 cases were analyzed by infrared spectroscopy[M]. WANG Xuming, translate. Beijing: Science Press, 1984 |
| [26] |
杨辉, 刘豪, 朱德力, 等. 活性炭纤维联合脱硫脱硝的机理分析[J]. 中国电机工程学报, 2015, 35(10): 2495. YANG Hui, LIU Hao, ZHU Deli, et al. Mechanism of combined removal of SO2 and NO over activated carbon fibers[J]. Proceedings of the CSEE, 2015, 35(10): 2495. |
| [27] |
刘辉, 李平, 魏雨, 等. 红外光谱技术在铁氧化物形成研究中的应用[J]. 河北师范大学学报(自然科学版), 2005, 29(3): 272. LIU Hui, LI Ping, WEI Yu, et al. Application of IR spectra in the studies on the formation of iron (Hydr)oxides[J]. Journal of Hebei Normal University (Natural Science Edition), 2005, 29(3): 272. DOI:10.3969/j.issn.1000-5854.2005.03.015 |
 2019, Vol. 51
2019, Vol. 51


