2. 深圳市水资源利用与 环境污染控制重点实验室,广东 深圳 518055;
3. 哈尔滨工业大学(深圳) 建筑学院,广东 深圳 518055
2. Shenzhen Key Laboratory of Water Resource Utilization and Environmental Pollution Control, Shenzhen 518055, Guangdong, China;
3. School of Architecture, Harbin Institute of Technology (Shenzhen), Shenzhen 518055, Guangdong, China
作为世界上产量和使用量最大的溴系阻燃剂,四溴双酚A(Tetrabromobisphenol A,简称TBBPA)广泛应用于各类电子、化工、塑料等行业生产工艺中,并经常出现在相应废水中,若这些工业废水尾水处理不彻底,TBBPA便会随排水进入受纳水体[1].研究表明,TBBPA具有多种毒性,对水生生物如水藻、蚤类、鱼类等存在较大影响,破坏受纳水体生态平衡[2];通过生物富集作用,TBBPA可对动物的肾脏、神经系统及内分泌系统等造成干扰和损害,甚至威胁到人体身体健康[3].由于TBBPA具有生物难降解性,传统的生物降解技术不能彻底去除废水中的TBBPA[4].因此,有必要研发高效的TBBPA降解技术,保证TBBPA彻底去除,降低排水生物毒性.近年来,化学高级氧化技术因其降解效果好而广泛应用于TBBPA的降解研究[5-7],其中,臭氧氧化技术具有处理效果明显、易于工程实施、便于推广应用等优点,具有较大的研究和应用价值.
目前,针对TBBPA降解技术的研究主要侧重于目标污染物本身的脱除,对于TBBPA降解过程中的生物毒性变化规律及相应的毒性控制效果还缺乏系统研究[8-9];另外,TBBPA微溶于水,实际工业废水中TBBPA质量浓度范围为 < 100 μg/L,而现有研究中多是利用有机助溶剂配制的高质量浓度TBBPA溶液(质量浓度50~100 mg/L),与实际质量浓度相差甚远,且有机助溶剂影响降解效果[10].因此,有必要系统研究与实际废水浓度相接近的TBBPA降解效果、降解过程中生物毒性的变化规律及毒性控制效果.
本研究将臭氧氧化技术应用于低浓度的TBBPA降解,探索目标污染物的脱除效果,深入研究TBBPA降解过程中水样生物毒性的变化情况及控制效果,包括急性毒性、慢性毒性和遗传毒性,并通过对降解中间产物进行定性及半定量研究,进一步分析生物毒性变化的内在原因,最后,在此基础上推测臭氧降解TBBPA的反应机理.
1 实验 1.1 试剂与仪器试剂:四溴双酚A粉末、酵母提取物、胰蛋白胨、组氨酸、生物素等试剂均为优级纯,盐酸羟氨、柠檬酸、葡萄糖等为分析纯,发光细菌冻干粉(从美国SDIX公司购得)、大型蚤(从华南环境科学研究所水生毒理实验室引种)、鼠伤寒沙门氏菌(选择TA100菌株,由美国Moltox公司购得)等.
仪器:青岛国林臭氧发生器、Eppendorf 5418离心机、美国Waters Acquity HClass超高效液相色谱(UPLC)、气相色谱-质谱联用仪(Agilent7890A/GC-5975C MS)、美国SDIX DeltaTox毒性检测仪、恒温培养箱、日本奥林巴斯荧光显微镜、美国Milli-Q超纯水净化系统.
1.2 实验方法实验在直径20 cm的臭氧反应柱进行(反应装置如图 1所示),反应所用TBBPA溶液提前24 h配制,在pH为7.0、温度为(25±1) ℃超纯水中将TBBPA固体粉末进行充分溶解,检测其平衡质量浓度为0.18 mg/L.反应开始时,用循环泵将所配TBBPA溶液打入臭氧反应柱内,臭氧经臭氧发生器制备后经气体流量计控制投加量进入反应柱,反应后尾气由碘化钾溶液进行吸收.反应在一定的时间点取样50 mL,并立即用20 μL 0.1 mol/L的盐酸羟氨终止反应.样品经5 000 r/min的转速离心5 min,转移上清液以备后续检测.
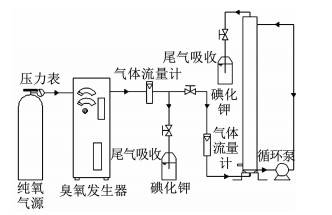
|
图 1 反应装置 Fig. 1 Diagram of reaction device |
TBBPA质量浓度利用UPLC进行检测分析,采用Waters BEHC18(1.7×100 mm)色谱柱、Acquity UPLC TUV检测器、甲醇/水(体积比)70/30的流动相,进样量1 μL、流速0.5 mL/min、柱温30 ℃、检测波长为210 nm.
TBBPA降解过程中水样的生物毒性主要包括急性毒性、慢性毒性和遗传毒性.急性毒性利用SDIX DeltaTox毒性检测仪进行检测,采用发光细菌法(GB/T 15441—1995),测定水样对发光细菌的发光度(X),计算相对发光抑制率(T),从而得到水样对于发光细菌的半效应质量浓度(EC50).慢性毒性采用大型蚤14 d毒性测试法,参考OECD大型蚤21 d慢性毒性测试标准方法进行,获得水样对于大型蚤死亡率的14 d最大无效应质量浓度(NOEC).急性毒性和慢性毒性均转化成毒性当量(toxicity unit,TU值)进行分析(TU=100%/EC50或TU=100%/NOEC)[11].依据美国废水排放毒性标准,要求急性毒性在0.3 TU以下,慢性毒性在1 TU以下[12].遗传毒性测定方法采用Ames试验,利用平板掺入法(GB 15193.4—1994),在37 ℃下培养48 h后,记录每皿的回变菌落数.同一剂量组各平行皿回变菌落数的平均值,与各未处理对照组自发回变菌落平均值的比值,为致突变比RM.当RM≥2,则测试水样为致突变阳性,即具有致突变性.
TBBPA降解中间产物定性分析利用Agilent GC-MS仪进行测定.水样经3次重复萃取、静置分层、无水硫酸钠脱水、玻璃纤维滤膜过滤等预处理步骤后转移至氮吹管,所得萃取液经氮吹浓缩至近干后加入1 mL二氯甲烷.气相色谱条件:采用HP-5型石英毛细管柱为色谱柱(30 m×250 μm×0.25 μm),氦气为载气,流速1 mL/min;进样口温度260 ℃,进样量1 μL,分流比10: 1.升温程序:柱温40 ℃(保持3 min),升温速率为15 ℃/min升至300 ℃(保持10 min),继续升温至325 ℃(保持3 min),用时25.67 min.质谱条件:质量扫描区间50~560 m/z,离子源230 ℃,电子轰击源EI为70 eV,四级杆温度150 ℃.
2 结果与讨论 2.1 TBBPA的降解情况首先考察臭氧氧化技术在不同pH(鉴于TBBPA的溶解性,pH考察范围为6.0~9.0)和不同氧化剂投加量条件下对TBBPA(0.15 mg/L)的降解情况,结果如图 2所示.
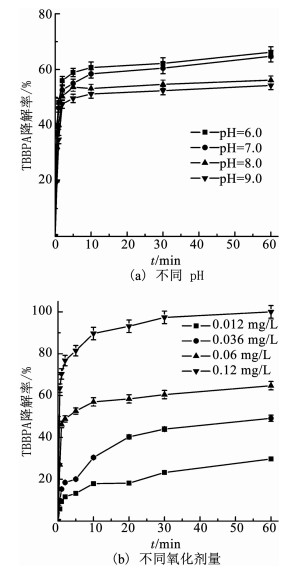
|
图 2 臭氧氧化技术对TBBPA的降解情况 Fig. 2 Degradation of TBBPA by ozonation |
如图 2(a)所示,当TBBPA质量浓度为0.15 mg/L、臭氧投加量为0.06 mg/L时,随着初始溶液pH由6.0升高至9.0,臭氧氧化技术对TBBPA的降解率从66.2%逐渐降低至54.3%.分析原因可知,随着pH的升高,更多的臭氧分子发生了自分解,参与TBBPA降解反应的臭氧分子减少,且臭氧的氧化还原电位降低,因此,TBBPA的降解效果变差.同时,由于TBBPA是双质子酸(TBBPA=TBBPA-+H+,pKa, TBBPA=7.5;TBBPA-=TBBPA2-+H+,pKa, TBBPA-=8.5),随着pH的增加,溶液中的TBBPA分子越来越多地以盐的形式存在(如TBBPA-、TBBPA2-),增加了TBBPA的电负性,从而不利于TBBPA与臭氧之间的接触反应[13].由于反应60 min后,pH在6.0和7.0条件下TBBPA的降解率接近,后续研究选择初始pH为7.0.如图 2(b)所示,当臭氧质量浓度从0.012 mg/L增加至0.12 mg/L,TBBPA的降解率从29.3%逐渐升高至100%.臭氧质量浓度的增加,使得溶液中的臭氧分子及新生成的· OH质量浓度增加,从而增加了与溶液中TBBPA分子的有效接触反应机会,因此,TBBPA的去除率相应增加.当TBBPA完全脱除时,臭氧与TBBPA的摩尔比仅为9: 1,可见臭氧氧化技术对低质量浓度的TBBPA具有良好的降解效果.
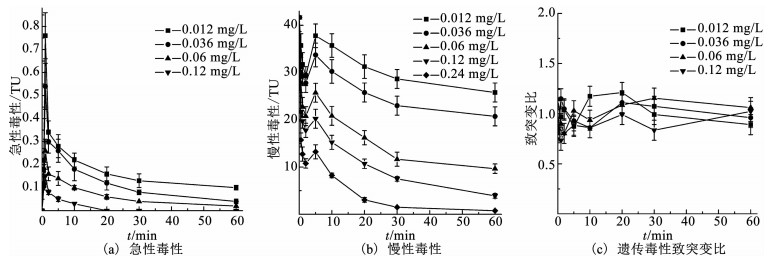
2.2 生物毒性的变化及控制情况在溶液初始pH为7.0、TBBPA质量浓度为0.15 mg/L时,研究不同臭氧投加量条件下臭氧氧化技术降解TBBPA反应过程中水样的生物毒性变化及控制情况,包括急性毒性、慢性毒性和遗传毒性,结果如表 1和图 3所示.由图 3(a)可知,在臭氧氧化技术降解TBBPA反应过程中,水样的急性毒性呈先急剧升高后逐渐降低的趋势.反应开始前,毒性当量接近为0,说明TBBPA本身的急性毒性非常低,可忽略不计.反应初期,急性毒性快速升高,在反应1 min时达最高值0.76 TU(此时臭氧投加量为0.012 mg/L);随着反应时间的延长,毒性当量逐渐降低,当反应至60 min时,不同臭氧投加量条件下的急性毒性均被控制在0.1 TU以下.由图 3(b)可知,与急性毒性相比,TBBPA具有较高的慢性毒性,其毒性当量高达41.67 TU.在TBBPA降解过程中,水样的慢性毒性呈先略有降低、继而升高、后逐渐降低的趋势.反应在5 min时再次达到最高值37.8 TU(此时臭氧投加量为0.012 mg/L).随着反应的深入,慢性毒性逐渐减弱,当反应60 min后,毒性当量最低可控制在0.76 TU(此时臭氧投加量为0.24 mg/L).
| 表 1 不同投加量臭氧去除TBBPA过程中Ames试验回变菌落数 Tab. 1 Number of revertant colonies in Ames test during TBBPA degradation by different dosages of ozone |
|
图 3 反应过程中生物毒性的变化及控制情况 Fig. 3 Variation and control of toxicity during the reaction |
随着臭氧投加量的增加,臭氧氧化技术对TBBPA降解过程中的急性毒性和慢性毒性控制效果逐渐增强.当臭氧质量浓度从0.012 mg/L增加至0.12 mg/L时,急性毒性在反应1 min时从0.76 TU降低至0.15 TU、在反应20 min时从0.16 TU降低至0 TU;慢性毒性在反应5 min时从37.8 TU降低至13.2 TU、在反应60 min时从25.8 TU降低至0.76 TU,急性毒性和慢性毒性均达到美国废水排放毒性标准.
如表 1所示,对反应过程中各水样进行Ames试验,获得空白组回变菌落数为160±12,试验组TA100菌株的回变菌落数范围为(117±6)~(193±17),结果表明,实验组对比空白组的回变菌落数均无明显增多.计算试验组与空白组数据的比值,得到致突变比(RM),结果如图 3(c)所示,RM为0.73~1.21,均小于2,即均不具有致突变性.可见,在臭氧氧化技术降解TBBPA过程中,所产生的降解产物均未能诱发碱基置换突变,即不具有基因水平的遗传毒性.
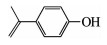
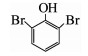
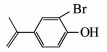
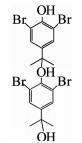
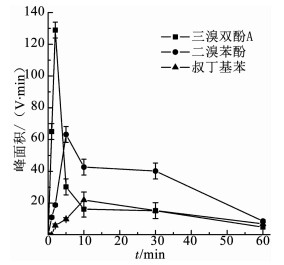
由图 3(a)、(b)可知,在臭氧氧化技术降解TBBPA的反应初期,水样的急性毒性和慢性毒性均呈升高趋势.为了解释这一现象,对反应过程中的中间产物进行GC-MS/MS定性分析,结果如表 2所示,可知中间产物主要有三溴双酚A、多个二溴苯酚类物质及完全脱溴产物叔丁基苯等.毒理学数据显示,三溴双酚A、二溴苯酚类物质、叔丁基苯的LD50(大鼠,口径)分别为2 000,282,2 600 mg/kg,远低于TBBPA的LD50(3 160 mg/kg),说明这些中间产物的毒性均高于TBBPA物质本身[14].进一步对这3个中间产物进行半定量分析(如图 4所示,以峰面积计),结果表明,随着TBBPA的降解,三溴双酚A、二溴苯酚和叔丁基苯的生成量在反应初期迅速升高、然后逐渐降低,其生成情况与水样的生物毒性变化规律基本一致.随着反应时间的延长,有毒中间产物峰面积逐渐减少,说明其被深入降解,生物毒性随之被有效控制.
| 表 2 臭氧降解TBBPA过程中的有机中间产物 Tab. 2 Intermediates of TBBPA degradation by ozonation |
|
图 4 中间产物峰面积变化情况 Fig. 4 Variation of the peak area of the intermediates |
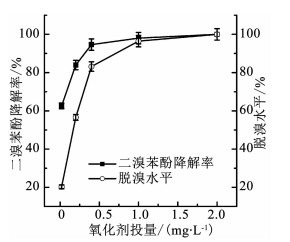
由于臭氧降解TBBPA过程中主要中间产物为二溴类物质,且其毒性最高,因此,有必要了解臭氧氧化技术对此类中间产物的降解能力.以2, 6-二溴苯酚为例(其初始质量浓度为0.1 mg/L),臭氧投加质量浓度分别为0.02,0.2,0.4,1.0,2.0 mg/L(臭氧与2, 6-二溴苯酚摩尔比分别为1: 10,1: 1,2: 1,5: 1,10: 1),溶液初始pH为7.0,温度为(25±0.5)℃.在反应30 min时取样,水样经预处理后利用气相色谱仪检测2, 6-二溴苯酚剩余质量浓度,同时利用离子色谱仪检测反应过程中生成的游离溴离子含量以反应脱溴水平,结果如图 5所示.结果表明,臭氧氧化技术对TBBPA有毒中间产物2, 6-二溴苯酚具有较好的降解效果和脱溴能力.当臭氧与2, 6-二溴苯酚的摩尔比由1: 10升高到10: 1时,经30 min接触反应,2, 6-二溴苯酚的降解率从62.6%增加至100%,2, 6-二溴苯酚可被完全去除;脱溴率从20.3%增加至100%,最终无含溴有毒中间产物.
|
图 5 臭氧对2, 6-二溴苯酚的降解情况 Fig. 5 Degradation of 2, 6-dibromophenol by ozonation |
综上,臭氧降解TBBPA过程中水样的急、慢性毒性先升高后降低趋势与更高毒性中间产物的积累及进一步降解密切相关.通过增加臭氧投加量和延长接触氧化时间,使反应过程中生成的有毒中间产物得到降解,可有效控制水样的生物毒性.
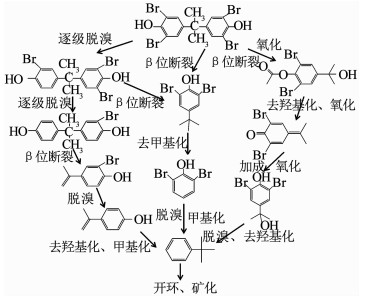
2.3 降解机理分析臭氧氧化工艺除污机制已被广泛证明包括臭氧分子直接氧化途径和·OH间接氧化途径[15];同时,根据TBBPA分子结构中电荷密度和自旋密度的分布情况,TBBPA容易受攻击的主要结构包括连接两苯环的C—C键和苯环上的C—Br键[16].本研究结合文献调研和表 2中测定的有机中间产物对臭氧降解TBBPA的机理进行分析,结果如图 6所示.
|
图 6 臭氧降解TBBPA的可能性机理 Fig. 6 Possible mechanism of TBBPA degradation by ozonation |
推测臭氧降解TBBPA反应途径主要有:1)TBBPA通过逐级脱溴反应生成三溴双酚A、二溴双酚A及一溴双酚A,经β位断裂反应使得中心碳原子断开生成溴代芳香有机物邻溴对异丙烯基苯酚,并继续经脱溴反应、去羟基化和甲基化反应生成单苯环芳香烃叔丁基苯;2)反应初始臭氧及·OH直接攻击TBBPA中心碳原子C—C键,其断裂后生成2, 6-二溴对叔丁基苯酚,继续经去甲基化生成二溴苯酚,二溴苯酚经脱溴生成叔丁基苯;3)TBBPA经β位断裂反应后经臭氧氧化及羟基化反应后,其苯环对位羟基较活跃,被氧化生成2, 6-二溴对(2-丙醇)乙酸苯酯及2, 6-二溴对异丙烯基苯醌,后被氧化羟基化生成2, 6-二溴对-(2-叔丁醇)苯酚,继而经加成、氧化、脱溴及去羟基化等反应,生成叔丁基苯.最终,所有中间产物经开环并被最终矿化为二氧化碳和水.
综上,臭氧降解TBBPA的主要反应过程包括脱溴反应、β位断裂反应、加成反应、去羟基化反应、甲基化反应等.
3 结论1) 臭氧氧化技术对水中低质量浓度TBBPA(0.15 mg/L)也可有效降解.当溶液pH为7.0、臭氧投加量为0.12 mg/L时,经60 min接触氧化反应TBBPA可被完全脱除.
2) 在TBBPA降解初期,水样的急、慢性毒性均有增高趋势;随着反应的深入,有毒中间产物被深入降解,急、慢性毒性均得到良好的控制.生物毒性变化趋势与更高毒性有机中间产物的积累和降解有密切联系.
3) 反应过程中水样的致突变比RM均小于2.0,表明水样不具有基因水平的遗传毒性.
4) 随着臭氧投加量的增加,臭氧氧化技术对反应过程中的急、慢性毒性控制得更快、更显著.当臭氧投加量为0.12 mg/L时,急性毒性在反应20 min时被完全控制;慢性毒性在反应60 min时被控制至0.76 TU,均达到废水排放毒性标准.
5) 臭氧氧化技术降解TBBPA的主要反应过程包括脱溴反应、β位断裂反应、加成反应、去羟基化反应、甲基化反应等.
| [1] |
LIU Kou, LI Jun, YAN Shengjun, et al. A review of status of tetrabromobisphenol A (TBBPA) in China[J]. Chemosphere, 2016, 148: 8. DOI:10.1016/j.chemosphere.2016.01.023 |
| [2] |
LIU Hongling, MA Zhiyuan, ZHANG Tao, et al. Pharmacokinetics and effects of tetrabromobisphenol A (TBBPA) to early life stages of zebrafish (Danio rerio)[J]. Chemosphere, 2018, 190: 243. DOI:10.1016/j.chemosphere.2017.09.137 |
| [3] |
SHI Zhixiong, ZHANG Lei, ZHAO Yunfeng, et al. A national survey of tetrabromobisphenol-A, hexabromocyclododecane and decabrominated diphenyl ether in human milk from China: Occurrence and exposure assessment[J]. Science of the Total Environment, 2017, 599/600: 237. DOI:10.1016/j.scitotenv.2017.04.237 |
| [4] |
LIU Aifeng, SHI Jianbo, QU Guangbo, et al. Identification of emerging brominated chemicals as the transformation products of tetrabromobisphenol A (TBBPA) derivatives in soil[J]. Environmental Science & Technology, 2017, 51: 5434. |
| [5] |
GAO Shengwang, GUO Changsheng, HOU Song, et al. Photocatalytic removal of tetrabromobisphenol A by magnetically separable flower-like BiOBr/BiOI/Fe3O4 hybrid nanocomposites under visible-light irradiation[J]. Journal of Hazardous Materials, 2017, 331: 1. DOI:10.1016/j.jhazmat.2017.02.030 |
| [6] |
GU Chen, WANG Jing, LIU Shasha, et al. Biogenic Fenton-like reaction involvement in cometabolic degradation of tetrabromobisphenol A by Pseudomonas sp. fz[J]. Environmental Science & Technology, 2016, 50: 9981. |
| [7] |
张丹丹, 于鑫, 何士龙. 臭氧氧化四溴双酚A过程中溴离子和溴酸盐生成的影响因素[J]. 化工进展, 2012, 31(6): 1368. ZHANG Dandan, YU Xin, HE Shilong. Effect of different influence factors on Br- and BrO3- generation during ozonation of TBBPA[J]. Chemical Industry and Engineering Progress, 2012, 31(6): 1368. DOI:10.16085/j.issn.1000-6613.2012.06.044 |
| [8] |
CAO Muhan, WANG Peifang, AO Yanhui, et al. Photocatalytic degradation of tetrabromobisphenol A by a magnetically separable grapheno-TiO2 composite photocatalyst: Mechanism and intermediates analysis[J]. Chemical Engineering Journal, 2015, 264: 113. DOI:10.1016/j.cej.2014.10.011 |
| [9] |
GU Jianqiang, JING Yuying, MA Yini, et al. Effects of the earthworm Metaphire guillelmi on the mineralization, metabolism, and bound-residue formation of tetrabromobisphenol A (TBBPA) in soil[J]. Science of the Total Environment, 2017, 595: 528. DOI:10.1016/j.scitotenv.2017.03.273 |
| [10] |
ZHOU X, GUO J, ZHANG W, et al. Tetrabromobisphenol A contamination and emission in printed circuit board production and implications for human exposure[J]. Journal of Hazardous Materials, 2014, 273(6): 27. |
| [11] |
徐建英, 赵春桃, 魏东斌. 生物毒性检测在水质安全评价中的应用[J]. 环境科学, 2014, 35(10): 3991. XU Jianying, ZHAO Chuntao, WEI Dongbin. Toxicity tests and their application in safety assessment of water quality[J]. Environmental Science, 2014, 35(10): 3991. DOI:10.13227/j.hjkx.2014.10.049 |
| [12] |
梁慧, 袁鹏, 宋永会, 等. 工业废水毒性评估方法与应用研究进展[J]. 中国环境监测, 2013, 29(6): 85. LIANG Hui, YUAN Peng, SONG Yonghui, et al. Progress on toxicity assessment methods of industrial wastewater and their application[J]. Environmental Monitoring in China, 2013, 29(6): 85. DOI:10.19316/j.issn.1002-6002.2013.06.017 |
| [13] |
LI Nan, ZHANG Jiaqi, WANG Cuiping, et al. Enhanced photocatalytic degradation of tetrabromobisphenol A by tourmaline-TiO2 composite catalyst[J]. Journal of Materials Science, 2017, 52(12): 6937. DOI:10.1007/s10853-017-0926-8 |
| [14] |
DEBENEST T, GAGNÉ F, PETIT A N, et al. Ecotoxicity of a brominated flame retardant (tetrabromobisphenol A) and its derivatives to aquatic organisms[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2010, 152(4): 407. |
| [15] |
BROSÉUS R, VINCENT S, ABOULFADL K, et al. Ozone oxidation of pharmaceuticals, endocrine disruptors and pesticides during drinking water treatment[J]. Water Research, 2009, 43(18): 4707. DOI:10.1016/j.watres.2009.07.031 |
| [16] |
FENG Yiping, COLOSI L M, GAO Shixiang, et al. Transformation and removal of tetrabromobisphenol A from water in the presence of natural organic matter via laccase-catalyzed reactions: Reaction rates, products, and pathways[J]. Environmental Science & Technology, 2013, 47: 1001. |
 2019, Vol. 51
2019, Vol. 51