双酚A(BPA)是一种典型的环境内分泌干扰物,广泛存在于日常生活用品中,并通过食物链等途径进入人体体内进行富集,从而对人体内分泌系统健康构成严重威胁[1].基于活化过硫酸盐,产生硫酸根自由基(SO4·-)作为主要活性物种降解有机污染物的高级氧化法是近年来发展起来的新型水处理技术,因低能耗、高氧化势能及氧化剂的良好稳定性受到关注.海泡石是一种呈纤维状的天然黏土矿物质,标准化学式为Mg8Si12O30(OH)4(OH2)4.8H2O[2].其具有特征明显的晶体结构,结构单元由中间一层镁氧八面体和两层硅氧四面体组成.海泡石的理论计算比表面积可达800~900 m2/g,具有极强的吸附、脱色能力和良好的稳定性,因此,常被应用为重金属吸附剂、催化剂载体等.由于海泡石质轻、密度低的特点,在水处理环节不易被回收,将其作为载体负载具有磁性的四氧化三铁(Fe3O4)后,则可以通过外加磁场进行有效的收集.于生慧[3],杨欣洁[4],Liu等[5]都使用这种磁性复合材料进行了水中重金属离子以及有机污染物吸附方面的实验研究,这种处理技术充分利用了海泡石的结构优势,却忽略了Fe3O4本身是一种良好的催化剂活性组分.而将磁改性海泡石作为非均相催化剂,催化过氧化物(包括H2O2和过硫酸盐)去除水中有机污染物的研究更是鲜有报道.
本文采用共沉淀法制得磁改性海泡石催化剂,并用于催化过硫酸钾(PDS)去除水中BPA,通过X射线衍射仪、X射线光电子能谱分析、扫描电镜、透射电镜、氮气吸脱附等表征手段对催化剂结构进行了研究,考察了不同反应条件对BPA降解效果的影响,提出了吸附-氧化耦合过程的反应机理,并对催化剂的稳定性及铁离子的渗出情况进行了测试.
1 实验 1.1 试剂和仪器海泡石原样购于石家庄某海泡石厂,九水硝酸铁、七水硫酸亚铁、氢氧化钠、硝酸购于上海麦克林生化科技有限公司,双酚A、过硫酸钾、乙醇、叔丁醇购于Sigma Aldrich,硫酸亚铁铵、盐酸羟胺、邻菲罗啉购于上海国药基团,所用试剂均为分析纯.
D/Max 2550系列X射线衍射仪(XRD,日本理学公司);K-Alpha型X射线光电子能谱仪(XPS,英国赛默飞公司);氮气吸脱附仪(沃德仪器有限公司);1550VP型场发射扫描电镜(FESEM,德国蔡司);JEM-2100型透射电镜(TEM,日本电子公司);TENSOR27型红外光谱仪(FTIR,德国Bruker公司);1290型超高效液相色谱(UPLC,美国安捷伦公司);HH-6型数显恒温水浴锅(常州无有实验仪器有限公司);PHS-3D型pH计(上海雷磁有限公司);101型电热恒温鼓风干燥箱(北京中兴伟业公司).
1.2 磁改性海泡石催化剂的制备天然海泡石先使用超纯水进行清洗,以1/20的固液比将其分散至酸性溶液(pH=2)中搅拌2 h以移除杂质,在80 ℃烘箱烘干后,置于300 ℃马弗炉煅烧3 h,即得到改性的海泡石载体.
磁性海泡石通过共沉淀法制备.将一定比例的FeNO3·9H2O, FeSO4·7H2O和改性海泡石混合于相应量的超纯水,溶液在60 ℃水浴锅中搅拌15 min,随后逐滴滴入NaOH(1 mol/L)溶液直至体系pH达到9.所得的深棕色溶液继续加热搅拌30 min后从水浴锅中取出,冷却至室温,离心分离并用超纯水清洗至上层清液为中性.固体混合物用乙醇洗去未能溶解的铁盐,并在80 ℃下干燥12 h后粉碎至100目粒度,得到粉末磁改性海泡石催化剂.
1.3 测试方法 1.3.1 催化剂表征使用XRD对催化剂晶体结构进行表征(Cu Kα/石墨单色器,扫描速率2°/min,扫描角度10°~90°);使用XPS分析判断催化剂中所含元素的种类以及价态;使用氮气吸脱附仪对催化剂比表面积及孔径大小分布进行分析计算;使用SEM,TEM对不同放大倍数下的催化剂表面形貌进行表征.
1.3.2 液相指标分析方法使用UPLC对溶液中BPA质量浓度进行检测(色谱柱为Spheri-5 C18型,检测波长为276 nm);使用邻菲罗啉法对溶液中铁离子浓度进行检测.
1.3.3 活性测试方法取100 mL质量浓度为30 mg/L的BPA溶液于烧杯中,先通过酸碱缓冲液调节溶液pH,待稳定后添加一定量的磁改性海泡石催化剂,持续搅拌一定时间直至吸附平衡,随后按摩尔比例添加PDS,并以此时刻为反应时间原点.每隔一定时间使用针管注射器取样,即刻过滤(0.22 μm PES过滤膜)以转移催化剂,并移至液相色谱进样瓶待测.每次反应结束后,催化剂通过磁铁分离收集,使用超纯水反复冲洗,于80 ℃烘干箱中干燥3 h候后重复使用.
2 结果与分析 2.1 催化剂表征分析 2.1.1 晶体结构(XRD)分析混合价态铁氧化物的合成与前驱液中铁离子总浓度、Fe(Ⅱ)/Fe(Ⅲ)比例以及离子强度等因素相关.在磁性海泡石催化剂制备过程中,固定Fe(Ⅱ)/Fe(Ⅲ)比例,通过调整铁离子总浓度(0.06~0.24 mol/L)来考察其对催化剂成分的影响.如图 1所示,当铁离子总浓度为0.06 mol/L时,图谱中显示了Fe3O4的特征峰(JCPDS card No. 19-0629),在30°,35°,43°,60°出现的特征峰分别对应着晶面(220),(311),(511)和(440)[6],证明催化剂属于典型面心立方结构,也表明铁离子已经成功地负载在海泡石载体上,并以混合价态铁氧化物的形式存在.而随着前驱液铁离子浓度逐渐提高,这些特征峰开始逐渐消失,并被Fe2O3的特征衍射峰取代.因此,实验最终确定以0.06 mol/L作为催化剂制备前驱液的固定铁离子浓度.
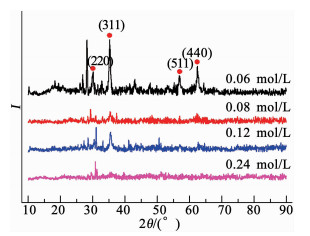
|
图 1 各种前驱液浓度制备出的催化剂XRD图 Fig. 1 XRD patterns with different precursor solutions |
含铁矿物中的亚铁离子和铁离子可以通过XPS探测与区分.图 2所示为磁改性海泡石催化剂的XPS光谱图,图 2没有发现Fe2O3的特征卫星震荡峰,Fe2p3/2和Fe2p1/2的结合能分别为710.98和724.69 eV,与Fe3O4的一致,表明铁元素以+2和+3价存在于催化剂中,进一步证实所生成的铁氧化物是磁铁矿[7].而镁元素的特征峰则应来自海泡石载体的硅酸镁成分.
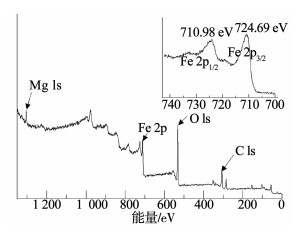
|
图 2 磁改性海泡石催化剂的XPS光谱 Fig. 2 XPS spectra of magnetic-modified sepiolite catalyst |
由图 3(a)可以看出,负载前海泡石宽约50 nm的纤维束单元,表面光滑,结构清晰.而在负载之后,纤维束表面布满了细小的Fe3O4颗粒,并因此而变得粗糙不平(图 3(b)~(d)).

|
图 3 负载前(a)、后(b, c, d)的海泡石高分辨率SEM图 Fig. 3 HRSEM image of sepiolite before (a) and after loading(b, c, d) |
由催化剂的TEM图(图 4)可以清晰看出,Fe3O4纳米颗粒的方形切面及四方体结构(图 4(a), (b)),颗粒附着在海泡石表面,大小在10~30 nm内.根据高分辨TEM(图 4(c)),可以看出,其晶面间距分别为0.297,0.254和0.161 nm,分别对应(220),(311)和(511)晶面[6].

|
图 4 磁改性海泡石催化剂的TEM图 Fig. 4 TEM and HRTEM image of magnetic-modified sepiolite catalyst |
图 5为磁改性海泡石催化剂的氮气吸附/脱附等温线和孔径分布.可以看出,在相对压力(p/p0)达0.8~0.9时,吸附量的增长速率开始显著提高,吸附过程属于典型的IV型吸附,具有明显的滞后回环,暗示催化剂中存在介孔.根据多孔材料孔径大小的定义,小于2 nm的为微孔,2~50 nm的为介孔,大于50 nm的为大孔[8].由图 5~7插图可以看出,催化剂的孔径分布主要在2~50 nm,部分大于50 nm,因此,主要由介孔和少部分大孔组成.根据BET计算方法得到磁改性海泡石催化剂的比表面积、平均孔径和孔容分别为81.02 m2/g,7.88 nm以及0.116 cm3/g.
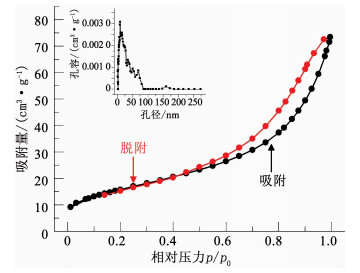
|
图 5 磁改性海泡石催化剂的氮气吸附/脱附等温线及孔径分布(插图) Fig. 5 Nitrogen adsorption/desorption isotherm and pore size distribution (illustration) of magnetic-modified sepiolite catalyst |
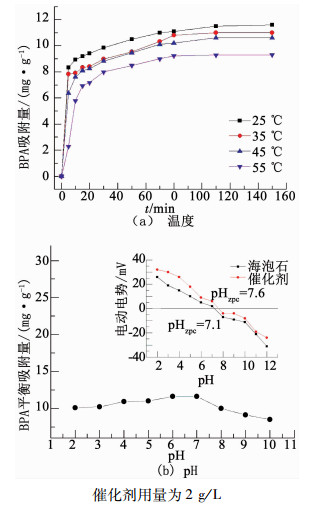
|
图 6 BPA在不同温度及溶液pH下的吸附行为及催化剂的等电点(b插图) Fig. 6 Adsorption behavior of BPA at different temperatures and solution pH values, and the isoelectric point of the catalyst (illustration b) |
|
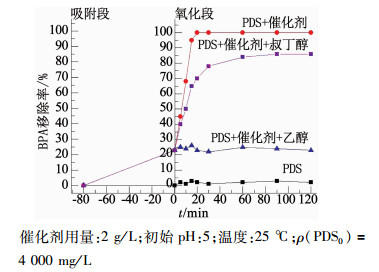
图 7 不同体系催化PDS降解BPA的效果 Fig. 7 BPA removal efficiency in different systems |
由于海泡石载体具有优良的吸附能力,在催化活性测试前,首先研究催化剂对BPA的吸附行为.图 6(a)为25, 35, 45以及55 ℃下,催化剂对BPA的吸附情况.可以看出,在所有温度下,BPA的吸附量都在前10 min内快速提高,随后缓慢增加并在80 min内达到吸附平衡,各温度下的平衡吸附量分别为11.6,11.0,10.6以及9.3 mg/g.平衡吸附量与吸附速率均随着温度升高而降低,说明该吸附过程为放热过程[9].在液体中,固体颗粒表面的电荷分布对有机物的吸附行为有较大影响,等电点(pHzpc)是颗粒表面电荷为零时溶液的pH[10].催化剂表面的净电荷量随溶液pH的变化如图 6(b)中插图所示,可知海泡石载体和催化剂的等电点分别为7.1和7.6.当溶液pH低于等电点时,催化剂表面基团质子化(≡S-OH→≡S-OH2+)而带正电,反之,则会因为表面基团脱羟基或者去质子化(≡S-OH→≡S-O-)而带负电[11].催化剂的等电点高于海泡石载体,是因为磁性Fe3O4纳米颗粒的引入改变了复合物的整体电化学性能.不同溶液pH下,BPA平衡吸附量的变化如图 6(b)所示,当溶液pH低于7时,BPA的平衡吸附量基本不发生变化,而当pH高于7时则开始逐渐下降.BPA在碱性溶液中主要以负二价离子或负一价离子的形式存在(式(1)~(2)[12],因此,会排斥带负电的固体颗粒表面,导致吸附量下降.
| $ \mathrm{H}_{2} \mathrm{BPA} \rightarrow \mathrm{H}^{+}+\mathrm{HBPA}^{-}(\mathrm{pH} 为 7 \sim 12), $ | (1) |
| $ \mathrm{HBPA}^{-} \rightarrow \mathrm{H}^{+}+\mathrm{BPA}^{2-}(\mathrm{pH}为 8 \sim 12). $ | (2) |
图 7为不同体系催化PDS降解BPA的效率曲线.在加入PDS前,溶液预先搅拌80 min以达到吸附平衡,待吸附结束,溶液中残留77%的BPA(没有催化剂的体系未发生吸附).随后向溶液中加入PDS,在催化剂的作用下,BPA的完全降解在前20 min内即完成.
含R-羟基的乙醇与·OH和SO4·-的反应速率常数分别为(1.2~2.8)×109和(1.6~7.7)×107/(mol/L · s),远高于大多有机物,因此,可以快速同时淬灭两种自由基;而不含R-羟基的叔丁醇与·OH和SO4·-的反应速率常数则分别为(3.8~7.6)×108和(4~9.1)×105/(mol/L · s),相差近1 000倍[13],因此,会优先淬灭·OH.当向两个体系中分别加入过量的乙醇和叔丁醇时,可以看出,BPA降解速率及降解效果降低.加入过量叔丁醇的体系内,BPA的30 min降解率由100%下降到78%,说明体系内存在一部分·OH被其捕获,从而影响了降解效果;加入过量乙醇的体系内,BPA的降解几乎被完全抑制,说明体系中起主要降解作用的是SO4·-.
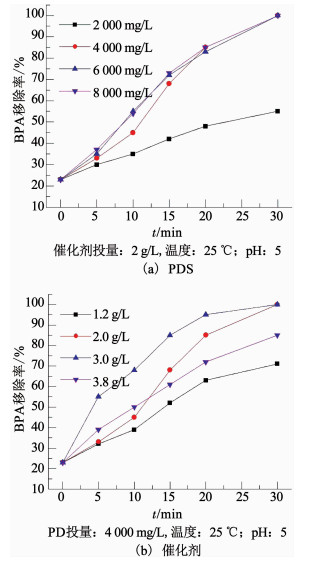
2.3.2 PDS投量对BPA降解效率的影响图 8(a)为不同的PDS投量对BPA降解效率的影响.当PDS的投量为2 000 mg/L时,BPA的30 min降解率仅可达55%,催化PDS产生SO4·-是BPA发生降解的唯一原因,当其投量不足时,BPA的完全降解必然无法实现.进一步提高PDS投量至4 000 mg/L,BPA在20 min内即可接近完全降解,而继续提高时,则已无其他显著变化.在该组实验中催化剂的投量固定为2.0 g/L,为PDS提供的活性点密度也是固定的,当其数量不足时,过多的氧化剂将无法再持续提高自由基的产量.
|
图 8 不同反应条件下体系降解BPA的效果 Fig. 8 BPA removal efficiency under different reaction conditions |
图 8(b)为不同的催化剂投量对BPA降解效率的影响.当催化剂投量为1.2 g/L时,BPA的30 min降解率仅可达71%,当投量继续提高至2.0和3.0 g/L时,BPA的30 min降解率也随之提高并可达到100%.这是由于催化剂表面的活性位点是催化PDS的主要来源,提高催化剂投量相当于增大了PDS被催化的概率.但当投量进一步提高至3.8 g/L时,BPA降解效率却降低至85%,这可能是因为体系中悬浮的过多催化剂颗粒对自由基产生的湮灭作用,另一方面,自由基的瞬时大量生成也引发了自身淬灭反应.
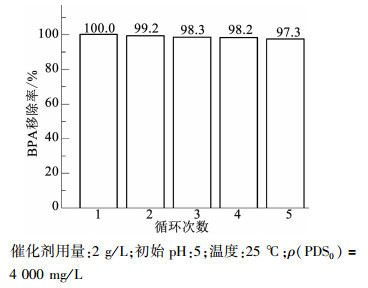
2.4 催化剂重复性测试基于活性测试部分对反应条件的探索,选择在最优条件(催化剂用量:2 g/L;初始pH:5;温度:25 ℃;ρ(PDS0)=4 000 mg/L)下对催化剂的重复使用性能进行考察.每次反应之后通过外加磁场分离固体催化剂,反复清洗并烘干后继续使用.图 9为5次循环使用后,体系对BPA的60 min降解效率.可以看出,循环使用对催化剂的活性影响波动在3%以内,体系仍保持着较高的有机物降解能力,5次实验后BPA的60 min降解率可达到97.3%,较首次使用下降了2.7%.原因可能包括:数次反应过程中纳米Fe3O4发生了团聚,减少了暴露在外的活性位点;催化PDS过程中被氧化为3价的铁元素部分未能重新被还原为2价;反应在酸性条件下进行,逐渐有部分铁离子渗出至溶液中,降低了催化剂的活性组分含量.为了考察催化剂的稳定性及铁离子渗出情况,又对每次反应完成后溶液内的铁离子进行质量浓度分析.结果显示,在前3次反应中(包含催化剂首次使用的反应),溶液铁离子质量浓度均在检测限以下(1 mg/L),而在第4次反应后,溶液中开始检测出铁离子,质量浓度分别为2.1,1.5和1.6 mg/L,说明在反应后期,确实有少量铁的渗出,但即使全部为2价铁离子,其质量浓度依然不足以引发均相反应[14-16].总体来说,在重复使用测试中,催化剂依然呈现了良好的稳定性及高效性.
|
图 9 催化剂重复性测试 Fig. 9 BPA degradation with recycled catalyst |
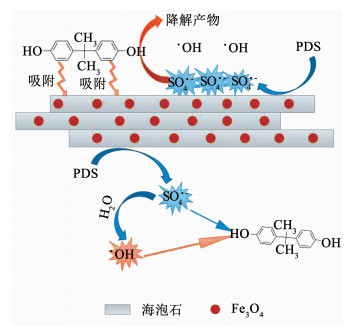
由于催化剂的海泡石载体本身对BPA分子具有强吸附作用,认为体系中的BPA降解同时发生在催化剂表面和溶液当中,如图 10机理图所示.
|
图 10 磁性海泡石催化PDS降解BPA的吸附-氧化耦合过程机理 Fig. 10 Mechanism of adsorption-oxidation coupling process of BPA degradation by catalyzed PDS by magnetic-modified sepiolite |
PDS在催化剂表面经活性位点催化产生SO4·-,一部分直接对被吸附的BPA分子进行原位氧化,另一部分则扩散到溶液中氧化未被吸附的BPA分子.由自由基猝灭实验的结果已经可知,体系中BPA分子的降解主要是来自SO4·-进攻,少量的·OH可能来自SO4·-对水分子的夺H作用[17].这种吸附-氧化耦合的催化氧化方式,使自由基免于在扩散过程(由催化剂表面向溶液主体)中被各类粒子湮灭,一定程度上提高了自由基的使用效率.
3 结论1) 使用共沉淀法通过调节前驱液铁离子浓度制备得到负载于海泡石上的纳米Fe3O4催化剂,颗粒平均粒径为10~30 nm,比表面积、平均孔径和孔容分别为81.02 m2/g,7.88 nm和0.116 cm3/g.
2) 磁改性海泡石催化剂对溶液中的BPA具有较好的吸附作用,平衡吸附量随着温度升高而降低,室温下(25 ℃)的平衡吸附量为11.6 mg/g,而当溶液pH低于7时,平衡吸附量不随溶液pH发生变化.
3) 活性测试结果表明,磁改性海泡石是一种有效的过硫酸盐催化剂,可以高效催化PDS产生自由基物种.室温下,催化剂投量为2 g/L、PDS投量为4 000 mg/L、pH为5时,催化剂催化PDS对BPA(30 mg/L)的完全降解可在20 min内完成,且重复使用5次之后,仍能保持较好的催化活性.
4) 自由基猝灭实验证明体系内自由基以SO4·-为主,少量·OH为辅.前者由PDS经催化剂催化产生,同时攻击吸附在固体表面和溶液中的BPA分子,后者由H2O分子经SO4·-夺H后产生,攻击溶液中的BPA分子.
5) 使用磁改性海泡石催化剂催化PDS降解BPA的反应体系内,存在吸附-氧化的耦合反应过程,这种方式使BPA降解可以直接在催化剂表面发生,避免了一部分因扩散而造成的自由基湮灭,有效提高了自由基的使用效率.
| [1] |
VANDENBERG L N, LUTHI D, QUINERLY D. Plastic bodies in a plastic world: Multi-disciplinary approaches to study endocrine disrupting chemicals[J]. Journal of Cleaner Production, 2017, 140: 373. DOI:10.1016/j.jclepro.2015.01.071 |
| [2] |
AKKARI M, ARANDA P, BELVER C, et al. ZnO/sepiolite heterostructured materials for solar photocatalytic degradation of pharmaceuticals in wastewater[J]. Applied Clay Science, 2018, 156: 104. DOI:10.1016/j.clay.2018.01.021 |
| [3] |
于生慧.纳米环境矿物材料的制备及重金属处理研究[D].合肥: 中国科学技术大学, 2016 YU Shenghui. Preparation of nano-mineral ecomaterials and their applications in heavy metals treatment[D]. Hefei: University of Science and Technology of China, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10358-1016103133.htm |
| [4] |
杨欣洁.新型磁性复合有机海泡石对双酚A的吸附试验研究[D].长沙: 湖南大学, 2015 YANG Xinjie. Adsorption of bisphenol A from aqueous solutions onto new magnetic composite organic sepiolite[D]. Changsha: Hunan University, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10532-1015731415.htm |
| [5] |
LIU Haicheng, CHEN Wei, LIU Cheng, et al. Magnetic mesoporous clay adsorbent: Preparation, characterization and adsorption capacity for atrazine[J]. Microporous & Mesoporous Materials, 2014, 194(7): 72. DOI:10.1016/j.micromeso.2014.03.038 |
| [6] |
LI Wenhui, WU Xiaofeng, LI Shuangde, et al. Magnetic porous Fe3O4/carbon octahedra derived from iron-based metal-organic framework as heterogeneous Fenton-like catalyst[J]. Applied Surface Science, 2018, 436: 252. DOI:10.1016/j.apsusc.2017.11.151 |
| [7] |
ZHOU Yang, XIAO Bo, LIU Shouqing, et al. Photo-Fenton degradation of ammonia via a manganese-iron double-active component catalyst of graphene-manganese ferrite under visible light[J]. Chemical Engineering Journal, 2016, 283(12): 266. DOI:10.1016/j.cej.2015.07.049 |
| [8] |
ANGIN D, KOSE T E, SELENGIL U. Production and characterization of activated carbon prepared from safflower seed cake biochar and its ability to absorb reactive dyestuff[J]. Applied Surface Science, 2013, 280(5): 705. DOI:10.1016/j.apsusc.2013.05.046 |
| [9] |
DONG Yi, WU Deyi, CHEN Xuechu, et al. Adsorption of bisphenol A from water by surfactant-modified zeolite[J]. Journal of Colloid & Interface Science, 2010, 348(2): 585. DOI:10.1016/j.jcis.2010.04.074 |
| [10] |
PARK J, REGALBUTO J R. A simple, accurate determination of oxide pzc and the strong buffering effect of oxide surfaces at incipient wetness[J]. Journal of Colloid & Interface Science, 1995, 175(1): 239. DOI:10.1006/jcis.1995.1452 |
| [11] |
颜靖.有机改性海泡石吸附水中酸性品红的试验研究[D].长沙: 湖南大学, 2013 YAN Jing. Adsorption of acid fuchsin from aqueous solutions onto organic sepiolite[D]. Changsha: Hunan University, 2013 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D390279 |
| [12] |
徐西蒙. FeOCl催化剂用于非均相Fenton体系催化降解水中微量有机物[D].上海: 华东理工大学, 2013 XU Ximeng. FeOCl catalysts for the heterogeneous Fenton degradation of trace organic contaminants[D]. Shanghai: East China University of Science and Technology, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10251-1013155070.htm |
| [13] |
BUXTON G V, GREENSTOCK C L, HELMAN W P, et al. Critical review of rate constants for reactions of hydrated electrons[J]. Journal of Physical & Chemical Reference Data, 1988, 17(2): 513. DOI:10.1063/1.555805 |
| [14] |
杨基先, 王蕾, 郭海娟, 等. Fe3O4-H2O2类Fenton体系催化降解苯酚[J]. 哈尔滨工业大学学报, 2014, 46(12): 39. YANG Jixian, WANG Lei, GUO Haijuan, et al. Catalyzed degradation of phenol by Fe3O4-H2O2 Fenton-like system[J]. Journal of Harbin Institute of Technology, 2014, 46(12): 39. DOI:10.11918/j.issn.0367-6234.2014.12.007 |
| [15] |
DO Q C, KIM D G, KO S O. Catalytic activity enhancement of a Fe3O4@SiO2 yolk-shell structure for oxidative degradation of acetaminophen by decoration with copper[J]. Journal of Cleaner Production, 2018, 172: 1243. DOI:10.1016/j.jclepro.2017.10.246 |
| [16] |
MUNOZ M, PEDRO Z M D, CASAS J A, et al. Preparation of magnetite-based catalysts and their application in heterogeneous Fenton oxidation: A review[J]. Applied Catalysis B Environmental, 2015, 176/177: 249. DOI:10.1016/j.apcatb.2015.04.003 |
| [17] |
赵莹, 任月明, 张慧玉, 等. GO/CoFe2O4催化过硫酸盐降解邻苯二甲酸二丁酯效能[J]. 哈尔滨工业大学学报, 2017, 49(8): 31. ZHAO Ying, REN Yueming, ZHANG Huiyu, et al. Efficiency of dibutyl phthalate degradation by GO/CoFe2O4 catalytic oxidation of peroxymonosulfate[J]. Journal of Harbin Institute of Technology, 2017, 49(8): 31. DOI:10.11918/j.issn.0367-6234.201612067 |
 2019, Vol. 51
2019, Vol. 51


