2. 哈尔滨工业大学 环境学院,哈尔滨 150090;
3. 城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090
2. School of Environment, Harbin Institute of Technology, Harbin 150090, China;
3. State Key Laboratory of Urban Water Resources and Environment(Harbin Institute of Technology), Harbin 150090, China
中国是一个农业大国,是世界上秸秆资源量最为丰富的国家之一[1-2].同时,随着城市化进程的加快,污水处理能力快速提高,污泥量也同步大幅增加[3].如何将秸秆、污泥资源化利用是一个严峻而紧迫的环境问题.厌氧消化是指在厌氧条件下,通过产酸菌、产甲烷菌等多种微生物将糖类、脂类等有机物通过体内微生物一系列的复杂生物化学反应最终产生甲烷、氢气、二氧化碳,为自身新陈代谢提供能量的过程[4].由于中国污泥中的有机物、脂肪和蛋白质含量低于发达国家,通过添加秸秆来补充碳源,并和污泥共同进行厌氧消化,生产沼气,从而达到污泥、秸秆资源化利用的目的.
自然界大部分的微生物在实验室条件下具有低培养性[5],利用分子生物学技术不必在实验室条件下培养微生物,而直接通过研究环境微生物中的遗传物质来达到研究目的.国内外学者利用分子生物学技术对污泥、秸秆、餐厨垃圾、猪粪等常见厌氧消化底物的优势菌属和生物群落做了广泛深入的研究.穆维娜[6]研究了秸秆蓝藻厌氧发酵过程中不同阶段的优势菌属,主要含有6个门的细菌,分别为厚壁菌门、变形菌门、拟杆菌门、绿弯菌门、螺旋体门、绿菌门.不同产气发酵阶段的优势菌所属门不同.赵一全等[7]研究了玉米秸秆厌氧发酵过程中添加氮素对微生物群落和沼气产量的影响,结果表明:处理体系中Clostridium,Methanoculleus,Sphaerochaeta和Ruminofilibacter 等菌属的丰度在产气高峰时期提升,在能量代谢中与甲烷代谢相关的基因丰度有所提升.Li等[8]研究了将剩余污泥、猪粪和餐厨垃圾以1: 3: 2的比例混合后进行厌氧发酵,结果表明效果优于用单一基质为底物的厌氧发酵过程,Methanosaeta是主要以单一底物为基质的产甲烷菌属,Methanosarcina则在以混合底物为基质的厌氧过程中占据产甲烷菌属的优势地位.Xiao等[9]研究了用废旧菌基为底物的厌氧消化过程,结果表明,Proteobacteria在不同发酵阶段占据优势种群地位,Crenarchaeota在古菌中占比较高.古菌相对丰度最高的属是Methanothermobacter和Methanobacterium.Liu等[10]在一种组合的以玉米秸秆为底物的三级厌氧消化反应器中发现氢营养型产甲烷菌Methanobacteriaceae和多功能产甲烷菌Methanosarcinaceae占据优势地位,并且具有产乙酸功能的Ruminococcaceae和Syntrophomonadaceae种群富集在该反应器中.目前以单一底物、秸秆混合餐厨垃圾、秸秆混合猪粪的厌氧消化研究较多,但以秸秆污泥为混合底物进行微生物群落分析缺乏相应的研究.本研究利用高通量测序技术,研究秸秆污泥厌氧消化中的微生物群落结构分布特征,对比在高低两种不同基质负荷条件下的微生物种群分布状况,以期促进秸秆污泥厌氧消化工艺的应用与发展.
1 实验 1.1 实验材料本实验所用玉米秸秆收集于哈尔滨市呼兰区某农田.秸秆先用铡刀切成4~5 cm的小段,然后用小型粉碎机将秸秆小段研磨成秸秆颗粒,之后再将秸秆颗粒通过30目筛备用.实验所用市政污泥来自哈尔滨文昌二沉池的回流污泥(理化性质见表 1),取后静置3 d,然后倒出上清液,装于塑料桶内,放在-4 ℃的冰箱中备用.实验中秸秆需进行预处理,将通过筛网的秸秆颗粒浸泡于质量分数为2%的NaOH溶液中,放入超声装置中超声60 min.然后放于设定温度为55 ℃的恒温水浴箱中1 d.预处理后的秸秆和污泥以TS比为1: 2混合作为底物[11].
| 表 1 原玉米秸秆与市政污泥的理化性质 Tab. 1 Physicochemical properties of original corn straw and municipal sludge |
实验装置为1个容量为5 L的圆柱形有机玻璃反应器,反应器上方装有pH检测器、ORP检测器、温度检测记探头、进料口,并有一通气口,通气口上方连接一气袋,用来收集厌氧反应所产生的气体,整个反应器的四周缠有加热丝装置,用加热装置使加热丝温度维持在35 ℃左右.出料口在筒体的下方,反应器上方装有一个固定好的搅拌桨装置,并让搅拌桨伸入反应器,保证各组分混合均匀.反应器为半连续流反应器,不需要接种.在高基质负荷条件下,每日通过蠕动泵进出料500 mL,在低基质负荷条件下,每日通过蠕动泵进出料300 mL,消化时间均为30 d.
1.3 实验方法前期实验分别在TS负荷为10,12,16,20,24,28,32 g/(L · d)进行.实验结果表明,在负荷为20 g/(L · d)时甲烷产量最大,当负荷超过20 g/(L · d)时,反应器极易产生酸化,使反应器失稳.低负荷是日常正常维持反应器中微生物活性的最低负荷量,当负荷低于12 g/(L · d)时,日产气波动较为剧烈.故最终选取低负荷为12 g/(L · d),高负荷为20 g/(L · d)[11].实验采用温度为(35±1)℃.每5 d取样测试常规理化指标,在反应的第0天,第5天,第10天,第20天,第30天取样进行16S rDNA测序,实验周期均为30 d.G1、G2、G3、G4、G5分别代表高负荷基质条件下的第0天、第5天、第10天、第20天、第30天取样编号,C1、C2、C3、C4、C5分别代表低负荷基质条件下的第0天、第5天、第10天、第20天、第30天取样编号.
1.4 理化指标分析方法pH采用pH计(HANNA)测定.样品以9 000 r/min离心20 min后,取上清液过0.45 μm滤膜后测量氨氮.TS、VS采用重量法测定.气体体积采用抽气法测定,具体检测的气体成分为CH4、CO2,气体成分含量采用气相色谱法(Agileat)测定.
1.5 Ⅰ llumina HiSeq PE250高通量测序分析 1.5.1 样品DNA提取样品DNA提取采用Tiangen soil gene extraction kit(DP336)试剂盒,按照其说明书进行DNA提取.然后利用Thermo NanoDrop 2000紫外微量分光光度计和1%琼脂糖凝胶电泳进行总DNA质检.
1.5.2 采用的特异性引物16S rDNA扩增选择区域为V3-V4区,使用的通用引物为341F(5′-CCTACGGGRSGCAGCAG-3′)和806R(5′-GGACTACVVGGGTATCTAATC-3′).在通用引物的5'端加上适合Illumina Miseq PE250测序的Index序列和接头序列,完成特异性引物的设计.
1.5.3 PCR扩增和产物纯化以稀释后的基因组DNA为模板,使用KAPA HiFi Hotstart ReadyMix PCR kit高保真酶进行PCR,确保扩增的准确性和高效性.用2%琼脂糖凝胶电泳检测PCR产物,并用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物.回收后,利用Thermo NanoDrop 2000紫外微量分光光度计和2%琼脂糖凝胶电泳进行文库质检.
1.5.4 Illumina测序样品送上海锐翌生物科技有限公司,使用Illumina Miseq PE250进行上机测序.对原始数据进行QC后,用Usearch软件对数据进行去嵌合体和聚类分析.Usearch聚类时,先将Reads按照丰度从大到小排序,通过97%相似度进行聚类,得到OTU,每个OTU可代表一个物种.统计每个样品匹配到OTU的Reads数,为避免因样品测序数据大小不同造成分析的偏差,在测序深度足够的情况下,依据匹配到OTU的最小序列数进行随机抽平处理,进行Alpha多样性分析.从每个OTU中分别提取一条Read作为代表序列,将该代表序列与RDP数据库比对,对每个OTU进行物种分类,得到物种丰度表,进行后续分析.
2 结果与讨论 2.1 厌氧消化性能参数在整个实验周期内,各常规理化指标均未发生巨大变动.表 2为高低基质负荷条件下的平均日产气量、甲烷体积分数、TS、VS、NH4+-N等参数的平均值及pH的变化范围.可以看出,在高负荷条件下(G组)的产气量约为4.1 L,低负荷条件下(C组)的产气量约为2.1 L,高负荷的日基质量约为低负荷条件下的1.67倍,产气量却提升了近2倍,表明高负荷基质条件下提升了反应器潜在的产气能力,也间接说明了寻找最佳的基质负荷有助于提升混合底物的产气潜能,充分利用混合底物进行资源回收.甲烷体积分数在高负荷条件下略高,但两种条件下的甲烷含量都符合沼气中甲烷含量的通常已知范围.在低负荷条件下pH的变化范围为6.84~7.03,高负荷条件下的pH的变化范围为6.87~6.97.氨氮的质量浓度在低负荷条件为209.5 mg/L,在高负荷条件为172.1 mg/L,低负荷条件下略高于高负荷条件下的值.高负荷条件下的TS、VS去除率也略高于低负荷条件,说明在高负荷条件下,微生物群落对底物的利用效率更高.其中日产气量在由低负荷基质条件向高负荷基质条件过渡的阶段有所波动,在结束了低基质实验周期,开始进行高基质实验周期的第1周内,产气量经历了一个先升高再降低、最后又上升的趋势.在高基质实验条件的第1天,产气量上升到4 L左右,第2天降至3 L左右,在接下来的5 d内,产气量逐步攀升,至4 L左右,随后日产气量波动变化不大,始终稳定在4.1~4.2 L的水平.可能的原因为:当忽然提高进料负荷时,打破了原先反应器中各种微生物代谢的平衡,需要适应高负荷进料条件下带来的物质、能量冲击,使微生物自身的代谢活动满足这一变化.而最终产气量又趋于稳定,说明反应器中的微生物群落适应了高负荷条件下物质和能量的供给,从而使宏观的产气量趋于稳定,也说明该反应器具有一定的抗冲击负荷.
| 表 2 不同负荷下的理化性质 Tab. 2 Physicochemical properties in different substrate loading conditions |
由于秸秆具有较高的碳氮比,作为单一发酵物质,易出现发酵时间过长、降解率低的现象.郝鑫等[12]研究了秸秆和餐厨垃圾不同配合比条件下对产气性能的影响,结果表明, 餐厨垃圾和秸秆以1: 1的质量比进行厌氧发酵时,产气量最高,为347 mL/g VS.Pei等[13]研究表明,餐厨垃圾与秸秆的质量比为3: 1时,共消化产气效果最好,甲烷产量比秸秆单独消化提高了70%.王晓娇等[14]研究了不同种类的粪便(牛粪、猪粪、鸡粪)与小麦秸秆混合发酵的特性,结果表明,3种原料混合发酵的累计产气量均高于单一原料发酵.蛋白质和脂肪在餐厨垃圾中的含量较高,污泥中含有厌氧过程所需营养元素,但其碳氮比较低.粪便中有机质含量较高,产气速度快但含有厌氧发酵抑制因子.综合比较发现,以多种混合底物为基质的厌氧发酵体系较以单一底物为基质的厌氧体系具有更强的发酵潜力,多种底物的联合厌氧发酵可以弥补单一底物在营养物质组成上的劣势,从而优化营养物质组成的配比,进行更为平衡可控的厌氧发酵进程.
2.2 微生物群落多样性分析在OTU为97%的相似性水平下,对厌氧消化过程中微生物群落多样性进行分析比较.Chao指数用来估计样品所含OTU的总数.由表 3数据可知,测序数据量较为合理,测序条数很好的覆盖到样品中的大部分微生物,测序结果较为可靠.
| 表 3 C组和G组的相关测序指数 Tab. 3 Related sequencing indexes for group C and group G |
Shannon指数用来估算微生物群落多样性的高低,Shannon值越大,多样性越高.由表 3可知,两种负荷的基质条件下,Shannon值都较大且较为接近,说明了在两种条件下,生物群落的多样性都较为丰富,且微生物群落的组成也较为相似,整体微生物种群在实验阶段,未发生巨大的波动,说明反应器运行状况较为平稳.
Simpson指数体现了优势物种生物量占群落生物总量的比重,该指数越大表明优势菌群生物量占总生物量比重越大,反之则表示优势菌群生物量占总生物量比重越小[15].由表 3可知,高负荷基质条件下的Simpson指数值更为接近,都在0.06左右,而低负荷基质条件下的Simpson指数值较高负荷条件更为分散,最小为0.05,最大为0.08,说明在整个高负荷基质体系下优势种群的稳定性较低负荷体系下更高.但总体来看,在两种基质条件下,优势种群在整个群落中都基本占据了比较大的优势地位,且优势程度也较为类似,说明两种条件下反应器中优势种群的优势地位维持程度良好.
2.3 微生物群落结构分布特征本研究中共检测到的前20个门中,古菌群落在高负荷基质条件下在整个微生物群落中平均占据8.43%,包括2个门,分别是占据0.18%泉古菌门(Crenarchaeota)、占据8.25%广古菌门(Euryarchaeota),细菌在整个微生物群落中平均占据91.57%.古菌群落在低负荷基质条件下在整个微生物群落中平均占据5.65%,包括2个门,分别是占据0.40%泉古菌门(Crenarchaeota)、占据5.25%广古菌门(Euryarchaeota),细菌在整个微生物群落中平均占据94.35%.测序结果表明, 秸秆污泥厌氧消化微生物中细菌群落比古菌群落更加丰富多样,这与Sundberg等[16]研究的厌氧发酵微生物群落中各种群占比的结果类似.
高负荷基质条件下,由图 1可知,在门分类水平上,相对丰度大于5%的优势菌有:51.06%的拟杆菌门(Bacteroidetes)、11.65%的厚壁菌门(Firmicutes)、8.25%的广古菌门(Euryarchaeota)、8.24%的Cloacimonetes、6.02%的互养菌门(Synergistetes)、5.69%的绿弯菌门(Chloroflexi)、5.21%的变形菌门(Proteobacteria).低负荷基质条件下,占比最高的是相对丰度为50.78%的拟杆菌门,其次是7.67%的Cloacimonetes、6.46%的互养菌门(Synergistetes)、6.33%的厚壁菌门(Firmicutes)等,低负荷与高负荷基质条件下菌群类型基本一致,只是各种群相对丰度有所不同.在高负荷基质条件下,相对丰度最高的是拟杆菌门和厚壁菌门,两者常见于各类厌氧发酵装置中,其中部分拟杆菌具有降解纤维素的能力[17].拟杆菌门(Bacteroidetes)己被证明是厌氧环境中有降解大分子碳水化合物的产酸微生物群落[18].厚壁菌门能够产生降解复杂有机物的纤维素酶、蛋白酶和各种胞外水解酶[19].Klock等[20]做了青贮饲用甜菜厌氧发酵过程中的微生物群落结构分析,发现厚壁菌门(Firmicutes)、δ-变形菌门(Delta-Proteobacteria)和拟杆菌门(Bacteroidetes)为最优势的种群.李雪[21]研究了青贮秸秆、水稻秸秆、干玉秆和烟草秸秆厌氧发酵中优势菌群的状况,结果表明,4种秸秆共有的优势菌群(基于门分类)为厚壁菌门、拟杆菌门、绿弯菌门、甲烷八叠球菌门.上述研究及实验结果表明,在富含纤维素成分的厌氧底物发酵过程中,拟杆菌门和厚壁菌门的微生物群落发挥着十分重要的作用.
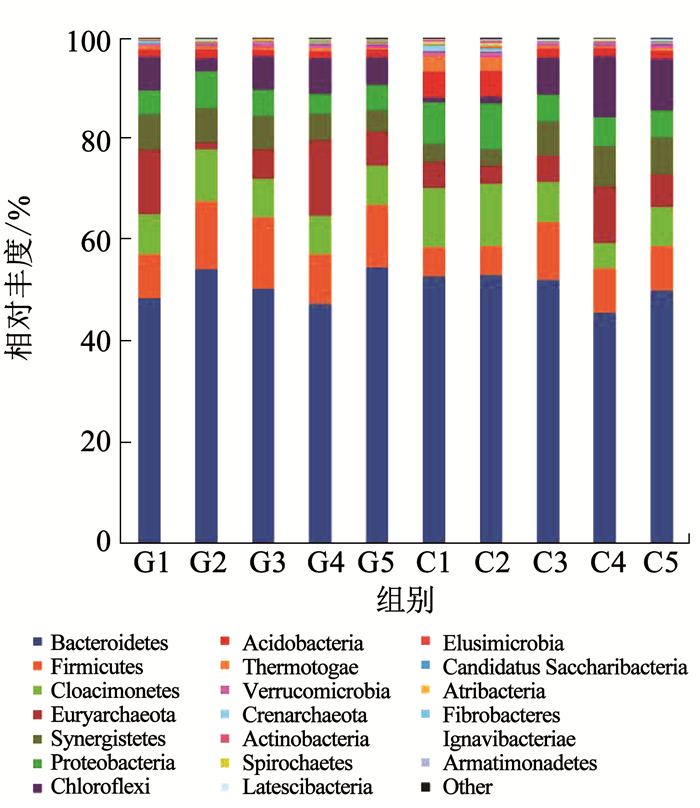
|
图 1 C组和G组在不同阶段的门水平上的微生物群落分布 Fig. 1 Distribution of microbial community of group C and group G at the phylum level in different phases |
在本实验中,拟杆菌门占比较高,由于拟杆菌门是厌氧环境中主要的产酸微生物群落,且有一部分拟杆菌门能够分解纤维素,说明在整个厌氧反应体系中,水解产酸代谢活动较为旺盛,整个反应体系运行状况良好.与此同时,拟杆菌门和厚壁菌门,两者常见于健康人体的胃肠道细菌中,占比多于90%[22].在本实验中,对每日进料的秸秆污泥也做了高通量测序分析,结果表明,基质中的主要优势菌群也为拟杆菌门和厚壁菌门,故分析拟杆菌门占比较高的另一个原因有可能是市政剩余污泥中含有大量来自人体消化道的拟杆菌门群落.
由图 2可知,拟杆菌纲(Bacteroidia)在高、低两种负荷条件下的相对丰度都较高,分别为50.25%,45.69%.甲烷微菌纲(Methanomicrobia)在低负荷基质条件下的相对丰度变化不大,均在8%左右,而在高负荷基质条件下的相对丰度波动较大,最低为G2的1.2%,最高则为G4的21%.有可能是由于高负荷的基质扰动了甲烷微菌纲正常的生长代谢,造成了一定的波动.其余菌群在两种条件下相对丰度总体变化不大.
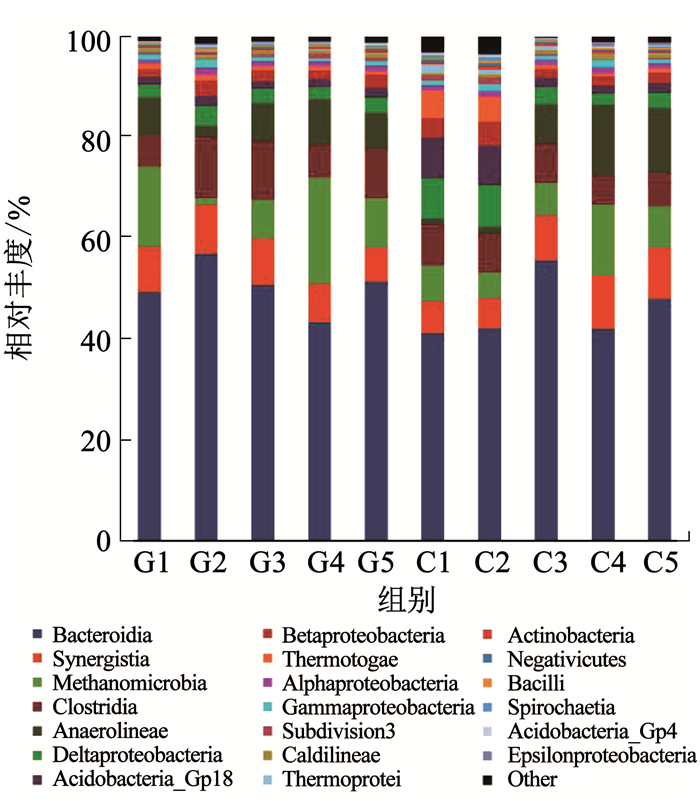
|
图 2 C组和G组在不同阶段的纲水平上的微生物群落分布 Fig. 2 Distribution of microbial community of group C and group G at the class level in different phases |
图 3为属分类水平上细菌群落结构状况,相较于门和纲分类水平看,各菌群在两种条件下的相对丰度都有不同的表现,各菌群的相对丰度都处在一个动态的变化之中.在高负荷基质条件下,Candidatus Cloacamonas、Thermovirga、Methanothrix这3种属细菌的相对丰度占据了比较大的优势.戚绪亮[23]的研究表明,在利用EGSB反应器进行皮革废水甲烷化的过程中,Candidatus Cloacamonas具有厌氧产氢的功能且含量最高.Thermovirga是属于梭菌纲(Clostridia)互营单胞菌科下的一种菌.Methanothrix的波动较大,为乙酸型产甲烷古菌.在低负荷基质条件下,当Candidatus Cloacamonas的相对丰度较高时,Methanothrix的相对丰度则较低(C1、C2样),而当Methanothrix的相对丰度较高时,Candidatus Cloacamonas的相对丰度则有所降低,两者相对丰度变化的可能原因是对有关底物存在着一定的竞争关系.在低负荷基质条件下,Gp18的相对丰度较高负荷条件下略高.其余菌群的相对丰度都较低,在测序结果中,还包含着大量的其他种类的细菌,虽不属于优势菌种,但也是秸秆污泥厌氧发酵微生物群落的重要组成部分.

|
图 3 C组和G组在不同阶段的属水平上的微生物群落分布 Fig. 3 Distribution of microbial community of group C and group G at the genus level in different phases |
在高低两种负荷基质条件下,产甲烷古菌的相对丰度发生了明显变化,在高负荷条件下比低负荷条件高约2.78%.在低负荷基质条件下,由于每日输入反应器的秸秆污泥量较少,整个微生物群落处于饥饿状态,且由于产甲烷古菌的相对丰度较不产甲烷菌处于劣势,其对物质、能量的竞争摄取能力也不如不产甲烷菌强势,所以,在低负荷条件下,产甲烷古菌的相对丰度较高负荷条件较低.在高负荷条件下,甲烷产量比低负荷条件下高出近1倍,说明产甲烷古菌相对丰度的变化会导致产甲烷量的变化.这种变化是一种直接的影响,因为产甲烷古菌在整个厌氧消化体系中扮演着消费者的角色,其要利用不产甲烷菌在水解酸化阶段产生的各种代谢中间产物来代谢生产甲烷,产甲烷古菌在整个微生物群落中相对丰度的增加,说明了产甲烷古菌的代谢活动更为旺盛,所以,在高负荷条件下的甲烷产量更高.进一步说明了产甲烷古菌的相对丰度和产气量存在着一定的正相关关系.
2.4 微生物的系统进化关系在分子进化研究中有必要进一步研究系统内部各微生物种群的进化关系,通过系统进化关系推断揭示某一分类水平OTUs序列间碱基的差异,结合各个OTUs序列所代表的物种注释信息,进而构建物种进化树,便可了解生物进化历史和机制.微生物之间在系统进化树中的枝长越短表明微生物之间的系统发育越近.分支的颜色表示对应的不同门分类水平.
高负荷条件下,系统进化树主要分为3大分支.第1大主分支主要由变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)等组成,第2大主分支由厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、纤维杆菌门(Fibrobacteres)、柔膜菌门(Tenericutes)组成,第3大分支主要由广古菌门(Euryarchaeota)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)等组成.在低负荷基质条件下,系统进化树主要分为3大分支.第1大主分支由变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)组成,第2大主分支由厚壁菌门(Firmicutes),纤维杆菌门(Fibrobacteres), 互养菌门(Synergistetes)组成,第3大分支由其余菌群组成,包括广古菌门(Euryarchaeota)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)等.2种条件下的微生物系统进化不尽相同,说明微生物群落在不同基质负荷条件下的进化关系存在一定的差异,微生物种群在面对不同的营养负荷类型时,存在一定的群落差异.
根据图 4中各微生物群落进化树枝长的长短情况来看,Firmicutes、Fibrobacteres、Synergistetes间枝长较短,且属于同一分枝,说明它们之间的亲缘关系较近.Euryarchaeota的枝长与其他菌的枝长相比较长,从系统发育上来讲Euryarchaeota与其他菌的亲缘关系较远.但是Pacearchaeota中的AR13,Parcubacteria中的某些未被分类的菌群,这些未被分类的菌群与Euryarchaeota中的产甲烷菌系统发育较近,亲缘关系较接近,因此,可推断出这些未被分类的菌群中有些菌群可能与产甲烷相关.这些未被分类的菌群是否具有产甲烷的潜力,还需要进一步深入研究.
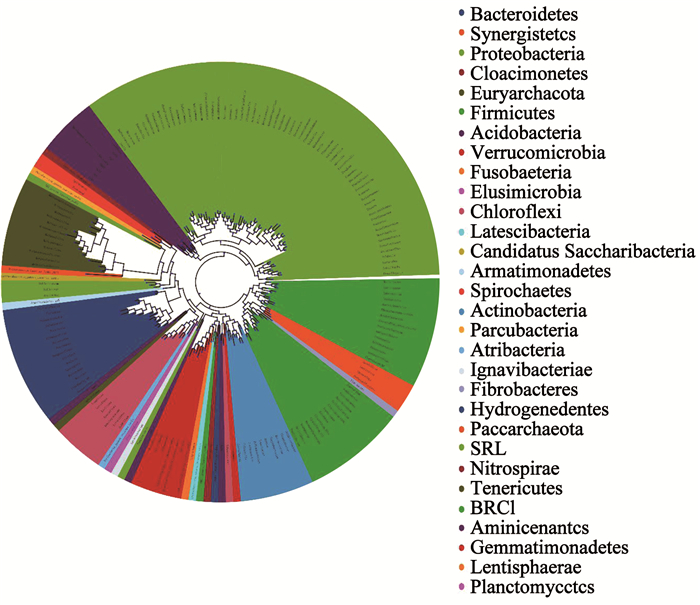
|
图 4 C组的系统进化树 Fig. 4 Phylogenetic tree of group C |
在两种负荷基质条件下,如图 4, 5所示, 均检测到12种产甲烷菌属,包括甲烷食甲基菌属(Methanomethylovorans)、甲烷八叠球菌属(Methanosarcina)、甲烷发菌属(Methanothrix)、甲烷螺菌(Methanospirillum)、甲烷囊菌属(Methanoculleus)、甲烷粒菌属(Methanocorpusculum)、甲烷泡菌属(Methanofollis)、mathanoregula、甲烷绳菌属(Methanolinea)、Methanomassiliicoccus、甲烷杆菌属(Methanobacterium)、甲烷短杆菌(Methanobrevibacter).其中Methanomethylovorans、Methanomassiliicoccus属于甲基营养型产甲烷菌.甲基营养型产甲烷菌能利用甲基类化合物(如甲醇)、甲胺类化合物(如甲胺、二甲胺、三甲胺)和甲基硫化合物(如甲硫醇、二甲基硫)进行产CH4生长[24].Methanospirillum、Methanoculleus、Methanocorpusculum、Methanofollis、Methanolinea、Methanobrevibacter属于氢营养型产甲烷菌,氢营养型产甲烷古菌利用H2、甲酸盐等电子供体还原CO2产生CH4[24].Methanothrix是专性乙酸营养型产甲烷古菌,乙酸营养型产甲烷古菌只利用乙酸产生CH4和CO2[24].Methanosarcina代谢类型多样,包括氢营养型、甲基营养型和乙酸型产甲烷菌;Methanobacterium中有些属于氢营养型产甲烷菌,有些属于甲基营养型产甲烷菌.孔德望等[25]研究了猪粪厌氧发酵消化液回流体系微生物群落结构特征,结果表明,该体系中微生物以梭菌属和甲烷八叠球菌属为优势菌属,产气率随其相对丰度的增大而升高,而与甲烷短杆菌属和甲烷球菌属的相对丰度变化呈负相关.张蕾等[26]研究了规模化秸秆沼气发酵反应器中的微生物群落特征,得出秸秆沼气反应器中,产甲烷古菌种类较少,大部分属于氢营养型甲烷菌,甲烷鬃菌属(Methanosaeta)为优势种群.说明在不同底物条件下,各厌氧反应器中的产甲烷优势菌属也不尽相同.相较于以其他基质为底物的厌氧消化过程中产甲烷菌属代谢类型单一的特点,秸秆污泥厌氧消化过程中产甲烷菌属代谢类型较为多样.

|
图 5 G组的系统进化树 Fig. 5 Phylogenetic tree of group G |
检测到的12种产甲烷菌属绝大部分属于广古菌门,其代谢类型丰富多样,包括甲基营养型、氢营养型、专性乙酸营养型,可利用甲基类化合物、甲胺类化合物、甲基硫化物、乙酸、H2、甲酸盐等电子供体还原CO2产甲烷.在高基质负荷状态下,为不产甲烷菌、产甲烷菌提供了更高的物质、能量基础(基质负荷提高了66.7%),充分发挥了两者相互协同产甲烷的潜能,且厚壁菌门、广古菌门的相对丰度也较低基质负荷有了一定的提高,进一步促进了基质转甲烷过程,使得产气量增加了95.2%,说明了提高基质负荷有利于厌氧消化过程的产气.
实验结果说明在秸秆污泥厌氧发酵体系下,产甲烷古菌种类较为丰富,3种营养类型的产甲烷古菌都能在体系中检出.由于基质中市政污泥的成分较为复杂,有机物种类含量丰富,为产甲烷古菌的生长代谢提供了广泛的物质基础,各产甲烷古菌利用不同的底物发酵中间产物来进行产甲烷.与此同时,厌氧消化的物料成分复杂,参与厌氧消化的微生物群落多变,产甲烷古菌的生长条件比较苛刻,容易受到环境因子(如pH、O2、温度和铵)的干扰[27].在一个稳定的厌氧消化系统中,产甲烷古菌和不产甲烷菌拥有一种动态平衡的关系,即两者相互联系、相互依赖、相互影响、相互制约.不产甲烷菌为产甲烷古菌提供生长和行使功能必要的基质,后者又为前者解除生化反应的反馈抑制,对发酵系统中有机物的降解起着质子调节、电子调节和营养调节的作用[28].综合整个实验结果来看,秸秆污泥厌氧共消化体系中微生物的代谢途径较为丰富,各种微生物群落生长代谢相互依存、相互平衡,具有一定的抗冲击负荷,建立了较为平衡的稳态缓冲体系.
3 结论1) 以秸秆污泥为基质的厌氧消化体系中,基质负荷提高66.7%,产气量增加了95.2%,说明了在适当的范围内,提高基质负荷有利于厌氧消化过程的产气即基质转甲烷过程.
2) 随着基质负荷的提高,厚壁菌门、广古菌门的相对丰度也随之增加,两者增强了厌氧消化的程度.相较于以其他底物为基质的厌氧消化过程中拟杆菌门相对丰度占比不高的状况,在秸秆污泥厌氧消化体系中,不同基质负荷条件下拟杆菌门的细菌都是相对丰度占比最高的菌属,以其他基质为底物的厌氧消化过程中的优势菌群如厚壁菌门、变形菌门则为次优势菌属,这可能与拟杆菌门中的一些细菌具有能降解纤维素的能力有关.
3) 秸秆污泥厌氧消化体系中,细菌较古菌具有更高的丰度,相较于以其他底物为基质的厌氧消化过程中古菌代谢类型较为单一的状况,以秸秆污泥为底物的厌氧消化反应中古菌群落代谢类型多样,分属氢营养型、甲基营养型、乙酸营养型,表明各种微生物群落生长代谢相互依存、相互平衡,具有一定的抗冲击负荷,建立了较为平衡的稳态缓冲体系.
| [1] |
郭冬生, 黄春红. 近10年来中国农作物秸秆资源量的时空分布与利用模式[J]. 西南农业学报, 2016, 29(4): 948. GUO Dongsheng, HUANG Chunhong. Spatial and temporal distribution of crop straw resources in past 10 years in China and its use pattern[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(4): 948. DOI:10.16213/j.cnki.scjas.2016.04.039 |
| [2] |
石祖梁. 中国秸秆资源化利用现状及对策建议[J]. 世界环境, 2018(5): 16. SHI Zuliang. Current situation of utilization of straw resources in China and relevant countermeasures and suggestions[J]. World Environment, 2018(5): 16. |
| [3] |
张汝. 浅论污泥资源化利用的现状和发展[J]. 中国金属通报, 2018(7): 130. ZHANG Ru. Discussion on the current situation and development of sludge resource utilization[J]. China Metal Bulletin, 2018(7): 130. |
| [4] |
LI Yebo, PARK S, ZHU Jiying. Solid-state anaerobic digestion for methane production from organic waste[J]. Renewable and Sustainable Energy Reviews, 2011, 15(1): 821. DOI:10.1016/j.rser.2010.07.042 |
| [5] |
TORSVIK V, OVREAS L. Microbial diversity and function in soil: From genes to ecosystems[J]. Current Opinion in Microbiology, 2002, 5(3): 240. |
| [6] |
穆维娜.蓝藻秸秆厌氧产沼气及其微生物群落结构分析[D].合肥: 安徽大学, 2016 MU Weina. Co-fermentation of blue algae with straw and the characteristics of microbial communities during bio-gas production[D]. Hefei: Anhui University, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10357-1017004867.htm |
| [7] |
赵一全, 马茹霞, 李家威, 等. 玉米秸秆厌氧发酵过程中添加氮素对微生物群落和沼气产量的影响[J]. 中国沼气, 2018, 36(5): 66. ZHAO Yiquan, MA Ruxia, LI Jiawei, et al. Effects of nitrogen addition on biogas production and microbial community in corn straw anaerobic digestion system[J]. China Biogas, 2018, 36(5): 66. |
| [8] |
LI Dan, KIM M, KIM H, et al. Evaluation of relationship between biogas production and microbial communities in anaerobic co-digestion[J]. Korean Journal of Chemical Engineering, 2018, 35(1): 179. DOI:10.1007/s11814-017-0246-3 |
| [9] |
XIAO Zheng, LIN Manhong, FAN Jinlin, et al. Anaerobic digestion of spent mushroom substrate under thermophilic conditions: Performance and microbial community analysis[J]. Applied Microbiology and Biotechnology, 2018(10): 1. DOI:10.1007/s00253-017-8578-9 |
| [10] |
LIU Yue, WACHEMO A, YUAN Hairong, et al. Anaerobic digestion performance and microbial community structure of corn stover in three-stage continuously stirred tank reactors[J]. Bioresource Technology, 2019, 287: 121339. DOI:10.1016/j.biortech.2019.121339 |
| [11] |
党宁.污泥秸秆厌氧共消化研究[D].兰州: 兰州理工大学, 2018 DANG Ning. Study of anaerobic co-digestion of sludge straw[D]. Lanzhou: Lanzhou University of Technology, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10731-1018956428.htm |
| [12] |
郝鑫, 苏婧, 孙源媛, 等. 餐厨垃圾与污泥、秸秆不同配比联合厌氧发酵对产气性能的影响[J]. 环境科学研究, 2020, 33(1): 235. HAO Xin, SU Jing, SUN Yuanyuan, et al. Biogas production of anaerobic co-digestion with different ratios of waste, sewage sludge and rice straw[J]. Research of Environmental Sciences, 2020, 33(1): 235. DOI:10.13198/j.issn.1001-6929.2019.02.05 |
| [13] |
PEI Zhanjiang, LIU Jie, SHI Fengmei, et al. High-solid anaerobic co-digestion of food waste and rice straw for biogas production[J]. Journal of Northeast Agricultural University (English Edition), 2014, 21(4): 61. DOI:10.1016/S1006-8104(15)30021-0 |
| [14] |
王晓娇, 李轶冰, 杨改河, 等. 牛粪、鸡粪和稻秆混合的沼气发酵特性与工艺优化[J]. 农业机械学报, 2010, 41(3): 104. WANG Xiaojiao, LI Yibing, YANG Gaihe, et al. Fermentation and process optimization of mixed cow dung, chicken manure and rice straw for biogas production[J]. Transactions of the Chinese Society of Agricultural Machinery, 2010, 41(3): 104. |
| [15] |
陈重军, 张海芹, 汪瑶琪, 等. 基于高通量测序的ABR厌氧氨氧化反应器各隔室细菌群落特征分析[J]. 环境科学, 2016, 37(7): 2652. CHEN Chongjun, ZHANG Haiqin, WANG Yaoqi, et al. Characteristics of microbial community in each compartment of ABR ANAMMOX reactor based on high-throughput sequencing[J]. Environmental Science, 2016, 37(7): 2652. DOI:10.13227/j.hjkx.2016.07.031 |
| [16] |
SUNDBERG C, AL-SOUD A W, LARSSON M, et al. 454 pyrosequencing analyses of bacterial and archaeal richness in 21 full-scale biogas digesters[J]. FEMS Microbiology Ecology, 2013, 85(3): 612. DOI:10.1111/1574-6941.12148 |
| [17] |
吴彦彬, 李亚丹, 李小俊, 等. 拟杆菌的研究及应用[J]. 生物技术通报, 2007(1): 66. WU Yanbin, LI Yadan, LI Xiaojun, et al. The study and application on bacteroides[J]. Biotechnology Bulletin, 2007(1): 66. DOI:10.13560/j.cnki.biotech.bull.1985.2007.01.015 |
| [18] |
REN Jiwei, YUAN Xufeng, LI Jie, et al. Performance and microbial community dynamics in a two-phase anaerobic co-digestion system using cassava dregs and pig manure[J]. Bioresource Technology, 2014, 155: 342. DOI:10.1016/j.biortech.2013.12.120 |
| [19] |
LI Jiabao, RUI Junpeng, YAO Minjie, et al. Substrate type and free ammonia determine bacterial community structure in full-scale mesophilic anaerobic digesters treating cattle or swine manure[J]. Frontiers in Microbiology, 2015, 6: 1. DOI:10.3389/fmicb.2015.01337 |
| [20] |
KLOCKE M, MÄHNERT P, MUNDT K, et al. Microbial community analysis of a biogas-producing completely stirred tank reactor fed continuously with fodder beet silage as mono-substrate[J]. Systematic and Applied Microbiology, 2007, 30(2): 139. DOI:10.1016/j.syapm.2006.03.007 |
| [21] |
李雪.秸秆厌氧发酵产沼气潜力及微生物群落研究[D].延吉: 延边大学, 2018 LI Xue. Evaluation of biogas production performance and dynamics of the microbial community in different straw[D]. Yanji: Yanbian University, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10184-1018117833.htm |
| [22] |
郭慧玲, 邵玉宇, 孟和毕力格, 等. 肠道菌群与疾病关系的研究进展[J]. 微生物学通报, 2015, 42(2): 400. GUO Huiling, SHAO Yuyu, MENGHE Bilige, et al. Research on the relation between gastrointestinal microbiota and disease[J]. Microbiology China, 2015, 42(2): 400. DOI:10.13344/j.microbiol.china.140474 |
| [23] |
戚绪亮. EGSB反应器中皮革废水甲烷化、反硝化和厌氧氨氧化耦合研究[D].南京: 南京大学, 2013 QI Xuliang. Study on the integration of methanogenesis, denitrification and anaerobic ammonium oxidation in EGSB reactor[D]. Nanjing: Nanjing University, 2013 |
| [24] |
承磊, 郑珍珍, 王聪, 等. 产甲烷古菌研究进展[J]. 微生物学通报, 2016, 43(5): 1143. CHENG Lei, ZHENG Zhenzhen, WANG Cong, et al. Recent advances in methanogens[J]. Microbiology China, 2016, 43(5): 1143. DOI:10.13344/j.microbiol.china.150993 |
| [25] |
孔德望, 张克强, 房芳, 等. 猪粪厌氧发酵消化液回流体系微生物群落结构特征与产气关系研究[J]. 农业环境科学学报, 2018, 37(3): 559. KONG Dewang, ZHANG Keqiang, FANG Fang, et al. Study of microbial community and biogas production in anaerobic digestion of pig manure with digested slurry recirculation[J]. Journal of Agro-Environment Science, 2018, 37(3): 559. |
| [26] |
张蕾, 梁军锋, 崔文文, 等. 规模化秸秆沼气发酵反应器中微生物群落特征[J]. 农业环境科学学报, 2014, 33(3): 584. ZHANG Lei, LIANG Junfeng, CUI Wenwen, et al. Characteristics of microbial communities in full-scale biogas digesters with straw as substrate[J]. Journal of Agro-Environment Science, 2014, 33(3): 584. |
| [27] |
CHEN Ye, CHENG J J, CREAMER K S. Inhibition of anaerobic digestion process: A review[J]. Bioresource Technology, 2008, 99: 4044. DOI:10.1016/j.biortech.2007.01.057 |
| [28] |
韩睿.青海农用沼气池发酵微生物群落结构与功能研究[D].武汉: 华中师范大学, 2018 HAN Rui. Research on microbial community structure and their function of rural household biogas digesters in Qinghai[D]. Wuhan: Central China Normal University, 2018 http://cdmd.cnki.com.cn/Article/CDMD-10511-1018234205.htm |
 2020, Vol. 52
2020, Vol. 52


