2. 四川省国土空间规划研究院,成都 610036
2. Sichuan Institute of Territory Spatial Planning, Chengdu 610036, China
邻苯二甲酸酯(PAEs)是工业化合物类环境内分泌干扰物[1],国内外研究表明,PAEs对肝、肾、生殖系统具有潜在毒性[2-3].其中,二甲酸二(2-乙基)己酯(DEHP)为工业上使用频繁的塑化剂,相关工业对DEHP的使用后并没有对其残留部分进行针对性的去除,会随着工业废水、废弃产品熔铸处理、工业废气等方式直接或间接排入到环境当中,对人类赖以生存的饮用水环境、大气环境造成一种慢速但持久性的污染.同时,会随着人类的日常饮食饮水及大气降雨等方式[4]进入人体,并进行长期积累,对人体造成潜在危害,严重影响了人体健康.其中GB5749—2006《生活饮用水卫生标准》中也规定DEHP限值为8 μg/L,并将DEHP列为致癌类塑化剂.
分子印迹技术是以某一特定目标分子(模板分子)为模板,以含有不饱和键及易形成氢键官能团的某种物质为功能单体,模板分子与功能单体通过共价或非共价键作用相互结合,形成主客体配合物,接触过程中会形成多重作用点,通过聚合反应对主客体配合物进行固定,这种作用就会被“记忆”下来.洗脱或解离模板分子后,聚合物中就形成了与模板分子形状及功能基团排列相匹配、具有多重作用点的印迹空穴,此类空穴对模板分子具有高度特异性识别和选择性吸附能力.
近年来,国内外已有将分子印迹技术用于PAEs的吸附去除和分离检测的研究.Xu等[5]在羧基改性的二氧化硅纳米粒子上,采用3种不同的印迹聚合方法,制备出对DBP具有特异性吸附功能的高性能分子印迹聚合物,其聚合物对低浓度的DBP可达到良好的吸附效果(吸附浓度范围为5.0~30.0 μmol/L,吸附后自来水样品的检出限为0.06 μmol/L);Fan等[6]采用皮克林乳液聚合法,合成一种对DEHP有选择性的单分散大孔分子印迹微球(MIPMS),所得聚合物微球具有规则的多孔结构和窄直径分布,且采用DEHP-MIPs作为固相萃取的填料,建立了以1.7~2.5 μg/L为检测限,对瓶装水中的DEHP进行灵敏检测和富集的方法;Lin等[7]以邻苯二甲酸双(10-甲氧基-10-氧代癸烷)酯作为模板分子,并采用邻苯二甲酸酯分子印迹聚合物的预装配系统对其进行计算机模拟,采用量子化学方法,模拟出了分子聚合物预组装系统配置中其不同模板分子和功能单体对聚合物吸附强度的影响.
本文就DEHP进行重点研究.考虑到实验过程中对印迹聚合物的有效分离,以二氧化硅改性的磁性四氧化三铁(Fe3O4@SiO2)为载体[8],并以DEHP的同分异构体邻苯二甲酸二正辛酯(DNOP)作为辅助模板分子,结合多模板分子印迹聚合物及同类物质的分子印迹聚合物的制备思路,采用热引发聚合法[9-10]制备了双模板分子印迹聚合物(D-MIPs),同时制备了DEHP的单模板分子印迹聚合物(DEHP-MIPs)、非印迹聚合物(NIPs),并对其各自的吸附性能进行了综合比对.
1 实验 1.1 实验仪器与试剂傅里叶变换红外光谱仪(Nicolet iS5型),赛默飞世尔科技公司;紫外分光光度计(photoLab7600 UV-VIS型),WTW公司;磁力搅拌器(DF-101s型),郑州科泰实验设备有限公司;机械搅拌器(MS-40数显型),杭州米欧仪器有限公司;超声分散/清洗机(SB-4200DTS型),宁波新芝生物科技股份有限公司;恒温震荡摇床(ZWY-240型),上海智城分析仪器有限公司;真空干燥箱(DZF-0B型),上海跃进公司;真空泵(2XZ-2型),上海谭氏实业有限公司;高精度电子天平,美国奥豪斯公司;超纯水机(Smart-15L型),上海和泰仪器有限公司.
邻苯二甲酸二(2-乙基)己酯(DEHP,AR,99.0%)、邻苯二甲酸二正辛酯(DNOP,AR,98.0%)、邻苯二甲酸二甲酯(DMP,AR,99.0%)、邻苯二甲酸二乙酯(DEP,AR,99.5%)、邻苯二甲酸二丁酯(DBP,AR,99.0%)、α-甲基丙烯酸(MAA,AR)、二甲基丙烯酸乙二醇酯(EGDMA,98.0%,含90~110 mg/L MEHQ稳定剂)、偶氮二异丁腈(AIBN,AR)、硅酸四乙酯(TEOs,GC,99.0%)、乙腈(AR)、甲醇(AR)、乙酸(AR)、无水乙醇(AR)、氨水(AR,25%~28%),以上试剂均于上海阿拉丁公司购置;纳米四氧化三铁(Fe3O4,AR),麦卡希试剂.
1.2 载体Fe3O4@SiO2的制备选用现有的磁性纳米Fe3O4作为基准物质,对其进行SiO2的负载改性.制备方法如下:用量筒及移液枪分别量取120 mL无水乙醇、6 mL氨水、6 mL超纯水混合于250 mL圆底烧瓶中,并将高精度电子天平称取的4.500 g纳米Fe3O4加入其中,通入氮气15 min除去体系中的氧气,并置于超声分散机中超声分散10 min(频率25 kHz、功率比99%)至混合溶液体系均匀.加入TEOs与无水乙醇(V(TEOs): V(无水乙醇)=1: 10)的混合液33 mL,继续超声并机械搅拌30 min,然后置于恒温30 ℃的磁力搅拌器持续搅拌16 h.用无水乙醇和超纯水将反应产物反复洗涤至洗涤液颜色无明显变化时即可,且最后用超纯水洗涤数次,每次用强磁铁进行磁性分离,真空干燥20 h(温度55 ℃).
1.3 分子印迹聚合物的制备将DEHP、DNOP、MAA按摩尔比为0.8: 0.2: 4(DEHP的取量为1.6 mmol,0.59 mL)加入到量有60 mL乙腈的250 mL三口烧瓶中进行恒温超声分散30 min至均匀,制成预聚合溶液,静置12 h.然后于冰水环境下加入800 mg的Fe3O4@SiO2载体,100 mg AIBN,3.77 mL EGDMA(20 mmol),通入氮气15 min除氧,保持冰水环境超声分散30 min至体系均匀,于磁力搅拌器中热聚合反应24 h(温度60 ℃).将反应产物用甲醇和超纯水反复洗涤至洗涤液颜色无明显变化即可,进行真空干燥20 h,将反应产物转移至250 mL锥形瓶后再加入100 mL洗脱液(V(甲醇): V(乙酸)=9: 1)于恒温震荡摇床中进行震荡,每6 h进行洗脱液更换,用紫外分光光度计对洗脱液中DEHP和DNOP进行检测,直至两种模板分子被完全洗脱,干燥后即可得到所需的双模板D-MIPs.单模板印迹聚合物(DEHP-MIPs)在预聚合阶段不加入DNOP,且保持DEHP和MAA的摩尔比为1: 4[11];非印迹聚合物(NIPs)于预聚合阶段不加入模板分子,其余制备步骤与D-MIPs一致.
1.4 恒温静态吸附实验称取30 mg D-MIPs、DEHP-MIPs、NIPs加入15 mL 0.005~0.2 mmol/L(1.11~44.4 mg/L)以乙腈为溶剂[12]的DEHP溶液中,放入恒温震荡摇床均匀震荡2 h(20 ℃,转速150 r/min),磁性分离,上清液通过0.22 μm的有机系滤膜,并用紫外分光光度计检测其吸光度,计算各质量浓度ρ下对应的单位吸附容量.
1.5 吸附动力学实验称取30 mg D-MIPs、DEHP-MIPs、NIPs加入15 mL 0.1 mmol/L的DEHP乙腈溶液中,放入恒温震荡摇床进行均匀震荡(20 ℃,转速150 r/min),在固定的时间间隔内(1,2,5,10,15,20,30,45,60,90,120 min)磁性分离,上清液通过0.22 μm的有机系滤膜,用紫外分光光度计检测吸光度,并计算各个时间点t对应的单位吸附容量.
1.6 吸附选择竞争性实验称取30 mg D-MIPs、NIPs分别加入到15 mL DEHP、DNOP浓度均为0.1 mmol/L的混合乙腈吸附样本溶液1以及15 mL DMP、DEP、DBP浓度均为0.1 mmol/L的混合乙腈吸附样本溶液2,并放入恒温震荡摇床均匀震荡2 h(20 ℃,转速150 r/min),磁性分离,上清液通过0.22 μm的有机系滤膜,并用紫外分光光度计[13]检测各个物质上清液对应的吸光度,计算这5种物质的含量和相应的单位吸附容量.
1.7 再生性实验称取30 mg D-MIPs加入15 mL浓度为0.1 mmol/L的DEHP乙腈溶液中,放入恒温震荡摇床均匀震荡30 min(20 ℃,转速150 r/min),磁性分离,上清液通过0.22 μm的有机系滤膜,检测上清液吸光度.将吸附过后的D-MIPs加入洗脱液进行震荡洗脱至检测不到DEHP,干燥回收.重复上述步骤5次,分别记录每次吸附液上清液吸光度.NIPs的再生性实验步骤与上述保持一致.
2 结果与讨论吸附实验中,A、ρ、Q分别表示吸光度、吸附液质量浓度(mg/L)、聚合物吸附量(mg/g);m、V、η分别表示聚合物质量(mg)、附溶液体积(mL)与吸附率(%).k、Kd、K′分别表示一次线性拟合系数、分离系数和印迹选择性因子.所有数据代号及相应运算公式如下:
| $ {\rho _{\rm{t}}} = {A_{\rm{t}}}/k, $ | (1) |
| $ {Q_{\rm{t}}} = ({\rho _{\rm{0}}} - {\rho _{\rm{t}}}) \times V/m, $ | (2) |
| $ \eta = {\rho _{\rm{t}}}/{\rho _0} \times 100\% , $ | (3) |
| $ {k_{\rm{d}}} = {Q_{\rm{e}}}/{\rho _{\rm{e}}}, $ | (4) |
| $ k' = {k_{{\rm{d(MIPs)}}}}/{k_{{\rm{d(NIPs)}}}}^{\left[ {{\rm{14}}} \right]} \cdot $ | (5) |
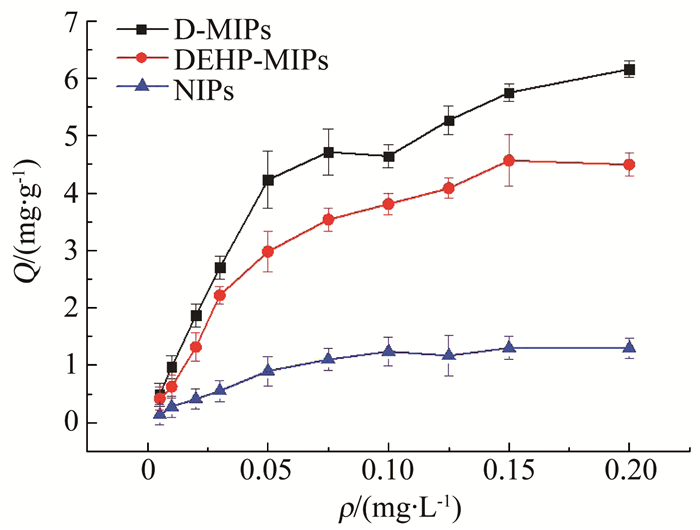
将静态吸附实验的多组数据通过所测拟合标线进行计算,并对其进行方差均值的处理分析,D-MIPs、DEHP-MIPs、NIPs对不同质量浓度DEHP的静态吸附曲线如图 1所示,并对3种聚合物吸附性能进行评价.
|
图 1 D-MIPs、DEHP-MIPs与NIPs对DEHP静态吸附曲线 Fig. 1 Static adsorption curves of D-MIPs, DEHP-MIPs, and NIPs for DEHP |
由图 1可知,在所测浓度范围内,3种聚合物对DEHP的吸附容量随吸附液浓度的上升而上升.最大吸附容量与最大吸附率分别为Qe(D-MIPs)=6.16 mg/g、ηe(D-MIPs)=87.49%;Qe(DEHP-MIPs)=4.49 mg/g、ηe(DEHP-MIPs)=74.97%;Qe(NIPs)=1.30 mg/g、ηe(DEHP-MIPs)=24.92%;其中,D-MIPs与DEHP-MIPs对DEHP的吸附容量均明显大于NIPs,表明印迹聚合物表面存在对DEHP进行特异性识别的印迹位点,使其内部产生的孔穴结构与DEHP分子在空间上相互匹配,并对其起记忆性作用,而非印迹聚合物不具备该特点.
而D-MIPs对DEHP的吸附容量大于DEHP-MIPs,这是因为DEHP与DNOP互为同分异构体,在分子构型上如图 2,3所示.

|
图 2 DEHP分子结构 Fig. 2 DEHP molecular structure |

|
图 3 DNOP分子结构 Fig. 3 DNOP molecular structure |
两种化合物在空间构型上存在高度相似,均属PAEs,且同类物质的印迹聚合物对于该类模板分子存在一定的吸附能力,说明DNOP以模板分子的形式引入,与DEHP进行组合后为DEHP的结合与洗脱创造出了更合适的孔穴,使其吸附量与特异性识别能力均有所提高.DEHP-MIPs和NIPs的曲线趋于饱和,达到了理论最大吸附容量,而D-MIPs一直呈上升趋势,则实测最大吸附容量≠理论最大吸附容量,即D-MIPs对DEHP没有达到理论最大吸附量,说明对DEHP具有更大吸附能力.
对整个静态吸附过程通过Langmuir、Freundilich方程进行模拟拟合,从而对其吸附机理进行更深层次的分析研究.以Qm表示其饱和吸附量,Langmuir、Freundilich吸附系数分别以KL、KF表示,其吸附方程分别为
| $ 1/{Q_{\rm{e}}} = 1/{Q_{\rm{m}}} + 1/({Q_{\rm{m}}}{k_{\rm{L}}}{\rho _{\rm{e}}}), $ | (6) |
| $ \ln {Q_{\rm{e}}} = \ln {K_{\rm{F}}} + \ln {\rho _{\rm{e}}}/n. $ | (7) |
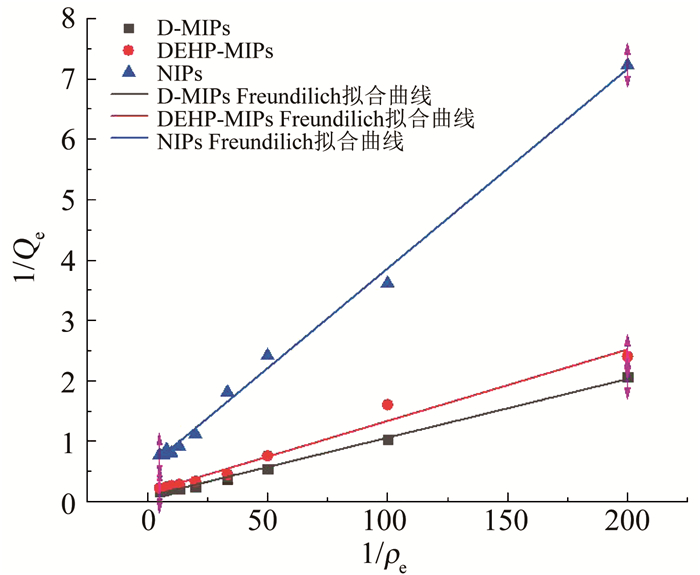
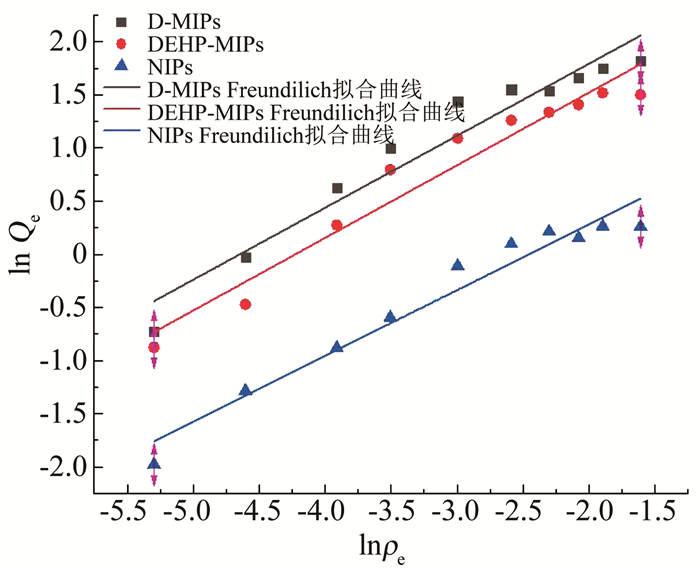
以式(6)、(7)进行拟合,分别得到Langmuir、Freundilich拟合曲线,如图 4,5所示,其拟合吸附参数见表 1,2.
|
图 4 D-MIPs、DEHP-MIPs与NIPs对DEHP吸附的Langmuir拟合曲线 Fig. 4 Langmuir fitting curves of D-MIPs, DEHP-MIPs, and NIPs for DEHP adsorption |
|
图 5 D-MIPs、DEHP-MIPs与NIPs对DEHP吸附的Freundilich拟合曲线 Fig. 5 Freundilich fitting curves of D-MIPs, DEHP-MIPs, and NIPs for DEHP adsorption |
| 表 1 Langmuir拟合曲线吸附参数 Tab. 1 Adsorption parameters of Langmuir fitting curves |
| 表 2 Freundilich拟合曲线吸附参数 Tab. 2 Adsorption parameters of Freundilich fitting curves |
将表 1,2中拟合结果和静态吸附实验过程结合来看,3种聚合物对DEHP的吸附过程更符合Langmuir吸附模型,其相关系数R2相较Freundilich模型值更大,表明该聚合物体系的吸附过程与单层特异性吸附类似.
2.2 D-MIPs吸附动力学分析对动态吸附实验的多组数据通过所测拟合标线进行计算,并对其进行方差均值的处理分析,D-MIPs、DEHP-MIPs、NIPs 3种聚合物的吸附动力学曲线如图 6所示.

|
图 6 D-MIPs、DEHP-MIPs和NIPs对DEHP吸附动力学曲线 Fig. 6 Adsorption kinetics curves of D-MIPs, DEHP-MIPs, and NIPs for DEHP |
对其吸附过程进行分析可知,3种聚合物的吸附容量均随时间增加而增加,且在不同时间点趋于饱和.D-MIPs与DEHP-MIPs分别在20~30 min、30~45 min达到该浓度下其静态最大吸附量,这是由于D-MIPs的印迹位点活性更强,所创造出的孔穴对DEHP的包覆更加适应,因此,其传质速度会比DEHP-MIPs提高50%左右.NIPs在10~15 min已达到吸附平衡,这是由于其外部没有与DEHP相应的识别位点及其内部没有与之相匹配的孔穴,仅通过聚合物本身比表面积大的特性进行吸附,因此吸附量小,吸附时间较短.在吸附平衡后的时间内,3种聚合物的吸附容量并无明显变化,说明对于DEHP的包覆能力较为稳定,不会出现明显的吸附物泄露情况.
对整个动力学吸附过程通过Lagergren伪一级、二级动力学模型进行模拟拟合,从而进一步对其动态过程的吸附机理进行研究.以K1、K2分别表示伪一级、二级的动力学速率常数,这两种动力学方程分别为
| $ {\rm{ln}}\left( {{\rm{1 - }}{Q_{\rm{t}}}/{Q_{\rm{e}}}} \right) = - {K_{\rm{1}}}t + \rho , $ | (8) |
| $ t/{Q_{\rm{t}}} = 1/({K_{\rm{2}}}Q_{\rm{e}}^{\rm{2}}) + t/{Q_{\rm{e}}} \cdot $ | (9) |
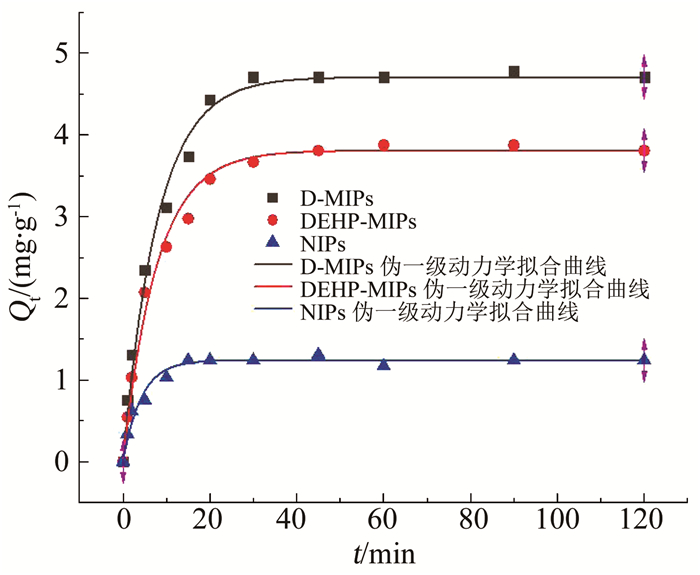
以式(8)、(9)对动力学吸附过程进行拟合,分别得到Lagergren伪一级、二级动力学的拟合曲线,如图 7,8所示,其拟合吸附参数见表 3,4.
|
图 7 D-MIPs、DEHP-MIPs与NIPs对DEHP吸附的伪一级动力学拟合曲线 Fig. 7 Pseudo-first-order kinetics fitting curves of D-MIPs, DEHP-MIPs, and NIPs for DEHP adsorption |

|
图 8 D-MIPs、DEHP-MIPs与NIPs对DEHP吸附的伪二级动力学拟合曲线 Fig. 8 Pseudo-second-order kinetics fitting curves of D-MIPs, DEHP-MIPs, and NIPs for DEHP adsorption |
| 表 3 伪一级动力学拟合曲线吸附参数 Tab. 3 Adsorption parameters of pseudo-first-order kinetics fitting curves |
| 表 4 伪二级动力学拟合曲线吸附参数 Tab. 4 Adsorption parameters of pseudo-second-order kinetics fitting curves |
将表 3,4中拟合结果与整个动力学实验过程结合来看,两种印迹聚合物对DEHP的吸附过程更符合伪二级动力学方程,其相关系数R2相较伪一级动力学方程更大;而非印迹聚合物对DEHP的吸附过程更符合伪一级动力学方程.上述结果说明,D-MIPs与DEHP-MIPs对于DEHP的动态吸附可分为2个过程,第一个过程是较为迅速的表面扩散型吸附,第二个过程则是其印迹结合位点对其进行特异性识别的吸附;而NIPs对DEHP的吸附主要仅依靠表面扩散型吸附.
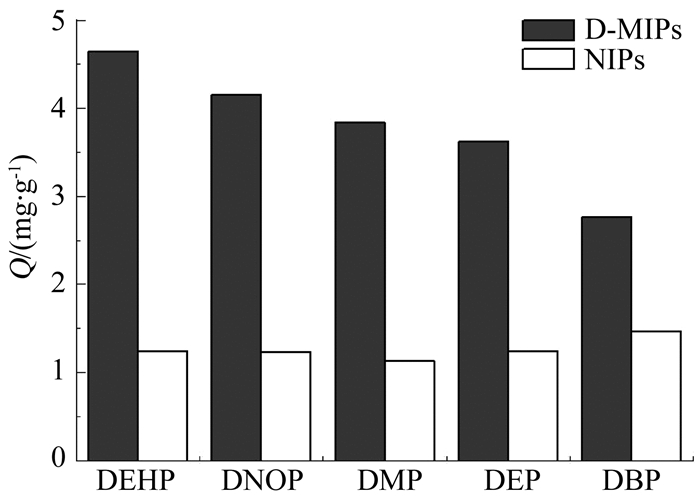
2.3 D-MIPs吸附选择性分析将D-MIPs与NIPs对5种相似类物质的吸附数据进行整理,各自对应的吸附容量如图 9所示.
|
图 9 D-MIPs与NIPs对5种PAEs的吸附容量 Fig. 9 Adsorption capacity chart of D-MIPs and NIPs for 5 PAEs |
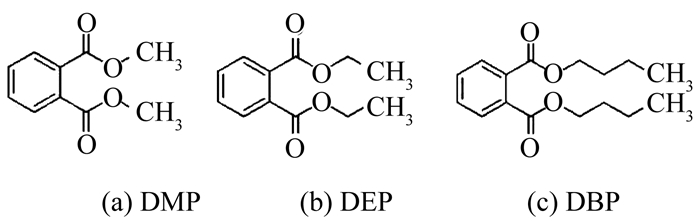
计算各自吸附底物对应的印迹选择因子K′(K′越大表示对该物质的选择性越强,吸附能力越好)及2种聚合物的分离系数,结果如表 5所示.可以看出,D-MIPs对于除DEHP外其他4种PAEs具有较良好的吸附性能,印迹选择因子K′在1.88~3.75.其中与DEHP互为同分异构体的DNOP的K′与Kd值最大,吸附容量最大,表现出的亲和性最高,说明其印迹孔穴与特异性识别位点最为相似,可作为最佳辅助模板分子;对DBP的K′与Kd最小,原因如下:首先,DMP/DEP/DBP 3种PAEs的分子结构均比DEHP小,其官能团与结构的相似程度与DNOP相比也更小,而且在D-MIPs中,并未引入这3种PAEs作为辅助模板分子进行印迹,则D-MIPs对这3种PAEs的吸附能力应小于DEHP/DNOP.同时,在分子结构的大小上,可由图 10观察到DMP < DEP < DBP,由于吸附过程中,化学结构越小的化合物更容易进入D-MIPs中所形成的特异性吸附孔穴,所以越容易被吸附,则D-MIPs表现出对DMP、DEP、DBP三者的吸附容量逐渐变小,对DBP的Kd与K′即为最小.综上,DBP在吸附过程中,更难以进入由DEHP/DNOP在D-MIPs中所创造的特异性吸附孔穴.
|
图 10 DMP/DEP/DBP平面分子结构 Fig. 10 Planar molecular structures of DMP/DEP/DBP |
| 表 5 D-MIPs与NIPs的选择性吸附参数 Tab. 5 Selective adsorption parameters of D-MIPs and NIPs |
NIPs对5种PAEs的吸附容量相差不大且都较小,说明其对几种吸附底物不具有特异性识别功能.
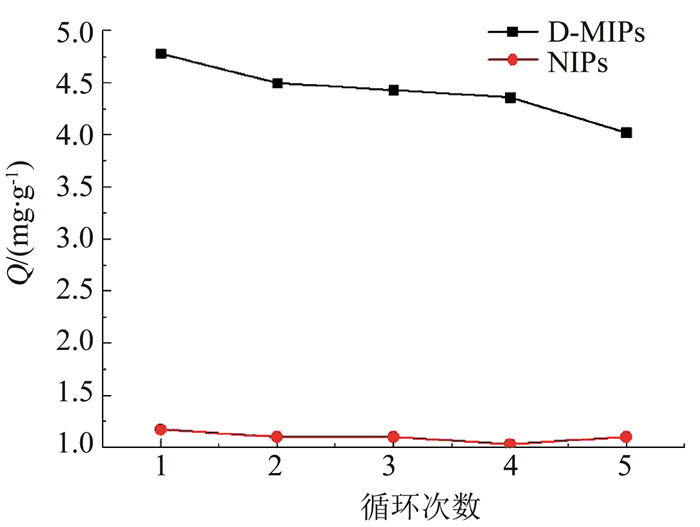
2.4 D-MIPs吸附再生性分析将5次循环吸附-洗脱的D-MIPs与NIPs的实验数据进行整合,其次数对应的吸附容量如图 11所示.可以看出,D-MIPs在经过第5次吸附-洗脱的实验后,仍保持有相对第1次84.02%的吸附容量.NIPs在第5次吸附-洗脱实验后保持着相对第1次94.06%的吸附容量,再生性能相较印迹聚合物更高,说明其对目标分子的包覆与融合能力弱于印迹聚合物,更容易被洗脱下来,吸附过程仅停留于聚合物外表面的吸附.该类聚合物均具有很高的再生性能,在节能环保、材料回用上具有潜在意义.
|
图 11 D-MIPs与NIPs 5次循环洗脱-吸附后对DEHP的吸附容量 Fig. 11 Adsorption capacity of D-MIPs and NIPs for DEHP after 5 cycles of elution-adsorption |
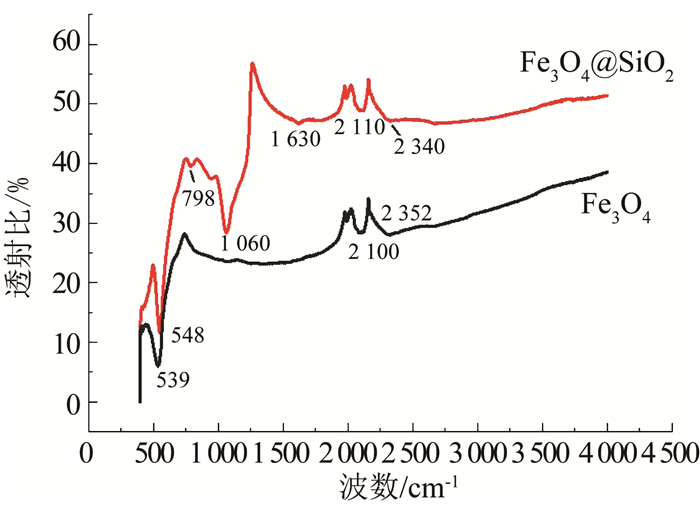
Fe3O4、Fe3O4@SiO2的红外光谱见图 12.图中对未改性的Fe3O4与SiO2改性的Fe3O4@SiO2进行了对比分析.两条谱线中539 cm-1与548 cm-1为F-O的伸缩振动吸收峰,表示其改性过后的Fe3O4@SiO2仍具有良好的磁性;798 cm-1是Si-O的对称伸缩振动峰,1 060 cm-1处出现的强振动峰则是由于Si-O-Si的反对称伸缩振动形成,这两个强峰均是SiO2最为典型的的红外特征峰,说明TEOs通过负载反应形成了SiO2并稳定包覆于Fe3O4的表面,表示其改性成功.1 630 cm-1处弱峰可能是由于NH3·H2O在负载过程中有残余部分反应形成的N—H键的弯曲振动.2 340 cm-1与2 352 cm-1处的弱峰可能是由于检测过程中CO2的混入所形成的反对称伸缩峰.其余两者都有的部分杂峰均较弱,可判定其为原有Fe3O4中混入的部分杂质造成.
|
图 12 Fe3O4与Fe3O4@SiO2红外光谱 Fig. 12 Infrared spectra of Fe3O4 and Fe3O4@SiO2 |
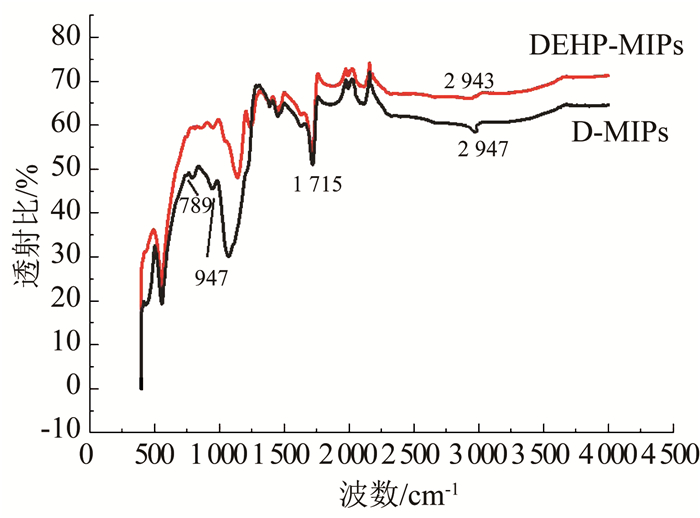
DEHP-MIPs、D-MIPs的红外光谱如图 13所示.可以看出,1 715 cm-1处振动吸收峰相较载体明显增强,其是由反应单体中C O的伸缩振动所形成的;2 943 cm-1与2 947 cm-1则是交联剂EGDMA与单体MAA通过交联聚合反应产生的C—H、—CH2—键伸缩振动形成的,说明印迹聚合物制备成功.D-MIPs相较于DEHP-MIPs的振动峰更为明显,表明其印迹聚合的效果更好,且两种印迹聚合物均保持了载体Fe3O4@SiO2原本的磁性与改性后的优良性能.
|
图 13 DEHP-MIPs与D-MIPs红外光谱 Fig. 13 Infrared spectra of DEHP-MIPs and D-MIPs |
1) 通过引入模板分子的同分异构体作为辅助模板分子,并与多模板印迹技术、磁性载体分离技术相结合所制得的双模板印迹聚合物D-MIPs,提高了单一模板对其目标分子的吸附容量,并实现了两种不同模板分子间印迹位点与特异性孔穴的协同促进作用.
2) 该印迹聚合物对5种同类相似PAEs均存在较好的吸附效能,且对所选2种模板分子具有更好的特异性识别功能,可同时达到相较单一模板聚合物更高效率的吸附.同时,为分离工业废水及日常饮用水中的DEHP,以及环境中其他的PAEs提供了新的思路,具有可观的应用前景.
| [1] |
TANG Xiaoyan, WANG Suyu, YANG Yang, et al. Removal of six phthalic acid esters (PAEs) from domestic sewage by constructed wetlands[J]. Chemical Engineering Journal, 2015, 275: 198. DOI:10.1016/j.cej.2015.04.029 |
| [2] |
OSMAN B, ÖZER E T, DEMIRBEL E, et al. Synthesis and characterization of L-tryptophan containing microbeads for removal of dimethyl phthalate from aqueous phase[J]. Separation & Purification Technology, 2013, 109: 40. DOI:10.1016/j.seppur.2013.02.025 |
| [3] |
PRANAW K, SINGH S, DUTTA D, et al. Biodegradation of dimethyl phthalate by an entomopathogenic nematode symbiont Xenorhabdus indica strain KB-3[J]. International Biodeterioration & Biodegradation, 2014, 89: 23. DOI:10.1016/j.ibiod.2014.01.002 |
| [4] |
LIU Hui, LIANG Hecheng, LIANG Ying, et al. Distribution of phthalate esters in alluvial sediment: A case study at JiangHan Plain, Central China[J]. Chemosphere, 2010, 78: 382. DOI:10.1016/j.chemosphere.2009.11.009 |
| [5] |
XU Wanzhen, ZHANG Xiaoming, HUANG Weihong, et al. Synthesis of surface molecular imprinted polymers based on carboxyl-modified silica nanoparticles with the selective detection of dibutyl phthalate from tap water samples[J]. Applied Surface Science, 2017, 426: 1075. DOI:10.1016/j.apsusc.2017.07.241 |
| [6] |
FAN Ting, YANG Wenming, WANG Ningwei, et al. Molecularly imprinted polymer microspheres derived from pickering emulsions polymerization in determination of di(2-ethylhexyl) phthalate in bottled water samples[J]. Journal of Applied Polymer Science, 2016, 133(22): 43. DOI:10.1002/app.43484 |
| [7] |
LIN X, LIU C, LU C, et al. Preparing phthalate molecularly imprinted polymer comprises e.g. carrying out computer simulation phthalate molecularly imprinted polymer pre-assembly system to phthalic acid bis (10-methoxy-10-oxodecane) ester as a template molecule: CN107400187-A[P]. 2017
|
| [8] |
秦世丽, 苏立强, 王鹏. 磁性复合模板分子印迹聚合物制备及识别性能研究[J]. 化工新型材料, 2017, 45: 144. QIN Shili, SU Liqiang, WANG Peng. Preparation and recognition of molecularly imprinted polymer with magnetic composite template[J]. New Chemical Materials, 2017, 45: 144. |
| [9] |
管习文, 李欣怡, 周琪, 等. 分子印迹聚合物的制备与应用进展[J]. 胶体与聚合物, 2015(2): 88. GUAN Xiwen, LI Xinyi, ZHOU Qi, et al. Progress in preparation and application of molecularly imprinted polymers[J]. Colloid and Polymer, 2015(2): 88. |
| [10] |
SOLEDAD-RODRíGUEZ B, FERNÁNDEZ-HERNANDO P, GARCINUNO-MARTÍNEZ R M, et al. Effective determination of ampicillin in cow milk using a molecularly imprinted polymer as sorbent for sample preconcentration[J]. Food Chemistry, 2017, 224: 432. DOI:10.1016/j.foodchem.2016.11.097 |
| [11] |
BOMPART M, GOTO A, WATTRAINT O, et al. Molecularly imprinted polymers by reversible chain transfer catalysed polymerization[J]. Polymer, 2015, 78: 31. DOI:10.1016/j.polymer.2015.09.060 |
| [12] |
ZHANG Xiaoming, YANG Wenming, WANG Ningwei, et al. Synthesis and evaluation of ionic liquid-mediated molecularly imprinted polymer for highly selective recognition of dibutyl phthalate from liquor samples[J]. Advances in Polymer Technology, 2017, 36(2): 220. DOI:10.1002/adv.21602 |
| [13] |
许凯, 郭伦, 骆红宇. 薄层色谱-紫外分光光度法测定PVC医疗器械中邻苯二甲酸二(2-乙基)己酯的研究[J]. 工程塑料应用, 2013, 41(11): 92. XU Kai, GUO Lun, LUO Hongyu. Research on determination of di(2-ethylhexyl)phthalate(DEHP) in PVC medical devices by TLC-UV spectrophotometry[J]. Engineering Plastics Application, 2013, 41(11): 92. DOI:10.3969/j.issn.1001-3539.2013.11.021 |
| [14] |
SUN Xiaoli, WANG Jincheng, LI Yun, et al. Highly selective dummy molecularly imprinted polymer as a solid-phase extraction sorbent for five bisphenols in tap and river water[J]. Journal of Chromatography A, 2014, 1343: 33. DOI:10.1016/j.chroma.2014.03.063 |
 2020, Vol. 52
2020, Vol. 52


