2. 陕西省膜分离重点实验室(西安建筑科技大学), 西安 710055;
3. 陕西省环境工程重点实验室(西安建筑科技大学), 西安 710055
2. Key Laboratory of Membrane Separation of Shaanxi Province (Xi'an University of Architecture and Technology), Xi'an 710055, China;
3. Key Laboratory of Environmental Engineering of Shaanxi Province
超滤技术被广泛应用于污水处理、二级处理水深度处理及海水淡化预处理等水处理领域中,而超滤膜污染一直是限制其高效低耗运行的主要因素之一[1-3].蛋白类有机物作为引起待处理废水中超滤膜污染主要物质之一,解析其膜污染机理受到普遍关注[4].
既往关于蛋白质膜污染行为的研究较多,主要集中于运行条件[4-5](驱动压力、错流速度等)、水质条件[6-8](pH、离子强度等)、膜材料种类[9]等因素对蛋白类有机物膜污染行为的影响.这些研究从不同角度揭示了蛋白类有机物的膜污染机理及其关键控制因素.但有研究者发现,待处理废水中的溶解性有机污染物通常与无机颗粒污染物同时存在,二者共存条件下的混合膜污染行为,用单类型污染物的膜污染机制并不能有效解释[10].与单类型污染物相比,探明有机污染物与无机颗粒共存条件下的膜污染行为,对实际应用中膜污染的预测与控制尤为重要[11-12].
本课题组前期针对蛋白类污染物,考察了其与无机SiO2颗粒共存条件下对聚偏氟乙烯超滤膜的污染行为[13],发现与单种蛋白类或者无机SiO2污染物所引起的膜污染行为不同,SiO2颗粒的存在可有效减缓蛋白类有机物在膜面的吸附累计速率及污染层密实度,引起较小的膜污染速率及不可逆污染.进一步证实了考察有机-无机污染物共存条件复合膜污染行为的重要性.
有机-无机污染物所引起的复合污染过程受到多种因素影响.而Ca2+可通过络合、中和、架桥等作用改变有机及无机污染物表面的性能,进而影响有机/无机污染物与膜、有机-无机污染物之间及同类型污染物之间的相互作用行为,最终影响混合污染行为[14-15].但是,相对单种污染物, 只有少数研究考察Ca2+对混合污染的影响机理.特别是关于Ca2+对蛋白类有机物与无机物共存条件下的膜污染行为的影响机制鲜有报道.
为探究Ca2+对有机-无机混合污染物膜污染行为的影响,选用了牛血清蛋白(BSA)、SiO2分别代表蛋白类及无机污染物,选择聚偏氟乙烯(PVDF)超滤膜,针对SiO2-BSA混合体系,在CaCl2离子强度为0~30 mmol/L,进行超滤膜污染实验,并采用原子力显微镜结合自制的BSA、SiO2探针,定量测定混合体系中各污染物与膜及各污染物之间的作用力随Ca2+浓度的变化特征,结合宏观膜污染行为,探明Ca2+对SiO2-BSA混合体系超滤膜污染行为的影响机制,为实际运行中混合体系超滤膜污染防控提供一定的指导.
1 实验 1.1 材料聚偏氟乙烯(PVDF,Solef 1015,苏威),无水氯化锂(LiCl,天津科密欧化学试剂有限公司),N,N-二甲基乙酰胺(DMAc,津福晨化学试剂厂),CaCl2(天津市天力化学试剂有限公司), 牛血清蛋白(BSA, 99%纯度, Sigma-Aldrich),SiO2(10~20 nm,>99.5%纯度,Sigma-Aldrich).
1.2 超滤膜制备将PVDF及LiCl按照一定比例溶解于DMAc中,置于60 ℃的恒温磁力搅拌器上搅拌12 h形成均质铸膜液, 静置脱泡处理后,将铸膜液均匀地涂覆于玻璃板表面,然后在40 ℃的恒温水浴中进行分相固化成膜.所制备的PVDF超滤膜纯水通量(330±20)L/(m2·h), 接触角(78.2±1.5)°,表面平均粗糙度(9.6±0.7)nm.
1.3 超滤膜过滤实验采用死端恒压系统进行超滤膜的过滤实验[16]:在0.15 MPa条件下进行超滤膜预压,然后在0.1 MPa下测试膜的纯水通量J0.最后在0.1 MPa下进行特定Ca2+浓度的SiO2-BSA混合污染物溶液过滤实验(DOC为10 mg/L,SiO2为10 mg/L,pH为7.0±0.1),在线监测过滤2 h过程中的膜通量J,采用J/J0先在恒速下搅拌10 min,接着超声10 min,最后将其静置20 min进行过滤实验.过滤实验结束后,将污染膜置于装有400 mL去离子水的烧杯中,在23 ℃恒温水浴振荡器上振荡2 min,之后将污染膜取出冲洗膜面并测量其纯水通量Jr,采用Jr/J0评价污染膜的通量恢复效果.
1.4 微观作用力测定采用Multimode 8.0原子力显微镜(AFM,布鲁克,德国)结合自制的胶体探针[23],在“接触”模式下进行胶体探针与样品表面之间相互作用力的测试.以干净PVDF膜为样品,分别采用BSA、SiO2探针测定各污染物与PVDF之间的相互作用力;以污染膜为样品,同样采用BSA、SiO2探针测定BSA-BSA、SiO2-SiO2之间及SiO2-BSA之间的作用力,测试溶液为1 mmol/L的NaHCO3溶液.针对每个样品,至少在6个不同的区域点进行作用力的测定,每个区域点重复测试10次以上[13, 20].
1.5 污染层形貌分析采用SEM表征污染膜表面污染层形貌结构.首先,采用真空冷冻干燥机(vacuum freeze dryer,DZ-2BC,天津市泰斯特仪器有限公司)对膜进行冷冻干燥处理.然后,将冷冻干燥的膜平整地黏贴于SEM样品台表面,喷金处理后,采用扫描电子显微镜(scanning electron microscope, SEM, JSM-6510LV)对膜进行表观特征分析.
1.6 分析方法使用Zeta电位仪(ZS90, 马尔文, 英国)测定SiO2-BSA混合溶液中污染物带电性及水力学半径.使用TOC分析仪(TOC-L, CPN, 日本)测定各透过液中有机污染物的浓度.
2 结果与讨论 2.1 SiO2-BSA带电性能及水力学直径随Ca2+浓度的变化表 1为CaCl2离子强度为0, 1, 5, 10及30 mmol/L(对应的离子浓度为0, 0.33, 1.67, 3.33, 10 mmol/L)条件下,SiO2-BSA混合污染物的Zeta电位及其水力学直径.可以看出,随着Ca2+浓度的增加,SiO2-BSA混合污染物的Zeta电位逐渐减小,而水力学直径呈现逐渐增大的趋势.这是因为SiO2及BSA皆带负电荷,随着离子强度的增大,Ca2+的电荷屏蔽、电荷中和及架桥等作用,导致二者表面带电量逐渐减小,且伴随着污染物间静电排斥力的减小,对应污染物间更容易团聚形成较大尺寸的团聚体,所以,水力学直径逐渐增大.
| 表 1 不同Ca2+浓度下SiO2-BSA的Zeta电位及水力学直径 Tab. 1 Zeta potential and hydrodynamic diameter of SiO2-BSA under different Ca2+ contents |
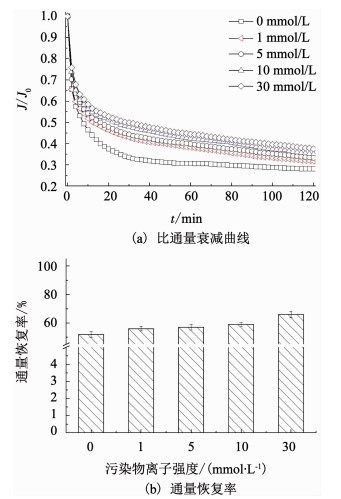
图 1为PVDF超滤膜过滤CaCl2离子强度为0,1,5,10及30 mmol/L的SiO2-BSA混合污染物溶液时,对应污染膜的比通量变化特征及膜通量恢复性能,表 2为BSA的TOC去除率.
|
图 1 不同Ca2+浓度下SiO2-BSA污染膜的比通量衰减曲线及通量恢复率 Fig. 1 Normalized flux and flux recovery rates of SiO2-BSA fouled membrane under different Ca2+ contents |
| 表 2 不同Ca2+浓度下的BSA去除率 Tab. 2 BSA removal rate under different Ca2+ ions content conditions |
在120 min运行时间内,离子强度为0,1,5,10及30 mmol/L时,对应的SiO2-BSA污染膜通量衰减率分别为72%,69%,67%,65%及62%.而相应的通量恢复率为52%,56%,57%,59%及66%.显然,随着Ca2+浓度的增大,对应污染膜的污染速率及不可逆污染皆在逐渐减小,说明Ca2+的存在可有效减缓SiO2-BSA对PVDF超滤膜的污染.这与Lee等的研究结果相反,他们考察Ca2+对天然有机物-无机颗粒混合膜污染行为的影响时发现,Ca2+的存在可以明显加剧混合污染的速率[17-19].他们推测,Ca2+降低了污染物与膜及有机物与无机污染物之间的静电排斥力,加快了有机物在膜面的吸附累积速率及致密污染层的形成,伴随着较为严重的膜污染,同时对有机物的截留率增大.而在本研究中,SiO2-BSA污染物溶液中一旦有Ca2+加入,PVDF超滤膜对BSA的去除率急剧减小,因此,关于Ca2+减缓SiO2-BSA混合体系膜污染行为的原因其实并不明确,仍需进一步研究.
2.3 Ca2+对SiO2-BSA体系中膜污染微观作用力的影响为探明Ca2+减缓混合体系膜污染的原因,在与宏观膜污染实验相对应的Ca2+浓度下,定量测定了SiO2-BSA混合体系中各污染物与膜、同类型污染物及无机与有机污染物之间的相互作用力.
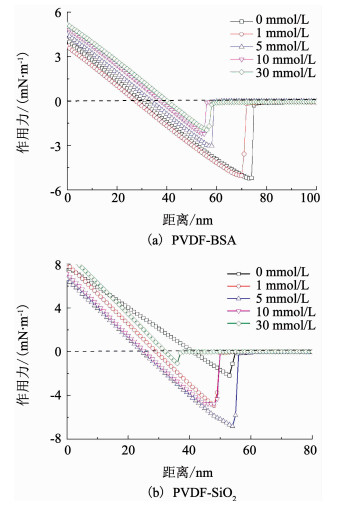
2.3.1 Ca2+对污染物-膜之间相互作用力的影响图 2为各Ca2+浓度下,BSA及SiO2与PVDF超滤膜之间的典型作用力曲线.其中,当离子强度为0,1,5,10及30 mmol/L时,PVDF-BSA之间的平均黏附力分别为5.14,5.07,2.96,2.02及1.92 mN/m,而PVDF-SiO2之间的平均黏附力分别为2.21,4.80,7.23,4.95及1.07 mN/m.显然,随着Ca2+浓度的增大,PVDF-BSA与PVDF-SiO2呈现两种不同的变化规律.
|
图 2 不同Ca2+浓度下PVDF-BSA及PVDF-SiO2之间的典型作用力曲线 Fig. 2 Curves of typical normalized adhesion forces versus distance for PVDF-BSA and PVDF-SiO2 under different Ca2+ contents |
首先,针对PVDF-BSA之间的作用力,其随着Ca2+浓度增加在逐渐减小.这主要是因为Ca2+是典型的水合阳离子,其在PVDF超滤膜及BSA表面的吸附累积,会有效地触发PVDF-BSA之间的水合排斥力,而该力会随着浓度的增大而增大,导致PVDF-BSA之间的作用力随着Ca2+浓度的增大而减小[20].
其次,针对PVDF-SiO2之间的作用力,当离子强度从0增大到5 mmol/L时,PVDF-SiO2间的作用力逐渐增大,当离子强度继续增大到10及30 mmol/L时,开始逐渐减小.这主要是因为在较低的Ca2+浓度下,静电作用力的变化起主导作用,导致PVDF-SiO2间作用力随着Ca2+浓度增大而增大.当离子强度大于5 mmol/L时,水合排斥力逐渐掩盖了静电作用力的变化,从而导致PVDF-SiO2作用力开始随着Ca2+浓度的增大而减缓[21].结合图 1可知,虽然在低Ca2+浓度下,PVDF-SiO2间作用力逐渐增大,一旦有Ca2+加入,运行初期的膜通量衰减速率及污染幅度明显减缓,这与PVDF-BSA间作用力变化特征完全相符,而PVDF-SiO2间作用力变化与运行初期膜污染行为似乎没有直接的关联.这主要是因为SiO2在水溶液中极易团聚形成大尺寸聚集体,并不能进入膜孔引起膜孔阻塞,对运行初期的膜污染影响较小[13].因此,当BSA与SiO2同时存在时, 运行初期控制膜污染的主要为BSA,即随着Ca2+浓度的增大,PVDF-BSA之间的作用力逐渐减小,削弱了BSA在膜孔膜面的吸附累积速率,伴随着运行初期膜污染速率的减小.
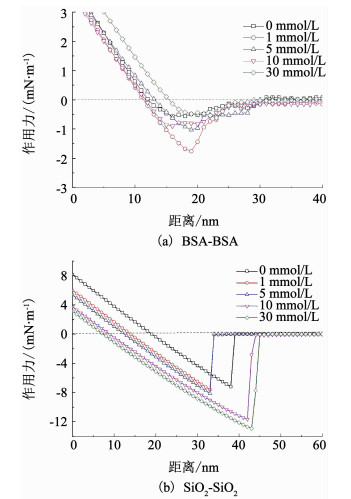
2.3.2 Ca2+对污染物-污染物间作用力的影响SiO2-BSA混合体系中,不同Ca2+浓度下,同类型污染物即BSA-BSA及SiO2-SiO2间的典型作用力曲线见图 3.
|
图 3 不同Ca2+浓度下BSA-BSA及SiO2-SiO2之间的典型作用力曲线 Fig. 3 Curves of typical normalized adhesion forces versus distance for BSA-BSA and SiO2-SiO2 under different Ca2+ contents |
CaCl2离子强度为0,1,5,10及30 mmol/L时,BSA-BSA之间的平均黏附力分别为0.65,1.71,1.15,0.96及0.93 mN/m,而SiO2-SiO2之间的平均黏附力分别为7.16,7.17,9.58,11.63及12.22 mN/m.显然,随着Ca2+浓度的增加,BSA-BSA间作用力以离子强度1 mmol/L为拐点,呈现先增大后减小的趋势,而SiO2-SiO2间作用力在持续增大.说明Ca2+的存在可有效降低水合离子在其表面的吸附积累,触发BSA间的水合排斥力,而SiO2-SiO2间的作用力始终以静电排斥力的变化为主导.这可能是因为相比BSA,SiO2更为亲水,而水分子在SiO2表面的吸附积累,不易触发水合排斥力,导致静电作用力的变化始终是控制SiO2之间作用力变化的主要因素[20],即SiO2-SiO2作用力随着Ca2+浓度的增大而增大.
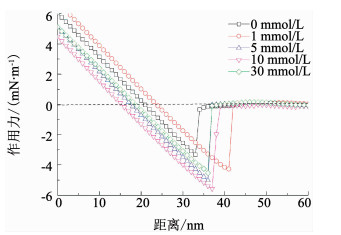
本研究同时考察了混合体系中不同类型污染物间作用力,即SiO2-BSA之间作用力随Ca2+浓度的变化特征,结果见图 4.在离子强度为0,1,5,10及30 mmol/L时,SiO2-BSA之间的平均黏附力分别为3.32,4.31,4.99,5.23及4.72 mN/m.与BSA-BSA之间的作用力变化特征相似,随着Ca2+浓度的增大,SiO2-BSA之间的相互作用力呈现先增大后减小的趋势,这是由静电作用力及水合排斥力的变化导致.但与BSA-BSA之间作用力变化特征不同的是,针对SiO2-BSA,当离子强度达到30 mmol/L时才出现作用力减小的现象,可能是由SiO2与BSA表面特性不同所致.前面提到,SiO2表面更不易与水合离子结合,因此,与BSA相比,更不易产生水合排斥[20].
|
图 4 不同Ca2+浓度下SiO2-BSA之间典型作用力曲线 Fig. 4 Curves of typical normalized adhesion forces versus distance for SiO2-BSA under different Ca2+ contents |
综上发现,在SiO2-BSA混合体系中,随着Ca2+浓度的增大,BSA-BSA、SiO2-SiO2及SiO2-BSA间作用力的变化并不相同,很难与图 1所示的膜污染行为建立之间的关联性.而前期研究表明,污染物间作用力主要是通过影响污染层的结构特征进而影响膜污染行为[13, 22],因此,进一步考察了各离子强度下对应的污染层结构特征,结果如图 5所示.

|
图 5 不同Ca2+浓度下SiO2-BSA污染膜表面SEM图 Fig. 5 SEM of membrane surfaces fouled by SiO2-BSA under different Ca2+ contents |
随着Ca2+浓度的增大,大尺寸的SiO2团聚体越来越多,污染层越来越松散.这主要是SiO2-SiO2及SiO2-BSA之间作用力的增大,加剧了BSA对SiO2颗粒之间的黏附作用,从而形成大尺寸聚集体,但这些大尺寸聚集体不易进入膜孔引起膜孔堵塞,被截留于膜面后形成松散的污染层,进而伴随着膜污染速率以及污染幅度的减小.虽然当离子强度增大到30 mmol/L时,SiO2-BSA之间的作用力有所减小,但污染物的团聚十分明显.因此,在离子强度为30 mmol/L时,污染物之间的团聚仍然是控制膜污染物的主导因素.
值得注意的是,虽然SiO2对BSA的吸附几乎随着Ca2+浓度的增大在持续增大,但是BSA的去除率随着Ca2+的增大在持续减小.这是因为随着Ca2+浓度的增大,BSA与PVDF及BSA之间的作用力即开始减小,所以,未被SiO2吸附的BSA分子,极易通过膜孔进入渗透液,引起BSA去除率的减小.
3 结论1) 随着SiO2-BSA体系中Ca2浓度的增大,SiO2-BSA所引起的超滤膜污染速率及污染幅度在逐渐减小,且不可逆污染也在减缓.说明Ca2+的存在可有效减缓SiO2-BSA对超滤膜的污染,而Ca2+对污染物-膜及污染物-污染物间相互作用力的改变是其减缓膜污染的主要原因.
2) 针对膜-污染物之间的相互作用力,随着Ca2+的加入,其可有效触发PVDF超滤膜与BSA及SiO2之间的水合排斥力,特别是BSA与PVDF间作用力,在离子强度为1 mmol/L时即开始减小,从而削弱BSA在PVDF表面的吸附累积速率,最终减缓了运行初期的膜污染速率.
3) 针对污染物之间的作用力,随着Ca2+浓度的增大,SiO2-BSA,BSA-BSA之间作用力皆是先增大后减小,SiO2-SiO2之间的作用力是逐渐增大,而SiO2-BSA之间作用力仅在离子强度达到30 mmol/L时出现略微减小的现象,三者的变化并不是完全一样.但随着Ca2+浓度的增加,SiO2-SiO2及SiO2-BSA之间的作用力增大,导致污染物团聚形成大尺寸聚集体,被截留于膜面后形成松散多孔的污染层,进而伴随着膜污染速率以及污染幅度的减小.
| [1] |
JERMANN D, PRONK W, BOLLER M. Mutual influences between natural organic matter and inorganic particles and their combined effect on ultrafiltration membrane fouling[J]. Environmental Science & Technology, 2008, 42(24): 9129. DOI:10.1021/es800654p |
| [2] |
YUAN W, ZYDNEY A L. Humic acid fouling during microfiltration[J]. Journal of Membrane Science, 1999, 157(1): 1. DOI:10.1016/S0376-7388(98)00329-9 |
| [3] |
SABLANI S S, DATTA A K, RAHMAN M S, et al. Handbook of food and bioprocess modeling techniques[M]. CRC Press, 2006
|
| [4] |
SHE Q, TANG C Y, WANG Y N, et al. The role of hydrodynamic conditions and solution chemistry on protein fouling during ultrafiltration[J]. Desalination, 2009, 249(3): 1079. DOI:10.1016/j.desal.2009.05.015 |
| [5] |
WANG Y N, TANG C Y. Protein fouling of nanofiltration, reverse osmosis, and ultrafiltration membranes: The role of hydrodynamic conditions, solution chemistry, and membrane properties[J]. Journal of Membrane Science, 2011, 376(1/2): 275. DOI:10.1016/j.memsci.2011.04.036 |
| [6] |
MO H, TAY K G, NG H Y. Fouling of reverse osmosis membrane by protein (BSA): Effects of pH, calcium, magnesium, ionic strength and temperature[J]. Journal of Membrane Science, 2008, 315(1/2): 28. DOI:10.1016/j.memsci.2008.02.002 |
| [7] |
CHAN R, CHEN V. The effects of electrolyte concentration and pH on protein aggregation and deposition: Critical flux and constant flux membrane filtration[J]. Journal of Membrane Science, 2001, 185(2): 177. DOI:10.1016/S0376-7388(00)00645-1 |
| [8] |
SALGIN S. Effects of ionic environments on bovine serum albumin fouling in a cross-flow ultrafiltration system[J]. Chemical Engineering & Technology: Industrial Chemistry-Plant Equipment-Process Engineering-Biotechnology, 2007, 30(2): 255. DOI:10.1002/ceat.200600342 |
| [9] |
HASHINO M, HIRAMI K, ISHIGAMI T, et al. Effect of kinds of membrane materials on membrane fouling with BSA[J]. Journal of Membrane Science, 2011, 384(1/2): 157. DOI:10.1016/j.memsci.2011.09.015 |
| [10] |
GUO W, NGO H H, LI J. A mini-review on membrane fouling[J]. Bioresource Technology, 2012, 122: 27. DOI:10.1016/j.biortech.2012.04.089 |
| [11] |
SHI X, FIELD R, HANKINS N. Review of fouling by mixed feeds in membrane filtration applied to water purification[J]. Desalination and Water Treatment, 2011, 35(1/2/3): 68. DOI:10.5004/dwt.2011.3131 |
| [12] |
LIU Y, MI B. Combined fouling of forward osmosis membranes: Synergistic foulant interaction and direct observation of fouling layer formation[J]. Journal of Membrane Science, 2012, 407: 136. DOI:10.1016/j.memsci.2012.03.028 |
| [13] |
MA B, WU G, LI W, et al. Roles of membrane-foulant and inter/intrafoulant species interaction forces in combined fouling of an ultrafiltration membrane[J]. Science of the Total Environment, 2019, 652: 19. DOI:10.1016/j.scitotenv.2018.10.229 |
| [14] |
KIM Y, ELIMELECH M, SHON H K, et al. Combined organic and colloidal fouling in forward osmosis: Fouling reversibility and the role of applied pressure[J]. Journal of Membrane Science, 2014, 460: 206. DOI:10.1016/j.memsci.2014.02.038 |
| [15] |
JERMANN D, PRONK W, BOLLER M. Mutual influences between natural organic matter and inorganic particles and their combined effect on ultrafiltration membrane fouling[J]. Environmental Science & Technology, 2008, 42(24): 9129. DOI:10.1021/es800654p |
| [16] |
MIAO R, WANG L, MI N, et al. Enhancement and mitigation mechanisms of protein fouling of ultrafiltration membranes under different ionic strengths[J]. Environmental Science & Technology, 2015, 49(11): 6574. DOI:10.1021/es505830h |
| [17] |
MAHLANGU T O, HOUK E M V, MAMBA B B, et al. Influence of organic, colloidal and combined fouling on NF rejection of NaCl and carbamazepine: Role of solute-foulant-membrane interactions and cake-enhanced concentration polarisation[J]. Journal of Membrane Science, 2014, 471: 35. DOI:10.1016/j.memsci.2014.07.065 |
| [18] |
LEE S, CHO J, ELIMELECH M. Combined influence of natural organic matter (NOM) and colloidal particles on nanofiltration membrane fouling[J]. Journal of Membrane Science, 2005, 262(1/2): 27. DOI:10.1016/j.memsci.2005.03.043 |
| [19] |
ARKHANGELSKY E, WICAKSANA F, TANG C, et al. Combined organic-inorganic fouling of forward osmosis hollow fiber membranes[J]. Water Research, 2012, 46(19): 6329. DOI:10.1016/j.watres.2012.09.003 |
| [20] |
MIAO R, WANG L, ZHU M, et al. Effect of hydration forces on protein fouling of ultrafiltration membranes: The role of protein charge, hydrated ion species, and membrane hydrophilicity[J]. Environmental Science & Technology, 2016, 51(1): 167. DOI:10.1021/acs.est.6b03660 |
| [21] |
MIAO R, LI X, WU Y, et al. A comparison of the roles of Ca2+ and Mg2+ on membrane fouling with humic acid: Are there any differences or similarities?[J]. Journal of Membrane Science, 2018, 545: 81. DOI:10.1016/j.memsci.2017.09.063 |
| [22] |
WANG L, MIAO R, WANG X, et al. Fouling behavior of typical organic foulants in polyvinylidene fluoride ultrafiltration membranes: Characterization from microforces[J]. Environmental Science & Technology, 2013, 47(8): 3708. DOI:10.1021/es4004119 |
| [23] |
DENG D, WANG L, LI X, et al. Effect mechanism of protein electrical property to hydration in ultrafiltration[J]. Journal of Harbin Institute of Technology, 2017, 49(8): 78. DOI:10.11918/j.issn.0367-6234.201608035 |
 2020, Vol. 52
2020, Vol. 52


