2. 北京卫星环境工程研究所 可靠性与环境工程技术重点实验室, 北京 100094;
3. 哈尔滨工业大学 材料科学与工程学院, 哈尔滨 150001
2. Science and Technology on Reliability and Environmental Engineering Laboratory, Beijing Institute of Spacecraft Environment Engineering, Beijing 100094, China;
3. School of Materials Science and Engineering, Harbin Institute of Technology, Harbin 150001, China
光催化技术是高效环保的污染治理手段之一,即通过光催化剂吸收太阳能并将其转化为化学能来实现有机污染物的降解,这种途径效率高且不引起二次污染,是环境治理的新方向[1].在所有的光催化剂中,TiO2材料具有合成过程简单、价格低廉、无二次污染、无毒无害等优点,是应用最广泛的半导体材料,是当前国际热门的研究领域[2].
自1972年Fujishima和Honda[3]第一次使用TiO2电极成功地进行光解水以后,人们在TiO2材料的合成工艺和光催化性能等研究方面取得了显著的收获[4-5].但以前研究多集中在悬浮相半导体光催化氧化方式,存在容易失效,发生团聚以及难回收、循环使用率低等缺陷,限制了其实际使用范围[6],而且TiO2吸附能力较差,光催化效率又易受到晶体结构、尺寸大小、比表面积的影响.因此,对TiO2进行负载化处理,增大比表面积是增强光催化性能以及可回收利用率的有效方式之一[7-9].目前国内外应用的载体主要有碳材料、活性氧化铝和沸石等[10-11].其中,沸石具有较大的比表面积、不规整的内表面布局,高的化学稳定性、粒子交换性能以及可以提供独特的纳米级反应场等诸多特点,广泛应用于TiO2光催化剂载体.沸石负载可以使液相体系中低剂量有机底物富集在催化剂表面集中催化,进而提高有机污染物的降解速率,是比较理想的催化性载体,得到了广泛研究[12-13].
此外,TiO2的禁带宽度为3.2 eV,对可见光的利用率较低,极大束缚了它的光催化性能.光生载流子在TiO2晶格内产生的同时,会在其内部和表面复合,降低了其光催化效率,因此,需对其进行改性[13-14],提高其光催化活性.目前,用于TiO2可见光催化改性的方法主要包括非金属掺杂、金属掺杂、金属与非金属共掺杂等[15-17].但单一元素改性会在TiO2内部产生光生电子-空穴的复合中心,降低光催化效率[15],且稳定性不高,具有一定的局限性.非金属与金属元素对TiO2进行共掺杂,可利用金属和非金属掺杂对TiO2光吸收或光催化性能的协同增强效应,既能减少电子-空穴复合中心的产生,又能有效地提高光生电子-空穴的迁移能力,是进一步提高TiO2的光催化效率的有效方式,近年来逐渐成为TiO2光催化领域的研究热点[18-19].
因此,本文采用溶胶-凝胶法制备Mn,N共掺杂TiO2光催化剂,然后采用沸石进行负载,以孔雀石绿(MG)为试验对象,研究了Mn,N共掺杂对光催化性能的影响,并初步分析了共掺杂对光催化性能的影响机制.
1 实验 1.1 试验试剂与仪器沸石,5A,湖州新奥利吸附材料有限公司;孔雀石绿,99.99%,沈阳化学试剂厂;钛酸四丁酯,99%,阿拉丁化学试剂有限公司;冰醋酸,分析,阿拉丁化学试剂有限公司;四水硝酸锰,分析,阿拉丁化学试剂有限公司.
TF55035KC-1管式炉,UV-550紫外分光光度计,Nicolet is5700傅立叶变换红外光谱仪,Rigaku D X-射线衍射仪,Merlin Compact扫描电子显微镜.
1.2 TiO2、Mn掺杂TiO2、N掺杂TiO2和Mn,N共掺杂TiO2光催化剂的制备1) TiO2、Mn掺杂TiO2、N掺杂TiO2和Mn,N共掺杂TiO2溶胶的制备
配制体积比为2: 8: 35的冰乙酸的水-乙醇溶液,按Mn/Ti的摩尔百分比为0.5%,加入四水硝酸锰;按N/Ti的摩尔百分比为10%,加入尿素,磁力搅拌后加入硝酸调节pH至2.5以下,形成混合溶液,随后将体积比为2: 7的钛酸四丁酯乙醇溶液缓慢加入到上述混合溶液中,并持续搅拌,使发生水解反应形成Mn,N共掺杂TiO2溶胶.
其中对于TiO2溶胶的制备过程中,不需要加入四水硝酸锰和尿素;对于Mn掺杂TiO2溶胶的制备,不需要加入尿素;对于N掺杂TiO2溶胶的制备,不需要加入四水硝酸锰.
2) TiO2、Mn掺杂TiO2、N掺杂TiO2和Mn,N共掺杂TiO2凝胶的制备
将TiO2、Mn掺杂TiO2、N掺杂TiO2和Mn和N共掺杂TiO2溶胶静置陈化12 h后,得到TiO2、Mn掺杂TiO2、N掺杂TiO2和Mn,N共掺杂TiO2凝胶.
3) TiO2、Mn掺杂TiO2、N掺杂TiO2和Mn,N共掺杂TiO2光催化剂的制备
制备的凝胶经过80 ℃干燥12 h,研磨成粉后置于程序升温管式炉内,并在500 ℃空气气氛下煅烧4 h,升温速率为2 ℃/min,得到TiO2、Mn掺杂TiO2、N掺杂TiO2和Mn,N共掺杂TiO2光催化剂.
1.3 沸石负载TiO2和沸石负载Mn,N共掺杂TiO2光催化剂的制备1) 沸石负载TiO2和Mn,N共掺杂TiO2凝胶的制备
将干燥过的一定质量的沸石分别加入到所制备的TiO2和Mn,N共掺杂TiO2溶胶中,磁力搅拌直到形成均匀的溶胶,陈化12 h,形成稳定的沸石负载TiO2和沸石负载Mn,N共掺杂TiO2凝胶.
2) 沸石负载TiO2和沸石负载Mn,N共掺杂TiO2光催化剂的制备
将制备的凝胶经过80 ℃干燥12 h,研磨成粉后置于程序升温管式炉内,并在500 ℃下空气煅烧4 h,升温速率为2 ℃/min,得到沸石负载TiO2和沸石负载Mn,N共掺杂TiO2光催化剂,其中TiO2与沸石的质量比为1: 4,即TiO2的负载量为20%.
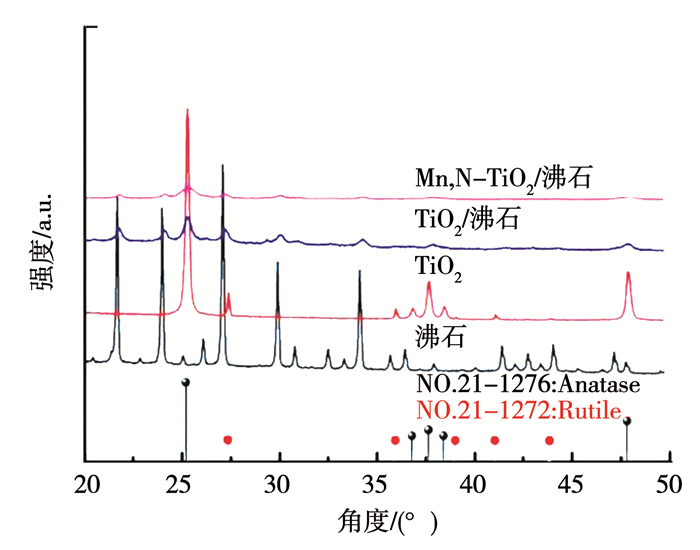
2 结果与讨论 2.1 沸石负载Mn,N共掺杂TiO2光催化剂的结构表征 2.1.1 X-射线衍射(XRD)分析图 1为沸石、TiO2、TiO2/沸石和Mn,N-TiO2/沸石样品的XRD图.从图 1中可知,在500 ℃温度煅烧下的TiO2样品在25.3°、37.7°、48.1°处出现了锐钛矿相衍射峰,且在27.4°、36.1°、39.2°处出现了金红石相衍射峰,此时的TiO2样品处于两相共存状态.同沸石负载后,TiO2/沸石样品中既出现了沸石的衍射峰也存在锐钛矿相TiO2衍射峰,并且TiO2的衍射峰位置没有发生改变,说明TiO2与沸石复合并没有改变其晶格结构.而离子掺杂改性后的TiO2/沸石样品与未掺杂改性的样品的XRD图相比,发现TiO2的衍射峰发生明显宽化,表明TiO2晶粒生长受限.此外,可能由于离子的掺杂量较少,无法在样品中检测出掺杂离子的衍射峰.但离子掺杂后,样品中金红石相消失,表明适量的离子掺杂起到抑制金红石相生成的作用,有利于提高其光催化性能.
|
图 1 沸石、TiO2、TiO2/沸石和Mn,N-TiO2/沸石XRD Fig. 1 XRD patterns of zeolite, TiO2, TiO2/zeolite, and Mn, N-TiO2/zeolite |
图 2(a)和图 2(b)分别为TiO2和沸石的SEM图,图 2(c)TiO2/沸石的SEM图,从图中可以看出,TiO2负载后,沸石表面形貌从光滑变得不平整,TiO2在沸石表面有明显团聚现象,图 2(d)为Mn,N-TiO2/沸石样品的SEM图,从图中可以看出锰、氮元素的掺杂有利于抑制TiO2颗粒的生长,缓解团聚现象,提高表面粗糙度,为光催化反应提供更多的反应面积.

|
图 2 不同催化剂样品的SEM Fig. 2 SEM images of different samples |
图 3为截取的Mn,N-TiO2/沸石样品的部分扫描区域及其EDS图谱,图 3(a)能够看出在沸石表面负载着一层TiO2.图 3(b)为样品中O元素的分布图,从图中可以看出,O元素均匀分布在整个扫描区域.图 3(c)为样品的Al元素分布图,样品中的Al元素来自于样品中的沸石分子筛,其均匀分布在整个扫描区域.图 3(d)为样品中的Ti元素分布图,从图中看出,Ti元素均匀分布,表明TiO2均匀分布在沸石分子筛的表面.图 3(e)是扫描电镜成功探测到掺杂的N元素存在,图中可以看出N元素均匀分布在整个扫描区域,表明N元素成功掺杂到样品中.图 3(f)为样品中Mn元素分布图,其来源于样品的Mn离子掺杂,从图中可以看出Mn元素含量较少但也均匀分布,表明Mn离子成功掺杂进入样品中.

|
图 3 Mn,N-TiO2/沸石的SEM以及EDS图谱 Fig. 3 SEM and EDS images of Mn, N-TiO2/zeolite |
图 4为未采用沸石负载的TiO2、Mn-TiO2、N-TiO2和Mn,N-TiO2样品的全光谱漫反射光谱图.从图 4中可知,TiO2对紫外光有很高的吸收利用率,但对可见光的利用率极低,而Mn-TiO2、N-TiO2以及Mn,N-TiO2在可见光区的吸收能力明显强于TiO2,其中Mn,N-TiO2光催化剂的可见光吸收能力最强.其归因于N掺杂在TiO2中引入了新的杂质能级在导带与价带之间形成了N-Ti-O键,使得在可见光范围的光利用率得到提升,并且Mn元素的掺杂可以在TiO2晶格中产生深层能级,可以让能量较弱的光子激发产生光生载流子,提高光的利用率.因此,Mn,N-TiO2对光的吸收能力最强,光催化活性更高.与此同时,Mn元素的引入有利于产生电子和传输电子,阻碍光生载流子的复合,促进光催化反应的进行.从图 4的插图中可以看出,金属与非金属元素掺杂后TiO2样品的吸收光谱明显发生了红移现象,表明金属与非金属元素掺杂可以拓宽TiO2的光响应范围.

|
图 4 TiO2、Mn-TiO2、N-TiO2和Mn,N-TiO2样品的全光谱漫反射光谱 Fig. 4 Diffuse reflectance spectroscopy of TiO2, Mn-TiO2, N-TiO2, and Mn, N-TiO2 |
图 5为TiO2/沸石和Mn,N-TiO2/沸石的全光谱漫反射光谱图.从图 5中可以看出,锰、氮元素共掺杂后,TiO2/沸石在紫外光区和可见光区域的吸收都得到显著提高,尤其是对可见光的吸收,有利于提高其光催化活性.且从宏观照片中可以看出,锰、氮元素共掺杂后,TiO2/沸石的颜色从白色变为浅灰色,进一步证明了掺杂有利于提高可见光吸收.

|
图 5 TiO2/沸石和Mn,N-TiO2/沸石的全光谱漫反射光谱 Fig. 5 Diffuse reflectance spectroscopy of TiO2/zeolite and Mn, N-TiO2/zeolite |
单一的非金属掺杂会在TiO2内部产生复合中心,阻碍光生电子-空穴达到TiO2表面参与催化反应,但非金属与金属共掺杂可以减少复合中心的产生,提高光生载流子的迁移能力,协同作用显著改善TiO2的光催化降解率.
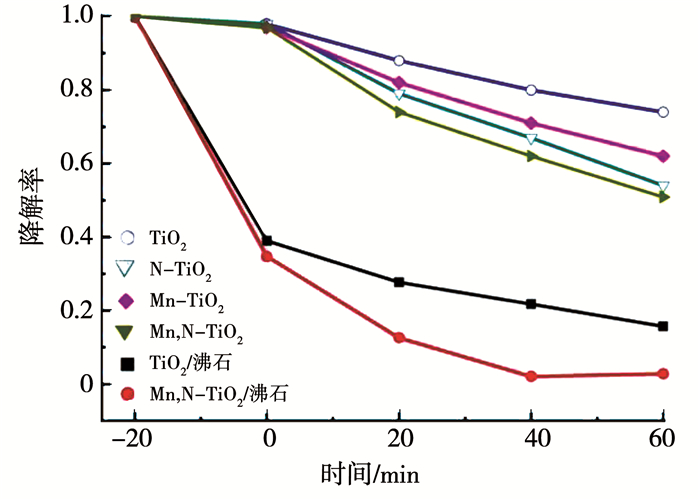
图 6为在可见光照射下TiO2、Mn-TiO2、N-TiO2、Mn,N-TiO2、TiO2/沸石和Mn,N-TiO2/沸石6种不同样品对MG的光催化降解对比曲线(其中灰色区域为无光照条件下的样品对MG的吸附,时间为20分钟),其中MG溶液的浓度为10 mg/L,催化剂用量为1 g/L.从图 6中可知,掺杂改性并未改变TiO2的吸附性能,但经过60 min的可见光照射后,样品对MG的催化降解率存在显著的差异.未掺杂的TiO2对MG的降解率只有26%,是因为TiO2主要吸收紫外光,对可见光几乎不吸收,光催化活性不高.锰、氮共掺杂后,样品对MG的光降解率显著高于未掺杂和单一元素掺杂,催化降解率达到49%,这是因为N掺杂替代部分氧原子,提升TiO2的价带高度,吸收带边发生红移,增强了TiO2对可见光的利用率,而Mn掺杂能够产生深层能级,可以让能量较弱的光子激发产生光生载流子,还能有效的阻碍电子-空穴的复合,增强光的利用率.锰、氮共掺杂起到了协同作用,减少复合中心的产生,改善光生载流子的迁移能力,提高TiO2的降解率.采用沸石进行负载后,显著提升了催化剂的吸附性能,进而提升了TiO2的降解率,TiO2/沸石的降解率可达到84%,比负载前提升了2倍以上.
|
图 6 不同催化剂对MG的光催化降解曲线 Fig. 6 Photocatalytic degradation of MG with different photocatalysts |
此外,采用沸石负载Mn,N-TiO2后,降解率可达到97%,实现了降解率的进一步提升.这主要是由于Mn和N的共掺杂对TiO2光吸收或光催化性能的协同增强效应导致,一方面,N掺杂扩大了TiO2光激发范围,在可见光照射下,电子从N2p被激发到TiO2导带,形成了光生电子-空穴,并分别在TiO2表面形成超氧自由基(·O2-)和羟基自由基(·OH),·O2-和·OH都对有机物具有强的氧化和分解能力,促进了MG的光催化降解;另一方面,Mn离子的引入形成了捕获中心,捕获TiO2光催化产生的电子,对光生电子-空穴的复合起到了很好的抑制作用,改善了光催化活性.
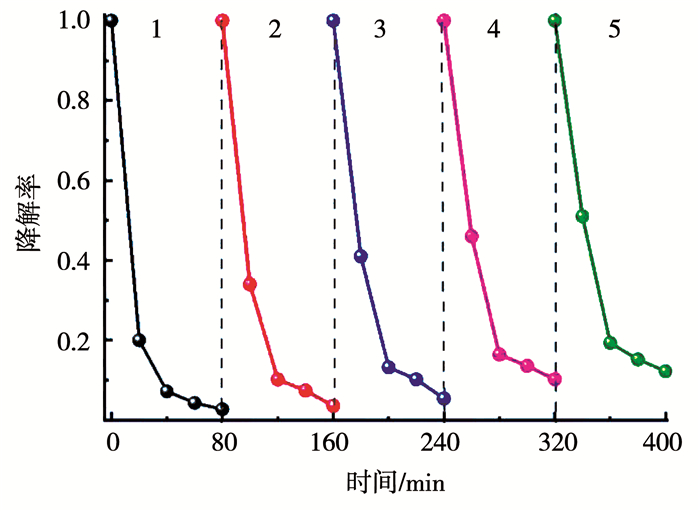
2.2.2 光催化稳定性分析为了研究离子掺杂对TiO2/沸石光催化剂的催化稳定性的影响,将催化剂加入到MG溶液中,避光吸附至饱和后进行可见光降解,实验后,将催化剂进行收集分离、清洗、干燥后重新使用.Mn,N-TiO2/沸石光催化剂对MG降解率随着催化次数的变化曲线如图 7所示.
|
图 7 Mn,N-TiO2/沸石光催化剂对MG的降解率随着循环次数的变化曲线 Fig. 7 Recycling test of photodegradation efficiency of MG by Mn, N-TiO2/zeolite photocatalyst |
从图 7可知,样品光催化性能随着循环次数的增加有所降低,第1次~第5次循环后的光降解率分别为97%、95%、93%、90%和88%(其中灰色区域为无光照条件下的样品对MG的吸附,时间为20 min).这可能是由于MG降解的中间产物吸附在催化剂表面,导致光催化剂有效表面积和催化活性位点相应减少,阻碍与MG的接触和氧化还原反应,而且催化剂表面富集的中间产物对光线有一定的反射作用,催化剂的光源利用率有所降低.因此,随着循环次数的增加,光催化效率降低.但5次循环使用后对MG的光降解率仍可达到88%,与未改性TiO2/沸石的光催化降解率相当,说明Mn,N-TiO2/沸石催化剂具有较好的稳定性.
2.2.3 光催化降解机理研究为了了解光催化降解过程,对降解过程中参与的自由基进行自由基检测试验.分别使用草酸铵(AO)、叔丁醇(TBA)和对苯醌(BQ)作为电子空穴(h+)、羟基自由基(·OH)以及超氧自由基(·O2-)作为活性自由基捕获剂.
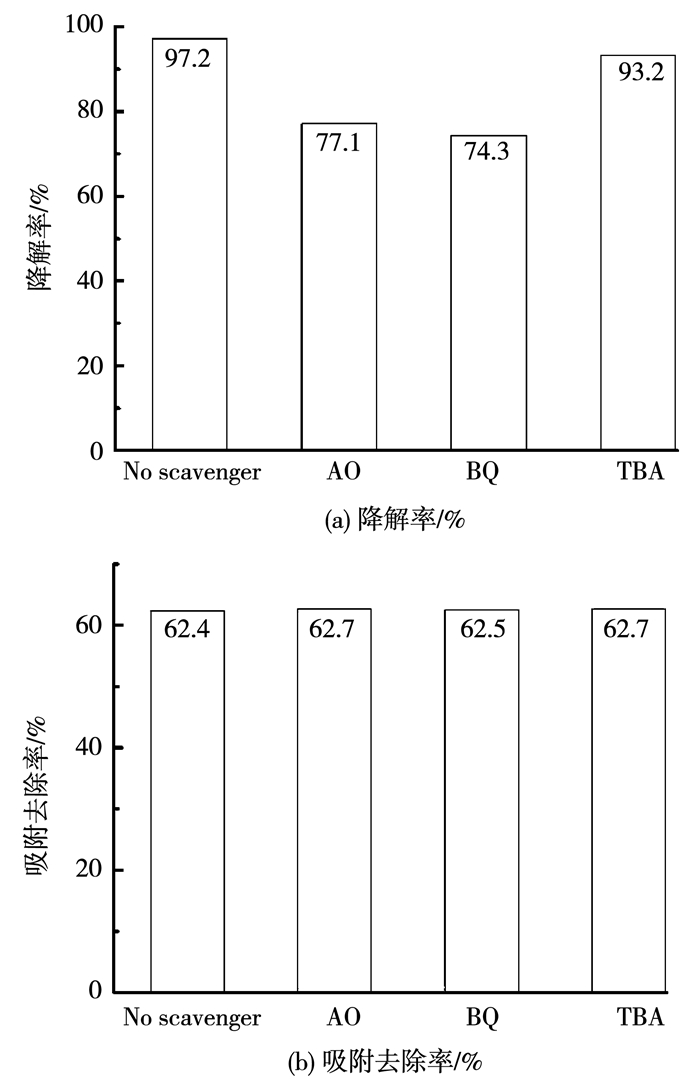
在可见光照射下对Mn,N-TiO2/沸石光催化剂进行催化MG的对照实验,研究在光催化降解过程中不同的活性自由基对光催化降解MG效率的影响,结果如图 8(a)所示.在无任何自由基捕获剂加入时,可见光照60 min后,MG的总降解率高达97.2%,当添加一定量的叔丁醇作为羟基自由基(·OH)捕获剂时,样品对MG的降解率下降至93.2%,但光催化效率依然维持在较高水平,说明在光催化降解过程中羟基自由基(·OH)参与较少,并非主要的催化活性自由基.而当添加一定量的草酸铵、对苯醌作为电子空穴(h+)和超氧自由基(·O2-)的捕获剂时,样品对MG的降解率显著下降,降解率分别下降至77.1%和74.3%,说明样品在光催化降解过程中,电子空穴(h+)和超氧自由基(·O2-)是光催化降解过程中的主要攻击物种.
|
图 8 不同自由基捕获剂对Mn,N-TiO2/沸石光催化剂降解MG的影响 Fig. 8 Effect of different radical scavengers on MG photocatalytic degradation rates by Mn, N-TiO2/zeolite photocatalyst |
同时也对在光催化降解过程中不同的活性自由基对光催化降解MG吸附去除率的影响进行了研究,结果如图 8(b)所示.光催化剂对MG的吸附去除率维持在62.5%左右,其主要是来自催化剂中沸石的吸附作用.因此,提高光生电子-空穴对的产生量和抑制光生电子-空穴对的复合,是改善TiO2的降解率的有效途径.
为进一步验证Mn,N-TiO2/沸石光催化剂对污染物的降解机理,对TiO2、TiO2/沸石以及Mn,N-TiO2/沸石光催化剂进行可见光催化降解MG实验,并对实验结果进行分析,结果如图 9所示.

|
图 9 (a) 不同样品光催化降解MG的降解曲线和(b)降解动力学曲线 Fig. 9 (a) Photocatalytic degradation of MG with different samples and (b) corresponding degradation kinetics curves |
图 9(a)为TiO2、TiO2/沸石以及Mn,N-TiO2/沸石在暗吸附之后在可见光照射下对MG的降解曲线.很显然,在无任何光催化剂加入时,MG没有被降解.在所有样品中Mn,N-TiO2/沸石具有最高的光催化活性.80 min的可见光照射之后,TiO2以及TiO2/沸石的降解率分别为37%、92%,而在可见光照射60 min后,Mn,N-TiO2/沸石的降解率就达到97%.结果表明,TiO2的负载化以及离子掺杂均能提高其光催化活性.
图 9(b)为不同样品降解MG的线性动力学模拟曲线.从图 9(b)中可以看出,光催化活性大小顺序为:Mn,N-TiO2/沸石>TiO2/沸石>TiO2>空白样.结果表明,对TiO2进行负载化以及离子掺杂改性处理,促进样品的光生电荷分离,使得光催化活性显著增强,光催化效率提高.
图 10为锰、氮共掺杂TiO2/沸石分子筛复合材料的光催化降解机理示意图.从图 10中可知,锰、氮共掺杂TiO2/沸石复合材料在暗处理的过程中利用沸石载体的较强吸附作用,将浓度较低的有机污染物集中吸附在复合材料催化剂表面进行集中催化降解.在光照条件下,当TiO2受到能量大于其Eg能量光子的激发时,其价带中的电子会吸收光子能量迁移到导带,同时在价带产生一个空穴,形成光生电子-空穴对.其中,氧化性极强的光生空穴能够将有机污染物、水和OH-等氧化成羟基自由基(·OH);而还原性极强的光生电子能够直接还原有机污染物,也能与TiO2晶体表面吸附的氧气分子(O2)反应形成负氧离子(·O2-),然后·O2-与氢离子(H+)结合生成羟基自由基(·OH),几乎可以降解所有的有机物.当用N对TiO2掺杂时能够降低TiO2的导带能级,提高价带能级,且N掺杂一般很少形成光生电子-空穴的复合中心,因此,能够有效地提高TiO2的光催化性能以及拓宽其吸收光谱区域;而Mn掺杂TiO2可以产生深层能级,让能量较小的光子激发产生光生载流子,并且产生光生载流子的浅势捕获肼,有效抑制光生载流子的复合.锰、氮共掺杂改性既能拓宽TiO2吸收光谱区域还能抑制光生电子-空穴的复合,提高光催化降解活性,最终有机污染物被催化降解成无害的H2O和CO2小分子发生脱附,降解使用后的光催化剂经煅烧处理,恢复如初,可以用于有机污染物循环催化降解.
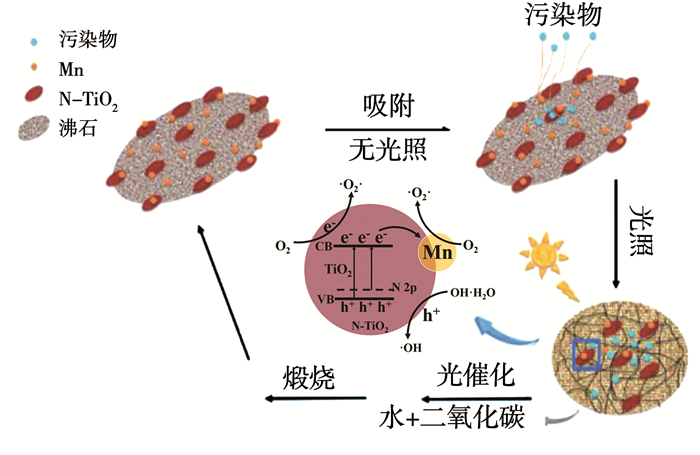
|
图 10 Mn,N-TiO2/沸石光催化剂的光催化降解机理示意 Fig. 10 Schematic of photodegradation mechanism for Mn, N-TiO2/zeolite photo catalyst |
1) 通过溶胶-凝胶法和沸石负载,成功制备出具有高可见光催化活性的Mn,N共掺杂TiO2/沸石光催化剂,在可见光下,60 min内对MG降解率达到97%.
2) 沸石负载TiO2,可有效提高TiO2的光催化活性,这主要归因于TiO2与沸石负载后光催化降解与载体吸附性能的协同作用,从而具有较高的光催化活性.
3) 锰、氮共掺杂TiO2/沸石光催化剂经过5次循环使用后,60 min内对MG降解率可维持在88%以上,锰、氮共掺杂可提高TiO2/沸石光催化剂的循环稳定性.
| [1] |
TONG Hua, OUYANG Shuxin, BI Yingpu, et al. Nano-photocatalytic materials:Possibilities and challenges[J]. Advanced Materials, 2012, 24(2): 229. DOI:10.1002/adma.201102752 |
| [2] |
XU Hua, OUYANG Shuxin, LIU Lequan, et al. Recent advances in TiO2-based photocatalysis[J]. Journal of Materials Chemistry A, 2014, 2(32): 12642. DOI:10.1039/C4TA00941J |
| [3] |
FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37. DOI:10.1038/238037a0 |
| [4] |
CHEN C A, CHEN Y M, KOROTCOV A, et al. Growth and characterization of well-aligned densely-packed rutile TiO2 nanocrystals on sapphire substrates via metal-organic chemical vapor deposition[J]. Nanotechnology, 2008, 19(7): 61. DOI:10.1088/0957-4484/19/7/075611 |
| [5] |
KASUGA T, HIRAMATSU M, HOSON A, et al. Cheminform abstract titania nanotubes prepared by chemical processing[J]. Cheminform, 2010, 31(2): 99. DOI:10.1021/cm050851b |
| [6] |
CAREY J H, LAWRENCE J, TOSINE H M. Photo-dechlorination of PCB's in the presence of titanium dioxide in aqueous suspensions[J]. Bulletin of Environmental Contamination & Toxicology, 1976, 16(6): 697. DOI:10.1007/BF01685575 |
| [7] |
GUESH K, MÁRQUEZ-ÁLVAREZ C, CHEBUDE Y, et al. Enhanced photocatalytic activity of supported TiO2 by selective surface modification of zeolite Y[J]. Applied Surface Science, 2016, 378: 473. DOI:10.1016/j.apsusc.2016.04.029 |
| [8] |
KITANO M, MATSUOKA M, UESHIMA M, et al. Recent developments in titanium oxide-based photocatalysts[J]. Applied Catalysis A:General, 2007, 325(1): 1. DOI:10.1016/j.apcata.2007.03.013 |
| [9] |
KUMAR S G, RAO K S R K. Comparison of modification strategies towards enhanced charge carrier separation and photocatalytic degradation activity of metal oxide semiconductors (TiO2, WO3 and ZnO)[J]. Applied Surface Science, 2017, 391: 124. DOI:10.1016/j.apsusc.2016.07.081 |
| [10] |
SHU Yajie, XU Yin, HUANG Haibao, et al. Catalytic oxidation of VOCs over Mn/TiO2/activated carbon under 185 nm VUV irradiation[J]. Chemosphere, 2018, 208: 550. DOI:10.1016/j.chemosphere.2018.06.011 |
| [11] |
LI Ming, LU Bin, KE Qinfei, et al. Synergetic effect between adsorption and photodegradation on nanostructured TiO2/activated carbon fiber felt porous composites for toluene removal[J]. Journal of Hazardous Materials, 2017, 333(5): 88. |
| [12] |
SU Huidong, MA Zheng, HU Tingting, et al. Sol-gel synthesis of TiO2/HZSM-5 composite photocatalyst on degradation of reactive brilliant red X3B[J]. Current Nanoscience, 2017, 13(3): 292. DOI:10.2174/1573413713666170201123624 |
| [13] |
YENER H B, YILMAZ M, DELIISMAILÖ, et al. Clinoptilolite supported rutile TiO2 composites:Synthesis, characterization, and photocatalytic activity on the degradation of terephthalic acid[J]. Separation and Purification Technology, 2017, 173: 17. DOI:10.1016/j.seppur.2016.09.010 |
| [14] |
XING Zipeng, ZHANG Jiaqi, CUI Jiayi, et al. Recent advances in floating TiO2-based photocatalysts for environmental application[J]. Applied Catalysis B:Environmental, 2018, 225: 452. DOI:10.1016/j.apcatb.2017.12.005 |
| [15] |
TIAN Fei, WU Zhansheng, YAN Yujun, et al. Synthesis of visible-light-responsive Cu and N-codoped AC/TiO2 photocatalyst through microwave irradiation[J]. Nanoscale Research Letters, 2016, 11(1): 292. DOI:10.1186/s11671-016-1503-9 |
| [16] |
ASAHI R, MORKAWA T, OHWAKI T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293(5528): 269. DOI:10.1126/science.1061051 |
| [17] |
KHAN S U M, AL-SHAHRY M, INGLER W B Jr. Efficient photochemical water splitting by a chemically modified N-TiO2[J]. Science, 2002, 297(5590): 2243. DOI:10.1126/science.1075035 |
| [18] |
QIU Bocheng, ZHONG Chengchao, XING Mingyang, et al. Facile preparation of C-modified TiO2 supported on MCF for high visible-light-driven photocatalysis[J]. RSC Advances, 2015, 5(23): 17802. DOI:10.1039/C4RA17151A |
| [19] |
DU Yansheng, DESKINS N A, ZHANG Zhongfu, et al. Two pathways for water interaction with oxygen adatoms on TiO2(110)[J]. Physical Review Letters, 2009, 102(9): 96. DOI:10.1103/PhysRevC.80.044323 |
 2020, Vol. 52
2020, Vol. 52


