2. 低碳绿色建筑国际联合研究中心(重庆大学),重庆 400045
2. Low Carbon Building International Joint Research Center (Chongqing University), Chongqing 400045, China
生物膜广泛存在于自然环境中,当载体表面含有少量的水分和营养物质就能被微生物定植并形成生物膜[1],因其具有良好的水处理能力而被广泛地应用于水处理反应器中。生物膜的理化性质包含其生物量、厚度、密度和其胞外聚合物(EPS)的组成成分等,这些性质与生物膜的附着能力、传质效率和细胞活性密切相关[2-3],因而影响了生物膜反应器的处理效果。在实际自然环境中,水体大多处于紊流状态,紊流对生物膜特性的影响是紊流时均流速、脉动流速和水流剪切力等共同作用的结果。已有研究表明,时均流速和水流剪切力对生物膜的理化性质有显著影响[4],而仅针对紊流脉动对其理化性质影响的研究鲜见报道。研究紊流脉动对生物膜理化性质的影响,可为生物膜反应器的设计与运行优化提供理论参考。
在通常的紊流中,均存在时均流速和脉动流速,两者相互影响、相互耦合,其间的关系极为复杂,难以区分各自的作用。振动格栅装置产生的紊流能在距离格栅一定的区域内形成时均流速为零的近似各向同性的紊流,并且通过改变格栅的运行参数(如格栅几何尺寸、振动冲程和频率等)可方便地调控紊流脉动流速和有效紊流强度,因此,借助其研究紊流脉动是一种有效的方法[5]。在过去50年里采用振动格栅形成的紊流已被广泛用于研究工程中许多与紊流脉动相关的问题[6]。基于此,设计了振动格栅生物膜反应器,利用粒子图像测速(PIV)技术对反应器紊流场进行测定,并将生物膜载片放置于近似各向同性紊流区域内,通过改变格栅的振动频率,研究紊流脉动对生物膜理化性质的影响。
1 实验 1.1 振动格栅生物膜反应器振动格栅生物膜反应器和格栅示意见图 1。该反应器分为主水箱和副水箱两个部分。主水箱是生成格栅紊流和附着生物膜的场所,副水箱的设置是为了减少微孔曝气对格栅紊流流场的影响。

|
图 1 振动格栅生物膜反应器和格栅示意(mm) Fig. 1 Schematic of oscillating-grid biofilm reactor and grids (mm) |
主水箱尺寸为310 mm×310 mm×500 mm,有效容积约为48 L。格栅栅条宽度和厚度为10 mm,栅孔宽50 mm,相邻两孔中心距M=60 mm,经计算格栅孔隙率为0.67(>0.60),因此,可以产生均匀稳定的紊流[7];格栅冲程S为50 mm,其振动中心距反应器底部390 mm。聚乙烯生物膜载片尺寸为30 mm×30 mm×10 mm,将载片固定且其中心距格栅振动中心165 mm>2M,因此,载片处于近似各向同性紊流区域内[8]。
副水箱尺寸为210 mm×210 mm×500 mm,有效容积约为20 L。副水箱中的污水曝气后经水箱上部的潜水泵和下部的水管实现与主水箱的水循环,循环周期为20 min。
振动格栅生物膜反应器重要部件如下:微孔曝气头,D=10 cm;曝气泵,Q=27 L/min;水泵,Q=300 L/h,2 W;电机,120 W,1 300 r/min。
1.2 实验用水所用污水为人工配置,加入葡萄糖、淀粉作为碳源,加入氯化铵作为氮源,并加入磷酸二氢钾、蛋白胨、硫酸铁、氯化钙、钼酸钠、硫酸锌、硫酸镁、氯化钴、硫酸锰为微生物提供生命所需微量元素。污水COD为200 mg/L,pH为6.8~7.8。
1.3 接种挂膜接种污泥来自重庆鸡冠石污水处理厂二沉池,为避免污泥沉降对接种产生影响,采用污泥沉降后的上清液进行接种。向反应器加入2 L污泥上清液并注入人工模拟污水,调节格栅振动频率,启动反应器,开始接种挂膜,接种时间为24 h。
1.4 实验方案首先利用PIV技术对该反应器的流场进行测量,格栅振动频率分别为0、0.5、1.0、1.5和2.0 Hz。接着进行生物膜培养实验,一个振动频率为一组实验,每组实验同时运行3个振动格栅生物膜反应器,反应器在接种挂膜24 h后运行10 d,5组实验共运行55 d,所有实验所处运行环境相同,水温由恒温控制器控制在26 ℃左右。每组实验结束后,将3个反应器中的生物膜载片取出,并将生物膜与载片分离,进行其生物量、厚度、密度和EPS组成成分的测定。
实验采用间歇进水模式,每天进水两次,每次进水量为主副水箱总有效容积的1/3,同时,为维持反应器中的营养状况,每3 d将两水箱完全排空,清洗两水箱后重新进水。
1.5 测定方法振动格栅生物膜反应器紊流流场采用PIV技术测定,PIV系统的CCD高速相机在1 min内拍摄600张示踪粒子运行轨迹照片,经过系统图像处理软件对所得照片进行一系列的处理,最终得到反应器二维流速场[9]。
生物量由干质量(mD)表示,采用超声法将生物膜与载片分离,分离后将其置于105 ℃烘箱烘至恒质量,烘干前后的质量相减所得值即为生物膜干质量;生物膜厚度(h)采用图像分析结构法测定[10],使用单反相机采集生物膜载片侧面图像,再用ImageJ软件测量厚度;根据载片尺寸(A=30×30 mm2)、生物膜干质量和厚度,通过式(1)即可计算生物膜密度:
| $ \rho = \frac{{{m_{\rm{D}}}}}{{A \cdot h}} $ | (1) |
EPS的提取方法是在文献[11]的基础上进行了适当修改,手工刮取生物膜于50 mL离心管中,用70 ℃ 0.05%NaCl溶液定容至50 mL,振荡1 min并离心10 min后,收集的上清液即为LB-EPS。再向离心管中加入NaCl溶液,并定容至50 mL,振荡离心管1 min后,将其60 ℃水浴30 min,水浴后再离心15 min所得上清液即为TB-EPS。提取所得的EPS均冷冻保存,以备EPS组分测定。EPS中蛋白质、多糖和DNA质量分数分别通过考马斯亮蓝显色(Bradford)法[12]、硫酸蒽酮法[13]和二苯胺试剂法[14]测定。
2 结果与讨论 2.1 反应器二维流速场和载片处有效紊流强度PIV系统测得反应器在不同振动频率下的二维流速场,通过Tecplot360软件对其进行可视化处理后得到瞬时流速场分布,如图 2所示。可以看出,紊流脉动流速随频率的增加而增大。
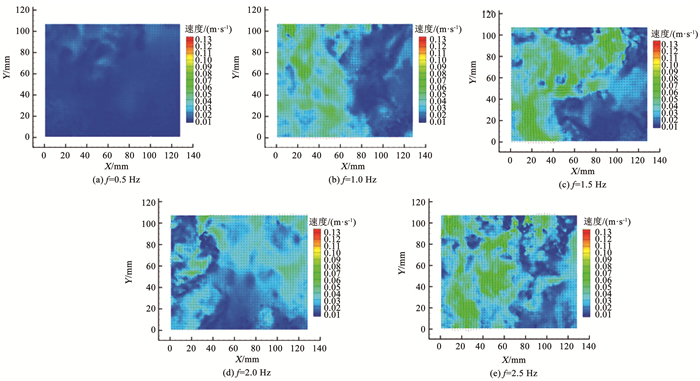
|
图 2 不同格栅频率下的瞬时流速场 Fig. 2 Instantaneous velocity field under different oscillating-grid frequencies |
由所测得的瞬时流速计算生物膜载片处两方向上脉动流速的均方根比(u/v),结果见图 3。不同振动频率下,载片所处范围的u/v为0.71~0.80,因此,载片位于近似各向同性紊流区域内[15]。
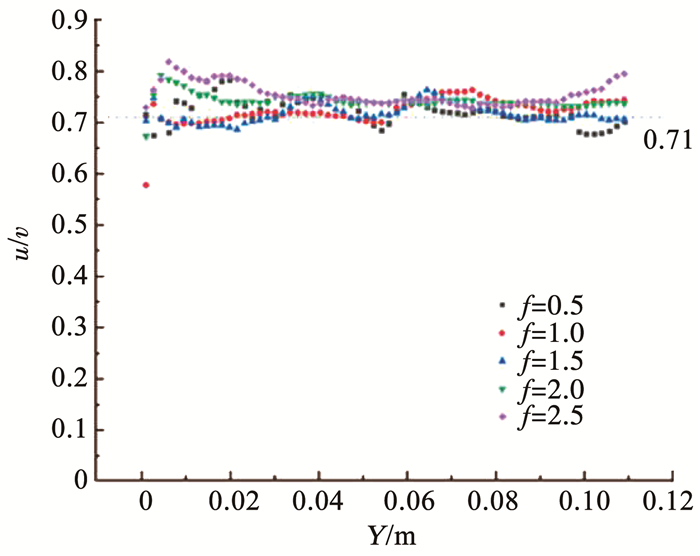
|
图 3 不同振动频率下的两方向均方根流速比(u/v) Fig. 3 Root mean square flow ratio in two directions under different oscillating-grid frequencies (u/v) |
Shy等[16]定义某一水平高度的有效紊流强度为
| $ q = \sqrt {\frac{1}{N}\sum\limits_{i = 1}^N {\left( {\frac{{u_i^{\prime 2} + v_i^{\prime 2} + w_i^{\prime 2}}}{3}} \right)} } $ | (2) |
式中:u′i、v′i和w′i分别为某一水平高度第i个测点的均方根速度的3个分量。根据紊流脉动瞬时流速和生物膜载片所处位置,即可计算不同振动频率下载片处的平均有效紊流强度,结果见表 1。
| 表 1 不同振动频率下载片处的平均有效紊流强度 Tab. 1 Average effective turbulent intensities at carriers under different oscillating-grid frequencies |
在不同紊流强度下,单片载片上的生物膜生物量见图 4。随着紊流脉动的增强,干质量先增大后减小。当紊流强度为0 cm/s时,生物膜干质量最小,为(2.7±0.1) mg,当紊流强度分别为0.56、1.45和1.92 cm/s时,生物膜干质量逐步增大至(3.7±0.3)、(12.01±0.98)和(18.29±0.8)mg,但当紊流强度进一步增大至2.54 cm/s时,生物膜干质量减小为(14.75±0.78)mg。生物膜传质分为外传质和内传质,水动力条件可以影响生物膜的外传质,在一定范围内,紊流脉动增强可以减少生物膜流动边界层和浓度边界层的厚度,减小膜外传质阻力,增加污水中营养物质和氧气的传质速率[17],从而促进微生物的生长,生物膜生物量增加。但是当紊流脉动继续增强,各向同性紊流在固体边界产生的水流剪切力也会增强[18],生物膜为抵抗高强度的水流剪切力而变得更致密[19],传质阻力增大,微生物生长速率降低,同时水流剪切力直接影响生物膜的脱落[20],因而在水流剪切力的作用下,部分生物膜从载片上脱落,当脱落的速率大于微生物生长速率时,载片上的生物量便减少。
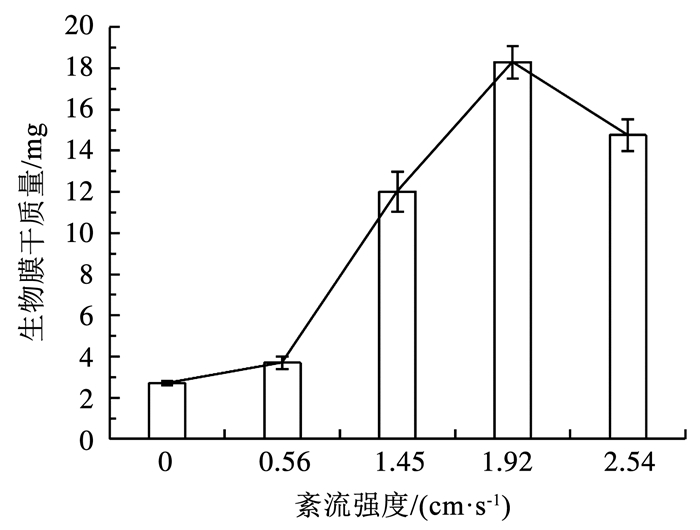
|
图 4 不同紊流强度下生物膜的生物量变化 Fig. 4 Changes in biofilm biomass under different turbulent intensities |
生物膜反应器中,在一定范围内生物膜生物量越多,反应器的处理效果越好,但是生物量过高,生物膜活性不一定高,污染物去除率也不一定高[21]。叶星等[22]用实验证明,随生物膜生物量的增大,反硝化生物滤池对总氮和硝酸盐的去除率先增大后减小。另外在生物滤池中生物量过大时,会影响滤池的过水通道,出水水质也会变差[23]。因此,通过改变紊流脉动强度使生物膜反应器内保持合适的生物量,可以使反应器维持良好的处理能力。
2.3 紊流脉动对生物膜厚度的影响在不同紊流强度下,生物膜厚度的变化如图 5所示。生物膜厚度同生物量的增减规律相似,随着紊流脉动的增强,厚度先增大后减小。格栅静止不动时生物膜最薄,厚度为(0.43±0.02)mm,当紊流强度分别为0.56、1.45和1.92 cm/s时,生物膜厚度逐步增大至(0.63±0.03)、(0.73±0.05)和(0.95± 0.06)mm,当紊流强度进一步增大至2.54 cm/s时,厚度减小为(0.51±0.02)mm。在一定范围内,紊流脉动增强,生物膜边界层变薄,传质阻力降低,传质速率加快,生物膜生物量增加,其厚度也增加;生物膜结构具有异质性和层次性,分为表层、基底层和中间层,表层生物膜很脆弱,易于从载体上脱落下来[24],因此,当紊流脉动过强时,表层生物膜会被固体边界的剪切力冲刷并与载片分离,厚度减小。

|
图 5 不同紊流强度下生物膜的厚度变化 Fig. 5 Changes in biofilm thickness under different turbulent intensities |
王荣昌等[25]发现,膜曝气生物膜反应器的氨氮表面去除率随着生物膜厚度先增大后减小。Celmer等[3]采用中空纤维膜生物膜反应器进行实验,结果显示,生物膜厚度越大,反应器的反硝化速率越小。因此,生物膜反应器中的紊流脉动强度可影响生物膜的厚度,进而影响反应器的处理效果。
2.4 紊流脉动对生物膜密度的影响在不同紊流强度下,生物膜密度的变化如图 6所示。当紊流强度为0和0.56 cm/s时,生物膜密度分别为(6.98±0.1)和(6.53±0.2)μg/mm3,几乎没有变化,当紊流强度进一步增大为1.45、1.92和2.54 cm/s时,生物膜密度也随之增大,分别为(18.28±0.3)、(21.39±0.37)和(32.14±0.5)μg/mm3。由此可知,当紊流脉动增强时,生物膜会变得更致密,来抵抗载体边界产生的水流剪切力,避免从载体上脱落,该结果与Beyenal等[19]的研究结果一致。

|
图 6 不同紊流强度下生物膜密度的变化 Fig. 6 Changes in biofilm density under different turbulent intensities |
Celmer等[26]认为生物膜密度是底物扩散的决定性因素,生物膜密度过大,会影响底物扩散至生物膜,从而影响生物膜反应器的处理效果。因此,控制好紊流脉动和生物膜密度,有利于保持生物膜反应器良好的处理效果。
2.5 紊流脉动对生物膜EPS组分的影响EPS提取过程中的各项操作可能破坏微生物细胞,内源物质就会进入上清液,对EPS组分的测量产生干扰。为考察本次提取是否可靠,测量了EPS中DNA质量分数,结果见表 2。可以看出,DNA质量分数大部分小于10 %,细胞破碎程度在可接受范围内。
| 表 2 不同振动频率下生物膜EPS中DNA质量分数 Tab. 2 DNA content in biofilm EPS under different oscillating-grid frequencies |
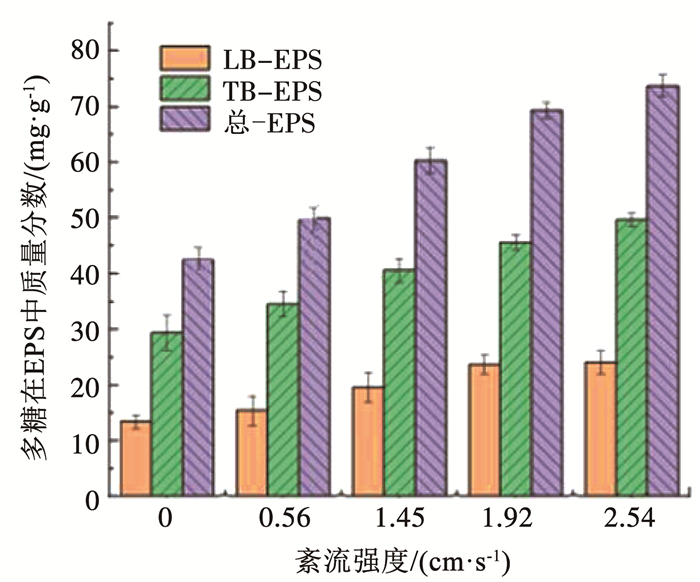
在5个紊流强度下,生物膜EPS中蛋白质和多糖质量分数见图 7、8。蛋白质和多糖在EPS中的质量分数随着紊流强度的增大而增加,且该两种物质在紧密结合型EPS(TB-EPS)中比在松散结合型EPS(LB-EPS)中多,由此可见紊流脉动的增强可以促进生物膜分泌EPS,尤其促进TB-EPS的分泌,TB-EPS质量分数的增多有利于生物膜附着在载片上而不脱落。蛋白质和多糖是EPS的重要组成部分,影响着生物膜与载片的结合,蛋白质由于其氨基酸和官能团而具有很强的疏水性[27],同时多糖含有氢键,可形成高含水凝聚胶,使EPS具有更强的凝聚力,生物膜的结构更加稳定,因此,蛋白质和多糖质量分数的增加,有利于生物膜抵御紊流脉动的增强。
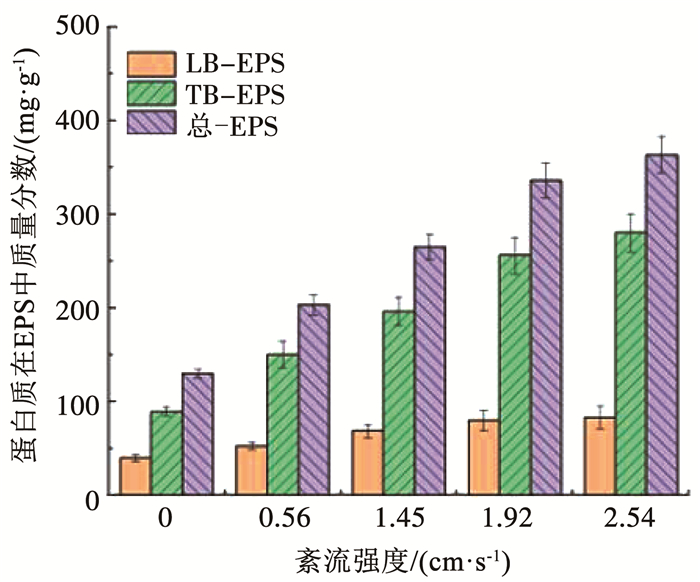
|
图 7 不同紊流强度下生物膜EPS中蛋白质质量分数 Fig. 7 Protein content in biofilm EPS under different turbulent intensities |
|
图 8 不同紊流强度下生物膜EPS中多糖质量分数 Fig. 8 Carbohydrates content in biofilm EPS under different turbulent intensities |
王荣昌等[25]在实验的后期发现,胞外多糖和TB-EPS的分泌增多,会导致氧传质阻力增加,从而导致氧通量降低,反应器的去除效率降低。因此,紊流脉动会影响生物膜EPS的组分和质量分数,进而影响生物膜反应器的处理效果。
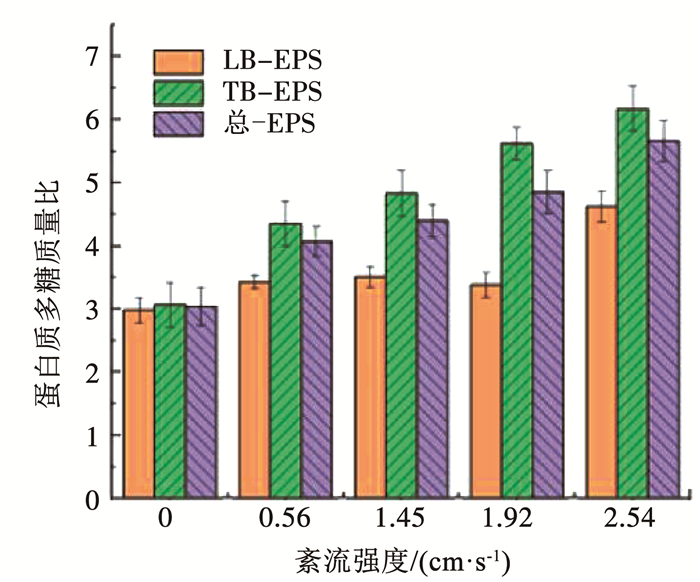
在不同紊流强度下,生物膜EPS中蛋白质与多糖的比值如图 9所示。无论在LB-EPS、TB-EPS还是总-EPS中,蛋白质多糖质量比均大于1,即蛋白质质量分数均大于多糖。蛋白质提供生物膜大部分的结合位点[28],另外,蛋白质与多糖的质量分数与生物膜的密度有关,密度大的生物膜蛋白质多糖比更高,生物膜也更稳定[3]。同时,EPS中还含有大量的胞外蛋白酶,以维持微生物的生长代谢活动。
|
图 9 不同紊流强度下生物膜EPS中蛋白质多糖质量比 Fig. 9 Ratio of protein to carbohydrates content in biofilm EPS under different turbulent intensities |
1) 紊流脉动速度随着格栅振动频率的增加而增大;生物膜载片处两方向上脉动流速的均方根比(u/v)为0.71 ~ 0.80,载片处于各向同性紊流区域内;在0、0.5、1.0、1.5和2.0 Hz 5种频率下载片处的有效紊流强度分别为0、0.56、1.45、1.92和2.54 cm/s。
2) 随着紊流脉动的增强,传质速率加快,生物膜生物量和厚度先增大后减小。当有效紊流强度为1.92 cm/s时,生物量和厚度在5个频率下达到最大,分别为(18.29±0.8)mg和(0.95±0.06)mm。
3) 当有效紊流强度为0和0.56 cm/s时,生物膜密度变化不大,而后密度随着紊流脉动的增强而增大,生物膜变得越来越致密,从而更好地抵御水流剪切力。当有效紊流强度增加到2.54 cm/s时,生物膜密度达(32.14±0.5)μg/mm3。
4) 紊流脉动的增强可以促进EPS的分泌,EPS中蛋白质和多糖的质量分数随着紊流脉动的增强而增大,且在TB-EPS中该两种物质多于LB-EPS中。同时,无论在何种形式的EPS中,蛋白质多糖质量比大于1,即蛋白质的质量分数均大于多糖。
| [1] |
WILKING J N, ANGELINI T E, SEMINARA A, et al. Biofilms as complex fluids[J]. MRS Bulletin, 2011, 36(5): 385. DOI:10.1557/mrs.2011.71 |
| [2] |
PECHAUD Y, MARCATO-ROMAIN C E, GIRBAL-NEUHAUSER E, et al. Combining hydrodynamic and enzymatic treatments to improve multi-species thick biofilm removal[J]. Chemical Engineering Science, 2012, 80: 109. DOI:10.1016/j.ces.2012.06.014 |
| [3] |
CELMER D, OLESZKIEWICZ J A, CICEK N. Impact of shear force on the biofilm structure and performance of a membrane biofilm reactor for tertiary hydrogen-driven denitrification of municipal wastewater[J]. Water Research, 2008, 42(12): 3057. DOI:10.1016/j.watres.2008.02.031 |
| [4] |
罗志逢. 供水管道生物膜生长的影响因素与控制方法研究[D]. 杭州: 浙江大学, 2016 LUO Zhifeng. Influencing factors and control methods of biofilm growth in water supply pipeline[D]. Hangzhou: Zhejiang University, 2016 |
| [5] |
MCCORQUODALE M W, MUNRO R J. A method for reducing mean flow in oscillating-grid turbulence[J]. Experiments in Fluids, 2018, 59(12): 182. DOI:10.1007/s00348-018-2636-7 |
| [6] |
YAN Jing, CHENG Niansheng, TANG Hongwu, et al. Oscillating-grid turbulence and its applications: a review/Turbulence de grille oscillante et ses applications: une revue[J]. Journal of Hydraulic Research, 2007, 45(1): 26. DOI:10.1080/00221686.2007.9521740 |
| [7] |
闫静, 唐洪武, 程年生, 等. 振动格栅紊流及其应用综述[J]. 水利学报, 2005(12): 1503. YAN Jing, TANG Hongwu, CHENG Niansheng, et al. Review on study of vibrating grid turbulence and its application[J]. Journal of Hydraulic Engineering, 2005(12): 1503. DOI:10.3321/j.issn:0559-9350.2005.12.018 |
| [8] |
ORLINS J J, GULLIVER J S. Turbulence quantification and sediment resuspension in an oscillating grid chamber[J]. Experiments in Fluids, 2003, 34(6): 662. DOI:10.1007/s00348-003-0595-z |
| [9] |
CAO Xiaodong, LIU Junjie, JIANG Nan, et al. Particle image velocimetry measurement of indoor airflow field: a review of the technologies and applications[J]. Energy and Buildings, 2014, 69: 367. DOI:10.1016/j.enbuild.2013.11.012 |
| [10] |
赵智颖, 李良秋, 马连营, 等. 生物膜定量分析方法研究进展[J]. 生物技术进展, 2016, 6(5): 319. ZHAO Zhiying, LI Liangqiu, MA Lianying, et al. Review on the quantification analysis methods of biofilm[J]. Current Biotechnology, 2016, 6(5): 319. DOI:10.3969/j.issn.2095-2341.2016.05.03 |
| [11] |
LI X Y, YANG S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge[J]. Water Research, 2007, 41(5): 1022. DOI:10.1016/j.watres.2006.06.037 |
| [12] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248. DOI:10.1016/0003-2697(76)90527-3 |
| [13] |
GAUDY A F. Colorimetric determination of protein and carbohydrate[J]. Ind Water Wastes, 1962, 7: 17. |
| [14] |
BROWN M J, LESTER J N. Comparison of bacterial extracellular polymer extraction methods[J]. Applied and Environmental Microbiology, 1980, 40(2): 179. DOI:10.1128/AEM.40.2.179-185.1980 |
| [15] |
DE SILVA I P D, FERNANDO H J S. Oscillating grids as a source of nearly isotropic turbulence[J]. Physics of Fluids, 1994, 6(7): 2455. DOI:10.1063/1.868193 |
| [16] |
SHY S S, TANG C Y, FANN S Y. A nearly isotropic turbulence generated by a pair of vibrating grids[J]. Experimental Thermal and Fluid Science, 1997, 14(3): 251. DOI:10.1016/S0894-1777(96)00111-2 |
| [17] |
李宇. 内环流生物膜反应器传质过程模拟及实验研究[D]. 大连: 大连理工大学, 2007 LI Yu. A simulation and experiment study on process of mass transport in internal loop biofilm reactor[D]. Dalian: Dalian University of Technology, 2007 |
| [18] |
MCCORQUODALE M W, MUNRO R J. Experimental study of oscillating-grid turbulence interacting with a solid boundary[J]. Journal of Fluid Mechanics, 2017, 813: 768. DOI:10.1017/jfm.2016.843 |
| [19] |
BEYENAL H, LEWANDOWSKI Z. Internal and external mass transfer in biofilms grown at various flow velocities[J]. Biotechnology Progress, 2002, 18(1): 55. DOI:10.1021/bp010129s |
| [20] |
KIM J W, CHOI H, PACHEPSKY Y A. Biofilm morphology as related to the porous media clogging[J]. Water Research, 2010, 44(4): 1193. DOI:10.1016/j.watres.2009.05.049 |
| [21] |
MOLL D M, SUMMERS R S, FONSECA A C, et al. Impact of temperature on drinking water biofilter performance and microbial community structure[J]. Environmental Science & Technology, 1999, 33(14): 2377. DOI:10.1021/es9900757 |
| [22] |
叶星, 马凯迪, 黄俊生, 等. 反硝化生物滤池中生物膜量与脱氮效果和脱氢酶活性的关系[J]. 环境工程学报, 2020, 14(5): 1210. YE Xing, MA Kaidi, HUANG Junsheng, et al. Relationship between biofilm mass and nitrogen removal efficiency, dehydrogenase activity in the denitrification biological filter[J]. Chinese Journal of Environmental Engineering, 2020, 14(5): 1210. DOI:10.12030/j.cjee.201907157 |
| [23] |
张宝杰, 闫立龙, 甄捷, 等. 曝气生物滤池最佳反冲洗周期及反冲洗方式研究[J]. 哈尔滨工业大学学报, 2006, 38(7): 1045. ZHANG Baojie, YAN Lilong, ZHEN Jie, et al. Research on the optimum backwashed cycle and the backwashed methods of the biological aerated filtrated reactor[J]. Journal of Harbin Institute of Technology, 2006, 38(7): 1045. DOI:10.3321/j.issn:0367-6234.2006.07.009 |
| [24] |
COUFORT C, DERLON N, OCHOA-CHAVES J, et al. Cohesion and detachment in biofilm systems for different electron acceptor and donors[J]. Water Science and Technology, 2007, 55(8/9): 421. DOI:10.2166/wst.2007.286 |
| [25] |
王荣昌, 肖帆, 赵建夫. 生物膜厚度对膜曝气生物膜反应器硝化性能的影响[J]. 高校化学工程学报, 2015, 29(1): 151. WANG Rongchang, XIAO Fan, ZHAO Jianfu. Effects of biofilm thickness on nitrification performance of membrane-aerated biofilm reactors[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(1): 151. DOI:10.3969/j.issn.1003-9015.2015.01.023 |
| [26] |
CELMER D, OLESZKIEWICZ J, CICEK N, et al. Hydrogen limitation: a method for controlling the performance of membrane biofilm reactor for autotrophic denitrification of wastewater[J]. Water Science and Technology, 2006, 54(9): 165. DOI:10.2166/wst.2006.704 |
| [27] |
HOU Xiaolin, LIU Sitong, ZHANG Zuotao. Role of extracellular polymeric substance in determining the high aggregation ability of anammox sludge[J]. Water Research, 2015, 75: 51. DOI:10.1016/j.watres.2015.02.031 |
| [28] |
HOUGHTON J I, QUARMBY J. Biopolymers in wastewater treatment[J]. Current Opinion in Biotechnology, 1999, 10(3): 259. DOI:10.1016/S0958-1669(99)80045-7 |
 2021, Vol. 53
2021, Vol. 53



