2. 特种化学电源国家重点实验室,贵州 遵义 563003
2. State Key Laboratory of Advanced Chemical Power Sources, Zunyi 563003, Guizhou, China
随着全球能源的消耗,电能作为一种可循环清洁能源受到越来越多的关注[1-2],在众多化学电源中,锂离子电池因其高电压、高能量密度和优异循环性能成功实现了商业化,目前大量应用于电动车以及电脑、通讯、消费电子领域[3-4],如何提高电池的性能以及安全性成为亟待解决的问题[5-6],电解液作为锂离子电池的重要组成部分,承载着正负极之间锂离子的传输以及提供正负极电化学反应物的重要任务,其性能直接影响着电池电化学性能和安全性,寻找实现电池高容量、高安全、长循环寿命的电解质体系是研究热点.锂盐作为电解质体系中提供锂离子来源的核心而备受研究者和生产商的关注.
目前商用较多的锂盐LiPF6循环性能较好,容量保持率较高,但这类电解液易挥发,热稳定性差,遇水易分解,安全事故频发,单纯使用LiPF6已无法满足现有高性能锂离子电池的需求.因此,设计开发新型电解质体系成为了研究热点.
近年来出现许多新型锂盐:四氟硼酸锂(LiBF4)、双草酸硼酸锂(LiBOB)、二氟草酸硼酸锂(LiDFOB)、双(氟磺酰)亚胺锂(LiFSI)、双(三氟甲磺酰)亚胺锂(LiTFSI)等[7-8],均展现出了巨大应用前景,然而单一锂盐存在不同缺陷,阻碍其商业化应用,而将不同锂盐组合,利用彼此的协同效应[9],产生了不同效果,构成混合盐体系具有单盐体系所不具备的能力,能够明显提升电池电化学性能.本文将对于混合盐体系对界面的作用进行讨论,探究未来混合盐体系的发展方向.
1 混合体系中单盐的性质用于组成混合盐的单盐种类较多,常用的新型锂盐主要是硼酸盐电解质、氟代磺酰亚胺盐电解质.
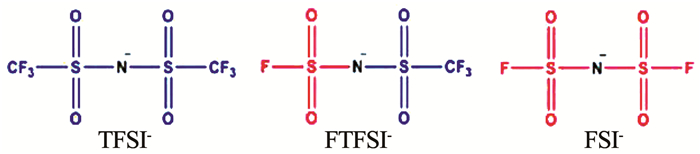
硼酸锂盐由于其出色的热稳定性、可观的离子电导率、成本低、环境友好以及可以形成良好的固体电解质界面而引起了广泛的关注.非芳香硼酸盐的结构式见图 1[10],其中LiBF4、LiBOB、LiDFOB与锂离子电池具有良好的相容性以及协同效应,LiBF4相比于LiPF6易溶于碳酸酯溶剂,低温下电荷传递阻抗较低,可以提高电解液的溶解度以及电导率[11].
然而BF4-与Li+配位后稳定,导致LiBF4具有低电导率与弱阳离子溶解性[12],容量低于同等水平LiPF6电池[13].LiBOB的作用不同于LiPF6,可以直接参与电极/电解质界面膜的形成,尤其是负极表面致密的SEI膜,有效地抑制了溶剂的嵌入与石墨的剥离,即使在高温下容量也无明显衰减[14].但是界面膜的致密性增加负极的阻抗,严重影响锂离子电池的倍率性能.LiDFOB与LiBOB、LiBF4结构十分相似(见图 1),该盐兼具两者的优点,热稳定性好,能够有效抑制Al基体的腐蚀,并且能够在石墨电极表面形成稳定的界面膜[15],然而其电导率较低,不适合单独作为电解质.
图 2[16]展示了几种氟代磺酰亚胺盐的结构,其以N为中心,—F与—CF3具有很强的吸电性,减弱了阴阳离子之间的静电作用,由这种阴离子构成的锂盐具有优异的电化学性能,具有高的电导率与热稳定性[17].
LiFSI具有与LiPF6相当的电导率以及高的热稳定性,被认为是一种有望取代LiPF6的电解质.然而LiFSI对Al集流体具有很强的腐蚀作用阻碍了该盐的应用[18].LiTFSI具有高热稳定性[19]、对水不灵敏,在3.7 V易发生Al集流体的腐蚀[20],FTFSI-则是介于FSI和TFSI之间的一种阴离子,具有较低熔点,能够改善离子液体电解质的结晶问题[21].表 1展示了常见的不同添加盐的优势与存在的不足,可以看出利用单盐作为电解质存在着缺陷.
| 表 1 锂离子电池常见添加盐特征数据 Tab. 1 Data of commonly used additive salts for Li ion battery |
除上述锂盐之外,可用作混合盐电解质盐体系的盐的还有LiF[42]、LiNO3[43]、Li2S5[44]、LiTFPFB[40]、LiFAP[24]、BEPyTFSI[45]、LiFTFSI[16]、PFPDPP等[46].
以上的锂盐单独作为锂离子电池电解质表现出一定局限性,研究人员利用不同锂盐之间的协同作用,将混合盐作为电解质体系用于电池中表现出优于单盐的性能,在提高离子电导率,提升还原稳定性,形成优异界面膜,抑制Al基体腐蚀上都展现出了巨大的潜力.锂盐除了影响电解液自身电导率、离子迁移数外,还体现在对正负极界面状态的改变,而且电池中的电化学反应也发生在界面上,因此不同电解质溶液在不同电极体系的界面作用尤为重要.
2 混合盐体系对正负极界面的影响相比于单盐体系,混合盐体系由于加入第二种锂盐,其理化性质必然会在一定程度上改变,物理性质如溶液的电导率、锂离子溶解度、热力学稳定性、黏度等,采用不同的锂盐,与集流体反应能够生成不同的有机锂盐,影响腐蚀速率.电化学反应的初期,溶剂与电解质部分消耗形成界面层,而这种不溶性固体产物对电极具有钝化作用,使某些电极材料对电解液分解的催化活性失效,阻止了溶剂的持续反应[47].比如,锂金属电池界面中LiNxOy、Li2O特殊空间分布和非均匀晶界能有效调节锂沉积的均匀性[48].电池的循环寿命很大程度上取决于电极与电解质的界面,其影响着离子在电极和电解质之间的电荷传递作用,影响着电池的充放电过程中的电极电化学极化、不可逆容量损失和体积膨胀等[49].而通过调控电解质盐的成分可以改变界面膜的组成,因此混合盐电解质是解决界面问题的重要方法.
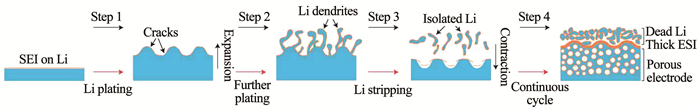
2.1 负极/电解质界面在充放电过程中,负极表面易沉积不均匀的锂金属而导致电池性能下降.如图 3所示[50],通常锂在缺陷位容易沉积,长此以往就产生了枝晶状的锂,而放电后部分锂会断开与电极的连接,成为死锂,无法参与电化学过程,导致电极厚度增加,影响电池的库伦效率,在充放电过程中锂枝晶的生长甚至刺穿隔膜,影响电池安全性,这些问题限制着锂金属电池的发展[51].
锂的高效循环需要改善其沉积形貌,减少金属锂与电解质的反应[52],电极/电解质界面是由溶剂与电解质与电极共同作用形成,影响因素较多,通过改变电极表面的组成可以影响界面性质,比如运用辊压在锂表面覆盖氧化石墨[53]、从蛋壳天然膜中获得生物大分子基质对锂电极表面进行改性来控制锂的生长[54].调节电解液成分是对电极/电解液界面最直接简单的一种改进方法.
混合盐体系影响界面组成,例如常用的混合盐LiDFOB,与LiPF6混合[55]或加入离子液体LiTFSI-ILs/PC体系[56]后均有效提升了界面稳定性.对比循环后Li负极的XPS曲线[57],发现LiDFOB引入B-O的键能较低(210.7 kJ·mol-1),键断裂产生缺电子态的B,其能够与富电子态的集团结合例如RO-Li,形成类似于LiBOB情况下的交联致密SEI膜[58].此时加入LiTFSI降低RO-Li而提高了SEI膜中-(CH2-CH2-O)n-的数量,界面膜具有更致密的结构,从而对锂金属形成更好的保护.这是混合盐常见的一种界面作用机理,其在界面处还原产生的基团,进一步诱导发生其他反应形成致密界面层.值得一提的是,氟化电解质的分解可以形成LiF,对LiF在界面中的位置未有定论,近期Huang等[59]使用冷冻透射电子显微镜对SEI中LiF的位置进行了研究,发现LiF不存在致密的SEI中,而是直接沉积在负极表面.未来随着表征技术的进步对复杂界面的解析会越来越清晰.
混合盐体系影响界面阻抗,Xiang等[60]以LiTFSI0.6-LiBOB0.4/EC-EMC(体积比4:6)为电解质,与LiPF6/EC-EMC电解质相比,双盐体系相较于单盐极化较小,循环后LiPF6体系界面产生大量失活的锂,阻抗迅速增长,混盐体系循环后界面层电阻更加稳定,具有低于LiPF6的界面电阻,同时LiTFSI-LiBOB混盐电解质具有高离子电导率,保证Li+快速传输.
混合盐体系对界面阻抗影响的主要原因是对界面形貌的控制,Zheng等[61]发现在LiTFSI-LiBOB/EC+EMC混合体系中添加一定量的LiPF6(0.05 mol·L-1)对Li‖NMC电池的循环性能和倍率性能均有提升.通过对3种不同电解质体系以1.75 mA·cm-2下循环100次后的锂金属表面扫描电子显微镜(SEM)分析得到图 4.图 4(a)~(c)可以看出,单盐体系下的锂片经过循环产生大量裂缝,形成的SEI膜质量差,无法保护锂与电解质反应.双盐体系中锂片表面展现出完全不同的形貌,金属锂主要部分循环后得到保护,破坏深度约30~50 μm.LiBOB加入使金属表面生成纤维状枝晶(图 4(e)),电解液与锂电极反应形成更多副产物,加入微量LiPF6添加剂,这种情况得以改善(图 4(f)).
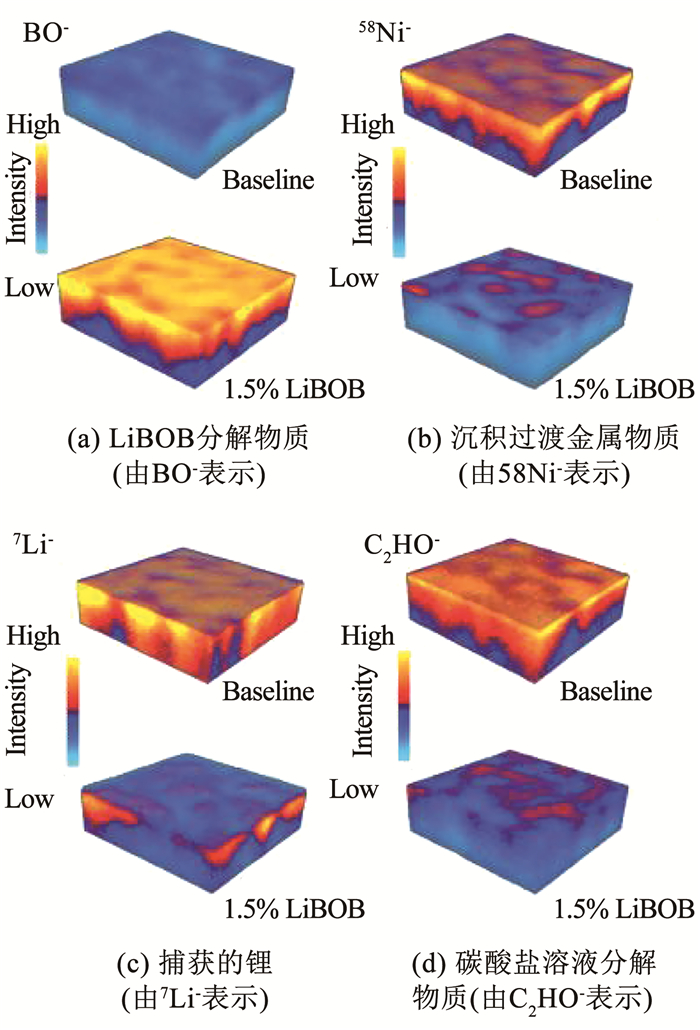
不仅锂金属负极,混合盐体系同样影响着石墨电极界面组成,Li等[37]向基础电解质中加入质量分数1.5%LiBOB组成混合盐体系,研究者对500次循环后的石墨电极的界面膜进行了飞行式二次离子质谱(TOF-SIMS)分析,结果见图 5,可以看出界面层中BO-含量增加,LiBOB在石墨表面分解,与此同时失效锂离子、溶剂分解产物均有所减少.因此混合盐体系能够有效地改变负极界面形貌,不论是锂金属还是石墨负极,不同的盐在电极表面的分解能够提供不同的基团和离子,根据要求选择不同锂盐达到不同的目的,如LiBF4工作温度区间宽,增强成膜能力; LiPF2O2低温性能好,能降低界面电阻; LiTFSI溶解度和电导率高; LiDFOB成膜性好,低温性好等.以一定的比例相互混合来达到最大的效果,促进形成致密的界面膜,从而阻止进一步的界面不良副反应.
|
图 5 500次循环后基础电解质与含有1.5%LiBOB添加的电解质的石墨电极的飞行式二次离子质谱[37] Fig. 5 3D distributions of TOF-SIMS sputtered volume collected on graphite anodes retrieved from 500-cycle full cells with baseline electrolyte and 1.5% LiBOB[37] |
对于正极,锂电池运行时通过对电解质设计使其分解包覆形成高兼容性以及机械性能良好的正极界面层,减少电解质在表面进一步分解.Liu等[41]通过LiPO2F2与LiPF6来提升Li‖NMC811电池的高压高倍率性能,LiPO2F2与基础电解质的混合将沉积电势由4.24 V提升至4.47 V,增加电势窗抑制电解液腐蚀,增加界面层的无机组成,前几个循环电池电化学阻抗高,随后Li+扩散阻力较单盐大大减小,双盐体系形成的稳定正极界面减少高电流下的不可逆容量损失.电解质中锂盐成分对于界面的作用,一方面源于锂盐溶解度、离子导电率等具有差异,另一方面由于不同锂盐所提供的阴离子与电极之间的反应产物不同.
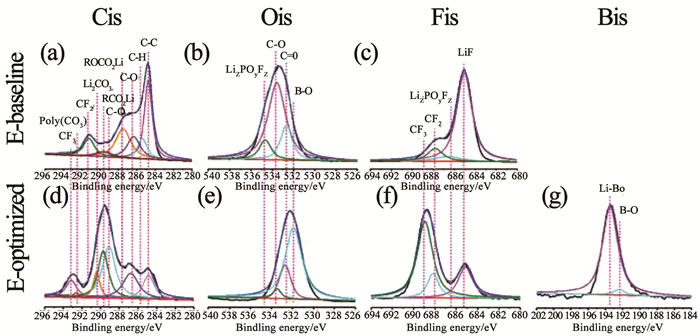
界面层组分不仅取决于锂盐,溶剂以及添加剂同样需要注意,界面的组成是电解质中各成分综合作用的结果.Zhao等[62]使用0.6 mol·L-1 LiTFSI+0.4 mol·L-1 LiBOB+0.05 mol·L-1 LiPF6 (EC:EMC, 体积比4:6)体系,对长循环后LiNi0.76Mn0.14Co0.10O2(NMC76)的界面层进行X射线光电子能谱分析,图 6(a)~(c)中的C=O、C-O、C-F2、大量C-C以及LiF来自于LiPF6分解,LiF(685 eV)峰表明LiPF6发生严重腐蚀,分解产生HF进攻阳极表面有大量阻碍Li+迁移的Li+/Ni2+混排以及无序岩盐相NiO生成,Li+传输动力下降以及容量衰减.混合盐体系(图 6(d)~(g))NMC76阳极表面C-C、C-O、LiF峰值均有所下降,更多聚碳酸酯被发现卷绕于NMC阳极上,适量LiPF6引发EC的聚合,这种结构能提高界面锂离子的传输能力以及整体稳定性.
|
图 6 使用基础电解液和优化电解液经过200个循环后,对NMC76正极进行XPS表征[62] Fig. 6 XPS characterization of harvested NMC76 cathodes after 200 cycles using baseline electrolyte and optimized electrolyte[62] |
混盐还能够一定程度改变正极材料表界面晶型结构,Lan等[63]向1 mol·L-1 LiPF6中添加15% LiBF4组成混盐电解质,1 C倍率下进行150次循环,对循环后的LNCM811锂离子电池正极进行了X射线衍射分析,I (003)/I (104)的比值增大,晶格的无序性减小,基础电解液循环后的界面结构无序性大于初始以及循环后的混合盐体系,加入质量分数15% LiBF4使阳极表面在经过循环后的结构更加接近初始值,畸变更小,利于提升电池的循环性能.
2.3 集流体的界面作用正负极材料涂覆或沉积在集流体上,正极通常使用铝箔而负极使用铜箔,铝作为标准的集流体材料,在对Li/Li+的高电位下会发生腐蚀,当电解质为酰亚胺盐时腐蚀尤为严重.Al的电化学腐蚀过程可以用以下公式表示:
| $ \begin{array}{c} \mathrm{Al} \rightarrow \mathrm{Al}^{3+}+3 \mathrm{e}^{-}, \end{array} $ | (1) |
| $ \mathrm{Al}^{3+}+\mathrm{X}^{-} \rightarrow \mathrm{AlX}_{(\mathrm{ads})}^{2+} / \mathrm{AlX}_{2(\mathrm{ads})}^{+} / \mathrm{AlX}_{3(\mathrm{ads})}. $ | (2) |
LiPF6电解液的分解产物与Al3+结合,能够在表面形成AlF3以及其他有机锂盐,抑制腐蚀.
混盐体系通过电解质间的协同作用,可改善集流体腐蚀问题,如Liu等[64]将LiODFB与高电导率的LiFSI混合,为观察混盐体系对集流体的作用,研究者对Li/Al半电池进行循环伏安测试,对比LiFSI+LiODFB-DME与LiFSI-DME两者的CV(循环伏安测试)图像,相较于单盐反应峰杂乱,混盐图像具有稳定的区间.对循环后的Al电极进行SEM表征得到图 7,无LiODFB时Al表面出现许多裂纹,发生严重腐蚀.混盐中的LiFSI保证电解液较高的电导率,添加LiODFB有效地抑制Al集流体的腐蚀,不同锂盐相互协同达到平衡来解决目标问题.
混盐体系的运用不仅能减轻对基体的腐蚀,还影响锂的沉积.Qiu等[65]使用LiTFSI-LiNO3-LiFSI三盐体系应用于锂金属电池,对锂沉积的Cu表面进行了表面形貌分析,通过图 8(a)可以看出,LiFSI加入后的锂在Cu表面产生肉眼可见的规则沉积层,具有明显的边缘.通过图 8(b)、(c)小电流下的表面SEM图可以看出LiFSI的加入使基体表面的沉积锂趋于平滑,颗粒较大,能够减少枝晶的产生.图 8(d)、(e)表明在大电流下锂的沉积同样均匀,这种形貌有利于循环中锂金属枝晶的控制.

|
图 8 Cu电极在不同锂沉积量的情况下表面图以及锂沉积在基体表面的形貌[65] Fig. 8 Optical images of Cu electrodes with different amounts of Li deposition and morphologies of Li deposition on substrate[65] |
上述大多为传统有机电解质,随着对于电池的要求越来越高,新型电解质应运而生,如水系电解质、聚合物电解质、全固态电解质等.高浓度盐电解质通过提高锂离子的浓度,弥补充电过程中锂离子损失带来的浓度不均,获得高倍率、高能量密度的充放电能力[66],根据离子溶剂化程度可将电解液分为“溶剂包盐”,“盐溶剂化”和“盐包溶剂”3种类型[67],浓电解液对锂离子的吸附有更好的稳定性[68].SEI膜的形成机理较传统电解液不同.Yamada等[69]发现含有高度离解的盐和低粘度溶剂的浓缩电解质可实现高倍率的电极反应,高浓度电介质中,阴离子首先还原,形成一类具有特殊三维(3D)溶液结构的新型电解液[70].与有机混盐不同,高浓度盐阴离子在溶液中形成分子簇使Li+在其中穿梭,能实现对于枝晶的抑制[71-72],常见的固态电解质盐包括Li7La3Zr2O12(LLZO)、Li10GeP2S12、Li0.5La0.5TiO3、NaZr2(PO4)3等[73].这种与传统电解质不同的体系同样有混盐的应用,例如Yu等[74]设计了一种多层聚合物电解质,LiTFSI提供导电锂盐,将Li1+xAlxTi2-x(PO4)3(LATP)粉末加入聚丙烯腈(PAN)与PEO-SN组成复合材料,两种材料均有一定弹性,在锂金属界面处有较高抗还原性,能够提高离子电导率并抑制锂枝晶.Zhang等[75]将Li6.75La3Zr1.75Ta0.25O12(LLZTO)粉末与一定比例的P(VDF-HFP)和LiTFSI加入NMP溶剂制成固体电解质,相较于PEO组成的聚合物电解质,LLZTO的陶瓷型电解质具有高离子迁移数和宽温度区间,LiTFSI能有效提高离子电导率,得到了更平整紧密的阴极NMC523表面形貌.Qiu等[76]制备了PAN-LLZTO-LiClO4-Mg(ClO4)2混合固态电解质,PAN热力学稳定,LLZTO保证电化学稳定性以及离子电导率,LiClO4是低成本的稳定锂盐,Mg(ClO4)2能够提升电池的质量比容量,促进Li+传导,参与SEI的形成.
不论传统电解质还是新型电解质,界面作为影响电池性能的关键点,由电解质在电极反应所形成.混盐使用对于界面的调控作用显著,例如改变界面元素组成、控制界面电阻、抑制枝晶生长,对负极、正极和集流体,都可通过混合锂盐配合溶剂生成一层稳定的界面膜从而提高循环性.除了界面的影响,新型锂盐还有其他优势,有时为解决特定问题对所需含量要求不高,以少量添加剂的身份加入,如加入少量LiDFOB就可以改善SEI膜的枝晶情况,有时又以一定的比例相互混合来达到最大的效果.不论含量多少,混合盐体系利用不同盐的特性解决已有问题,了解不同盐对于溶剂以及界面膜的响应有助于利用其不同的特性实现最优化的混合,提升锂电池的热力学性能以及电化学性能,具备高的实际应用价值.事实上,尽管混合电解质明显提升电池性能的文献较多,然而由于复杂组分的界面层通常在纳米级别,导致界面层精细结构分析困难,大多数的文献仅停留在组分表征,迫切需要新型表征手段在界面膜中的应用.
3 混合盐体系的应用界面作为电极与电解质之间传导离子的媒介,不论是锂离子电池、锂金属电池或者其他电池的电化学性能, 都受制于界面的性能,混合盐电解质因能够影响界面组成而广泛应用于不同种类的锂电池中.
3.1 锂离子电池(LIB)混合盐体系的应用石墨是锂离子电池最常用的负极材料,其平均电位较低(0.1 V vs. Li/Li+),不可逆容量小,同时具有高倍率、长循环寿命和优异电子导电性[77].对于传统的LiPF6电解质,研究者提出了许多通过混合盐电解质来改进的方法.
3.1.1 含有LiPF6的LIB混合盐体系在LiPF6中直接添加另一种锂盐来提升倍率性或循环性能等,Liu等[41]将LiPO2F2与LiPF6混合使用,抑制了电解液的氧化分解,减少了电极材料中过渡金属离子溶解与电解液的副反应,LiDFP的加入增加了表面层中F和P的含量,Al的质量分数从1.27%降低至0.41%,有效抑制了腐蚀,NCM811正极于混盐电解液中循环后保持着原本规则的球状形貌.Zhang等[55]使用LiODFB/LiPF6+(EC+PC+DMC)体系,其中, LiODFB表现出优秀的界面钝化作用,LiPF6保证了电解质的溶解性能,室温下LiODFB/LiPF6摩尔比为4:1时,经过100次循环电池容量仍可达到336.2 mAh.Wang等[78]同样在LiCoO2/石墨锂离子电池中使用LiODFB/LiPF6混合盐电解质,摩尔比为2:3,室温下以0.1 C循环80次,具备148 mAh·g-1的比容量,混盐在碳酸甘油酯中展现了更好的循环性.Zhang等[25]向1.0 mol·L-1 LiPF6/EC/EMC中加入0.2 mol·L-1 LiFSI和0.2 mol·L-1LiBOB组成混合盐,FSI-离子对Al的腐蚀作用被BOB-离子所抑制,其在LiFePO4全电池中以1 C倍率放电,200次循环后容量保持率达84.3%.
3.1.2 不含LiPF6的LIB混合盐体系对于无LiPF6的新型锂盐混合体系, 重要的是找到能够替代的稳定锂盐.Li等[79]调整混合盐体系中LiTFSIx-LiODFB(1-x)的x值,使LiODFB比例增加电导下降,但对Al集流体的保护作用增强,最终得到一种高电压工作电解质.x=5时循环100次的容量保持率达到74.4%,同条件下的LiPF6容量保持率仅为42.0%.Liang等[80]向LiTFSI-DMC中加入PP13DFOB-20,通过PP13DFOB优先氧化作用在LiNi0.5Mn1.5O4 (LNMO)电极表面得到了低阻抗的SEI膜并有效地钝化了Al箔,0.5 C下循环100次的, Li/LNMO与Li/石墨电池容量分别达到了121.2 mAh·g-1与369.2 mAh·g-1.Zaghib等[81]向2032扣式电池电解质1 mol·L-1 LiBF4+EC +GBL中加入0.5 mol·L-1 LiTFSI,电池的工作温度可达60 ℃,30 C以上的高倍率性能远高于普通LiPF6电解质.
3.2 锂金属电池(LMB)混合盐体系的应用锂金属作为负极拥有很高的理论比容量(3 860 mAh·g-1),极低的电化学电势(-3.04 V vs. SHE)以及低的密度(0.534 g·cm-3),由于其高的能量密度,锂金属电池得到了人们的关注.
3.2.1 含有LiPF6的LMB混合盐体系锂金属相对于石墨更加活泼,循环中容易产生枝晶和死锂,Li等[82]将LiTFSI-LiBOB双盐与LiPF6+VC+FEC/EC-EMC(体积比7:3)混合,电解质与EC溶剂的开环聚合,形成了电导率更高、更稳定的锂金属表面层,提高了锂金属电池的循环寿命.在Li‖NMC扣式电池60 ℃下以2.0 mA·cm-2循环260次仍具有92.6%的容量保持率.Geng等[38]使用0.8 mol·L-1 LiTFSI-0.2 mol·L-1 LiDFOB-0.01 mol·L-1 LiPF6电解质, 相比于传统LiP电解质,Li金属表面循环后变化较小,Li/LiCoO2电池中实现了良好的高温性能,80 ℃下以1.2 mA·cm-2电流密度放电,100次循环后容量保持率高达90%.Tsurumaki等[83]向1 mol·L-1 LiPF6+EC-DEC-DMC中加入离子液体BOB-IL与DFOB-IL,当0.3 mol·L-1离子液体加入后,正负极上形成了稳定的SEI膜,Li/LiNi0.5Mn1.5O4电池比容量达到了120 mAh·g-1左右,100次循环后容量保持率达到了99.2%.
3.2.2 不含LiPF6的LMB混合盐体系Fu等[84]将LiTFSI-LiODFB混合盐与添加剂FEC引入SN溶剂,其与锂金属阳极具有良好的界面相容性,在金属表面自发形成了稳定的富含B-F键和LiF的SEI膜.Beyene等[85]提出Cu‖LiFePO4电池中应用的LiFSI/LiTFSI(摩尔比2:1)+DME/DOL混合盐电解质,在沉积的锂金属表面形成了一层稳定的、离子导电的、富含绝缘无机组分的界面层,抑制了沉积锂与电解质的副反应,使电池在100次循环后容量效率达到了98.9%.Alvarado等[30]在DME中结合高浓度的LiFSI与LiTFSI,提升NCM-622半电池以及无锂负极全电池(NMC622 vs. Cu)的稳定电势窗至4.4 V,LiFSI与LiTFSI提供F,在锂电极表面发生反应使之覆盖上多层LiF,这种高LiF的界面层使混合盐体系的容量衰减得到有效控制.Dong等[86]使用LiPO2F2+LiFSI/DME作为电解质,LiPO2F2的良好稳定性和LiFSI的高离子电导率使得Cu电极上形成均匀且无枝晶的SEI膜,所组装的Li/Cu电池在1 mA下循环300次仅有1 mAh的容量衰减.
3.3 其他电池电解质体系的应用除了上述两种常见的锂电池,混合盐体系也应用于其他电解质体系, 如固态电解质以及锂硫电池的电解质.
3.3.1 固态电解质电池使用固体电解质的全固态锂电池被认为是新一代的储能设备,具有更好的安全性、长循环寿命、高能量密度以及更小的体积[87].然而,与常规有机液体电解质相比,存在一些挑战,例如室温离子电导率不足(10-5~10-3 S·cm-1),难以形成界面膜等[88].
Li等[89]设计了LiTFSI/LiBOB+PEGDA/GN固态聚合物电解质薄膜,这种薄膜灵活性以及热稳定性很好,在30 ℃时具有超过1.0 mS·cm-1的离子电导率,LiTFSI和LiBOB的协同作用给了这种体系出色的电化学性能.双盐聚合物电解质在锂金属电池30 ℃时0.2 C下初始容量为138 mAh·g-1,前370个循环中平均库仑效率达到了99.99%,容量保持率为86%.Fan等[90]提出了一种具有3D交联聚合物网络的凝胶聚合物双盐电解质体系,PEGDA与ETPTA聚合形成3D网络结构,通过原位聚合方法引入双盐,这种3D-GPE室温具备0.56 mS·cm-1的离子电导率,可在锂金属表面的形成稳定的SEI膜,锂金属电池在这种体系下经过了300次循环,容量保持率达到87.93%.
3.3.2 锂硫电池锂硫电池具有高的能量密度,在电网规模的储能中具有很好的前景,但是Li阳极的不稳定性是限制Li-S电池循环寿命和安全性的主要因素[91].与此同时低放电平台,高硫负载下,固体放电产物的成核生长缓慢阻碍Li-S电池获得高比容量[92].
Wu等[93]使用离子液体Pyr1 201TFSI与共溶剂TEGDME, 并加入LiTFSI与LiODFB作为电解质,没有加入双盐的电极表面产生了裂纹并伴随着严重的容量损失,而加入双盐的电极具有光滑的表面形貌.界面膜中的F、S元素含量有所提高,形成了LiF保护抑制枝晶.LiTFSI/LiODFB摩尔比为6:4时经过50次循环, 库伦效率仍然达到了96.8%.Adams等[94]以二甘醇二甲醚(G2)为溶剂、LiTFSI+LiNO3为电解质,LiNO3加入可以提高循环寿命,但是在DOL:DME溶剂中溶解度较低,以G2为溶剂可以有效地提高LiNO3的浓度,并抑制双盐在电极上的还原.
4 结论电解质对电池性能至关重要,不同锂盐所构成的电解质体系,其电池循环寿命、高温性能、倍率性能等指标有明显区别.新型锂盐如LiFSI、LiBOB、LiBF4等,由于各自的缺陷无法根本上取代LiPF6.研究者通过锂盐的混合,有效利用相互之间的协同效应,提升了电解质的综合性能.本文主要讨论了混合盐电解质对于锂电池界面的影响及其在不同体系中的应用,得出以下结论:
1) 混盐可以改变溶液离子电导率、锂离子溶解度、黏度等性质,同时其通过对电极/电解质界面以及电极材料表界面的影响来改善电池电化学性能.证明根据不同单盐具备的不同优势来设计混合盐电解质以实现目的是可行的.例如锂负极存在着枝晶问题,为控制其生长,加入成膜性好的LiBOB或LiDFOB单盐成分,表面生成致密稳定界面层来达到目标.混盐中的单盐能够协同影响界面层构成或材料表面晶型结构,提升锂离子的传输.在寻找解决电池问题的路径时,设计混合盐体系可以作为尝试的方案.
2) 大多数的混盐体系研究仅限于其对电池性能的改进,目前对于混盐对电池性能改善的作用机制还需要深入研究.对混合体系的作用机制,现有的解释通常从单盐出发来说明其本身的性质或者对于界面层的作用,对2种甚至3种盐之间相互的关系,尤其是不同的盐如何实现协同作用应该是未来研究的重要方向.
3) 电极/电解质界面的解析是研究混盐体系的重要环节,而该界面同时包含有机组分和无机组分,成分和结构复杂而且无法从电极上剥离,难以表征,导致目前混盐体系作用机理的理解仍然处于发展阶段,迫切需要大力发展新型表征手段(如冷冻电镜)来解析电极/电解质界面,进而理解混盐体系的作用机制.
4) 随着新型固态电池体系的混合盐的应用,高浓度锂盐体系、双盐聚合物电解质或者无机固态电解质与聚合物电解质组成复合电解质体系的电极/电解质界面研究仍处于初期阶段.对该体系混合盐的科学问题认识尚浅,尤其是混合盐电解质在新型固态电池中的研究值得期待.
| [1] |
GOODENOUGH J B, KIM Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587. DOI:10.1021/cm901452z |
| [2] |
DONG Yang, DI Shengli, ZHANG Fangbo, et al. Nonaqueous electrolyte with dual-cations for high-voltage and long-life zinc batteries[J]. Journal of Materials Chemistry A, 2020, 8: 3252. DOI:10.1039/C9TA13068C |
| [3] |
HONG E S, OKADA S, SONODA T, et al. Thermal stability of electrolytes with mixtures of LiPF6 and LiBF4 used in lithium-ion cells[J]. Journal of the Electrochemical Society, 2004, 151(11): A1836. DOI:10.1149/1.1802136 |
| [4] |
CUI Yi, WAN Jiayu, YE Yusheng, et al. A fireproof, lightweight, polymer-polymer solid-state electrolyte for safe lithium batteries[J]. Nano Letters, 2020, 20(3): 1686. DOI:10.1021/acs.nanolett.9b04815 |
| [5] |
FENG Xuning, OUYANG Minggao, LIU Xiang, et al. Thermal runaway mechanism of lithium ion battery for electric vehicles: a review[J]. Energy Storage Materials, 2018, 10: 246. DOI:10.1016/j.ensm.2017.05.013 |
| [6] |
尹成果, 马玉林, 程新群, 等. 锂离子电池高温电解液[J]. 化学进展, 2013, 25(1): 55. YIN Chengguo, MA Yulin, CHENG Xinqun, et al. Elevated-temperature electrolytes for Li-ion batteries[J]. Progress in Chemistry, 2013, 25(1): 55. DOI:10.7536/pc120630 |
| [7] |
PARIMALAM B S, LUCHT B L. Reduction reactions of electrolyte salts for lithium ion batteries: LiPF6, LiBF4, LiDFOB, LiBOB, and LiTFSI[J]. Journal of the Electrochemical Society, 2018, 165(2): A251. DOI:10.1149/2.0901802jes |
| [8] |
YAMADA Y, YAMADA A. Review—superconcentrated electrolytes for lithium batteries[J]. Journal of the Electrochemical Society, 2015, 162(14): A2406. DOI:10.1149/2.0041514jes |
| [9] |
程纯, 陆亦诚, 刘志豪, 等. 锂离子电池电解液功能性添加剂设计及应用[J]. 化学进展, 2019, 31(4): 631. CHENG Chun, LU Yicheng, LIU Zhihao, et al. Design and application of functional additives for lithium ion battery electrolyte[J]. Progress in Chemistry, 2019, 31(4): 631. |
| [10] |
LIU Zhihong, CHAI Jingchao, XU Gaojie, et al. Functional lithium borate salts and their potential application in high performance lithium batteries[J]. Coordination Chemistry Reviews, 2015, 292: 56. DOI:10.1016/j.ccr.2015.02.011 |
| [11] |
DOMBAYCIOGLU S, KOSE H, AYDIN A O, et al. The effect of LiBF4 salt concentration in EC-DMC based electrolyte on the stability of nanostructured LiMn2O4 cathode[J]. International Journal of Hydrogen Energy, 2016, 41(23): 9893. DOI:10.1016/j.ijhydene.2016.03.165 |
| [12] |
ELLIS L D, XIA J, LOULI A J, et al. Effect of substituting LiBF4 for LiPF6in high voltage lithium-ion cells containing electrolyte additives[J]. Journal of the Electrochemical Society, 2016, 163(8): A1686. DOI:10.1149/2.0851608jes |
| [13] |
WANG Yunju, LI Jiayu, HUANG Yuhao, et al. Anion storage behavior of graphite electrodes in LiBF4/sulfone/ethyl methyl carbonate solutions[J]. Langmuir, 2019, 35: 14804. DOI:10.1021/acs.langmuir.9b02758 |
| [14] |
ZHANG Zhian, ZHAO Xingxing, PENG Bo, et al. Mixed salts for lithium iron phosphate-based batteries operated at wide temperature range[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(7): 2260. DOI:10.1016/s1003-6326(15)63839-0 |
| [15] |
YU Juan, GAO Na, PENG Jiaxin, et al. Concentrated LiODFB electrolyte for lithium metal batteries[J]. Frontiers in Chemistry, 2019, 7: 494. DOI:10.3389/fchem.2019.00494 |
| [16] |
MA Qiang, FANG Zheng, LIU Pin, et al. Improved cycling stability of lithium-metal anode with concentrated electrolytes based on lithium (fluorosulfonyl)(trifluoromethanesulfonyl)imide[J]. ChemElectroChem, 2016, 3(4): 531. DOI:10.1002/celc.201500520 |
| [17] |
郑丽萍.新型氟磺酰亚胺锂盐应用于锂离子电池的研究[D].武汉: 华中科技大学, 2016 ZHENG Liping. Investigation on novel lithium fluorosulfonimides as conducting salts for lithium-ion batteries[D]. Wuhan: Huazhong University of Science and Technology, 2016 |
| [18] |
KANG S J, PARK K, PARK S H, et al. Unraveling the role of LiFSI electrolyte in the superior performance of graphite anodes for Li-ion batteries[J]. Electrochimica Acta, 2018, 259: 949. DOI:10.1016/j.electacta.2017.11.018 |
| [19] |
张玲玲, 马玉林, 杜春雨, 等. 锂离子电池高电压电解液[J]. 化学进展, 2014, 26(4): 553. ZHANG Lingling, MA Yulin, DU Chunyu, et al. Research on the high-voltage electrolyte for lithium ion batteries[J]. Progress in Chemistry, 2014, 26(4): 553. DOI:10.7536/PC130816 |
| [20] |
CHEN Xilin, XU Wu, ENGELHARD M H, et al. Mixed salts of LiTFSI and LiBOB for stable LiFePO4-based batteries at elevated temperatures[J]. Journal of Materials Chemistry A, 2014, 2(7): 2346. DOI:10.1039/c3ta13043f |
| [21] |
GAO Xinpei, WU Fanglin, MARIANI A, et al. Concentrated ionic-liquid-based electrolytes for high-voltage lithium batteries with improved performance at room temperature[J]. ChemSusChem, 2019, 12(18): 4185. DOI:10.1002/cssc.201901739 |
| [22] |
CHEN Zonghai, LU W Q, LIU J, et al. LiPF6/LiBOB blend salt electrolyte for high-power lithium-ion batteries[J]. Electrochimica Acta, 2006, 51(16): 3322. DOI:10.1016/j.electacta.2005.09.027 |
| [23] |
HAGOS T M, BERHE G B, HAGOS T T, et al. Dual electrolyte additives of potassium hexafluorophosphate and tris (trimethylsilyl) phosphite for anode-free lithium metal batteries[J]. Electrochimica Acta, 2019, 316: 52. DOI:10.1016/j.electacta.2019.05.061 |
| [24] |
GNANARAJ J S, ZINIGRAD E, ASRAF L, et al. On the use of LiPF3(CF2CF3)3(LiFAP) solutions for Li-ion batteries. Electrochemical and thermal studies[J]. Electrochemistry Communications, 2003, 5(11): 946. DOI:10.1016/j.elecom.2003.08.020 |
| [25] |
ZHANG Longfei, CHAI Lili, ZHANG Li, et al. Synergistic effect between lithium bis(fluorosulfonyl)imide (LiFSI) and lithium bis-oxalato borate (LiBOB) salts in LiPF6-based electrolyte for high-performance Li-ion batteries[J]. Electrochimica Acta, 2014, 127: 39. DOI:10.1016/j.electacta.2014.02.008 |
| [26] |
WEBER R, GENOVESE M, LOULI A J, et al. Long cycle life and dendrite-free lithium morphology in anode-free lithium pouch cells enabled by a dual-salt liquid electrolyte[J]. Nature Energy, 2019, 4: 683. DOI:10.1038/s41560-019-0428-9 |
| [27] |
WHBA R A G, TIANKHOON L, SU'AIT M S, et al. Influence of binary lithium salts on 49% poly(methyl methacrylate) grafted natural rubber based solid polymer electrolytes[J]. Arabian Journal of Chemistry, 2018, 13(1): 3351. DOI:10.1016/j.arabjc.2018.11.009 |
| [28] |
SHANGGUAN Xuehui, JIA Guofeng, LI Faqiang, et al. Mixed salts of LiFSI and LiODFB for stable LiCoO2-based batteries[J]. Journal of the Electrochemical Society, 2016, 163(13): A2797. DOI:10.1149/2.1241613jes |
| [29] |
CHEN Zhenying, ZHOU Jingjing, GUO Yongsheng, et al. A compatible carbonate electrolyte with lithium anode for high performance lithium sulfur battery[J]. Electrochimica Acta, 2018, 282: 555. DOI:10.1016/j.electacta.2018.06.093 |
| [30] |
ALVARADO J, SCHROEDER M A, POLLARD T P, et al. Bisalt ether electrolytes: a pathway towards lithium metal batteries with Ni-rich cathodes[J]. Energy & Environmental Science, 2019, 12(2): 780. DOI:10.1039/c8ee02601g |
| [31] |
YOON B, PARK J, LEE J, et al. High-rate cycling of lithium-metal batteries enabled by dual-salt electrolyte-assisted micropatterned interfaces[J]. ACS Applied Materials and Interfaces, 2019, 11: 31777. DOI:10.1021/acsami.9b05492 |
| [32] |
MOSA J, VÉLEZ J F, APARICIO M. Blend hybrid solid electrolytes based on LiTFSI doped silica-polyethylene oxide for lithium-ion batteries[J]. Membranes, 2019, 9(9): 109. DOI:10.3390/membranes9090109 |
| [33] |
LIANG Wenfeng, SHAO Yunfan, CHEN Yuming, et al. A 4 V cathode compatible, superionic conductive solid polymer electrolyte for solid lithium metal batteries with long cycle life[J]. ACS Applied Energy Materials, 2018, 1(11): 6064. DOI:10.1021/acsaem.8b01138 |
| [34] |
ZHANG Heng, FENG Wenfang, NIE Jin, et al. Recent progresses on electrolytes of fluorosulfonimide anions for improving the performances of rechargeable Li and Li-ion battery[J]. Journal of Fluorine Chemistry, 2015, 174: 49. DOI:10.1016/j.jfluchem.2014.07.028 |
| [35] |
SHAROVA V, MORETTI A, DIEMANT T, et al. Comparative study of imide-based Li salts as electrolyte additives for Li-ion batteries[J]. Journal of Power Sources, 2018, 375: 43. DOI:10.1016/j.jpowsour.2017.11.045 |
| [36] |
ZHAO Wengao, ZOU Lianfeng, ZHENG Jianming, et al. Simultaneous stabilization of LiNi0.76Mn0.14Co0.10O2 cathode and lithium metal anode by lithium bis(oxalato)borate as additive[J]. ChemSusChem, 2018, 11(13): 2211. DOI:10.1002/cssc.201800706 |
| [37] |
LI Jianyu, LI Wangda, YOU Ya, et al. Extending the service life of high-Ni layered oxides by tuning the electrode-electrolyte interphase[J]. Advanced Energy Materials, 2018, 8(29): 1801957. DOI:10.1002/aenm.201801957 |
| [38] |
GENG Zhen, LU Jiaze, LI Quan, et al. Lithium metal batteries capable of stable operation at elevated temperature[J]. Energy Storage Materials, 2019, 23: 646. DOI:10.1016/j.ensm.2019.03.005 |
| [39] |
YANG Guanghua, SHI Junli, SHEN Cai, et al. Improving the cyclability performance of lithium-ion batteries by introducing lithium difluorophosphate (LiPO2F2) additive[J]. RSC Advances, 2017, 42(7): 26052. DOI:10.1039/c7ra03926c |
| [40] |
SHANGGUAN Xuehui, XU Gaojie, CUI Zili, et al. Additive-assisted novel dual-salt electrolyte addresses wide temperature operation of lithium-metal batteries[J]. Small, 2019, 15(16): e1900269. DOI:10.1002/smll.201900269 |
| [41] |
LIU Lili, GU Shijie, WANG Shili, et al. A LiPO2F2/LiPF6 dual-salt electrolyte enabled stable cycling performance of nickel-rich lithium ion batteries[J]. RSC Advances, 2020, 10(3): 1704. DOI:10.1039/c9ra09841k |
| [42] |
LU Yingying, TU Zhengyuan, ARCHER L A. Stable lithium electrodeposition in liquid and nanoporous solid electrolytes[J]. Nature Materials, 2014, 13: 961. DOI:10.1038/nmat4041 |
| [43] |
LIANG Xiao, WEN Zhaoyin, LIU Yu, et al. Improved cycling performances of lithium sulfur batteries with LiNO3-modified electrolyte[J]. Journal of Power Sources, 2011, 196(22): 9839. DOI:10.1016/j.jpowsour.2011.08.027 |
| [44] |
ZHAO Chenzi, CHENG Xinbing, ZHANG Rui, et al. Li2S5-based ternary-salt electrolyte for robust lithium metal anode[J]. Energy Storage Materials, 2016, 3: 77. DOI:10.1016/j.ensm.2016.01.007 |
| [45] |
FERNICOLA A, CROCE F, SCROSATI B, et al. LiTFSI-BEPyTFSI as an improved ionic liquid electrolyte for rechargeable lithium batteries[J]. Journal of Power Sources, 2007, 174(1): 342. DOI:10.1016/j.jpowsour.2007.09.013 |
| [46] |
BOLLOJU S, CHIOU C-Y, VIKRAMADITYA T, et al. (Pentafluorophenyl)diphenylphosphine as a dual-functional electrolyte additive for LiNi0.5Mn1.5O4 cathodes in high-voltage lithium-ion batteries[J]. Electrochimica Acta, 2019, 299: 663. DOI:10.1016/j.electacta.2019.01.037 |
| [47] |
VAN REE T. Electrolyte additives for improved lithium-ion battery performance and overcharge protection[J]. Current Opinion in Electrochemistry, 2020, 21: 22. DOI:10.1016/j.coelec.2020.01.001 |
| [48] |
ZHANG Xueqiang, LI Tao, LI Boquan, et al. A sustainable solid electrolyte interphase for high-energy-density lithium metal batteries under practical conditions[J]. Angewandte Chemie International Edition, 2020, 59: 3252. DOI:10.1002/anie.201911724 |
| [49] |
CHENG Xinbing, ZHANG Rui, ZHAO Chenzi, et al. Toward safe lithium metal anode in rechargeable batteries: a review[J]. Chemical Revews, 2017, 117: 10403. DOI:10.1021/acs.chemrev.7b00115 |
| [50] |
LIN Dingchang, LIU Yayuan, CUI Yi. Reviving the lithium metal anode for high-energy batteries[J]. Nature Nanotechnology, 2017, 12: 194. DOI:10.1038/nnano.2017.16 |
| [51] |
XU Wu, WANG Jiulin, DING Fei, et al. Lithium metal anodes for rechargeable batteries[J]. Energy & Environmental Science, 2014, 7: 513. DOI:10.1039/c3ee40795k |
| [52] |
ZHOU Hongyao, YU Sicen, LIU Haodong, et al. Protective coatings for lithium metal anodes: recent progress and future perspectives[J]. Journal of Power Sources, 2020, 450: 227632. DOI:10.1016/j.jpowsour.2019.227632 |
| [53] |
KIM M S, RYU J H, DEEPIKA, et al. Langmuir-Blodgett artificial solid-electrolyte interphases for practical lithium metal batteries[J]. Nature Energy, 2018, 3: 889. DOI:10.1038/s41560-018-0237-6 |
| [54] |
JU Zhijin, NAI Jianwei, WANG Yao, et al. Biomacromolecules enabled dendrite-free lithium metal battery and its origin revealed by cryo-electron microscopy[J]. Nature Communications, 2020, 11: 488. DOI:10.1038/s41467-020-14358-1 |
| [55] |
ZHANG Zhian, CHEN Xujie, LI Fanqun, et al. LiPF6 and lithium oxalyldifluoroborate blend salts electrolyte for LiFePO4/artificial graphite lithium-ion cells[J]. Journal of Power Sources, 2010, 195(21): 7397. DOI:10.1016/j.jpowsour.2010.05.056 |
| [56] |
QIN Bingsheng, ZHANG Shu, HU Zhenglin, et al. Ionic liquid-based electrolyte with dual-functional LiDFOB additive toward high-performance LiMn2O4 batteries[J]. Ionics, 2017, 23: 1399. DOI:10.1007/s11581-016-1966-9 |
| [57] |
JIAO Shuhong, REN Xiaodi, CAO Ruiguo, et al. Stable cycling of high-voltage lithium metal batteries in ether electrolytes[J]. Nature Energy, 2018, 3: 739. DOI:10.1038/s41560-018-0199-8 |
| [58] |
JIANG Lihua, LIANG Chen, LI Huang, et al. Safer triethyl-phosphate-based electrolyte enables nonflammable and high-temperature endurance for a lithium ion battery[J]. ACS Applied Energy Materials, 2020, 3(2): 1719. DOI:10.1021/acsaem.9b02188 |
| [59] |
HUANG W, WANG H, BOYLE D T, et al. Resolving nanoscopic and mesoscopic heterogeneity of fluorinated species in battery solid-electrolyte interphases by cryogenic electron microscopy[J]. ACS Energy Letters, 2020, 5(4): 1128. DOI:10.1021/acsenergylett.0c00194 |
| [60] |
XIANG Hongfa, SHI Pengcheng, BHATTACHARYA P, et al. Enhanced charging capability of lithium metal batteries based on lithium bis(trifluoromethanesulfonyl)imide-lithium bis(oxalato)borate dual-salt electrolytes[J]. Journal of Power Sources, 2016, 318: 170. DOI:10.1016/j.jpowsour.2016.04.017 |
| [61] |
ZHENG Jianming, ENGELHARD M H, MEI Donghai, et al. Electrolyte additive enabled fast charging and stable cycling lithium metal batteries[J]. Nature Energy, 2017, 2(3): 17012. DOI:10.1038/nenergy.2017.12 |
| [62] |
ZHAO Wengao, ZHENG Jianming, ZOU Lianfeng, et al. High voltage operation of Ni-rich nmc cathodes enabled by stable electrode/electrolyte interphases[J]. Advanced Energy Materials, 2018, 8(19): 1800297. DOI:10.1002/aenm.201800297 |
| [63] |
LAN G, ZHOU H, XING L, et al. Insight into the interaction between Ni-rich LiNi0.8 Co0.1Mn0.1 O2 cathode and BF4--introducing electrolyte at 4.5 V high voltage[J]. Journal of Energy Chemistry, 2019, 39: 235. DOI:10.1016/j.jechem.2019.04.011 |
| [64] |
LIU Xiaoyan, SHEN Chao, GAO Na, et al. Concentrated electrolytes based on dual salts of LiFSI and LiODFB for lithium-metal battery[J]. Electrochimica Acta, 2018, 289: 422. DOI:10.1016/j.electacta.2018.09.085 |
| [65] |
QIU Feilong, LI Xiang, DENG Han, et al. A concentrated ternary-salts electrolyte for high reversible Li metal battery with slight excess Li[J]. Advanced Energy Materials, 2018, 9(6): 1803372. DOI:10.1002/aenm.201803372 |
| [66] |
YAMADA Y, WANG Jianhui, KO S, et al. Advances and issues in developing salt-concentrated battery electrolytes[J]. Nature Energy, 2019, 4(5): 427. DOI:10.1038/s41560-019-0336-z |
| [67] |
BORODIN O, SELF J, PERSSON K A, et al. Uncharted waters: super-concentrated electrolytes[J]. Joule, 2020, 4(1): 69. DOI:10.1016/j.joule.2019.12.007 |
| [68] |
BEZABH H K, TSAI M C, HAGOS T T, et al. Roles of film-forming additives in diluted and concentrated electrolytes for lithium metal batteries: a density functional theory-based approach[J]. Electrochemistry Communications, 2020, 133: 106685. DOI:10.1016/j.elecom.2020.106685 |
| [69] |
YAMADA Y, FURUKAWA K, SODEYAMA K, et al. Unusual stability of acetonitrile-based superconcentrated electrolytes for fast-charging lithium-ion batteries[J]. Journal of the American Chemical Society, 2014, 136: 5039. DOI:10.1021/ja412807w |
| [70] |
YAMADA Y. Concentrated battery electrolytes: developing new functions by manipulating the coordination states[J]. Bulletin of the Chemical Society of Japan, 2020, 93(1): 109. DOI:10.1246/bcsj.20190314 |
| [71] |
CHEN Ming, FENG Guang, QIAO Rui. Water-in-salt electrolytes: an interfacial perspective[J]. Current Opinion in Colloid & Interface Science, 2020, 47: 99. DOI:10.1016/j.cocis.2019.12.011 |
| [72] |
ZHANG Haitao, WANG Deyu, SHEN Cai. In-situ EC-AFM and ex-situ XPS characterization to investigate the mechanism of SEI formation in highly concentrated aqueous electrolyte for Li-ion batteries[J]. Applied Surface Science, 2020, 507: 145059. DOI:10.1016/j.apsusc.2019.145059 |
| [73] |
ZHAO Qing, STALIN S, ZHAO Chenzi, et al. Designing solid-state electrolytes for safe, energy-dense batteries[J]. Nature Reviews Materials, 2020, 5(3): 229. DOI:10.1038/s41578-019-0165-5 |
| [74] |
YU Xingwen, LI Jianyu, MANTHIRAM A. Rational design of a laminated dual-polymer/polymer-ceramic composite electrolyte for high-voltage all-solid-state lithium batteries[J]. ACS Materials Letters, 2020, 2(4): 317. DOI:10.1021/acsmaterialslett.9b00535 |
| [75] |
ZHANG Bochen, CHEN Long, HU Jiangkui, et al. Solid-state lithium metal batteries enabled with high loading composite cathode materials and ceramic-based composite electrolytes[J]. Journal of Power Sources, 2019, 442: 227230. DOI:10.1016/j.jpowsour.2019.227230 |
| [76] |
QIU Genrui, SUN Chunwen. A quasi-solid composite electrolyte with dual salts for dendrite-free lithium metal batteries[J]. New Journal of Chemistry, 2020, 44(5): 1817. DOI:10.1039/c9nj04897a |
| [77] |
CHAN A K, TATARA R, FENG Shuting, et al. Concentrated electrolytes for enhanced stability of Al-alloy negative electrodes in Li-ion batteries[J]. Journal of the Electrochemical Society, 2019, 166(10): A1867. DOI:10.1149/2.0581910jes |
| [78] |
WANG Jinglun, YONG Tianqiao, YANG Jianwen, et al. Organosilicon functionalized glycerol carbonates as electrolytes for lithium-ion batteries[J]. RSC Advances, 2015, 5: 17660. DOI:10.1039/c4ra15854g |
| [79] |
LI Faqiang, SHANGGUAN Xuehui, JIA Guofeng, et al. Dual-salts of LiTFSI and LiODFB for high voltage cathode LiNi0.5Mn1.5O4[J]. Journal of Solid State Electrochemistry, 2016, 20: 3491. DOI:10.1007/s10008-016-3313-5 |
| [80] |
LIANG Fuxiao, YU Jiali, CHEN Jiahui, et al. A novel boron-based ionic liquid electrolyte for high voltage lithium-ion batteries with outstanding cycling stability[J]. Electrochimica Acta, 2018, 283: 111. DOI:10.1016/j.electacta.2018.06.170 |
| [81] |
ZAGHIB K, DONTIGNY M, GUERFI A, et al. An improved high-power battery with increased thermal operating range: C-LiFePO4// C-Li4Ti5O12[J]. Journal of Power Sources, 2012, 216: 192. DOI:10.1016/j.jpowsour.2012.05.025 |
| [82] |
LI Xing, ZHENG Jianming, REN Xiaodi, et al. Dendrite-free and performance-enhanced lithium metal batteries through optimizing solvent compositions and adding combinational additives[J]. Advanced Energy Materials, 2018, 8(15): 1703022. DOI:10.1002/aenm.201703022 |
| [83] |
TSURUMAKI A, BRANCHI M, RIGANO A, et al. Bis(oxalato)borate and difluoro(oxalato)borate-based ionic liquids as electrolyte additives to improve the capacity retention in high voltage lithium batteries[J]. Electrochimica Acta, 2019, 315: 17. DOI:10.1016/j.electacta.2019.04.190 |
| [84] |
FU Chuankai, MA Yulin, LOU Shuaifeng, et al. A dual-salt coupled fluoroethylene carbonate succinonitrile-based electrolyte enables Li-metal batteries[J]. Journal of Materials Chemistry A, 2020, 8: 2066. DOI:10.1039/c9ta11341j |
| [85] |
BEYENE T T, BEZABH H K, WERET M A, et al. Concentrated dual-salt electrolyte to stabilize Li metal and increase cycle life of anode free Li-metal batteries[J]. Journal of the Electrochemical Society, 2019, 166: A1501. DOI:10.1149/2.0731908jes |
| [86] |
DONG Ning, YANG Guanghua, LUO Hao, et al. A LiPO2F2/LiFSI dual-salt electrolyte enabled stable cycling of lithium metal batteries[J]. Journal of Power Sources, 2018, 400: 449. DOI:10.1016/j.jpowsour.2018.08.059 |
| [87] |
ZHAO Chenzi, ZHAO Qing, LIU Xiaotun, et al. Rechargeable lithium metal batteries with an in-built solid-state polymer electrolyte and a high voltage/loading Ni-rich layered cathode[J]. Advanced Materials, 2020, 32(12): e1905629. DOI:10.1002/adma.201905629 |
| [88] |
SUN Chunwen, LIU Jin, GONG Yudong, et al. Recent advances in all-solid-state rechargeable lithium batteries[J]. Nano Energy, 2017, 33: 363. DOI:10.1016/j.nanoen.2017.01.028 |
| [89] |
LI Si, CHEN Yuming, LIANG Wenfeng, et al. A superionic conductive, electrochemically stable dual-salt polymer electrolyte[J]. Joule, 2018, 2: 1838. DOI:10.1016/j.joule.2018.06.008 |
| [90] |
FAN Wei, LI Nianwu, ZHANG Xiuling, et al. A dual-salt gel polymer electrolyte with 3D cross-linked polymer network for dendrite-free lithium metal batteries[J]. Advanced Science, 2018, 5(9): 1800559. DOI:10.1002/advs.201800559 |
| [91] |
XU Zhixin, WANG Jiulin, YANG Jun, et al. Enhanced performance of a lithium-sulfur battery using a carbonate-based electrolyte[J]. Angewandte Chemie, 2016, 128: 10528. DOI:10.1002/ange.201605931 |
| [92] |
WANG Hui, ADAMS B D, PAN Huilin, et al. Tailored reaction route by micropore confinement for Li-S batteries operating under lean electrolyte conditions[J]. Advanced Energy Materials, 2018, 8(21): 1800590. DOI:10.1002/aenm.201800590 |
| [93] |
WU Feng, ZHU Qizhen, CHEN Renjie, et al. Ionic liquid-based electrolyte with binary lithium salts for high performance lithium-sulfur batteries[J]. Journal of Power Sources, 2015, 296: 10. DOI:10.1016/j.jpowsour.2015.07.033 |
| [94] |
ADAMS B D, CARINO E V, CONNELL J G, et al. Long term stability of Li-S batteries using high concentration lithium nitrate electrolytes[J]. Nano Energy, 2017, 40: 607. DOI:10.1016/j.nanoen.2017.09.015 |
 2021, Vol. 53
2021, Vol. 53