2. 三峡库区生态环境教育部重点实验室(重庆大学),重庆 400045;
3. 石河子大学 水利建筑工程学院,新疆 石河子 832003;
4. 同济大学 环境科学与工程学院,上海 200092
2. Key Laboratory of the Three Gorges Reservoir Region's Environment (Chongqing University), Ministry of Education, Chongqing 400045, China;
3. College of Water & Architectural Engineering, Shihezi University, Shihezi 832003, Xinjiang, China;
4. College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China
活性炭具有巨大的比表面积、发达的孔隙结构和丰富的表面官能团,可快速富集水中污染物,广泛应用于水处理工艺中[1-2].然而,活性炭在吸附污染物的过程中会逐渐达到吸附饱和,从而丧失吸附活性.传统的填埋或焚烧处理会造成环境污染和资源浪费,因此,有必要对吸附饱和的活性炭进行再生处理,以减少二次污染,实现资源重复利用.
常见的再生方法包括热再生[3]、溶剂再生[4]、生物再生[5]以及电化学再生[6]等,其中热再生是目前应用最广泛的技术,但其存在能耗高、炭质量损耗大等缺点.电化学再生因再生效率高、质量损失小,可实现原位再生等优点引起众多学者关注[7],其原理是通过电场的作用将活性炭上的污染物快速脱附到溶液中,从而恢复活性炭吸附能力,实现活性炭再生.Narbaitz等[8]利用电化学阴极再生吸附苯酚饱和的颗粒活性炭(GAC),发现阴极再生效率比阳极高5%~10%,但是脱附到溶液中的苯酚未能被有效降解,再生液还需二次处理.因此,需要开发新型的电再生技术,以求在达到高效再生的基础上实现脱附污染物的矿化,减少二次污染.
近年来,基于硫酸根自由基(SO4-·)的高级氧化技术在水处理领域受到了广泛的关注[9],SO4-·具有较高的氧化还原电位(E0=2.6 V),选择氧化性强,能有效降解水中有机污染物[10-11].SO4-·可通过阴极电场激发过硫酸盐产生,因此,将电化学再生与高级氧化技术相结合,理论上可同时实现活性炭再生与脱附污染物降解.Huang等[12]利用电场和Fe2+激发过硫酸盐再生苯酚饱和GAC,在电压22.5 V、Fe2+质量浓度1 000 mg/L、过硫酸盐质量浓度2 000 mg/L的条件下,GAC再生效率为58.2%,且该体系对苯酚的降解率可达75.3%.但是较高的电压会增加体系能耗,同时过硫酸盐的非生产性分解增加,导致再生成本提高.前期研究发现,活性炭阴极比金属电极更能有效地活化过硫酸盐生成SO4-·[13-14].同时,在电场的作用下,溶液中的Na+会迅速向阴极聚集,与阴极附近的苯酚反应生成不易被重吸附的苯酚钠,使活性炭中的苯酚在阴极更容易脱附[15].因此,将活性炭固定在阴极电极上进行原位再生,可能提高电流的利用效率,使得体系在较低的能耗下实现活性炭再生与再生液中污染物的高效降解.
本研究以电阴极/过硫酸盐体系原位再生吸附苯酚饱和的活性炭纤维(ACF),与电化学阴极、单独过硫酸盐体系的活性炭再生效率和污染物降解率进行综合比较.探究电流密度、过硫酸盐浓度、再生时间对电阴极/过硫酸盐再生体系的影响,通过多次再生分析该体系的应用潜力.
1 实验 1.1 材料和仪器ACF(厚度3 mm,比表面积900 m2/g)购自山东紫川炭纤维有限公司;过硫酸钠(AR,99 %)购自阿拉丁试剂(上海)有限公司;苯酚(AR,99%)和无水硫酸钠(AR,99%)购自成都市科隆化学品有限公司;甲醇(色谱级)购自霍尼韦尔贸易(上海)有限公司;超纯水(电导率18.2 MΩ·cm)由实验室制备.
苯酚浓度由高效液相色谱仪(Waters2956,美国)测定,色谱柱型号为5C18-MS-Ⅱ(4.6 mm I.D.×150 mm);流动相配比V(水)∶ V(甲醇)=20∶ 80,流速0.80 mL/min,柱温30 ℃,进样量10 μL,检测波长270 nm.ACF吸附实验在恒温培养振荡器(ZWY-2102C,上海智城分析仪器制造有限公司)中进行.吸附饱和的ACF置于鼓风干燥箱(DHG-9005,上海一恒科学仪器有限公司)中38 ℃条件下烘干.再生实验中,通电体系采用直流电源(PS-305DM,香港龙威仪器仪表有限公司)提供恒定电流.再生前后ACF形貌变化由场发射扫描电镜(MIRA3 FE,美国Tescan公司)表征,ACF孔隙结构变化由比表面仪(ASAP 2020M,美国Micromeritics公司)测定.
1.2 吸附实验称取0.2 g ACF,置于装有200 mL不同质量浓度梯度苯酚溶液的锥形瓶中,苯酚溶液质量浓度为50~1 700 mg/L.锥形瓶用瓶塞密封,在恒温培养振荡器200 r/min、25 ℃条件下吸附24 h至平衡,取样测量吸附平衡时溶液中苯酚剩余质量浓度.根据式(1)计算ACF在各平衡质量浓度下的吸附容量,并根据不同吸附等温模型对实验数据进行拟合.
| $ {Q_{\rm{e}}} = \frac{{({\rho _0} - {\rho _{\rm{e}}}) \cdot V}}{m}. $ | (1) |
式中:Qe为ACF在平衡质量浓度为ρe时的吸附容量(mg/g),ρ0为溶液中苯酚的初始质量浓度(mg/L),ρe为ACF吸附平衡时溶液中苯酚剩余质量浓度(mg/L),V为溶液体积(mL),m为ACF质量(g).
1.3 再生实验再生实验在体积为500 mL的无隔膜聚四氟乙烯圆柱形反应器中进行.在通电体系中,电极片为钛镀铂材质,尺寸为3.5 cm×5.0 cm,阴阳极间距2 cm,吸附饱和的ACF由钛丝固定在钛镀铂阴极内侧.反应器置于25 ℃恒温水浴中,下设磁力搅拌器,以800 r/min转速搅拌溶液.电化学阴极体系采用Na2SO4作为电解质,浓度为0.2 mol/L,单独过硫酸盐、电阴极/过硫酸盐体系中过硫酸盐浓度为0.1 mol/L.在多次吸附饱和-再生循环实验中,将ACF吸附苯酚至饱和,然后置于38 ℃条件下烘干,对烘干后的ACF进行第1次再生;再生后的ACF重新烘干、再次吸附饱和.将上述步骤重复4次,即可完成ACF的多次再生实验.可根据式(2)计算ACF的再生效率η(%),即
| $ \eta = \frac{{{Q_n}}}{{{Q_0}}}. $ | (2) |
式中:Q0为ACF的初始吸附容量(mg/g), Qn为ACF在第n次再生后的吸附容量(mg/g),n为再生次数.
2 结果与讨论 2.1 ACF对苯酚的吸附等温模型吸附等温模型能很好地描述ACF对苯酚的吸附过程,有助于探究ACF的吸附机理.目前应用较广泛的有Langmuir模型和Freundlich模型.
Langmuir模型(式(3))主要假设ACF表面吸附位点分布均匀,且对苯酚的吸附为单分子层吸附[16].
| $ {Q_{\rm{e}}} = \frac{{{Q_{\rm{m}}}{K_{\rm{L}}}{\rho _{\rm{e}}}}}{{1 + {K_{\rm{L}}}{\rho _{\rm{e}}}}}. $ | (3) |
式中:Qm为ACF对苯酚的最大吸附容量(mg/g); KL为平衡常数,与吸附自由能有关.
Freundlich模型(式(4))是根据经验总结得到的,主要应用于ACF对低浓度溶液的吸附过程[17].
| $ {Q_{\rm{e}}} = {K_{\rm{F}}}\rho _e^{^{\frac{1}{n}}}. $ | (4) |
式中:KF、1/n分别为Freundlich模型中与吸附容量和吸附强度有关的常数.
采用Langmuir和Freundlich吸附等温模型对ACF吸附苯酚的数据进行拟合,如表 1所示,ACF对苯酚的吸附容量可达280.22 mg/g,远高于传统的颗粒活性炭[18];Freundlich模型相关性R2(>0.95)大于Langmuir相关性R2(>0.90),ACF的吸附过程更符合Freundlich模型,说明该吸附是多分子层的非均一吸附过程.
| 表 1 不同吸附等温模型拟合参数 Tab. 1 Fitting parameters of different adsorption isotherm models |
将吸附饱和的ACF分别置于电化学阴极、单独过硫酸盐、电阴极/过硫酸盐体系中进行再生.通电体系电流密度均为57.14 mA/cm2,再生时间为6 h.电化学阴极、单独过硫酸盐、电阴极/过硫酸盐体系的再生效率分别为89.42%、40.13%、62.71%(图 1(a)).如图 1(b)所示,根据3个体系溶液中苯酚质量浓度的变化,可将再生过程可分为两个阶段.第1阶段:ACF内苯酚快速脱附,脱附速率大于吸附和降解速率,表现为溶液中苯酚质量浓度迅速上升,并在30 min内达到峰值.第2阶段:溶液中苯酚脱附速率显著降低,降解和被ACF再吸附速率大于或等于ACF中苯酚脱附速率,此阶段溶液中苯酚质量浓度随时间逐渐下降或近似保持平衡.

|
图 1 不同再生体系的对比 Fig. 1 Comparison of different regeneration processes |
在第1阶段,电化学阴极体系溶液中的苯酚质量浓度峰值为91.31 mg/L,远大于电阴极/过硫酸盐体系的30.57 mg/L和过硫酸盐体系的25.29 mg/L. 与单独过硫酸盐体系相比,苯酚在阴极电场的作用下更容易脱附到溶液中,主要原因是在通电体系中,阴极附近OH-生成增加,导致局部pH上升[1],促进了苯酚(pKa=8.99[19])的去质子化程度;此时,阴离子形式的苯酚受到阴极电场的斥力,持续脱附到溶液中.而与电化学阴极体系相比,电阴极/过硫酸盐体系在相同电流密度的情况下峰值较低,主要是由于在阴极电场和ACF的共同活化作用下,过硫酸盐被原位激发成硫酸根自由基(SO4-·),而SO4-·又可与水反应生成羟基自由基(·OH),如式(5)~(7)[13],这两种强氧化性自由基可将苯酚快速降解和矿化.其中,式(7)反应速率常数较低(k[H2O]<2×10-3s-1)[14],因此,在降解过程中SO4-·起主要作用.
| $ {{\rm{S}}_2}{\rm{O}}_8^{2-} + {{\rm{e}}^-} \to {\rm{SO}}_4^- \cdot + {\rm{SO}}_4^{2-}, $ | (5) |
| $ {\rm{ACF}} + {{\rm{S}}_2}{\rm{O}}_8^{2-} \to {\rm{AC}}{{\rm{F}}^ + } + {\rm{SO}}_4^- \cdot + {\rm{SO}}_4^{2-}, $ | (6) |
| $ {\rm{SO}}_4^- \cdot + {{\rm{H}}_2}{\rm{O}} \to \cdot {\rm{OH}} + {\rm{SO}}_4^{2-} + {{\rm{H}}^ + }. $ | (7) |
在第2阶段,电化学阴极体系溶液中苯酚质量浓度逐渐降低,至360 min时苯酚质量浓度为16.41 mg/L.实验过程中可观察到该体系溶液颜色从120 min开始逐渐加深,至反应结束时变成了深褐色,这是由于溶液中的苯酚在阳极长时间氧化作用下生成了对苯醌和其他毒性更强的副产物和低聚物[20].因此,虽然电化学阴极体系对ACF的再生效率可达89.42%,再生后的溶液对环境存在较大危害,还需二次处理才可排放.单独过硫酸盐体系中苯酚质量浓度在第2阶段也呈现下降趋势,主要原因包括溶液中的过硫酸盐对苯酚的缓慢降解,以及ACF对溶液中苯酚的再吸附.由单独过硫酸盐体系再生效率只有40.13%可知再吸附为主要因素.电阴极/过硫酸盐体系的再生效率为62.71%,且再生液中苯酚总量仅为ACF最大吸附容量(Qm=280.22 mg/g)的3.10%(溶液中苯酚质量浓度为3.47 mg/L),表明该体系可以在快速脱附苯酚的同时,通过体系中产生的SO4-·和·OH对苯酚高效降解.因此,电阴极/过硫酸盐体系既可保证ACF的再生效率,又能有效减少再生液的二次污染问题,具有很好的应用前景.
2.3 电阴极/过硫酸盐再生体系的影响因素 2.3.1 电流密度的影响如图 2(a)所示,在过硫酸盐浓度为0.1 mol/L、再生时间为6 h条件下,当电流密度从11.43 mA/cm2增加到57.14 mA/cm2时,再生效率由31.48%显著上升至62.71%,但当电流密度继续增加到114.28 mA/cm2,再生效率反而下降了9.02%,而溶液中苯酚质量浓度峰值则随电流增加逐渐降低(见图 2(b)).通常,电流的增加会提高电极片上的电子密度,促进过硫酸盐在阴极电场下被活化成SO4-·,提高溶液中苯酚降解效率,使得吸附平衡向脱附的方向进行,有利于ACF的再生.但是电流过大会使苯酚在阳极的氧化程度增加,生成较多的低聚物,会被ACF再吸附,而此过程多为不可逆吸附,进而降低了ACF的吸附容量.

|
图 2 电流密度的影响 Fig. 2 Effect of current intensity |
在电阴极/过硫酸盐体系中,氧化剂过硫酸盐作为SO4-·和·OH的来源,其浓度是影响再生效率的重要因素.如图 3(a)所示,在电流密度为57.14 mA/cm2、再生时间为6 h的条件下,当过硫酸盐浓度由0.05 mol/L增加到0.1 mol/L时,再生效率从52.52%增加到62.71%,表明在一定范围内,增加过硫酸盐的浓度会提高再生效率;而当过硫酸盐浓度继续增加到0.2 mol/L时,再生效率下降了11.29%,原因可能是高浓度的过硫酸盐溶液造成ACF孔隙堵塞和结构破坏,导致其吸附容量降低.如图 3(b),溶液中苯酚质量浓度峰值随过硫酸盐浓度增加而显著降低;反应结束时,0.1和0.2 mol/L过硫酸盐条件下溶液中苯酚质量浓度均降至较低水平.结合再生效率数据可知,电阴极/过硫酸盐再生体系在过硫酸盐浓度为0.1 mol/L时效果较好.

|
图 3 过硫酸盐浓度的影响 Fig. 3 Effect of persulfate concentration |
如图 4所示,在电流密度为57.14 mA/cm2、过硫酸盐浓度为0.1 mol/L的情况下,当再生时间由1 h增加到3 h,ACF的再生效率由58.85%上升到68.73%;而当再生时间继续增加至4,6和8 h,再生效率分别下降了1.67%、6.02%和11.30%.电阴极/过硫酸盐体系在1 h时,溶液中苯酚余量(溶液中苯酚占ACF最大吸附苯酚总量Qm的百分比)为19.52%,随后持续下降;至6 h时已经下降至3.10%的较低水平.当再生时间继续延长至8 h,苯酚质量浓度未有明显降低,而再生效率从3 h起持续下降.这可能是因为溶液中积累的中间产物(如对苯醌、邻苯二酚、草酸等[1])会再吸附到ACF内部,堵塞了ACF微孔,降低其吸附能力[20];另外,再生时间过长会导致体系能耗增加,因此,选用6 h作为电阴极/过硫酸盐体系的最优时间工况.

|
图 4 再生时间的影响 Fig. 4 Effect of regeneration time |
为探究电阴极/过硫酸盐体系对ACF的多次再生效能,在电流密度57.14 mA/cm2、过硫酸盐浓度0.1 mol/L、再生时间6 h条件下,进行了4次吸附饱和-再生循环实验.如图 5(a)所示,经过第1次再生,ACF的吸附容量下降为初始的62.71%,其后每次循环再生ACF的吸附容量均下降10%左右.值得注意的是,虽然4次吸附-再生循环实验中ACF的吸附容量逐次降低,脱附到再生液中的苯酚质量浓度峰值却非常接近(图 5(b)),较合理的解释是在第1次再生的过程中,ACF的微孔受到一定程度的堵塞和破坏,介孔数量增加,不仅使ACF吸附容量下降,而且使得苯酚在同样的电斥力条件下更容易脱附到溶液中,因而其后几次再生过程中苯酚能够在第1阶段迅速脱附到达峰值,但是在第2阶段对苯酚再吸附和原位活化过硫酸盐的能力均有所下降.
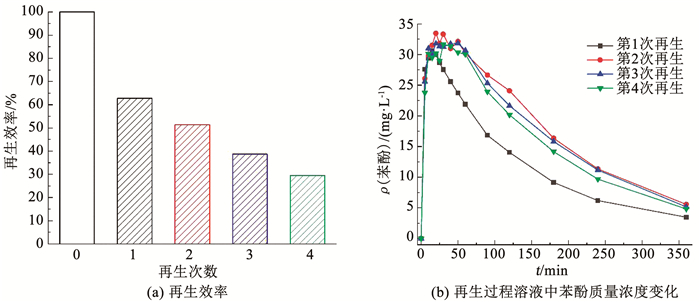
|
图 5 再生次数的影响 Fig. 5 Effect of regeneration cycles |
图 6为ACF再生前后的氮气吸附-脱附曲线,原始ACF样品在相对压力较低条件下吸附量上升较为明显,当相对压力逐渐增加,吸附量趋于平缓,表明ACF具有发达的微孔结构,吸附能力较强.经过电阴极/过硫酸盐体系一次再生后,ACF对氮气的吸附量有所下降,但是在相对压力较高的情况下,吸附量却急速上升,且滞后环的面积有所增加,可能是再生过程中ACF微孔被破坏,产生了一定数量的介孔[21].第4次再生后,ACF的吸附量有持续下降的趋势,且滞后环的面积减少,说明介孔数量下降,部分孔隙堵塞.

|
图 6 ACF再生前后的氮气吸附-脱附曲线 Fig. 6 Nitrogen adsorption and desorption curves of ACF before and after regeneration |
由ACF再生前后孔径分布曲线(图 7)可以看出,原始ACF的孔径大多在2 nm以下,第1次再生后的ACF孔径在1.3 nm以下分布情况几乎与原始ACF重合,在1.4~2.0 nm下降较为明显,在5.5 nm的介孔处分布增加,表明一次再生后ACF被破坏的微孔数量有限,介孔数量的增加是导致ACF在相对压力较高情况下对氮气吸附量上升的主要原因.第4次再生后ACF微孔和介孔数量整体呈现下降趋势,与氮气吸附曲线结果相吻合.

|
图 7 ACF再生前后的孔径分布 Fig. 7 Poresize distribution of ACF before and after regeneration |
前期研究发现,在ACF活化过硫酸盐产生SO4-·降解污染物的过程中,ACF表面容易被氧化,形貌发生较大的改变[22].而在阴极电场存在的情况下,SO4-·作为主要的氧化物质,其产生速率更高[23],但是ACF受到的破坏反而很小.经机理分析可知,ACF在提供电子活化过硫酸盐的过程中未及时补充电子(式(6)),因而会被氧化.而当阴极电场存在情况下,由于阴极局部pH较高,ACF(pHPZC=6.9[16])本身带负电荷,且阴极电场持续为ACF提供电子补充,很好地保护了ACF,使其免受过硫酸盐的氧化,此时ACF主要起到催化作用(式(8))[22].而在电阴极/过硫酸盐再生体系中,由于过硫酸盐浓度过高,过量的SO4-·除了参与降解脱附到溶液中的苯酚,还有可能对ACF表面结构产生一定的破坏.因此,需要对再生后的ACF进行电镜扫描以验证分析.如图 8所示,原始ACF表面光滑洁净,第1次再生后ACF表面结构破坏明显,推测可能是再生过程中被过硫酸盐及其产生的SO4-·氧化所致,而ACF受·OH的氧化作用较小,主要是因为在阴极电场的极化作用下,ACF上聚集的较多电子会与·OH发生反应,减少了·OH对ACF的氧化作用(式(9))[2].第4次再生后的ACF不仅表面被杂质完全覆盖,而且缝隙处还填充有较大的颗粒结晶物,说明经过多次再生-吸附循环,ACF表面会逐渐被污染物包覆,导致微孔被堵塞,降低了再生效率.电阴极/过硫酸盐再生体系的作用机理见图 9.
| $ {{\text{S}}_{2}}\text{O}_{8}^{2-}+{{\text{e}}^{-}}\underrightarrow{\text{ACF}}\text{SO}_{4}^{-}\cdot +\text{SO}_{4}^{2-}, $ | (8) |
| $ \cdot {\rm{OH}} + {{\rm{e}}^ - } \to {\rm{O}}{{\rm{H}}^ - }. $ | (9) |

|
图 8 ACF再生前后的SEM图 Fig. 8 SEM images of ACF before and after regeneration |

|
图 9 电阴极/过硫酸盐再生体系机理 Fig. 9 Mechanism of cathode/persulfate regeneration process |
上述结果表明,在多次吸附-再生循环过程中,ACF在阴极并不能够得到足够的保护,溶液中高浓度的过硫酸盐会产生过量的SO4-·,从而对ACF的孔隙结构造成了破坏.另外,在长时间的再生过程中,溶液中的苯酚及其氧化副产物会被ACF再吸附,导致其微孔被堵塞. 以上是ACF在电阴极/过硫酸盐再生体系中难以恢复原始吸附容量的主要原因.
3 结论1) ACF对苯酚的最大吸附容量为280.22 mg/g,吸附过程符合Freundlich吸附等温模型,为非均一吸附.
2) 电阴极/过硫酸盐体系对ACF的综合再生效果显著优于电化学阴极和单独过硫酸盐体系.
3) 在电流密度57.14 mA/cm2、过硫酸盐浓度0.1 mol/L、再生时间6 h时,电阴极/过硫酸盐体系再生效果最好,在该工况下ACF再生效率为62.71%,再生液中苯酚总量仅为ACF最大吸附容量的3.10%.
4) 电阴极/过硫酸盐再生体系多次再生过程中,过硫酸盐以及体系中产生的过量自由基会对ACF的结构产生一定的破坏.
| [1] |
TRELLU C, OTURAN N, KEITA F K, et al. Regeneration of activated carbon fiber by the electro-Fenton process[J]. Environmental Science & Technology, 2018, 52(3): 7450. DOI:10.1021/acs.est.8b01554 |
| [2] |
ZHAN Juhong, WANG Huijiao, PAN Xuejun, et al. Simultaneous regeneration of p-nitrophenol-saturated activated carbon fiber and mineralization of desorbed pollutants by electro-peroxone process[J]. Carbon, 2016, 101: 399. DOI:10.1016/j.carbon.2016.02.023 |
| [3] |
MORENO-CASTILLA C, RIVERA-UTRILLA J, JOLY J P, et al. Thermal regeneration of an activated carbon exhausted with different substituted phenols[J]. Carbon, 1995, 33(10): 1417. DOI:10.1016/0008-6223(95)00090-Z |
| [4] |
DUTTA T, KIM T, VELLINGIRI K, et al. Recycling and regeneration of carbonaceous and porous materials through thermal or solvent treatment[J]. Chemical Engineering Journal, 2019, 364: 514. DOI:10.1016/j.cej.2019.01.049 |
| [5] |
IVANCEV-TUMBAS I, DALMACIJA B, TAMAS Z, et al. Reuse of biologically regenerated activated carbon for phenol removal[J]. Water Research, 1998, 32(4): 1085. DOI:10.1016/s0043-1354(97)00337-0 |
| [6] |
NARBAITZ R M, MCEWEN J. Electrochemical regeneration of field spent GAC from two water treatment plants[J]. Water Research, 2012, 46(15): 4852. DOI:10.1016/j.watres.2012.05.046 |
| [7] |
MCQUILLAN R V, STEVENS G W, MUMFORD K A. The electrochemical regeneration of granular activated carbons: A review[J]. Journal of Hazardous Materials, 2018, 355: 34. DOI:10.1016/j.jhazmat.2018.04.079 |
| [8] |
NARBAITZ R M, CEN Jianqi. Electrochemical regeneration of granular activated carbon[J]. Water Research, 1994, 28(8): 1771. DOI:10.1016/0043-1354(94)90250-X |
| [9] |
LIU Zhen, DING Haojie, ZHAO Chun, et al. Electrochemical activation of peroxymonosulfate with ACF cathode: Kinetics, influencing factors, mechanism, and application potential[J]. Water Research, 2019, 159: 111. DOI:10.1016/j.watres.2019.04.052 |
| [10] |
MIKLOS D B, REMY C, JEKEL M, et al. Evaluation of advanced oxidation processes for water and wastewater treatment: A critical review[J]. Water Research, 2018, 139: 118. DOI:10.1016/j.watres.2018.03.042 |
| [11] |
LEE Y C, LO S L, KUO J, et al. Promoted degradation of perfluorooctanic acid by persulfate when adding activated carbon[J]. Journal of Hazardous Materials, 2013, 261: 463. DOI:10.1016/j.jhazmat.2013.07.054 |
| [12] |
HUANG Xiaoyi, AN Dong, SONG Jiaxiu, et al. Persulfate/electrochemical/FeCl2 system for the degradation of phenol adsorbed on granular activated carbon and adsorbent regeneration[J]. Journal of Cleaner Production, 2017, 165: 637. DOI:10.1016/j.jclepro.2017.07.171 |
| [13] |
LIU Zhen, ZHAO Chun, WANG Pu, et al. Removal of carbamazepine in water by electro-activated carbon fiber-peroxydisulfate: Comparison, optimization, recycle, and mechanism study[J]. Chemical Engineering Journal, 2018, 343: 28. DOI:10.1016/j.cej.2018.02.114 |
| [14] |
PENNINGTON D E, HAIM A. Stoichiometry and mechanism of the chromium(Ⅱ)-peroxydisulfate reaction[J]. Journal of the American Chemical Society, 1968, 90(14): 3700. DOI:10.1021/ja01016a017 |
| [15] |
ZHANG Huiping. Regeneration of exhausted activated carbon by electrochemical method[J]. Chemical Engineering Journal, 2002, 85(1): 81. DOI:10.1016/S1385-8947(01)00176-0 |
| [16] |
LIU Qingsong, ZHENG Tong, WANG Peng, et al. Adsorption isotherm, kinetic and mechanism studies of some substituted phenols on activated carbon fibers[J]. Chemical Engineering Journal, 2010, 157(2/3): 348. DOI:10.1016/j.cej.2009.11.013 |
| [17] |
岳钦艳, 杨晶, 高宝玉, 等. 活性炭纤维对水中酚类化合物的吸附特性[J]. 环境科学, 2008, 29(10): 2862. YUE Qinyan, YANG Jing, GAO Baoyu, et al. Adsorption characteristics of phenol compounds in water by activated carbon fiber[J]. Environmental Science, 2008, 29(10): 2862. DOI:10.3321/j.issn:0250-3301.2008.10.031 |
| [18] |
展巨宏. 电催化臭氧法再生活性炭纤维研究[D]. 昆明: 昆明理工大学, 2016 ZHAN Juhong. Regeneration mechanism of saturated activated carbon fiber by the electro-peroxone process[D]. Kunming: Kunming University of Science and Technology, 2016 |
| [19] |
DABROWSKI A, PODKOSCIELNY P, HUBICKI Z, et al. Adsorption of phenolic compounds by activated carbon: A critical review[J]. Chemosphere, 2005, 58(8): 1049. DOI:10.1016/j.chemosphere.2004.09.067 |
| [20] |
ZHAN Juhong, WANG Yujue, WANG Huijiao, et al. Electro-peroxone regeneration of phenol-saturated activated carbon fiber: The effects of irreversible adsorption and operational parameters[J]. Carbon, 2016, 109: 321. DOI:10.1016/j.carbon.2016.08.034 |
| [21] |
KRUK M, JARONIEC M. Gas adsorption characterization of ordered organic-inorganic nanocomposite materials[J]. Chemistry of Materials, 2001, 13(10): 3169. DOI:10.1021/cm0101069 |
| [22] |
赵纯, 余聃, 李向宇, 等. 外加电流阴极保护强化ACF激活PDS降解水中卡马西平[J]. 哈尔滨工业大学学报, 2019, 51(2): 50. ZHAO Chun, YU Dan, LI Xiangyu, et al. Degradation of carbamazepine in aqueous solution by electrically protected and enhanced activated carbon fibers activating peroxodisulfate[J]. Journal of Harbin Institute of Technology, 2019, 51(2): 50. DOI:10.11918/j.issn.0367-6234.201803113 |
| [23] |
LIU Zhen, REN Bangxing, DING Haojie, et al. Simultaneous regeneration of cathodic activated carbon fiber and mineralization of desorbed contaminations by electro-peroxydisulfate process: Advantages and limitations[J]. Water Research, 2020, 171: 115456. DOI:10.1016/j.watres.2019.115456 |
 2021, Vol. 53
2021, Vol. 53


