近年来,药物广泛应用于人们生活中,在水环境中检测量逐年升高,成为一种新型污染物.双氯芬酸属于非甾体抗炎药,每年总消耗量近千吨,污水厂常规处理去除率较低,且难生物降解.若长期存在于水环境中,不仅会对水生生物产生负面影响,还会通过生物富集作用,给人类带来潜在的风险和危害[1].
目前,去除水中双氯芬酸的方法主要有高级氧化法、膜滤法、吸附法等,吸附法因操作简便、成本低、效率高以及无中间副产物等特性逐渐引起研究者的关注,常用的吸附剂主要有活性炭、黏土、针铁矿、金属有机骨架[2-4].然而这些吸附剂因再生困难、制备繁琐或者分离困难而造成二次污染等问题影响了实际应用[5].
壳聚糖是一种良好的天然高分子材料,其分子结构中具有大量氨基和羟基,有很好的絮凝、络合及静电作用.但在实际应用中也存在着一些问题:壳聚糖主要以粉末状形式存在,在酸性溶液中稳定性差,并且进行吸附实验时很难快速有效地从水体中分离.因此,可通过官能团的功能化修饰改性,增强其化学稳定性,提高其吸附选择性及吸附效果[6-7].若将磁性颗粒负载到壳聚糖上,通过磁分离技术,就可以实现吸附剂的回收和利用[8-9].目前,磁性壳聚糖的制备方法主要有原位共沉淀法、水热法、微乳液法[8, 10].其中原位共沉淀法操作简单方便,制备的材料比较均一,是普遍应用的方法之一[11].
本文采用原位共沉淀法制备磁性壳聚糖小球,利用戊二醛及乙二胺对其交联改性.将制备的吸附剂用于吸附水中双氯芬酸,并通过等温吸附和动力学等过程对吸附效果和吸附机理进行研究.
1 实验 1.1 实验仪器及试剂实验仪器:DZF真空干燥箱,HH电热恒温水浴锅(北京科伟永兴仪器有限公司);JJ-1(A)精密电动搅拌器(金坛市荣华仪器制造有限公司);SHA-CA水浴恒温振荡器(常州市伟嘉仪器制造有限公司);FA2104电子分析天平(上海民桥精密科学仪器有限公司);UV-1600PC紫外可见分光光度计(上海美普达仪器有限公司);pHS-3E pH计(上海仪电科学仪器股份有限公司).
化学试剂:壳聚糖(脱乙酰度为80%~95%);戊二醛(质量分数25%);双氯芬酸钠(≥99%);六水合氯化铁、七水合硫酸亚铁、乙二胺、环氧氯丙烷均为分析纯;实验用水为去离子水.
1.2 材料制备 1.2.1 磁性壳聚糖小球(MCS)的制备将1.65 g壳聚糖溶于75 mL 3%的醋酸溶液中,2.7 gFeCl3·6H2O和1.39 gFeSO4·7H2O加入到上述壳聚糖乙酸溶液中,搅拌2 h,将该混合溶液缓慢滴加到4 mol/L的NaOH乙醇溶液中,搅拌固化3 h后用去离子水将其洗至中性,并放入去离子水中备用.
1.2.2 乙二胺改性磁性壳聚糖小球(EMMCS)的制备乙二胺改性磁性壳聚糖反应过程如图 1所示.改性步骤为:1)将制备的磁性壳聚糖小球放入500 mL的戊二醛溶液中,交联24 h后用无水乙醇和去离子水反复洗涤;2)将洗涤后的小球放入400 mL去离子水中,用NaOH溶液调节pH为9.5,加入一定量的环氧氯丙烷,将溶液升温至60 ℃,活化5.5 h后,将小球洗至中性;3)将上述小球转移至250 mL去离子水中,调节反应体系pH为10,加入乙二胺,将水溶液升温至60 ℃,反应3.5 h后,用去离子水洗至中性,50 ℃真空干燥8 h备用.
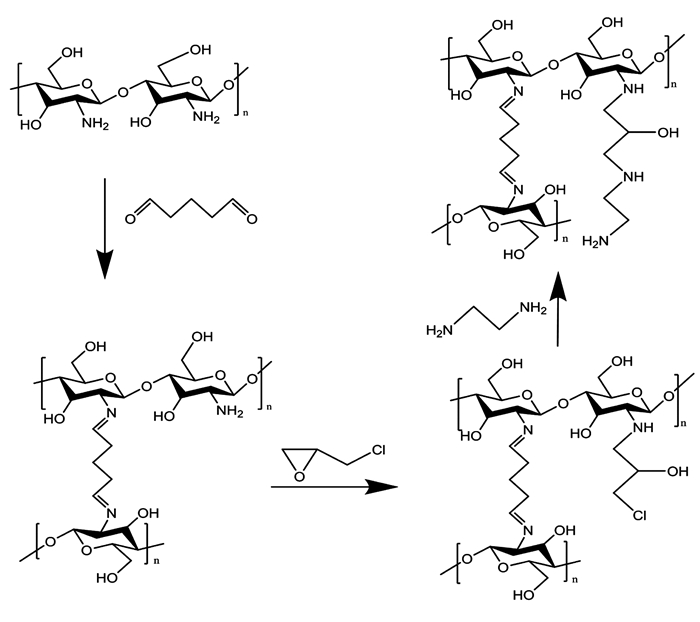
|
图 1 乙二胺改性壳聚糖过程 Fig. 1 Modification of chitosan by ethylenediamine |
在其他制备条件不变的情况下,分别研究戊二醛、环氧氯丙烷和乙二胺投加量不同时制备的壳聚糖小球对双氯芬酸的吸附效果,交联剂投加量见表 1.将制备的吸附剂放入50 mg/L的双氯芬酸溶液中震荡吸附12 h,根据吸附效果从中选出最佳吸附剂,并将其用于双氯芬酸的影响因素实验中.
| 表 1 不同吸附剂的交联剂投加量 Tab. 1 Dosages of cross-linking agents of different adsorbents |
通过冷场发射扫描电子显微镜(SU-8020,日本日立)及透射电子显微镜(HT7700,日本高科)观察壳聚糖及改性后的磁性壳聚糖小球形貌与结构,利用傅里叶红外光谱仪(VERTEX70,德国布鲁克公司)分析吸附剂EMMCS-G表面官能团的种类变化,吸附剂的晶型结构用X射线衍射仪(D8 Advance,德国布鲁克公司)测定,采用振动样品磁强计(BHV-50HTI,日本理研电子公司)表征吸附剂的磁学性能.
2 结果与讨论 2.1 最佳吸附剂选择根据1.2中制备条件及表 1中戊二醛、环氧氯丙烷以及乙二胺的投加量,制备吸附剂A、B、C、D、E、F、G、H、I,并将其放于20 mL初始质量浓度为50 mg/L的双氯芬酸溶液中震荡吸附12 h后,测定不同吸附剂的吸附效果,结果如图 2所示.由吸附剂A,B及C的吸附效果可以看出,当乙二胺加入量不变时,随着戊二醛加入量增多,去除率先升高后下降,在戊二醛加入量为4 mL时,效果最佳.这是由于戊二醛投加量不足时,交联作用较弱,但戊二醛加入过多又会导致氨基过度消耗,降低了交联效果,减少了有效吸附位点,使吸附效果不再提高反而下降.对于乙二胺投加量亦是如此,对比吸附剂B,D,E和F的吸附量可知,当戊二醛和环氧氯丙烷加入量一定时,乙二胺投加量增大,氨基数量增加,吸附位点增多,使吸附量提高,当继续增大时,吸附量不再提高,可能是因为壳聚糖上的氨基已经与乙二胺反应完全,过量的乙二胺反而会使活性位点减少,影响吸附效果.环氧氯丙烷的作用主要是在壳聚糖分子上引入环氧基,从而使其进一步与乙二胺反应,因此,讨论了当乙二胺投加量不变时,环氧氯丙烷对吸附效果的影响.结果表明,当环氧氯丙烷投加量为12 mL时,吸附效果最好.通过对比这几种吸附剂的吸附效果,选择吸附剂G(EMMCS-G)作为双氯芬酸的吸附剂,并将其用于动力学、热力学、pH等影响因素实验.

|
图 2 不同吸附剂的吸附效果 Fig. 2 Adsorption capacity of different adsorbents |
图 3为壳聚糖和改性磁性壳聚糖(EMMCS-G)的扫描电镜图和透射电镜图.由SEM图显示,壳聚糖形态呈块状,表面较为光滑,EMMCS-G形貌上为球形颗粒状,且整体呈现立体网状的空间结构,比表面积较大,更有利于吸附质分子与壳聚糖颗粒接触或者嵌入其中,增加对污染物的吸附.从TEM图中两种物质的形态来看,Fe3O4颗粒已成功被壳聚糖包覆[12],并且均匀地分布于壳聚糖交联体中, 粒径为5~25 nm,在EMMCS-G的TEM图中黑色颗粒状物质为Fe3O4,浅灰色部分为壳聚糖交联体.

|
图 3 壳聚糖及EMMCS-G的SEM图像和TEM图像 Fig. 3 SEM and TEM images of chitosan and EMMCS-G |
图 4为壳聚糖(CS)和改性磁性壳聚糖(EMMCS-G)在500~4 000 cm-1检测的红外光谱图.可以看出,改性磁性壳聚糖在560~660 cm-1是Fe3O4中Fe—O键的特征吸收峰[13],说明Fe3O4成功嵌入壳聚糖中.3 427 cm-1处吸收峰表示N—H和O—H的伸缩振动,2 918 cm-1以及2 875 cm-1两处为饱和C—H键的伸缩振动对应的吸收峰[11],1 080 cm-1处为壳聚糖分子中伯醇C—O键和伯胺C—N键伸缩振动的综合影响,1 604 cm-1左右为伯胺N—H键的弯曲振动吸收峰.改性后的壳聚糖(EMMCS-G)在各吸收峰处虽有所偏移,但基本与壳聚糖分子一致,且在1 635 cm-1左右出现了比较明显的C=N吸收峰,表明壳聚糖与戊二醛反应形成席夫碱[14-15].在3 411 cm-1以及1 049 cm-1左右的吸收峰明显变尖,说明改性后氨基和羟基的数量增加,乙二胺已成功接枝到壳聚糖分子上[16-17].

|
图 4 壳聚糖和EMMCS-G的红外光谱 Fig. 4 FTIR spectra of chitosan and EMMCS-G |
EMMCS-G的XRD图见图 5.图中出现了6个衍射峰(2θ=30.1°,35.5°,43.2°,53.4°,57.0°,62.7°),这些特征峰对应的晶型分别为(220)、(311)、(400)、(422)、(511)、(440),与标准的Fe3O4衍射数据(JCPDS No.88-0315)相符.进一步表明了Fe3O4成功被壳聚糖包覆,改性之后的磁性壳聚糖中Fe3O4晶型结构并未发生改变,使吸附剂保持良好的磁学性能[18].
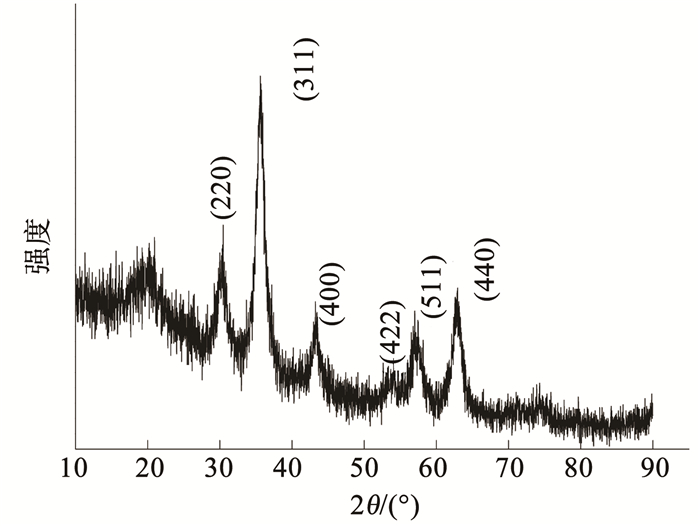
|
图 5 EMMCS-G的XRD图 Fig. 5 XRD pattern of EMMCS-G |
图 6为Fe3O4和改性磁性壳聚糖(EMMCS-G)的磁滞回线,可以看出,Fe3O4和EMMCS-G的饱和磁化强度分别为54.1和18.9 emu/g.由此可知,Fe3O4与壳聚糖结合后,其饱和磁化强度有所减弱,但实验中通过外加磁场,在40 s内完全可以达到将吸附剂从溶液中分离的效果(如图 6中插图所示),较普通壳聚糖的分离效率提高了30倍,进一步证明了吸附剂具有良好的磁学性能[19-20].
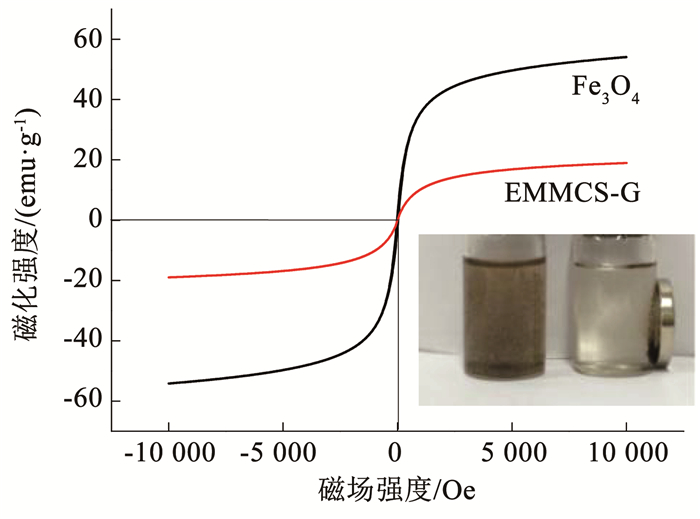
|
图 6 Fe3O4和EMMCS-G的磁滞回线 Fig. 6 Magnetic hysteresis loops of Fe3O4 and EMMCS-G |
配制初始质量浓度分别为50,100,150 mg/L的双氯芬酸溶液,取20 mL上述溶液和15 mg吸附剂EMMCS-G放入试剂瓶中,在25 ℃的水浴恒温震荡箱中以200 r/min的转速震荡,并于不同时间取样,测定剩余溶液质量浓度,并求出吸附量q及去除率η,计算公式如下:
| $ {q_t} = \frac{{\left( {{c_0}-{c_t}} \right)V}}{m}, $ | (1) |
| $ {\eta _t} = \frac{{{c_0}-{c_t}}}{{{c_0}}} \times 100\% . $ | (2) |
式中:qt为t时刻的吸附量(mg/g),c0、ct分别为初始时刻、t时刻的双氯芬酸溶液质量浓度(mg/L),V为双氯芬酸溶液的体积(mL),m为吸附剂质量(mg),ηt为t时刻的吸附去除率(%).
图 7(a)为EMMCS-G对3种不同初始质量浓度双氯芬酸溶液的吸附动力学曲线.可以看出,在反应初期(0~12 h),吸附量随时间变化接近直线增长,吸附速率较快,后期吸附量增长逐渐缓慢,3种质量浓度的溶液吸附情况均在48 h达到吸附平衡.出现这种现象主要是由于随着吸附的进行,吸附剂表面的大量活性位点被占据,且吸附剂表面和溶液中的双氯芬酸分子之间可能存在静电排斥作用以及吸附质向吸附剂内部缓慢扩散等原因导致吸附量增长缓慢并逐渐趋于平衡[5].3种不同初始质量浓度的双氯芬酸达到吸附平衡的时间对比表明,双氯芬酸初始质量浓度对平衡时间也存在一定影响,初始质量浓度越大,吸附平衡时间越长.

|
图 7 双氯芬酸初始质量浓度不同时EMMCSz-G对双氯芬酸的吸附动力学曲线和动力学模型 Fig. 7 Adsorption kinetic curves and kinetic models for diclofenac adsorption by EMMCS-G at different initial diclofenac concentrations |
根据准一级和准二级动力模型对数据进行拟合.准一级动力模型主要说明吸附过程由扩散步骤控制,是物理吸附过程;而准二级动力学模型则假定吸附过程由化学吸附控制,是通过吸附剂和吸附质之间的电子共用或电子转移来实现的[21].
准一级模型:
| $ \ln \;\left( {{q_{\rm{e}}} - {q_t}} \right) = {\rm{ln}}\;\;{{\rm{q}}_{\rm{e}}} - {k_l}t, $ | (3) |
准二级模型:
| $ \frac{t}{{{q_t}}} = \frac{1}{{{k_2}q_{\rm{e}}^2}} + \frac{t}{{{q_{\rm{e}}}}}. $ | (4) |
式中:qe为时间平衡时的吸附量,k1(h-1)和k2(g·mg/h)分别为准一级、准二级反应速率常数.
图 7(b)、(c)分别为准一级动力学模型和准二级动力学模型的拟合曲线,表 2为拟合后的动力学模型参数.可以看出,准二级动力学模型中的相关系数R2大于准一级模型,且准二级动力学中拟合的吸附量理论值qe(cal)更接近实测值qe(exp).双氯芬酸溶液初始质量浓度为100和150 mg/L时,速率常数k1几乎没有发生变化,这与吸附曲线的变化趋势不符[22].因此,磁性壳聚糖吸附双氯芬酸的过程更符合准二级动力学模型,表明该吸附过程主要是化学吸附控制过程[23].
| 表 2 双氯芬酸初始质量浓度不同时EMMCS-G对双氯芬酸的吸附动力学模型参数 Tab. 2 Parameters of adsorption kinetic model for diclofenac adsorption by EMMCS-G at different initial diclofenac concentrations |
准确称取15 mg EMMCS-G和20 mL不同初始质量浓度的双氯芬酸溶液(20~200 mg/L)在温度分别为25,35,45 ℃下震荡48 h.图 8(a)为3种不同温度条件下吸附量与双氯芬酸初始质量浓度之间的关系曲线.可以看出,随着双氯芬酸溶液平衡质量浓度的增加,吸附量逐渐升高.这是由于当吸附质浓度增大时,吸附剂与吸附质之间接触机会增加,导致传质驱动力增加,吸附量增大.同时可以看出,在相同平衡浓度下,随着温度的升高,吸附量呈现增加的趋势.

|
图 8 不同温度下EMMCS-G对双氯芬酸的吸附等温线和等温吸附模型 Fig. 8 Adsorption isotherm curves and linearized adsorption isotherm models for diclofenac adsorption by EMMCS-G at different temperatures |
通过Langmuir、Freundlich和Temkin 3种模型对实验结果进行拟合.Langmuir模型是假设吸附形成均匀吸附的单分子层,且被吸附的分子间没有相互作用.Freundlich模型则假设吸附过程为非均匀吸附,吸附质分子之间会相互作用,形成多层吸附的现象[2].Temkin模型是描述单分子层的化学吸附过程,反应中吸附热随吸附量线性降低[24].3种模型的方程式如下:
Langmuir模型
| $ \frac{{{c_{\rm{e}}}}}{{{q_{\rm{e}}}}} = \frac{{{c_{\rm{e}}}}}{{{q_{\rm{m}}}}} + \frac{1}{{{K_{\rm{l}}}{q_{\rm{m}}}}}, $ | (5) |
Freundlich模型
| $ {\rm{ln}}{q_{\rm{e}}} = {\rm{ln}}\;{K_{\rm{f}}} + \frac{1}{n}{\rm{ln}}\;{c_{\rm{e}}}, $ | (6) |
Temkin模型
| $ {q_{\rm{e}}} = \frac{{RT}}{{{b_{\rm{T}}}}}{\rm{ln}}\;{a_{\rm{T}}} + \frac{{RT}}{{{b_{\rm{T}}}}}{\rm{ln}}\;{c_{\rm{e}}}. $ | (7) |
式中:ce(mg/L)为达到吸附平衡时的平衡质量浓度,qm(mg/g)为理论最大吸附量,Kl(L/mg)为Langmuir模型中的吸附速率常数,Freundlich模型中参数Kf主要与吸附容量有关,1/n为表示吸附力的常数,一般认为1/n小于1时,该吸附过程为优惠型吸附,大于1时为非优惠型吸附[25].aT(L/mg)和bT(J/mol)为Temkin模型中的线性常数.R(8.314 J/(mol·K))为气体常数.
Langmuir模型、Freundlich模型和Temkin模型的拟合曲线见图 8(b)、(c)和(d),表 3为3种模型的拟合参数值.由表 3可知,从等温线模型拟合的相关系数R2来看,当温度在25~45 ℃,该吸附过程更符合Freundlich模型,表明吸附过程发生了多层的物理吸附现象,且3种温度条件下n值均大于1,即1/n在0~0.5,说明该吸附过程容易进行,是优惠吸附[19, 26].随着温度升高,Kf逐渐增大,表明在所研究的温度范围内,
| 表 3 不同温度下EMMCS-G对双氯芬酸的Langmuir、Freundlich和Temkin等温线模型参数 Tab. 3 Parameters of Langmuir, Freundlich, and Temkin adsorption isotherm models for diclofenac adsorption by EMMCS-G at different temperatures |
高温有利于吸附过程的进行,温度越高,吸附效果越好[2].Langmuir模型和Temkin模型的相关系数虽不及Freundlich模型,但R2均大于0.95,说明吸附过程可能存在一定单分子层的化学吸附行为[24],证明了物理吸附和化学吸附同时存在的可能性.
2.5 吸附热力学热力学参数包括自由能ΔG0(kJ/mol)、标准焓变ΔH0(J/mol)和标准熵变ΔS0(J/(mol·K)),计算公式如下:
| $ \Delta {G^0} = -RT{\rm{ln}}\;K, $ | (8) |
| $ {\rm{ln}}\;{K_{\rm{c}}} = \frac{{\Delta {S^0}}}{R}-\frac{{\Delta \;{H^0}}}{{RT}}. $ | (9) |
式中:R(8.314 J/(mol·K))为气体数,T(K)为开尔文温度,K为热力学等温变化常数.根据式(8),(9)作Van't Hoff图(如图 9所示),相关热力学参数如表 4所示.可以看出,在本文研究的温度范围内,自由能均为负值,随着温度升高,自由能的绝对值逐渐增大,说明吸附过程是自发反应,且自发性随温度升高而增加,由此表明高温有利于吸附反应自发程度的提高[27].ΔH0值大于0,进一步证实了该反应过程是一个吸热反应,根据焓变值和自由能的变化可以推断该反应存在化学吸附现象[28-29].熵变ΔS0为正值,说明吸附双氯芬酸过程增加了吸附剂表面的混乱程度.随着温度增加,固液之间的随机性增加,吸附物质自由度增强.

|
图 9 与热力学参数相关的Van't Hoff图 Fig. 9 Van't Hoff diagram of relevant thermodynamic parameters |
| 表 4 不同温度下EMMCS-G对双氯芬酸的吸附热力学参数 Tab. 4 Thermodynamic parameters for diclofenac adsorption by EMMCS-G at different temperatures |
向初始质量浓度为50 mg/L的双氯芬酸溶液中加入15 mg EMMCS-G,用0.1 mol/L的HCl和NaOH溶液调节溶液的pH至5~11,于25 ℃下以200 r/min的速度震荡48 h.
图 10为不同pH条件下EMMCS-G的Zeta电位图及双氯芬酸吸附量曲线.可以看出,当溶液pH处于5.0~8.5,随着pH的增加,EMMCS-G对双氯芬酸的吸附量先升高后缓慢下降,当pH=6.5,即溶液处于偏中性状态时吸附量达到最大值.出现这种现象可能是由于随着pH的升高,溶液中带负电荷的离子型双氯芬酸逐渐增多,且此时壳聚糖表面氨基发生质子化带正电荷,因此, 由于较强的静电引力作用,EMMCS-G对双氯芬酸的吸附量逐渐升高.但随pH继续升高,壳聚糖表面电位值逐渐降低,溶液中的OH-数量也在增加.壳聚糖与双氯芬酸之间的静电引力在减弱的同时,OH-与双氯芬酸离子之间形成竞争吸附,致使吸附量下降[18].

|
图 10 不同pH条件下EMMCS-G的Zeta电位图及对双氯芬酸的吸附曲线 Fig. 10 Zeta potential of EMMCS-G and adsorption curves of diclofenac by EMMCS-G at different pH |
当pH>8.5(pHZPC)时,壳聚糖表面的氨基发生去质子化且带负电荷,壳聚糖与双氯芬酸离子之间存在静电斥力,并且随着溶液pH的升高,这种静电斥力不断增强,因此,吸附效果大幅下降.
当pH较低或者较高时,静电引力已经不能成为吸附的主导作用,但结果表明仍有部分双氯芬酸被吸附到吸附剂表面,所以,除静电引力外,可能还存在其他作用力,如氢键作用[30].图 11为EMMCS-G吸附双氯芬酸机理图.

|
图 11 EMMCS-G吸附双氯芬酸机理 Fig. 11 Mechanism of diclofenac adsorption by EMMCS-G |
取20 mL初始质量浓度为50 mg/L的双氯芬酸溶液,分别加入5,10,15,20,30,50,60,80,100 mg的EMMCS-G,置于25 ℃的恒温水浴震荡箱中反应12 h.
图 12为不同吸附剂质量浓度对双氯芬酸去除的影响.可以看出,随着吸附剂质量浓度的增加,去除率逐渐提高,吸附量下降.这是由于当吸附剂质量浓度增大时,吸附位点增多,有更多的双氯芬酸分子被吸附到吸附剂表面,使去除率提高.同时,吸附剂质量浓度增加后,分配至单位质量吸附剂上的吸附质分子数量减少,单位质量的吸附剂利用率降低,从而使吸附量下降[31].

|
图 12 不同吸附剂质量浓度下EMMCS-G对双氯芬酸的吸附量/去除率曲线 Fig. 12 Adsorption capacity and removal efficiency curves of diclofenac by EMMCS-G under various adsorbents concentrations |
取150 mg EMMCS-G放于200 mL初始质量浓度为50 mg/L的双氯芬酸溶液中,达到吸附平衡后,测定剩余溶液质量浓度.然后用磁铁将吸附剂从溶液中分离出来,放于0.1 mol/L的NaOH溶液中震荡解吸24 h,用去离子水洗涤吸附剂至中性后干燥并用于下一次吸附实验,此步骤重复4次,测定每次解吸实验后,吸附剂的吸附效果.图 13为4次吸附-解吸实验EMMCS-G吸附量的变化.可以看出,相比初始吸附,在后几次的吸附实验中,EMMCS-G对双氯芬酸的吸附量有所下降,可能是由于一部分双氯芬酸分子进入到吸附剂内部,导致吸附质无法完全被洗脱下来,因此,活性位点减少,吸附量下降[32].在4次再生实验中,EMMCS-G对双氯芬酸的吸附量仍然能够保持初始吸附量的75.4%,82.1%,81.4%和68.6%,且均在21 mg/g以上,表明EMMCS-G具有较好的重复利用能力.

|
图 13 不同再生次数下EMMCS-G对双氯芬酸的吸附量 Fig. 13 Adsorption capacity of EMMCS-G for diclofenac removal under different regeneration cycles |
1) 通过戊二醛和乙二胺对磁性壳聚糖进行交联改性,研究了不同戊二醛、环氧氯丙烷及乙二胺投加量下改性磁性壳聚糖小球对双氯芬酸的吸附效果.结果表明,戊二醛、环氧氯丙烷和乙二胺投加量分别为4,12和6 mL时制备的吸附剂(EMMCS-G)吸附效果最佳.反应最适pH为6.5,当双氯芬酸质量浓度为50 mg/L,吸附剂投加量为100 mg时,反应12 h后,去除率达76%以上,去除效果较好.
2) 利用SEM、TEM、FTIR、XRD及VSM等手段对EMMCS-G进行表征,结果表明壳聚糖成功包覆Fe3O4,通过乙二胺改性,吸附剂分子中氨基数量明显增加,且具有良好的磁学性能.
3) EMMCS-G对双氯芬酸的吸附过程符合准二级动力学模型,结合吸附热力学分析,发现吸附过程中存在化学吸附现象,该过程符合Freundlich等温吸附模型.在溶液酸碱度实验中,发现吸附过程主要通过静电引力作用,说明该吸附过程还存在物理吸附现象,是化学吸附与物理吸附的共同作用.
4) 经过4次吸附-解吸实验,EMMCS-G对双氯芬酸仍保持较好的吸附能力.
5) 传统吸附材料如活性炭制备和再生成本较高, 膨润土在应用中存在难以回收和分离等问题.相较而言,壳聚糖价格低廉,可生物降解,环保无毒,磁性壳聚糖小球制备方法操作简便,在酸性溶液中稳定性增强,通过外加磁场可实现快速分离,无二次污染,具备优良的吸附效果和重复利用性,应用前景较佳.
| [1] |
曹双双, 段艳平, 涂耀仁, 等. 铁氧磁体纳米颗粒去除水体中新型污染物双氯芬酸[J]. 环境化学, 2018, 37(4): 761. CAO Shuangshuang, DUAN Yanping, TU Yaoren, et al. Removal of emerging contaminant diclofenac from water using ferrite nanoparticles[J]. Environmental Chemistry, 2018, 37(4): 761. |
| [2] |
DE FRANCO M A E, DE CARVALHO C B, BONETTO M M, et al. Diclofenac removal from water by adsorption using activated carbon in batch mode and fixed-bed column: Isotherms, thermodynamic study and breakthrough curves modeling[J]. Journal of Cleaner Production, 2018, 181: 145. DOI:10.1016/j.jclepro.2018.01.138 |
| [3] |
ZHAO Yue, LIU Fei, QIN Xiaopeng. Adsorption of diclofenac onto goethite: Adsorption kinetics and effects of pH[J]. Chemosphere, 2017, 180: 373. DOI:10.1016/j.chemosphere.2017.04.007 |
| [4] |
BHADRA B N, AHMED I, KIM S, et al. Adsorptive removal of ibuprofen and diclofenac from water using metal-organic framework-derived porous carbon[J]. Chemical Engineering Journal, 2017, 314: 50. DOI:10.1016/j.cej.2016.12.127 |
| [5] |
熊振湖, 王璐, 周建国, 等. 磁性多壁碳纳米管吸附水中双氯芬酸的热力学与动力学[J]. 物理化学学报, 2010, 26(11): 2890. XIONG Zhenhu, WANG Lu, ZHOU Jianguo, et al. Thermodynamics and kinetics of adsorption of diclofenac on magnetic multiwalled carbon nanotubes in an aqueous solution[J]. Acta Physico-Chimica Sinica, 2010, 26(11): 2890. DOI:10.3866/PKU.WHXB20101130 |
| [6] |
唐志儒, 陈一, 闻岳, 等. 交联壳聚糖珠吸附活性染料的动力学研究[J]. 环境工程学报, 2012, 6(9): 3007. TANG Zhiru, CHEN Yi, WEN Yue, et al. Kinetics study of reactive dyes adsorption by crosslinked chitosan beads[J]. Chinese Journal of Environmental Engineering, 2012, 6(9): 3007. |
| [7] |
周利民, 王一平, 黄群武. 乙二胺改性壳聚糖磁性微球吸附Hg2+和UO22+[J]. 核化学与放射化学, 2007, 29(3): 184. ZHOU Limin, WANG Yiping, HUANG Qunwu. Adsorption of Hg2+ and UO22+ by ethylenediamine modified chitosan magnetic microspheres[J]. Journal of Nuclear and Radiochemistry, 2007, 29(3): 184. DOI:10.3969/j.issn.0253-9950.2007.03.011 |
| [8] |
蒲生彦, 王可心, 马慧, 等. 磁性壳聚糖凝胶微球对水中Pb(Ⅱ) 的吸附性能[J]. 中国环境科学, 2018, 38(4): 1364. PU Shengyan, WANG Kexin, MA Hui, et al. Adsorption properties of magnetic chitosan hydrogelmicrospheres to Pb(Ⅱ) from aqueous solutions[J]. China Environmental Science, 2018, 38(4): 1364. |
| [9] |
丁杰, 沙焕伟, 赵双阳, 等. 磁性氧化石墨烯/壳聚糖制备及其对磺胺嘧啶吸附性能研究[J]. 环境科学学报, 2016, 36(10): 3691. DING Jie, SHA Huanwei, ZHAO Shuangyang, et al. Synthesis of graphene oxide/magnetite chitosan composite and adsorption performance for sulfadiazine[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3691. DOI:10.13671/j.hjkxxb.2016.0142 |
| [10] |
FAN Lulu, ZHANG Ying, LI Xiangjun, et al. Removal of alizarin red from water environment using magnetic chitosan with Alizarin Red as imprinted molecules[J]. Colloids and Surfaces B: Biointerfaces, 2012, 91: 250. DOI:10.1016/j.colsurfb.2011.11.014 |
| [11] |
CHEN Yuwei, WANG Jianlong. Preparation and characterization of magnetic chitosan nanoparticles and its application for Cu(Ⅱ) removal[J]. Chemical Engineering Journal, 2011, 168(1): 286. DOI:10.1016/j.cej.2011.01.006 |
| [12] |
CHEN Bo, ZHAO Huinan, CHEN Sijiang, et al. A magnetically recyclable chitosan composite adsorbent functionalized with EDTA for simultaneous capture of anionic dye and heavy metals in complex wastewater[J]. Chemical Engineering Journal, 2019, 356: 69. DOI:10.1016/j.cej.2018.08.222 |
| [13] |
WANG Jingsong, PENG Ruiting, YANG Jinhui, et al. Preparation of ethylenediamine-modified magnetic chitosan complex for adsorption of uranyl ions[J]. Carbohydrate Polymers, 2011, 84(3): 1169. DOI:10.1016/j.carbpol.2011.01.007 |
| [14] |
ZHOU Limin, JIN Jieyun, LIU Zhirong, et al. Adsorption of acid dyes from aqueous solutions by the ethylenediamine-modified magnetic chitosan nanoparticles[J]. Journal of Hazardous Materials, 2011, 185(2/3): 1045. DOI:10.1016/j.jhazmat.2010.10.012 |
| [15] |
MONIER M, AYAD D M, WEI Y, et al. Adsorption of Cu(Ⅱ), Co(Ⅱ), and Ni(Ⅱ) ions by modified magnetic chitosan chelating resin[J]. Journal of Hazardous Materials, 2010, 177(1/2/3): 962. DOI:10.1016/j.jhazmat.2010.01.012 |
| [16] |
ZHOU Limin, LIU Zhirong, LIU Jinhui, et al. Adsorption of Hg(Ⅱ) from aqueous solution by ethylenediamine-modified magnetic crosslinking chitosan microspheres[J]. Desalination, 2010, 258(1/2/3): 41. DOI:10.1016/j.desal.2010.03.051 |
| [17] |
杨武, 潘薇, 郭昊. 壳聚糖和乙二胺改性Fe3O4磁性纳米粒子的制备及其对酸性品红的吸附特性[J]. 西北师范大学学报(自然科学版), 2016, 52(3): 78. YANG Wu, PAN Wei, GUO Hao. Modification of the nano Fe3O4 using chitosan and ethylenediamine and its adsorption behavior for acid magenta[J]. Journal of Northwest Normal University (Natural Science), 2016, 52(3): 78. DOI:10.16783/j.cnki.nwnuz.2016.03.015 |
| [18] |
LIANG Xuexue, OMER A M, HU Zhaohong, et al. Efficient adsorption of diclofenac sodium from aqueous solutions using magnetic amine-functionalized chitosan[J]. Chemosphere, 2017, 217: 270. DOI:10.1016/j.chemosphere.2018.11.023 |
| [19] |
MIAO Jiahe, WANG Fenghe, CHEN Yajun, et al. The adsorption performance of tetracyclines on magnetic graphene oxide: A novel antibiotics absorbent[J]. Applied Surface Science, 2019, 475(1): 549. DOI:10.1016/j.apsusc.2019.01.036 |
| [20] |
LI Kun, WANG Yawen, HUANG Mu, et al. Preparation of chitosan-graft-polyacrylamide magnetic composite microspheres for enhanced selective removal of mercury ions from water[J]. Journal of Colloid and Interface Science, 2015, 455: 261. DOI:10.1016/j.jcis.2015.05.043 |
| [21] |
REYNAUD F, TSAPIS N, DEYME M, et al. Spray-dried chitosan-metal microparticles for ciprofloxacin adsorption: Kinetic and equilibrium studies[J]. Soft Matter, 2011, 7(16): 7304. DOI:10.1039/c1sm05509g |
| [22] |
苏立强, 滕跃, 王媛媛, 等. 磁性壳聚糖表面印迹四环素材料的制备及其吸附性能研究[J]. 分析实验室, 2017, 36(9): 1071. SU Liqiang, TENG Yue, WANG Yuanyuan, et al. Study on preparation and adsorption properties of magnetic-chitosan surface imprinted tetracycline[J]. Chinese Journal of Analysis Laboratory, 2017, 36(9): 1071. DOI:10.13595/j.cnki.issn1000-0720.2017.0230 |
| [23] |
HUANG Mingjie, ZHOU Tao, WU Xiaohui, et al. Adsorption and degradation of norfloxacin by a novel molecular imprinting magnetic Fenton-like catalyst[J]. Chinese Journal of Chemical Engineering, 2015, 23(10): 1698. DOI:10.1016/j.cjche.2015.08.030 |
| [24] |
赵文杰, 孙雪菲, 丁可, 等. 一种新型改性交联壳聚糖的制备及其对废水中四环素的去除机理[J]. 山东大学学报(工学版), 2014, 44(5): 65. ZHAO Wenjie, SUN Xuefei, DING Ke, et al. The preparation of a new kind of modified chitosan material and its removing mechanism of tetracycline from waste water[J]. Journal of Shandong University (Engineering Science), 2014, 44(5): 65. DOI:10.6040/j.issn.1672-3961.0.2013.329 |
| [25] |
RANGABHASHIYAM S, ANU N, GIRI NANDAGOPAL M S, et al. Relevance of isotherm models in biosorption of pollutants by agricultural byproducts[J]. Journal of Environmental Chemical Engineering, 2014, 2(1): 398. DOI:10.1016/j.jece.2014.01.014 |
| [26] |
JODEH S, ABDELWAHAB F, JARADAT N, et al. Adsorption of diclofenac from aqueous solution using Cyclamen persicum, tubers based activated carbon (CTAC)[J]. Journal of the Association of Arab Universities for Basic and Applied Sciences, 2016, 20(1): 32. DOI:10.1016/j.jaubas.2014.11.002 |
| [27] |
INYINBOR A A, ADEKOLA F A, OLATUNJI G A. Kinetics, isotherms and thermodynamic modeling of liquid phase adsorption of Rhodamine B dye onto Raphia hookerie fruit epicarp[J]. Water Resources and Industry, 2016, 15: 14. DOI:10.1016/j.wri.2016.06.001 |
| [28] |
RATHOD M, HALDAR S, BASHA S. Nanocrystalline cellulose for removal of tetracycline hydrochloride from water via biosorption: Equilibrium, kinetic and thermodynamic studies[J]. Ecological Engineering, 2015, 84: 240. DOI:10.1016/j.ecoleng.2015.09.031 |
| [29] |
YU Zihan, ZHANG Xiaodan, HUANG Yuming. Magnetic chitosan-iron(Ⅲ) hydrogel as a fast and reusable adsorbent for chromium(Ⅵ) removal[J]. Industrial & Engineering Chemistry Research, 2013, 52(34): 11956. DOI:10.1021/ie400781n |
| [30] |
HU Dalin, HUANG Haoyu, JIANG Ran, et al. Adsorption of diclofenac sodium on bilayer amino-functionalized cellulose nanocrystals/chitosan composite[J]. Journal of Hazardous Materials, 2019, 369: 483. DOI:10.1016/j.jhazmat.2019.02.057 |
| [31] |
罗钰, 白波, 王洪伦, 等. MnO2@海藻酸基炭吸附去除双氯芬酸钠及其再生[J]. 化学工程, 2018, 46(4): 23. LUO Yu, BAI Bo, WANG Honglun, et al. Adsorptive removal of diclofenac by MnO2@alginate-carbon and regeneration[J]. Chemical Engineering(China), 2018, 46(4): 23. DOI:10.3969/j.issn.1005-9954.2018.04.005 |
| [32] |
ZHANG Shaopeng, DONG Yayi, YANG Zhen, et al. Adsorption of pharmaceuticals on chitosan-based magnetic composite particles with core-brush topology[J]. Chemical Engineering Journal, 2016, 304: 325. DOI:10.1016/j.cej.2016.06.087 |
 2021, Vol. 53
2021, Vol. 53


