2. 中日友好环境保护中心,北京 100029
2. Sino-Japan Friendship Center for Environmental Protection, Beijing 100029, China
近年来,对于畜禽产品的需求不断扩大,集约化养殖场为提高畜禽生长和预防畜禽疾病,大量使用兽用抗生素添加剂,30%~90%的抗生素都会通过畜禽的粪便和尿液而排出体外[1].过量使用兽用抗生素可能引起畜禽肠道细菌染色体突变或已有抗性基因被细菌移动元件捕获,畜禽粪便除有抗生素残留外,还携带抗性细菌及抗性基因(antibiotic resistance genes,ARGs)[2].长期施用未被处理的畜禽粪便容易造成环境中抗性细菌的增多,而这些抗性细菌携带的抗生素抗性基因通过水平转移(horizontal gene transfer,HGT)在环境中传播,导致环境中的病原菌对抗生素的抗性增强,从而威胁人类的健康.
在中国的北方地区,畜禽粪便中检出率最高的抗生素是四环素类,其次是喹诺酮类、磺胺类和大环内酯类[3].研究表明,堆肥是一种有效削减粪便中抗生素、ARGs和病原菌的有效方式.Chen等[4]研究表明,金霉素、磺胺甲基嘧啶、恩诺沙星和红霉素在堆肥结束时全部降解.Zaleski等[5]研究牛粪堆肥时发现,90%以上的大肠杆菌和沙门氏菌在10 d以内灭活,李氏杆菌在堆肥14 d后检测不到[6].
目前,中国养殖场猪粪多是经堆肥后回用于农田,堆肥产品中的耐药菌也进入土壤环境,粪便堆肥产品中未被消灭的致病性耐药菌依然会对土著微生物造成危害[7],现阶段仍缺乏堆肥产品中耐药病原微生物的研究.因此,对于猪粪及其堆肥产品中耐药细菌的种类、数量和分布的探究为评价粪源有机肥料的环境风险提供重要理论依据.本试验采微生物培养、微量肉汤稀释法和细菌16S rDNA分子鉴定等方法,对从养猪场的猪粪及外源添加不同初始浓度金霉素的猪粪堆肥样品中筛选可培养的抗生素抗性细菌,并通过美国国家生物技术信息中心(NCBI)数据库的比对,鉴定所筛选抗生素抗性细菌的种类,并对细菌的耐药性及分布规律进行研究,并通过对猪粪及其堆肥产品中可培养耐药菌的对比研究,揭示堆肥对耐药细菌的影响及潜在环境危害.
1 实验 1.1 实验样品的收集实验所需的母猪粪取自哈尔滨的养猪场,堆肥样品来源于实验室前期进行的外源添加不同初始浓度金霉素的猪粪堆肥结束时的堆肥产品,对照组CK初始金霉素(chlortetracycline, CTC)残留量为(0.71±0.02)mg/kg,P1组初始CTC残留量为(20.27±3.01)mg/kg,P2组初始CTC的残留量为(101.35±7.07)mg/kg.采集的猪粪及其堆肥产品分两部分保存,一部分置于4 ℃冰箱保存,用于可培养抗生素抗性细菌的筛选、药物检测及常规理化性质的检测;另一部分置于-20 ℃冰箱保存,用于兽用抗生素的检测.
1.2 培养基的制备LB液体培养基:含10 g胰蛋白胨、5 g酵母提取物和5 g NaCl,以蒸馏水定容至1 L,pH为7.0,于121 ℃灭菌20 min,备用.
LB固体培养基:含10 g胰蛋白胨、5 g酵母提取物和5 g NaCl,15 g琼脂粉,以蒸馏水定容至1 L,pH为7.0,于121 ℃灭菌20 min,备用.
麦康凯琼脂培养基:购置于中国青岛海博生物公司,称取50.0 g麦康凯琼脂培养基粉末,以蒸馏水定容至1 L,pH为7.0,于105 Pa、121 ℃灭菌15 min,备用.
1.3 可培养细菌的分离纯化分别从每个样品稀释平板上随机挑取单菌落,在平板上划线挑取单菌落,再次划线,经过3次纯化,保证得到单一纯化的菌株.纯化的菌株分别接种到LB液体培养基上,于37 ℃、220 r/min培养24 h,按20%的比例加入适量甘油,置-20 ℃冰箱保存菌种.
1.4 可培养细菌的计数取5 g猪粪和堆肥样品置于三角瓶中,加入45 mL的灭菌生理盐水(0.85%),在200 r/min振荡器振荡20 min,震荡结束后静置5 min,分别吸取1 mL样品置于灭菌的且含9 mL生理盐水的试管中,依次稀释到10-1~10-6.取混匀后稀释的10-4样品100 μL涂布于琼脂平板上,以平板上150~200个菌落为标准,确定稀释梯度.作3个平行.37 ℃于培养箱中倒置培养36 h.36 h后平板上长出细菌后即可进行计数.
1.5 耐药细菌计数取混匀后稀释的10-4浓度的样品分别均匀涂布在含有CTC终质量浓度为30 μg/mL、磺胺甲基嘧啶(Sulfamerazine, SMZ)终质量浓度为10 μg/mL、恩诺沙星(Enrofloxacin, ENR)终质量浓度为10 μg/mL、红霉素(Erythromycin, ERY)终质量浓度为8 μg/mL的抗性平板.另取100 μL对上述4种抗生素均无抗性的大肠杆菌(DH5α)分别涂布在每种抗生素抗性平板上,作为阴性对照.
1.6 DNA提取方法筛选的细菌基因组提取使用E.Z.N.A Ⓡ Soil DNA Kit(Omega Bio-Tek, USA),按照其说明操作,用NanoDrop 8000高通量分光光度计(NanoDrop Technologies, Germany)测定DNA浓度和纯度.DNA于-20 ℃冰箱保存备用.
1.7 微量肉汤稀释法测定MIC值实验用组合式药敏MIC & MBC测试盒(冻干型)购置于天津市金章科技有限公司,操作方法按照其说明书进行.选取常用的兽用抗生素,阿莫西林/克拉维酸(Amoxicillin/clavulanic acid,AMO)、环丙沙星(Ciprofloxacin,CIP)、ENR、ERY、SMZ、四环素(Tetracycline,TET)、CTC和甲氧苄啶/磺胺甲恶唑(Trimethoprim/sulfamethoxazole,TMP)这8种抗生素进行实验.用微量移液器按照100 μL/孔的量取0.5麦氏浓度的菌液加入药敏板中,使菌液最终接种浓度约为105CFU/mL,盖上无菌盖.菌液接种完成后,将药敏板置于垫有湿纱布的瓷盘内,放置于35 ℃恒温箱中孵育16~24 h.观察平板菌落的生长情况并计数.抗生素储备液的质量浓度如表 1所示.
1.8 可培养耐药细菌16S rRNA的PCR扩增以提取的粪便和堆肥中可培养耐药细菌的基因组为模板,用通用引物27F/1492R(见表 2)进行PCR扩增细菌.PCR的反应条件为:95 ℃预变性5 min; 94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸90 s,循环25次; 72 ℃延伸10 min.所得扩增的产物经纯化后到生工生物工程(上海)股份有限公司进行测序,获得的序列在NCBI数据库中进行BLAST序列比对,筛选同源序列.将分离纯化的16S rRNA基因序列与下载的同源序列通过MEGA 4.0软件进行完全比对.
| 表 2 16S rRNA引物序列及退火温度 Tab. 2 16S rRNA primer sequence and annealing temperature |
猪粪样品中可培养细菌菌落数为1.05×1010 CFU/g(干质量),堆肥第1天CK、P1和P2样品中可培养细菌菌落数分别为2.48×109, 4.29×109和4.19×109 CFU/g,明显低于粪便样品中的可培养细菌菌落数.在堆肥升温期,第1~第4天温度由35 ℃升高到50 ℃,嗜温菌活跃,堆体CK、P1和P2可培养菌落数迅速升高.如图 1所示,高温期(第9~28天)时,由于粪便中的大多病原微生物被杀灭,堆体CK、P1和P2的可培养细菌菌落数下降明显.随后,堆肥进入降温期,在第44天时,堆体温度降到44 ℃,此时嗜温菌再次活跃,继续分解难降解有机物,使可培养细菌菌落数有所升高.随着温度逐渐降低并趋于稳定及腐殖质的形成,可培养细菌菌落数也逐渐趋于稳定.堆肥结束时,CK、P1和P2中可培养细菌菌落数分别为4.88×109,6.25×109和5.31×109 CFU/g.

|
图 1 堆肥过程可培养细菌数量的变化 Fig. 1 Changes in numbers of culturable bacteria during composting |
本研究中的猪粪样品除了含有CTC,还检测到了ENR、ERY和SMZ药物残留.由图 2可知,经过高温堆肥后,只有ENR耐药菌数量增加了,CK、P1和P2堆体分别增加了0.71log、1.43log和0.57log.CK、P1和P2堆肥的CTC耐药菌分别削减了0.66log、0.45log和1.03log.CK、P1和P2堆肥的ERY耐药菌分别削减了0.46log、0.67log和0.60log.CK、P1和P2堆肥的SMZ耐药菌分别削减了0.76log、0.66log和0.67log.由图 2(a)可知,ENR耐药菌数量在堆肥的高温期(第4~28天)迅速升高,这表明ENR耐药菌属于嗜热菌,而在降温期和腐熟期其数量缓慢下降,直至堆肥结束,其数量保持稳定.堆肥过程中CTC耐药菌数量是4种耐药菌中最低的,这可能是由于CTC的杀菌效果好导致其耐药菌数量少.说明堆肥对于SMZ、ERY和CTC耐药菌的削减是非常有效的.

|
图 2 堆肥过程中可培养耐药细菌的变化 Fig. 2 Changes of culturable resistant bacteria during composting |
在堆肥的升温期(第1~4天),CTC残留量缓慢降低,堆体CK中CTC在第4天全部降解.升温期的CTC、ERY和SMZ抗性细菌与可培养细菌菌落数比值是逐渐升高的(图 3),表明这3种耐药菌中的嗜温菌在堆肥升温期极为活跃,促使堆肥温度不断上升.在堆肥高温期(第4~28天),堆体P1和P2中的CTC质量浓度迅速下降,堆体P1中的CTC在第28天全部降解.高温期的CTC、ERY和SMZ抗性细菌与可培养细菌菌落数比值迅速下降,表明这3种耐药菌中的嗜温菌受高温的抑制作用而衰亡或休眠,但ENR耐药菌与可培养细菌菌落数比值明显升高,说明本研究的堆肥过程中ENR耐药细菌大多是促进堆肥迅速进入高温期的嗜热菌,在高温阶段起主要作用.堆肥的降温期(第28~59天),堆体P2中的CTC残留量缓慢下降,直至第44天CTC全部降解.降温期的CTC、ERY和SMZ抗性细菌与可培养细菌菌落数比值稍有波动,但变化不大,而此时ENR耐药菌与可培养细菌菌落数比值迅速下降,这是由于温度的下降导致嗜温菌重新复苏,开始活跃,而ENR耐药菌多为嗜热菌,温度下降对ENR耐药菌与可培养细菌菌落数的比值影响较大.在堆肥的腐熟期(第59~113天),CTC、ERY、ENR和SMZ抗性细菌与可培养细菌菌落数比值逐渐趋于稳定,变化不大.堆肥结束后,CTC、ERY、ENR和SMZ抗性细菌占可培养菌落数百分比分别为0.03%~0.06%、10.49%~17.73%、0.46%~0.76%和8.38%~16.52%.

|
图 3 堆肥过程中可培养耐药菌占可培养细菌菌落数比例变化 Fig. 3 Changes of ratio of culturable resistant bacteria to culturable bacteria during composting |
如表 3所示,温度与CTC耐药菌数量(0.01<p<0.05)、ENR耐药菌数量(p<0.01)、ERY耐药菌数量(p<0.01)、SMZ耐药菌数量(p<0.01)均呈显著正相关,这说明堆肥过程中温度是影响可培养耐药菌数量的关键因素.CTC残留量与CTC耐药菌数量(0.01<p<0.05)、ERY耐药菌数量(p<0.01)呈显著正相关.由于CTC属于广谱性抗生素,相关性结果表明,CTC残留量越高,其对CTC耐药菌和ERY耐药菌的抑制作用越强.
| 表 3 耐药菌数量、CTC浓度和温度之间的相关性分析 Tab. 3 Correlation among culturable resistant bacteria, concentration of CTC, and temperature |
猪粪中的病原菌和有害微生物经高温好氧堆肥被杀死,在堆肥过程中逐渐形成新的稳定的、营养较高的腐殖质.而堆肥产品将直接施用于土壤中,用以提高有机质、氮、磷、钾等养分,促进农作物的生长,从而达到提高土壤肥力的效果.采用LB培养基和麦康凯培养基(MAC)筛选猪粪及其堆肥产品中的可培养耐药细菌共88株.如图 4所示,LB培养基筛选出49株CTC耐药菌,MAC培养基筛选出39株CTC耐药菌.LB培养基中筛选出1株鹑鸡肠球菌和1株粪肠球菌,而MAC培养基中没有筛选出肠球菌,这是由于肠球菌属于革兰阳性(G+)球菌,MAC培养基中的胆酸盐能抑制革兰氏阳性(G+)菌生长,更有利于大肠杆菌的筛选.由图 4可知,堆肥产品P2中筛选出的可培养CTC耐药菌株数明显小于猪粪、CK堆肥产品和P1堆肥产品.这可能是由于P2堆肥初始时CTC的残留量为(101.35±7.07)mg/kg,远大于CK((0.71±0.02)mg/kg)和P1((20.27±3.01)mg/kg),但是初始P2堆肥中高浓度的CTC对微生物的抑制(杀菌)作用较为明显,随着堆肥不断腐熟,CTC在堆肥降温期降解完全,抗生素的压力逐渐减小,堆肥的高温阶段对可培养CTC耐药菌(图 2(a))及其与总可培养细菌数量比值(图 3(a))的削减较为明显,以致堆肥P2的可培养CTC耐药菌数量及其与总可培养细菌数量的比值均小于CK和P1,这些因素导致堆肥结束时P2堆肥中可培养CTC耐药菌数量较低.由图 4可以看出,无论是LB培养基还是MAC培养,P1和P2堆肥产品并没有检测到弗格森埃希菌,而在猪粪样品和CK堆肥产品中检测到可培养的弗格森埃希菌,这可能是由P1和P2堆肥中初始CTC浓度高于CK,导致CTC对弗格森埃希菌的抑制作用较大而造成的.
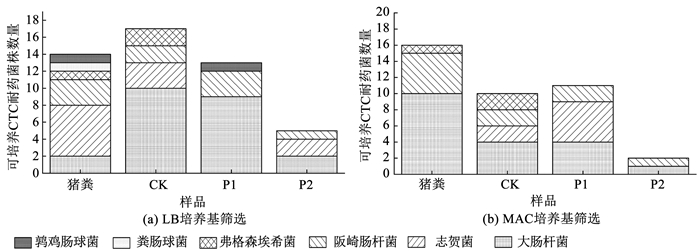
|
图 4 可培养金霉素耐药细菌的筛选 Fig. 4 Screening of culturable CTC resistant bacteria |
对已筛选出的88株CTC耐药菌进行测序和比对,剔除重复的菌后,有25株不同的CTC耐药菌,分布在4个不同的属,6个不同的种,根据美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的标准将筛选的耐药细菌进行敏感(S)、中介(I)、耐药(R)分类[8-10],表 4为抗生素抗性检测统计结果.
| 表 4 抗生素抗性检测统计结果 Tab. 4 Statistical results of antibiotic resistance test |
本研究中没有TMP耐药菌,这可能是由于取的猪粪源于饲料或治疗用TMP量较少的猪中.而对于SMZ,只有菌C4是SMZ的耐药菌,其他菌株都对SMZ敏感.由表 3可知,CTC和TET两种药物的耐药菌分别为23株和20株.ERY属于大环内酯类抗生素,菌EGS、E6、E7是ERY的耐药菌,有11株菌对ERY是敏感的.ENR的耐药菌有5株,有15株对ENR是中度敏感.CIP的耐药菌有4株,敏感的菌株有19株.AMO的耐药菌仅有E15 1株,其他大部分是对AMO敏感的菌株.
对于3种及3种以上抗生素有抗性的菌是多重耐药菌.本研究中多重耐药菌的检出率为20%.其中,菌C4、E4和E15是对3种抗生素具有耐药性的菌.检出的多重耐药菌包括鹑鸡肠球菌和肠杆菌两类.菌E6和E7都对CTC、TET、ERY、ENR和CIP这5种抗生素具有抗性.三重耐药菌C4来源于猪粪和CK堆肥产品,而在P1和P2堆肥产品中并没有筛选到,这表明初始含20和100 mg/kg CTC的猪粪堆肥过程对菌C4的去除是有效果的.三重耐药菌E15仅来源于猪粪样品,在堆肥样品CK、P1和P2中并未检测到,这说明高温好氧堆肥对于菌E15有效削减.三重耐药菌E4和五重耐药菌E7来源于猪粪样品与CK、P1和P2堆肥产品,这表明堆肥过程并没有对菌E4和E7起到削减作用.
3 讨论微生物在好氧堆肥过程中起着重要的作用,而在堆肥的各个阶段中细菌最普遍、数量最多[11-12].在堆肥第9天温度达到60 ℃,而第9~28天是堆体CK、P1和P2的高温期,温度均>55 ℃超过7 d,符合国家的GB7959—87《粪便无害化处理卫生要求》.由于嗜温菌因堆肥高温期温度较高而休眠或死亡,嗜热微生物迅速繁殖成为优势菌群,分解半纤维素、纤维素等难分解物质,同时,大多数病原菌被杀死,达到堆肥的无害化[13].堆肥第1天,堆体CK中可培养细菌的数量比P1和P2堆体少,可能是由于初始粪便样品中含有的可培养细菌不均匀.堆体P1中CTC在第28天全部降解完全,而堆体P2中CTC在第44天全部降解完全.因此,抗生素在堆肥降温期和腐熟期时对可培养细菌的选择性压力消失.在第59~113天,堆体CK中可培养细菌数量比堆体P1和P2中少,这可能是经过堆肥高温期后,含有较高浓度的CTC堆体对可培养的嗜温菌起到了富集作用,堆体P1和P2在堆肥降温期和腐熟期时可培养细菌数量要高于堆体CK.已有研究表明,牛粪和秸秆堆肥腐熟期时,含有高浓度土霉素的堆体在堆肥腐熟期,存在更多数量的可培养细菌[14].这与本研究结果相似.
已有多项研究表明,导致畜禽粪便存在多种抗生素的耐药菌[15],其主要原因一方面是过量未被畜禽吸收而通过尿液和粪便代谢到环境中的抗生素对肠道细菌的筛选,而不耐受抗生素的部分肠道细菌被“淘汰”;另一方面是畜禽长期食用和治疗用抗生素的选择压力使其肠道细菌产生耐药性[16].本研究中的堆肥产品源于初始含CTC的猪粪堆肥,而且猪粪样品中残留ENR、ERY和SMZ,所以,以筛选可培养CTC耐药菌为主,展开多重耐药性的研究.
TMP和SMZ属于磺胺类药,是广谱类的抑菌剂,被用于治疗畜禽疾病或者是动物饲料添加剂而添加到畜禽饲料中[17].本研究的抗生素抗性检测统计结果表明所筛选25株细菌对TMP都是敏感的,而没有呈现耐药菌株.ARG发生的HGT,是由肠杆菌在一些兽用抗生素的选择性压力下而产生的[18].环境中的低浓度TMP和SMZ对这些敏感性菌株影响较大,长期的抗生素刺激下会使敏感菌株转化成耐药菌株.然而,已有研究表明,畜禽养殖场中TMP和黏菌素等多种抗生素的耐药性逐年增加[19].鹑鸡肠球菌属于粪肠球菌属,而粪肠球菌属为重要的医院感染病原菌之一[20].随着抗菌药物的不断应用,获得性的耐药肠球菌菌株在不断增加.由大肠杆菌引发的畜禽疾病是养殖场中最具危害的常见病和多发病,甚至是引起仔猪疫病发病率和死亡率最高的病原菌[21].
大肠杆菌产生耐药性主要通过主动外排作用、ARG的HGT和改变外膜蛋白而产生[22].王永芬等[23]研究表明,在临床上常用兽用抗生素对于猪源致病性大肠杆菌都会产生耐药性,耐受5种以上抗生素的耐药菌株占60%之多,而新型抗菌药对致病大肠杆菌产生的耐药率也高达40%.由于多重耐药大肠杆菌E4和E7在堆肥结束后依旧存在于堆肥产品中,当环境中存在低浓度的多重抗生素时,多重耐药菌在多重抗生素的长期胁迫下会产生多重ARG.已有研究表明,抗生素的亚MIC不仅能够胁迫ARGs的出现还能够提高细菌的突变比例[24].越来越多的研究表明,在猪肠道细菌中检测到四环素类ARG,如tetA、tetB、tetG、tetM等;喹诺酮类ARG,如ermB、ermE、ermF等;喹诺酮类ARG,如qnrA和qnrS等;β-内酰胺类ARG,如blaTEM、blaCTX-M、blaSHV等[25-26].畜禽粪便的堆肥产品对于土壤修复,是将养殖过程中具有耐药性的病原微生物引入环境的重要途径之一,也是促进ARGs由养殖环境向土壤转移的重要途径.已有较多研究显示,长期施用粪便导致农田土壤中ARGs的丰度和种类显著增多(p<0.05)[27-28].具有多重耐药性的病原菌携带的ARGs通过HGT在耐药菌之间、耐药菌与土壤微生物之间发生转移,从而促进环境中ARGs的传播与扩散.同时,有研究表明,由畜禽粪便而传播到土壤里的多重耐药细菌将持久存在于土壤中[29].
因此,本研究从耐药菌多重耐药性的角度阐明堆肥过程对磺胺类、四环素类、大环内酯类和喹诺酮类多重耐药细菌的抗性种类、分布的影响,得出由于不同类别的耐药细菌对药物的抗性不同以及对温度的敏感程度不同,从而影响猪粪好氧堆肥对其削减程度不同,这些研究为完善堆肥产品对环境的风险评价提供理论基础具有重要意义.
4 结论1) 猪粪样品中可培养细菌菌落数为1.05×1010 CFU/g,堆肥结束时,CK、P1和P2中可培养细菌菌落数分别为4.88×109,6.25×109和5.31×109 CFU/g.
2) 猪粪好氧堆肥对CTC、SMZ和ERY耐药菌能够有效削减.堆肥结束时,CK、P1和P2堆体对CTC、ERY、SMZ耐药菌分别削减了0.45log~1.03log、0.46log~0.67log和0.66log~0.76log.由于ENR耐药菌中嗜热微生物较多,堆肥结束时CK、P1和P2堆体中的可培养ENR耐药菌数量分别增加了0.71log、1.43log和0.57log.
3) 堆肥可以消减部分多重抗性细菌,但仍有部分多重抗性细菌在堆肥结束后残存在产品中,这些多重抗性菌是粪肥返田需要关注的环境风险.
| [1] |
ZHANG Yuping, ZHANG Chiqian, PARKER D B, et al. Occurrence of antimicrobials and antimicrobial resistance genes in beef cattle storage ponds and swine treatment lagoons[J]. Science of the Total Environment, 2013, 463/465(5): 631. DOI:10.1016/j.scitotenv.2013.06.016 |
| [2] |
ROOSA S, WATTIEZ R, PRYGIEL E, et al. Bacterial metal resistance genes and metal bioavailability in contaminated sediments[J]. Environmental Pollution, 2014, 189(12): 143. DOI:10.1016/j.envpol.2014.02.031 |
| [3] |
HOU Jie, WAN Weining, MAO Daqing, et al. Occurrence and distribution of sulfonamides, tetracyclines, quinolones, macrolides, and nitrofurans in livestock manure and amended soils of Northern China[J]. Environmental Science and Pollution Research International, 2015, 22(6): 4545. DOI:10.1007/s11356-014-3632-y |
| [4] |
CHEN Zhiqiang, WANG Yao, WEN Qinxue. Effects of chlortetracycline on the fate of multi-antibiotic resistance genes and the microbial community during swine manure composting[J]. Environmental Pollution, 2018, 237: 977. DOI:10.1016/j.envpol.2017.11.009 |
| [5] |
ZALESKI K J, JOSEPHSON K L, GERBA C P, et al. Potential regrowth and recolonization of salmonellae and indicators in biosolids and biosolid-amended soil[J]. Applied and Environmental Microbiology, 2005, 71(7): 3701. DOI:10.1128/AEM.71.7.3701-3708.2005 |
| [6] |
MILLNER P, INGRAM D, MULBRY W, et al. Pathogen reduction in minimally managed composting of bovine manure[J]. Waste Management, 2014, 34(11): 1992. DOI:10.1016/j.wasman.2014.07.021 |
| [7] |
OLIVEIRA M, USALL J, VIÑAS I, et al. Transfer of Listeria innocua from contaminated compost and irrigation water to lettuce leaves[J]. Food Microbiology, 2011, 28(3): 590. DOI:10.1016/j.fm.2010.11.004 |
| [8] |
Performance standards for antimicrobial susceptibility testing; twenty-third informational supplement: M100-S23[S]. Wayne: Clinical and Laboratory Standards Institute, 2018
|
| [9] |
Methods for antimicrobial susceptibility testing of anaerobic bacteria: M11-A8[S]. Wayne: Clinical and Laboratory Standards Institute, 2012
|
| [10] |
Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically: M07-A10[S]. Wayne: Clinical and Laboratory Standards Institute, 2015
|
| [11] |
SUZUKI M T, TAYLOR L T, DE LONG E F. Quantitative analysis of small-subunit rRNA genes in mixed microbial populations via 5'-nuclease assays[J]. Applied and Environmental Microbiology, 2000, 66(11): 4605. DOI:10.1128/AEM.66.11.4605-4614.2000 |
| [12] |
BERNAL M P, ALBURQUERQUE J A, MORAL R. Composting of animal manures and chemical criteria for compost maturity assessment: A review[J]. Bioresource Technology, 2009, 100(22): 5444. DOI:10.1016/j.biortech.2008.11.027 |
| [13] |
李国学, 张福锁. 固体废物堆肥化与有机复混肥生产[M]. 北京: 化学工业出版社, 2000: 75. LI Guoxue, ZHANG Fusuo. Solid waste composting and organic compound fertilizer production[M]. Beijing: Chemical Industry Press, 2000: 75. |
| [14] |
QIAN Xun, SUN Wei, GU Jie, et al. Variable effects of oxytetracycline on antibiotic resistance gene abundance and the bacterial community during aerobic composting of cow manure[J]. Journal of Hazardous Materials, 2016, 315: 61. DOI:10.1016/j.jhazmat.2016.05.002 |
| [15] |
YANG Qingxiang, REN Siwei, NIU Tianqi, et al. Distribution of antibiotic-resistant bacteria in chicken manure and manure-fertilized vegetables[J]. Environmental Science and Pollution Research, 2014, 21(2): 1231. DOI:10.1007/s11356-013-1994-1 |
| [16] |
ZHAO Ling, DONG Yuanhua, WANG Hui. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5): 1069. DOI:10.1016/j.scitotenv.2009.11.014 |
| [17] |
国彬, 姚丽贤, 刘忠珍, 等. 磺胺类兽药对土壤微生物数量的影响[J]. 环境化学, 2012, 31(7): 1009. GUO Bin, YAO Lixian, LIU Zhongzhen, et al. The impact of sulfonamide veterinary drugs on soil microbes quantity[J]. Enviromental Chemistry, 2012, 31(7): 1009. |
| [18] |
赖晓琳, 吴平霄, 阮博. 四环素对大肠杆菌抗生素抗性基因进化的影响[J]. 环境科学学报, 2019, 39(8): 2475. LAI Xiaolin, WU Pingxiao, RUAN Bo. Evolution of antibiotic resistance genes in E.coli by tetracycline[J]. Acta Scientiae Circumstantiae, 2019, 39(8): 2475. DOI:10.13671/j.hjkxxb.2019.0139 |
| [19] |
贾良梁, 罗静如, LUPPIA. 猪肠型大肠杆菌病的治疗[J]. 国外畜牧学(猪与禽), 2018, 38(10): 18. JIA Liangliang, LUO Jingru, LUPPI A. Treatment of swine enterotype escherichia coli[J]. Animal Science Abroad (Pigs and Poultry), 2018, 38(10): 18. DOI:10.3969/j.issn.1001-0769.2018.10.003 |
| [20] |
高世华, 池细俤. 葡萄球菌属、肠球菌属分布及体外耐药性变迁[J]. 中国误诊学杂志, 2010, 10(16): 3793. GAO Shihua, CHI Xidi. Change of distribution and extracorporeal drug resistance of Staphylococcus and Enterococcus[J]. Chinese Journal of Misdiagnostics, 2010, 10(16): 3793. |
| [21] |
隆茂俊, 姚晓慧, 夏利宁. 某猪场不同生长期猪源大肠杆菌耐药性分析[J]. 中国畜禽种业, 2018, 14(7): 31. LONG Maojun, YAO Xiaohui, XIA Lining. Analysis of resistance of escherichia coli from pigs in different growing stages in a pig farm[J]. The Chinese Livestock and Poultry Breeding, 2018, 14(7): 31. DOI:10.3969/j.issn.1673-4556.2018.07.019 |
| [22] |
季秋晴, 沙岩, 王丹, 等. 肠杆菌对抗生素的耐药性研究进展[J]. 临床医学研究与实践, 2018, 3(28): 203. JI Qiuqing, SHA Yan, WANG Dan, et al. Advances in research on resistance of enterobacterium to antibiotics[J]. Clinical Research and Practice, 2018, 3(28): 203. DOI:10.19347/j.cnki.2096-1413.201828089 |
| [23] |
王永芬, 席磊, 赵志军, 等. 不同生物制剂对猪致病性大肠杆菌的体外抑菌试验[J]. 云南农业大学学报(自然科学), 2012, 27(1): 60. WANG Yongfen, XI Lei, ZHAO Zhijun, et al. Study on antibacterial effects of different biological agents on pigpathogenic Escherichia coli[J]. Journal of Yunnan Agricultural University(Nature Science), 2012, 27(1): 60. DOI:10.3969/j.issn.1004-390X(n).2012.01.012 |
| [24] |
JUTKINA J, MARATHE N P, FLACH C F, et al. Antibiotics and common antibacterial biocides stimulate horizontal transfer of resistance at low concentrations[J]. Science of the Total Environment, 2018, 616/617: 172. DOI:10.1016/j.scitotenv.2017.10.312 |
| [25] |
郑宁国, 黄南, 王卫卫, 等. 高温堆肥过程对猪粪来源抗生素抗性基因的影响[J]. 环境科学, 2016, 37(5): 1986. ZHENG Ningguo, HUANG Nan, WANG Weiwei, et al. Effects of thermophilic composting on antibiotic resistance genes (ARGs) of swine manure source[J]. Environmental Science, 2016, 37(5): 1986. DOI:10.13227/j.hjkx.2016.05.049 |
| [26] |
郑新添, 黄其春, 陈星星, 等. 源自猪场环境大肠杆菌耐药性检测及其产ESBLs菌耐药基因特征[J]. 安徽农业大学学报, 2014, 41(3): 375. ZHENG Xintian, HUANG Qichun, CHEN Xingxing, et al. Antimicrobial susceptibility and ESBLs' genotype of Escherichia coli isolated from external environment nearby pig farm[J]. Journal of Anhui Agricultural University, 2014, 41(3): 375. DOI:10.13610/j.cnki.1672-352x.20140423.037 |
| [27] |
CHEN Qinglin, AN Xinli, LI Hu, et al. Long-term field application of sewage sludge increases the abundance of antibiotic resistance genes in soil[J]. Environment International, 2016, 92/93: 1. DOI:10.1016/j.envint.2016.03.026 |
| [28] |
CHENG Weixiao, LI Jianan, WU Ying, et al. Behavior of antibiotics and antibiotic resistance genes in eco-agricultural system: A case study[J]. Journal of Hazardous Materials, 2016, 304: 18. DOI:10.1016/j.jhazmat.2015.10.037 |
| [29] |
YANG Qingxiang, WANG Ruifei, REN Siwei, et al. Practical survey on antibiotic-resistant bacterial communities in livestock manure and manure-amended soil[J]. Journal of Environmental Science and Health Part B, 2016, 51(1): 14. DOI:10.1080/03601234.2015.1080481 |
 2021, Vol. 53
2021, Vol. 53


