2. 哈尔滨工业大学 环境学院,哈尔滨 150001
2. School of Environment, Harbin Institute of Technology, Harbin 150001, China
莠去津(ATZ)是一种广泛使用的三嗪类除草剂,在土壤、地表水和地下水中常被检出[1]。由于其结构稳定、被微生物矿化过程十分缓慢,在水体和土壤中的半衰期较长。虽然莠去津是一种低毒性农药,但水中残留的莠去津会抑制水生植物的生长甚至致其死亡,并对人类和动物的生殖、免疫功能引发障碍[1-2]。
零价铁(Fe0)具有还原性,其氧化还原电位为-0.44 V[3],可以还原去除地下水中的卤代有机污染物[4]。与其他过渡金属相比,Fe0无毒且价格低廉,适用于水体或土壤的修复。在O2存在的条件下,通过双电子转移和单电子转移,能够产生H2O2、O2-·、·OH、Fe(Ⅳ)等氧化物种氧化As(Ⅲ)和农药等有机污染物[5-6]。向Fe0体系中加入过氧化物能够明显地提高对有机污染物的降解率[7-8]。Fe0活化过硫酸盐(PDS/Fe0)可以有效地降解地下水和废水中的萘、氯苯、三氯乙烯、甲基叔丁基醚、卡马西平、乙酰氨基酚、磺胺甲恶唑、硝基苯(NB)[8-10]。与PDS相比,过氧单硫酸盐(PMS)因—O—O—键两侧基团的不对称更容易被活化[11]。Bajagain等[12]对比了Fe0活化PMS(PMS/Fe0)、PDS/Fe0、H2O2/Fe0对石油烃的降解,发现PMS/Fe0的效果最好,同时发现Fe0活化PMS降解石油烃的效果好于Fe(Ⅱ)和Co(Ⅱ)。金属活化PMS的过程中—O—O—键将发生异裂,PMS/Fe0体系中可能会产生·OH、SO4-·或者·OH和SO4-·。而PMS/Fe0和PDS/Fe0体系中自由基种类的鉴定主要是采用醇类抑制试验和电子顺磁共振(EPR)技术[9, 12],并且对自由基的相对生成量鲜有量化研究的报道。
EPR技术采用自由基捕获剂5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)鉴定体系中的·OH和SO4-·时,DMPO与SO4-·的加成产物会迅速水解产生DMPO与·OH的加成产物[13],从而干扰体系中·OH的鉴定。而醇类抑制试验对非均相催化体系鉴定自由基种类的准确性也有待于商榷[14-15]。基于此,采用污染物竞争自由基的方法实现原位鉴定PMS/Fe0的种类,并基于稳态假设推导适用于非均相体系中定量·OH和SO4-·产率比的计算公式。研究了不同工艺参数(溶液pH、PMS投加量、Fe0投加量、ATZ初始浓度)条件下,PMS/Fe0对ATZ的降解动力学。最后,研究了模拟地下水水质条件下ATZ的降解效果,为应用PMS/Fe0工艺降解实际地下水中ATZ提供理论参考。
1 实验 1.1 试剂与材料莠去津(分析纯)、硝基苯(质量分数≥99.0%)、过氧单硫酸盐(2KHSO5·KHSO4·K2SO4,Oxone)、氢氧化钾(质量分数≥85%)均购自西格玛奥德里奇(上海)贸易有限公司,还原铁粉(150 μm)购自阿拉丁(Aladdin)试剂集团有限公司,硫酸、盐酸羟胺、碘化钾、无水碳酸钠、五水合硫代硫酸钠均购自上海国药集团化学试剂有限公司。所用试剂均为分析纯,溶液均采用Milli-Q超纯水配置。莠去津的结构式为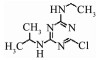
所有实验在250 mL三角瓶中进行,三角瓶置于转速为200 r/min的水浴恒温振荡器,反应温度为25 ℃。试验开始前装有150 mL超纯水的三角瓶置于水浴恒温振荡器预热60 min,然后依次加入一定量的ATZ、PMS和零价铁,加入零价铁后立即计时。在设定好的取样时间点用注射器吸取4 mL溶液,经由Whatman GF/F玻璃纤维滤膜过滤后,采用甲醇和盐酸羟胺终止反应。在考察溶液初始pH对该工艺降解莠去津影响的试验中,溶液初始pH变化为2.5~9,通过投加硫酸和氢氧化钾调节加入零价铁前反应溶液的pH为设定值。所有实验均重复两次以上。
1.3 分析方法ATZ和NB的浓度采用液相色谱(Waters Acquity UPLC H-Class)测定。色谱柱型号为Waters Acquity UPLCⓇBEH C18 column (2.1 mm×100 mm,1.7 μm颗粒),流动相采用甲醇和10 mmol/L磷酸溶液,两者体积比为60∶ 40,流动速率为0.1 mL/min,柱温为25 ℃,进样体积10 μL,PDA检测器检测波长分别为226和263 nm。溶液的pH使用上海雷磁精密酸度计(PHS-3C)pH计测定,温度使用水银温度计测量。PMS的浓度采用碘量法测定[16]。
1.4 基于目标物竞争反应的自由基鉴定及产率计算方法NB与SO4-·反应速率慢,其速率常数k≤106 L/(mol·s)[16],所以,选择NB作为·OH的探针化合物;ATZ与SO4-·和·OH反应都比较快,作为同时与两种自由基反应的探针化合物[14]。若降解ATZ的活性物质为SO4-·和·OH,则NB和ATZ降解的反应动力学表达式如式(1)和(2)所示。由于体系中有ATZ和NB的存在,·OH和SO4-·与PMS的反应、·OH和SO4-·的自由基自猝灭反应以及·OH和SO4-·之间的转化反应都可以近似忽略不计,则体系中·OH和SO4-·的反应动力学表达式如式(3)和(4)所示。基于稳态假设,体系中·OH和SO4-·的稳态浓度如式(5)和(6)所示,进而推导ATZ和NB降解的假一级速率常数比(k0, ATZ/k0, NB)如式(7)所示。
| $ -\frac{\mathrm{d} c_{\mathrm{NB}}}{\mathrm{d} t}=k_{1}[\cdot \mathrm{OH}] c_{\mathrm{NB}}=k_{0, \mathrm{NB}} c_{\mathrm{NB}} $ | (1) |
| $ \begin{aligned} -\frac{\mathrm{d} c_{\mathrm{ATZ}}}{\mathrm{d} t}=& k_{2}[\cdot \mathrm{OH}] c_{\mathrm{ATZ}}+k_{3}\left[\mathrm{SO}_{4}^{-} \cdot\right] c_{\mathrm{ATZ}}=\\ & k_{0, \mathrm{ATZ}} c_{\mathrm{ATZ}} \end{aligned} $ | (2) |
| $ \frac{\mathrm{d} c_{\cdot \mathrm{OH}}}{\mathrm{d} t}=P_{\cdot \mathrm{OH}}-k_{1}[\cdot \mathrm{OH}] c_{\mathrm{NB}}-k_{2}[\cdot \mathrm{OH}] c_{\mathrm{ATZ}} $ | (3) |
| $ \frac{{{\rm{d}}{c_{{\rm{S}}{{\rm{O}}_4}^{ - .}}}}}{{{\rm{d}}t}} = {P_{{\rm{S}}{{\rm{O}}_4}^{ - .}}} - {k_3}\left[ {{\rm{S}}{{\rm{O}}_4}^{ - .}} \right]{c_{{\rm{ATZ}}}} $ | (4) |
| $ [\cdot \mathrm{OH}]=\frac{P_{\cdot 0 \mathrm{H}}}{k_{1} c_{\mathrm{NB}}+k_{2} c_{\mathrm{ATZ}}} $ | (5) |
| $ \left[{{\rm{S}}{{\rm{O}}_4}^{ - .}}\right]=\frac{P_{{\rm{S}}{{\rm{O}}_4}^{ - .}}}{k_{3} c_{\mathrm{ATZ}}} $ | (6) |
| $ \frac{k_{0, \mathrm{ATZ}}}{k_{0, \mathrm{NB}}}=\frac{\frac{k_{2}}{k_{1} c_{\mathrm{NB}}+k_{2} c_{\mathrm{ATZ}}}+\frac{P_{{\rm{S}}{{\rm{O}}_4}^{ - .}}}{P_{\cdot \mathrm{OH}}} \times \frac{1}{c_{\mathrm{ATZ}}}}{\frac{k_{1}}{k_{1} c_{\mathrm{NB}}+k_{2} c_{\mathrm{ATZ}}}} $ | (7) |
式中:k1为·OH和NB的反应速率常数,k2为·OH和ATZ的反应速率常数,k3为SO4-·和ATZ的反应速率常数, k0, NB和k0, ATZ为NB和ATZ降解的假一级速率常数,cNB和cATZ为NB和ATZ的浓度, P·OH和PSO4-·为生成·OH和SO4-·的速率。
1.5 方差分析对不同工艺参数条件下PMS/Fe0降解ATZ的数据进行方差分析。原始数据为6列190行,每行对应一个工艺参数条件(PMS浓度、pH、反应时间、Fe投加量和ATZ初始浓度)及其条件下ATZ的剩余率(c/c0)。方差分析采用统计软件SPSS进行。
2 结果与讨论 2.1 不同工艺参数条件下ATZ降解动力学 2.1.1 pH对ATZ降解率的影响从图 1可以看出,溶液pH的改变可以显著地影响PMS/Fe0降解ATZ的效率。随着pH的增加,ATZ的降解率降低。在pH为2.5和3.0条件下,反应15 min时ATZ的降解率分别达到100%和96%。利用假一级动力学模型对pH为2.5、3.0、4.0和5.0的反应数据进行拟合,得到假一级速率常数kobs、半衰期t1/2及相关系数R2见表 1。可以看出,随着pH由2.5升高到5.0,kobs从0.282 min-1降至0.020 min-1,半衰期t1/2从2.46 min增至34.66 min。在pH为7和9时,由于反应初期存在平台期,不能用假一级动力学模型进行拟合。在pH为7条件下,反应60 min时,ATZ的降解率为76%。而在pH为9条件下,60 min时的降解率仅为21%,这可能是在碱性条件下,不利于Fe0向Fe2+的转化。并且有研究表明,大量氢氧根离子的存在导致Fe0的表面钝化成膜[17]。尽管在碱性条件下溶液中可能生成SO4-·和·OH,但是实验结果表明,pH为9的反应条件对ATZ的降解是不利的。pH越低,ATZ的降解效果越佳,这是因为酸性条件下有利于Fe2+的形成,从而产生更多的SO4-·[18];并且在酸性条件下Fe0被腐蚀导致表面积增大[19],从而增加Fe2+的释放速率。
|
图 1 pH对PMS/Fe0体系中ATZ降解率的影响 Fig. 1 Influence of pH value on degradation efficiency of ATZ in PMS/Fe0 system |
| 表 1 在不同条件下PMS/Fe0降解ATZ的假一级速率常数及半衰期 Tab. 1 Pseudo-first order rate constant and half-life of ATZ degradation by PMS/Fe0 under different conditions |
从降解ATZ的能量利用率来分析,降低溶液的pH将缩短反应时间,即减小了降解污染物所需要的水力停留时间。在实际工程应用中如固定床,降低pH会减少降解污染物所需要的水力接触时间,即会降低基建成本。但是降低pH需要投加酸,又会增加药剂成本。因此,在实际应用中,从经济角度出发,应综合基建成本和药剂投入成本,分析降解污染物的最佳pH。
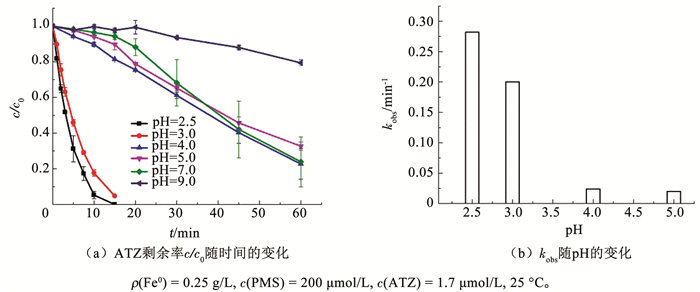
2.1.2 氧化剂投加量对ATZ降解率的影响通过改变PMS的投加量(10~200 μmol/L),考察其对ATZ降解率的影响,结果见图 2。在研究的PMS投量范围内,反应15 min时,ATZ的降解率都大于95%。但是随着PMS的浓度由10 μmol/L增加至200 μmol/L时,ATZ的降解率先增大后降低。25 μmol/L时降解率达到最大,kobs为1.402 min-1 (表 1)。这是由于低PMS浓度时,随着PMS投量的增加,溶液中活性自由基也增加,从而提高了ATZ的降解率;但是当PMS的浓度过高时,溶液中过量的PMS与·OH和SO4-·发生反应,从而减少·OH和SO4-·的可利用量(式(8)和(9)),并且过量·OH和SO4-·会出现猝灭现象(式(10)~(12))[20],使得系统中·OH和SO4-·减少,其氧化效应减弱,导致有机物降解率减慢。Mogharbel等[21]在PDS/Fe0体系降解3, 5, 6-三氯吡啶-2-醇研究中也有类似的结论,PDS浓度为0~25 mmol/L时,污染物的降解率随PDS浓度的增加先升高后降低。在PDS浓度为15 mmol/L时,污染物的降解率最大。
| $ \cdot \mathrm{OH}+{{\rm{H}}{\rm{S}}{{\rm{O}}_5}^{ -}} \longrightarrow {\mathrm{SO}_{5}}^{-} \cdot+\mathrm{H}_{2} \mathrm{O} $ | (8) |
| $ {{\rm{S}}{{\rm{O}}_4}^{ - .}} \cdot+{\mathrm{HSO}_{5}}^{-} \longrightarrow {\mathrm{SO}_{5}}^{-} \cdot+\mathrm{SO}_{4}^{2-}+\mathrm{H}^{+} $ | (9) |
| $ {\mathrm{SO}_{4}}^{-} \cdot+{\mathrm{SO}_{4}}^{-} \cdot \longrightarrow \mathrm{S}_{2} \mathrm{O}_{8}^{2-} $ | (10) |
| $ \cdot \mathrm{OH}+\cdot \mathrm{OH} \longrightarrow \mathrm{H}_{2} \mathrm{O}_{2} $ | (11) |
| $ \cdot \mathrm{OH}+{\mathrm{SO}_{4}}^{-} \cdot \longrightarrow {\mathrm{HSO}_{5}}^{-} $ | (12) |
|
图 2 氧化剂浓度对PMS/Fe0体系中ATZ降解率的影响 Fig. 2 Influence of oxidant concentration on degradation efficiency of ATZ in PMS/Fe0 system |
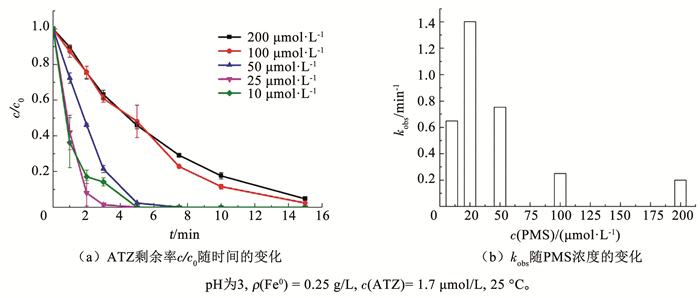
如图 3所示,PMS投加量为25 μmol/L,ATZ投加量为1.7 μmol/L,Fe0的投量为0.05~0.25 g/L时,增加Fe0的投加量会提高ATZ的降解率。当Fe0投加量为0.05 g/L,反应15 min时,ATZ的降解率为70%。当溶液中的Fe0投加量为0.1 g/L,反应15 min时,ATZ的降解率达到100%。而当溶液中Fe0的投加量达到0.25 g/L时,ATZ的降解率达到99%只需要3 min。从表 1可以看出,Fe0投量由0.05 g/L增加至0.25 g/L时,kobs几乎相应地成正比例增加(图 3(b))。这是由于增加Fe0投加量,会释放更多的Fe2+来催化PMS产生·OH和SO4-·,从而提高ATZ的降解率。Hussain等[22]在PDS/Fe0降解对氯苯胺研究中也有相同的结论。PDS投加量为2.5 mmol/L,Fe0投加量为0.35~5.0 g/L时,随着Fe0投加量的增加,氯苯胺的降解率也随之增加。
|
图 3 Fe0投加量对PMS/Fe0体系中ATZ降解率的影响 Fig. 3 Influence of Fe0 dosage on degradation efficiency of ATZ in PMS/Fe0 system |
如图 4所示,PMS和Fe0投加量分别为25 μmol/L和0.1 g/L的条件下,当ATZ初始浓度为1.7 μmol/L,反应15 min时ATZ的降解率达到100%。当ATZ的初始浓度增加为3.4 μmol/L时,反应15 min后ATZ的降解率为94%。可以看出,随着ATZ初始浓度的增加,其降解率降低。与此同时,kobs也从0.275 min-1减小至0.182 min-1。Jegadeesan等[23]也发现了相同结论,在C-Fe-PMS体系中,目标污染物刚果红染料(Congo red dye)质量浓度从75 mg/L增至100 mg/L时,假一级反应速率常数由1.01×10-2 min-1降至6.42×10-3 min-1。
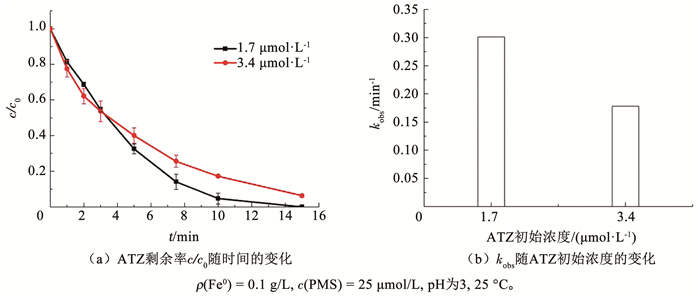
|
图 4 ATZ初始浓度对PMS/Fe0体系中ATZ降解率的影响 Fig. 4 Influence of initial ATZ concentration on degradation efficiency of ATZ in PMS/Fe0 system |
通过计算相邻取样点的浓度差与时间差的比值,可以计算出ATZ的平均降解速率,见图 5。在反应的初始阶段(2 min之前),高浓度ATZ(3.4 μmol/L) 的平均降解速率高于低浓度的ATZ(1.7 μmol/L)。随着时间的延长,低浓度ATZ(1.7 μmol/L)平均降解速率明显快于高浓度的ATZ。这是由于反应初期体系中的有机污染物主要是ATZ,提高ATZ的浓度会增加自由基的利用效率,提高ATZ的平均降解速率;随着反应时间的延长,ATZ在降解的过程中会有相应的中间有机物产物生成,这些中间产物也会竞争体系中的SO4-·和·OH,从而导致反应后期(2 min以后)提高ATZ的浓度反而降低ATZ的平均降解速率。
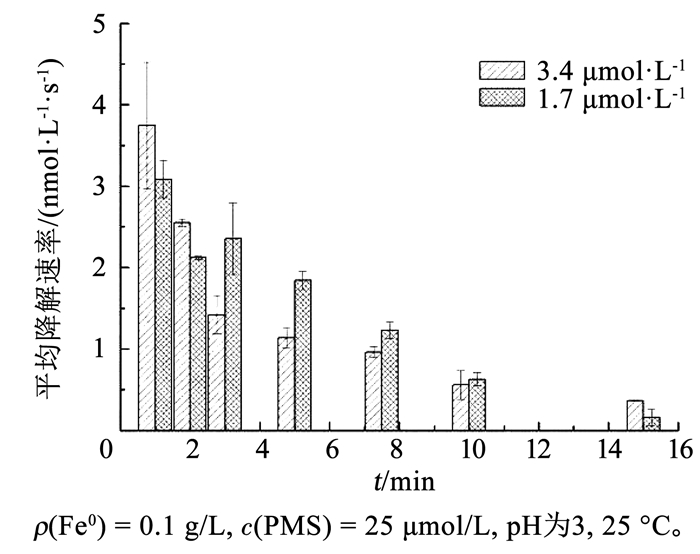
|
图 5 不同初始浓度条件下ATZ平均降解速率随时间变化 Fig. 5 Variation of average degradation rate of ATZ under different initial concentrations |
在一定污染物浓度范围内,相同的PMS投加量和Fe0投加量条件下,产生几乎等量的SO4-·和·OH。故增加ATZ的初始浓度会由于增加自由基的使用率而提高其平均降解速率(反应初期,2 min之前),但污染物的降解率却是降低的。
2.1.5 方差分析对不同工艺参数条件下PMS/Fe0降解ATZ的数据进行方差分析,结果见表 2。Fe0投加量、pH、时间、PMS投加量这4个因素对应的F值均较大,对应的显著性P值为0;而ATZ初始浓度的F值较小,对应的显著性P值为0.118。若取显著性水平α=0.05,ATZ初始浓度的主效应未达到显著;而Fe0投加量、pH、时间、PMS投加量的主效应显著,各参数不同水平下各总体均值有显著差异。可以看出,Fe0投加量、pH、反应时间、PMS投加量对ATZ的降解影响显著,而ATZ初始浓度的影响并不显著。
| 表 2 方差分析(ANOVA)结果 Tab. 2 ANOVA analysis results |
金属活化PMS的过程是PMS得到一个电子,其—O—O—键发生断裂,可能生成SO4-·和HO-,也可能生成SO42-和·OH。甲醇(ME)与SO4-·的反应速率约是叔丁醇(TBA)与SO4-·反应速率的10倍;同时甲醇和叔丁醇与·OH的反应速率常数接近,故两种醇对污染物的抑制作用常用来判定体系中的SO4-·和·OH[24-25]。
向体系中加入ME和TBA,考察其对ATZ降解率的影响。如图 6所示,当溶液中含有2 mmol/L的ME和TBA时,TBA和ME对ATZ的降解都有明显的抑制作用;并且在反应初期ME对ATZ的降解抑制作用强于TBA。当ME和TBA浓度达到10 mmol/L时,甲醇的抑制作用并没有明显强于叔丁醇,并且在反应初期ME的抑制作用小于TBA。理论上,10 mmol/L的TBA能够捕获50%的SO4-·和几乎全部的·OH,而10 mmol/L的ME能够捕获约90%的SO4-·和几乎全部的·OH。10 mmol/L的ME对ATZ的降解的抑制程度理论上应该大于TBA,并且抑制程度的差别反映了SO4-·对ATZ降解的贡献。如果只考虑TBA和ME对SO4-·和·OH的捕获作用,图 6的结果表明, SO4-·对ATZ降解的贡献应该很小,·OH是PMS/Fe0降解ATZ的主要活性物种。基于此,10 mmol/L的ME应该几乎完全抑制ATZ的降解,但是实验结果并非如此。这一方面可能是因为单独的Fe0对于ATZ的吸附作用或者还原作用。从图 6可以看出,单独的Fe0对ATZ并没有明显的降解效果,说明Fe0对ATZ没有吸附作用或者还原作用。另一方面也可能是在Fe0表面,ATZ和醇类的浓度分布与主体溶液比例不同,导致实验结果与理论预测不相符。由此可以看出, ME和TBA捕获自由基的方法并不适合鉴定该非均相体系中的SO4-·和·OH。
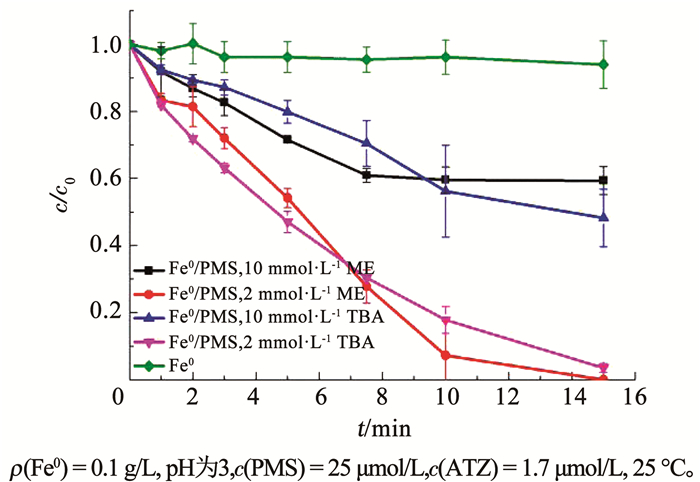
|
图 6 ME和TBA浓度对PMS/Fe0体系中ATZ降解率的影响 Fig. 6 Influence of ME and TBA concentrations on degradation efficiency of ATZ in PMS/Fe0 system |
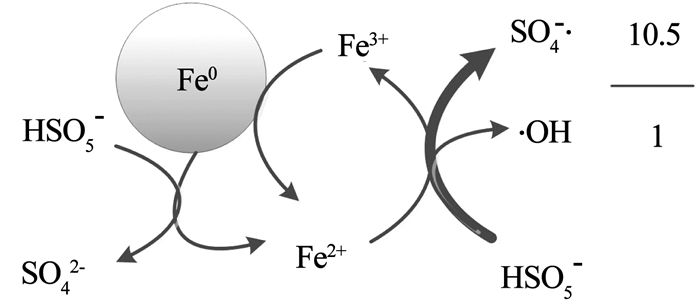
进一步采用基于目标物竞争反应的方法来鉴别体系中的自由基种类。从图 7可以看出,PMS/Fe0对NB存在降解作用,说明该体系中有·OH的生成。k1和k2分别为(3.2~4.7)×109和(2.5~3)×109 L/ (mol·s)[14, 26]。假设体系中只有·OH,k2/k1应该在0.5~1。而从图 7可以得出k0, ATZ/k0, NB为20,远大于k2/k1。这说明SO4-·对ATZ的降解也有贡献,PMS/Fe0体系中·OH和SO4-·均是降解ATZ的活性物质。根据式(7)所示的SO4-·和·OH的生成速率比(PSO4-·/P·OH)与ATZ和NB降解的假一级速率常数比(k0, ATZ/k0, NB)的关系,表 3列出了不同PSO4-·/P·OH条件下对应的k0, ATZ/k0, NB。当PSO4-·/P·OH= 10.5,可以计算出k0, ATZ/k0, NB=20。故本实验中得到k0, ATZ/k0, NB为20,说明PMS/Fe0体系中SO4-·和·OH的生成速率比值为10.5。这表明Fe0活化PMS产生的活性自由基主要为SO4-·。Fe0活化PMS产生活性自由基的路径可以概括如图 8所示。Fe0与PMS发生两电子转移生成Fe2+,Fe2+进一步与PMS发生一电子转移生成Fe3+,Fe3+在Fe0的还原作用下会重新生成Fe2+。而PMS与Fe2+发生一电子转移,生成SO4-·或·OH,并且生成SO4-·的反应是主要路径。
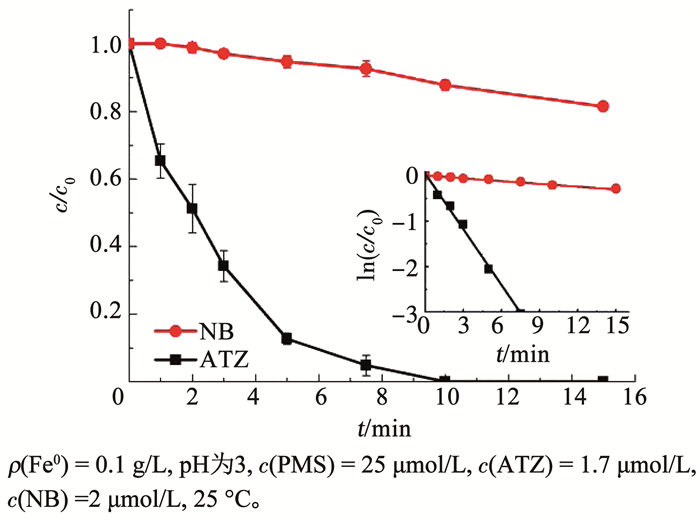
|
图 7 PMS/ Fe0体系中NB和ATZ的降解率 Fig. 7 Degradation efficiency of NB and ATZ in PMS/Fe0 system |
| 表 3 ATZ和NB降解的假一级速率常数比与SO4-·和·OH的产生速率比的理论变化 Tab. 3 Variation of the pseudo-first order rate constant ratio of ATZ and NB degradation with production ratio of SO4-· and ·OH |
|
图 8 PMS/ Fe0产生SO4-·和·OH的路径示意 Fig. 8 Schematic of the production of SO4-· and ·OH in PMS/Fe0 system |
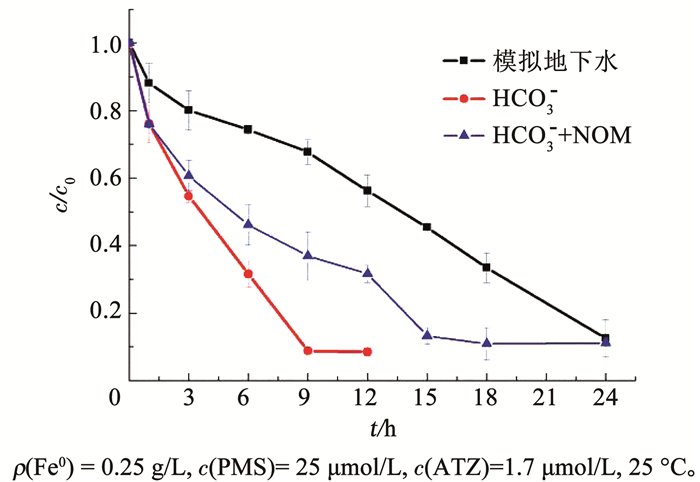
参考地下水的水样数据[9, 27]配置模拟地下水,具体水质指标见表 4。图 9描述了模拟地下水中ATZ的降解规律,可以看出,ATZ的降解速率相对于超纯水条件下明显降低。在模拟地下水条件下,反应1 h,ATZ的降解率约为12%;反应12 h,ATZ的降解率约为44%;反应24 h,ATZ的降解率约为87%。这可能是由模拟水体中的背景成分对溶液pH、自由基生成以及自由基捕获的影响导致。由图 9可以看出,只有HCO3-条件下,反应9 h ATZ的降解率约为91%,说明HCO3-对ATZ的降解存在明显的抑制作用。这可能是由HCO3-对溶液pH的缓冲作用和对自由基的捕获作用导致的自由基产生速率和利用率的降低。由于PMS是一种含有KHSO4混合药剂,在超纯水条件下,PMS的加入会使得溶液的pH迅速降至4.8左右。然而在模拟地下水中,由于HCO3-碱度的存在,对溶液的pH起到缓冲作用,阻止了溶液pH的迅速下降。而2.1.1中的结果表明,pH的增高不利于PMS/Fe0体系中自由基的产生。同时,HCO3-对SO4-·和·OH有很强的捕获作用,明显降低自由基的利用率(自由基对目标物的分配比RPR值)[20]。HCO3-和NOM同时存在条件下,ATZ的降解进一步被抑制,反应18 h时,ATZ的降解率约为88%(图 9)。NOM与SO4-·和·OH的单位TOC二级反应速率常数分别为2.2×103和1.4×104 L/(mg·s),HCO3-和NOM同时存在会进一步降低自由基对目标物的分配比RPR值,从而导致自由基的利用率降低[20]。而模拟地下水条件下ATZ降解速率的进一步减慢,说明其他水体背景成分(如硝酸盐、硫酸盐、氯离子)仍有较强的抑制作用。硝酸盐可以被Fe0还原,竞争Fe0的活性位点;并且硝酸盐也是一种钝化剂,在Fe0表面产生铁氧化物或者氢氧化物加速Fe0的老化[28]。而氯离子和硫酸盐也可能由于在Fe0表面竞争吸附位点或者在铁表面形成的络合物阻塞活性位点,呈现出抑制作用[28]。虽然模拟地下水中污染物ATZ的降解速率较慢,若假设地下水的流速为0.1 m/d,只需将零价铁墙厚设置0.1 m,即可保证ATZ的降解率达到87%。
| 表 4 模拟地下水水质指标 Tab. 4 Water quality indexes of simulated groundwater |
|
图 9 模拟地下水条件下PMS/Fe0体系中ATZ的降解规律 Fig. 9 Degradation of ATZ by PMS/Fe0 system in simulated groundwater |
1) Fe0能够有效地活化PMS降解农药ATZ。在pH为2.5、Fe0和PMS的投加量分别为0.25 g/L和200 μmol/L的条件下,反应15 min时ATZ的降解率为100%。pH为2.5~9时,ATZ的降解速率随着pH的增加而降低。PMS投量为10~200 μmol/L时,ATZ的降解率先增大后降低。PMS投量为25 μmol/L时,ATZ降解速率达到最大,kobs为1.402 min-1。Fe0的投量为0.05~0.25 g/L时,ATZ的降解速率随着Fe0投加量的增大而增加,kobs由0.077 min-1增加至1.402 min-1。增加ATZ的初始浓度,ATZ的平均降解速率随之增加,而降解率和kobs随之降低。
2) Fe0投加量、pH、时间、PMS投加量对PMS/Fe0降解ATZ效率的影响主效应显著, 而ATZ初始浓度的影响并不显著。
3) NB和ATZ的竞争实验结果表明,PMS/Fe0体系中,SO4-·和·OH是降解ATZ的主要活性物种。进一步,基于稳态假设计算得出SO4-·和·OH的生成速率比值为10.5。
4) 模拟地下水水质背景条件下,Fe0和PMS的投量分别为0.25 g/L和25 μmol/L时,反应时间24 h,ATZ的降解率约为87%。
| [1] |
孟顺龙, 胡庚东, 瞿建宏, 等. 莠去津在水环境中的残留及其毒理效应研究进展[J]. 环境污染与防治, 2009, 31(6): 64. MENG Shunlong, HU Gengdong, QU Jianhong, et al. Research progress on atrazine residue in water environment and its toxicological effects[J]. Environmental Pollution and Prevention, 2009, 31(6): 64. DOI:10.15985/j.cnki.1001-3865.2009.06.025 |
| [2] |
GRAYMORE M, STAGNITTI F, ALLINSON G. Impacts of atrazine in aquatic ecosystems[J]. Environment International, 2001, 26(7/8): 483. DOI:10.1016/S0160-4120(01)00031-9 |
| [3] |
CHUN C L, BAER D R, MATSON D W, et al. Characterization and reactivity of iron nanoparticles prepared with added Cu, Pd, and Ni[J]. Environmental Science & Technology, 2010, 44: 5079. DOI:10.1021/es903278e |
| [4] |
WANG C B, ZHANG W X. Synthesizing nanoscale iron particles for rapid and complete dechlorination of TCE and PCBs[J]. Environmental Science & Technology, 1997, 31(7): 2154. DOI:10.1021/es970039c |
| [5] |
PANG S Y, JIANG J, MA J. Oxidation of sulfoxides and arsenic(Ⅲ) in corrosion of nanoscale zero valent iron by oxygen: evidence against ferryl ions (Fe(Ⅳ)) as active intermediates in fenton reaction[J]. Environmental Science & Technology, 2011, 45(1): 307. DOI:10.1021/es102401d |
| [6] |
JOO S H, FEITZ A J, WAITE T D. Oxidative degradation of the carbothioate herbicide, molinate, using nanoscale zero-valent iron[J]. Environmental Science & Technology, 2004, 38(7): 2242. DOI:10.1021/es035157g |
| [7] |
LIAO C J, CHUNG T L, CHEN W L, et al. Treatment of pentachlorophenol-contaminated soil using nano-scale zero-valent iron with hydrogen peroxide[J]. Journal of Molecular Catalysis A: Chemical, 2007, 265(1/2): 189. DOI:10.1016/j.molcata.2006.09.050 |
| [8] |
AL-SHAMSI M A, THOMSON N R. Treatment of organic compounds by activated persulfate using nanoscale zerovalent iron[J]. Industrial & Engineering Chemistry Research, 2013, 52(38): 13564. DOI:10.1021/ie400387p |
| [9] |
LI A L, WU Z H, WANG T T, et al. Kinetics and mechanisms of the degradation of PPCPs by zero-valent iron(Fe0) activated peroxydisulfate (PDS) system in groundwater[J]. Journal of Hazardous Materials, 2018, 357: 207. DOI:10.1016/j.jhazmat.2018.06.008 |
| [10] |
WANG J, WANG S. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502. DOI:10.1016/j.cej.2017.11.059 |
| [11] |
杨宏剑, 薛秀玲, 付旺. 过硫酸盐氧化剂对Al0/O2/H+体系降解TC的协同作用[J]. 环境化学, 2020, 39(9): 2584. YANG Hongjian, XUE Xiuling, FU Wang. The synergistic effect of persulfate oxidants on the degradation of TC in Al0/O2/H+ system[J]. Environmental Chemistry, 2020, 39(9): 2584. DOI:10.7524/j.issn.0254-6108.2019062305 |
| [12] |
BAJAGAIN R, JEONG S W. Degradation of petroleum hydrocarbons in soil via advanced oxidation process using peroxymonosulfate activated by nanoscale zero-valent iron[J]. Chemosphere, 2020, 270(21): 128627. DOI:10.1016/j.chemosphere.2020.128627 |
| [13] |
TIMMINS G S, LIU K J, BECHARA E J H, et al. Trapping of free radicals with direct in vivo EPR detection: a comparison of 5, 5-dimethyl-1-pyrroline-N-oxide and 5-diethoxyphosphoryl-5-methyl-1-pyrroline-N-oxide as spin traps for ·OH and SO4-·[J]. Free Radical Biology and Medicine, 1999, 27: 329. DOI:10.1016/S0891-5849(99)00049-0 |
| [14] |
GUAN Y H, MA J, REN Y M, et al. Efficient degradation of atrazine by magnetic porous copper ferrite catalyzed peroxymonosulfate oxidation via the formation of hydroxyl and sulfate radicals[J]. Water Research, 2013, 47(14): 5431. DOI:10.1016/j.watres.2013.06.023 |
| [15] |
SCHNEIDER J T, FIRAK D S, RIBEIRO R R, et al. Use of scavenger agents in heterogeneous photocatalysis: truths, half-truths, and misinterpretations[J]. Physical Chemistry Chemical Physics, 2020, 22: 15723. DOI:10.1039/D0CP02411B |
| [16] |
GUAN Y H, MA J, LI X C, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J]. Environmental Science & Technology, 2011, 45(21): 9308. DOI:10.1021/es2017363 |
| [17] |
KIM G, JEONG W, CHOE S. Dechlorination of atrazine using zero-valent iron (Fe0) under neutral pH conditions[J]. Journal of Hazardous Materials, 2008, 155(3): 502. DOI:10.1016/j.jhazmat.2007.11.092 |
| [18] |
WEI X Y, GAO N Y, LIC J, et al. Zero-valent iron (ZVI) activation of persulfate (PS) for oxidation of bentazon in water[J]. Chemical Engineering Journal, 2016, 285: 660. DOI:10.1016/j.cej.2015.08.120 |
| [19] |
DOMBEK T, DOLAN E, SCHULTZ J, et al. Rapid reductive dechlorination of atrazine by zero-valent iron under acidic conditions[J]. Environmental Pollution, 2001, 111(1): 21. DOI:10.1016/S0269-7491(00)00033-6 |
| [20] |
GUAN Y H, MA J, LIU D K, et al. Insight into chloride effect on the UV/peroxymonosulfate process[J]. Chemical Engineering Journal, 2018, 352: 477. DOI:10.1016/j.cej.2018.07.027 |
| [21] |
MOGHARBEL R, LIU M, ZOU S, et al. Degradation and statistical optimization of 3, 5, 6-trichloro-2-pyridinol by zero valent iron-activated persulfate[J]. Korean Journal of Chemical Engineering, 2019, 36(4): 540. DOI:10.1007/s11814-018-0222-6 |
| [22] |
HUSSAIN I, ZHANG Y Q, HUANG S B, et al. Degradation of p-chloroaniline by persulfate activated with zero-valent iron[J]. Chemical Engineering Journal, 2012, 203: 269. DOI:10.1016/j.cej.2012.06.120 |
| [23] |
JEGADEESAN G B, AMIRTHAVARSHINI S, DIVYA J, et al. Catalytic peroxygen activation by biosynthesized iron nanoparticles for enhanced degradation of Congo red dye[J]. Advanced Powder Technology, 2019, 30(12): 2890. DOI:10.1016/j.apt.2019.08.034 |
| [24] |
张瑛洁, 李大鹏, 曹天静, 等. 零价铁活化过硫酸铵氧化降解苯酚的研究[J]. 工业水处理, 2012, 32(9): 13. ZHANG Yingjie, LI Dapeng, CAO Tianjing, et al. Oxidative degradation of phenol by zero-valent iron activated ammonium persulfate[J]. Industrial Water Treatment, 2012, 32(9): 13. DOI:10.3969/j.issn.1005-829X.2012.09.004 |
| [25] |
CAO Tingting, ZHAO Munan, CUI Chongwei. DFT studies on the antiradical potential of phenolic compounds[J]. Journal of Harbin Institute of Technology(New Series), 2021, 28(2): 28. DOI:10.11916/j.issn.1005-9113.2019053 |
| [26] |
YANG Y, JIANG J, LU X, et al. Production of sulfate radical and hydroxyl radical by reaction of ozone with peroxymonosulfate: a novel advanced oxidation process[J]. Environmental Science & Technology, 2015, 49(12): 7330. DOI:10.1021/es506362e |
| [27] |
JIANG X, XIAO C L, LIANG X J, et al. Application of fuzzy comprehensive evaluation method in groundwater quality assessment in Handan city[J]. Advanced Materials Research, 2010, 113-116: 1275. DOI:10.4028/www.scientific.net/AMR.113-116.1275 |
| [28] |
SUN Y K, LI J X, HUANG T L, et al. The influences of iron characteristics, operating conditions and solution chemistry on contaminants removal by zero-valent iron: a review[J]. Water Research, 2016, 100: 277. DOI:10.1016/j.watres.2016.05.031 |
 2022, Vol. 54
2022, Vol. 54


