2. 东北师范大学 环境学院, 长春 130024
2. School of Environment, Northeast Normal University, Changchun 130024, China
微污染物,尤其是内分泌干扰物,频频在地表水、土壤中被检出[1-2]。这些内分泌干扰物容易释放到饮用水源中,导致乳腺癌、睾丸癌等疾病发病率增加,对人体健康构成重大威胁[3]。通过自由基高效降解的原理,过硫酸盐高级氧化技术可以用来高效去除饮用水中的微污染物。由于价格低、环境友好,二价铁盐Fe(II)常被用作过一硫酸盐(PMS)或过二硫酸盐(PDS)的催化剂[4]。然而,Fe(II)/PMS体系也存在其固有缺陷, 该体系中三价铁盐Fe(III)转化为Fe(II)的速率非常慢,导致体系中Fe(II)被快速消耗,PMS活化过程很快停止[5]; 此外,若过量投加Fe(II)盐易导致体系中Fe(II)盐过剩或产生大量的含铁盐污泥。因此,寻求低成本、绿色、可再生的过硫酸盐催化剂成为饮用水净化领域的研究热点。
蒙脱土(MMT)是自然界中最丰富的一种层状黏土材料,具有层状结构、阳离子交换能力强、比表面积大等性能,在吸附、分离等领域有着广泛的应用[6-7]。MMT是由一个八面体[AlO3(OH)3]6-夹在两个SiO2四面体片层之间组成的2: 1型层状硅酸盐。蒙脱土的片层空间可引入金属氧化物,显著增大其比表面积和微孔体积;同时,进入层间的金属氧化物可以提供特殊的催化位点[8]。例如,文献[9]将羟基铁蒙脱土煅烧后,制备得到α-Fe2O3-蒙脱土纳米复合材料。将其作为非均相光催化Fenton体系中的催化剂,以降解及矿化偶氮染料Orange II。在α-Fe2O3-蒙脱土制备过程中,需要将羟基铁蒙脱土在350 ℃下煅烧24 h,从而改变铁(氢)氧化物在蒙脱土层间的柱撑方式及存在形态。文献[10]研究了利用有机蒙脱土负载的nCoFe2O4(nCoFe2O4/OMt)活化的过一硫酸盐(PMS)对卡马西平(CBZ)的降解作用。在初始pH=6.8,温度25 ℃的实验条件下,在0.4 g/L nCoFe2O4/OMt和0.5 mmol/L PMS存在下,CBZ(5 mg/L)的降解率在60 min内达到93%。提高PMS浓度、降低初始pH可以增强CBZ降解。然而,高温煅烧会增加催化剂的制备成本。
研究发现,不经过高温煅烧处理的铁柱撑蒙脱土也能显示出显著的催化活性。文献[11]通过三价铁碱溶液浸渍过程中的阳离子交换反应,将铁离子的水解产物,如Fe(OH)2+、Fe(OH)2+和Fe2(OH)24+等嵌入蒙脱土并柱撑,形成羟基-铁柱撑蒙脱土,使其具有较高的光化学活性。通过Fe-MMT的系统表征可以发现,小尺寸的铁水解产物通过柱撑成功地嵌入黏土的片层空间。将其作为异质光芬顿体系的催化剂,用以降解活性艳橙等目标污染物。该催化剂表现出高催化活性,同时可有效控制铁浸出率。文献[12]检测发现,多环芳烃(PAHs)在蒙脱土表面的光转化过程中会产生环境持久性自由基。这一现象仅可在三价铁饱和浸渍的MMT上检测到,而在天然MMT体系中未检测到。这是因为三价铁饱和浸渍的MMT具有更强的给电子能力。
Fe3+与MMT价格低廉、环境友好且性质稳定,但是两种材料单独存在时都不能有效活化PMS。目前,有关三价铁饱和浸渍的MMT作为过硫酸盐的催化剂还没有引起广泛关注。本研究拟利用三价铁饱和浸渍的MMT活化PMS降解双酚A(BPA),并探讨其影响因素与活化机理。
1 实验材料与方法 1.1 铁盐改性蒙脱土(Fe-MMT)的制备与纯化通过磁力搅拌器,将5 g蒙脱土与0.1 mol/L FeCl3·6H2O (200 mL)混合过夜后,以3 000 r/min的转速离心20 min,然后将沉淀物再悬浮于另外200 mL的0.1 mol/L FeCl3·6H2O中。上述步骤重复4次,保证蒙脱石与Fe(III)进行饱和交换反应。然后,用去离子水反复洗涤铁盐改性蒙脱土,以8 000 r/min的转速离心20 min,直至上清液的电导率小于10 μS/cm。Fe-MMT冷冻干燥并研磨成粉,放至干燥器中备用。
1.2 吸附实验配置100 μmol/L的双酚A(BPA)母液,保存备用。将100 mL的BPA溶液(5 μmol/L)加入到200 mL玻璃烧杯中,以500 r/min的转速混合均匀,形成测试溶液。将2.5 g/L的MMT或Fe-MMT吸附剂加入到BPA测试溶液,以此作为反应开始的起点。分别在1、2、3、5、10、15、30 min及1 h取样,样品经有机滤膜(孔径为0.22 μm)过滤后,倒入液相小瓶中,并加入甲醇猝灭反应。处理后的样品冷藏保存,24 h内采用高效液相色谱测定BPA的浓度。吸附平衡容量的测定分别以1、5、10 μmol/L的BPA溶液为初始的反应溶液,以50 r/min的振荡速度,反应24 h后测定溶液中残余的BPA含量。
1.3 催化降解实验配置100 mmol/L的PMS储备液,在4 ℃条件下放入冰箱中保存备用,每周进行PMS有效浓度的滴定。配置100 μmol/L的BPA母液,保存备用。以三价铁盐改性前后的蒙脱土(MMT、Fe-MMT)为催化剂,构建MMT、Fe-MMT活化PMS降解BPA的反应体系。
取100 mL的BPA溶液(5 μmol/L),加入到200 mL的玻璃烧杯中,以500 r/min的转速搅拌均匀;同时,投加一定量的催化剂(2.5 g/L,即0.25 g)及PMS溶液(1 mmol/L),以此作为反应开始的起点,分别在1、2、3、5、10、15、30 min及1 h取样,样品经有机滤膜(孔径为0.22 μm)过滤后,倒入液相小瓶中,并加入甲醇猝灭反应。处理后的样品冷藏保存,24 h内采用高效液相色谱测定BPA的浓度。
1.4 铁离子泄漏量测定实验取100 mL的BPA溶液(5 μmol/L),加入到200 mL的玻璃烧杯中,以500 r/min的转速搅拌均匀;同时,投加一定量的催化剂(2.5 g/L)及PMS(0、0.2、0.4、0.8、1.0 mmol/L)溶液,以此作为反应开始的起点。反应1 h后,用注射器取样,经有机滤膜(孔径为0.22 μm)过滤后,取6 mL样品加入到10 mL离心管中,并加入2%的HNO3酸化后,采用ICP-OES测定样品中铁离子含量。
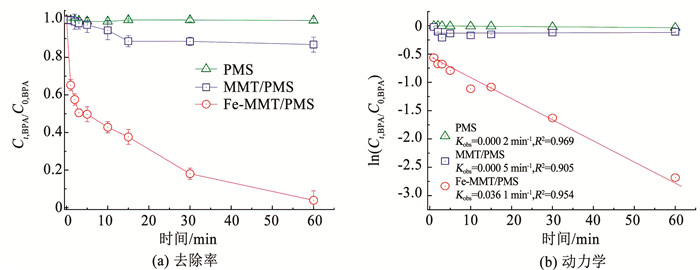
2 结果分析 2.1 铁盐改性蒙脱土去除水中双酚A的效能 2.1.1 铁盐改性蒙脱土活化过一硫酸盐的动力学双酚A是饮用水源中检出频率较高的微污染物之一,对其进行高效降解十分重要。如图 1(a)所示,单纯过一硫酸盐(PMS)对双酚A几乎没有去除率;添加蒙脱土(MMT)作为催化剂后,13.3%的双酚A在60 min内能被氧化去除,说明蒙脱土不能有效活化过硫酸盐。当添加铁盐改性蒙脱土(Fe-MMT)作为催化剂后,96.4%的双酚A在60 min内能被氧化去除。由此可见,铁盐改性蒙脱土是一种高效的过硫酸盐氧化催化剂。
|
图 1 蒙脱土、铁盐改性蒙脱土活化过一硫酸盐降解双酚A的去除率及动力学 Fig. 1 Removal and kinetics of BPA through PMS activation by MMT and Fe-MMT |
为进一步探究蒙脱土、铁盐改性蒙脱土的催化活性,图 1(b)为过一硫酸盐催化氧化降解双酚A的动力学拟合。如图 1(b)所示,蒙脱土活化过一硫酸盐降解双酚A的表观动力学速率很小,与过一硫酸盐自分解降解双酚A的表观动力学速率处于同一数量级;说明天然蒙脱土不具备活化过一硫酸盐的能力。不同的是,铁盐改性蒙脱土活化过一硫酸盐降解双酚A的表观动力学速率远远大于蒙脱土;进一步说明铁盐改性蒙脱土具有优良的催化特性。
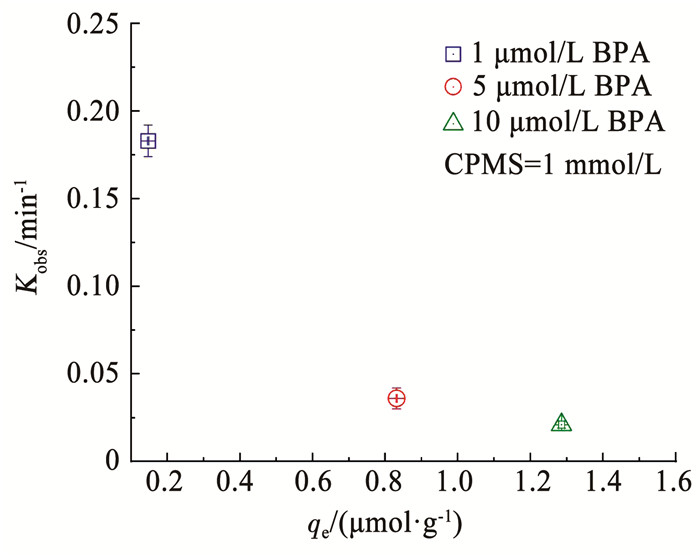
铁盐改性蒙脱土的吸附行为对双酚-A降解动力学的影响,见图 2。当吸附平衡容量(qe)由0.14 μmol/g增加到1.44 μmol/g时,双酚A的表观降解常数Kobs出现明显下降的趋势。Kobs值的减小表明双酚A的吸附作用与铁盐改性蒙脱土表面的PMS活化作用存在竞争关系。这些实验结果证明,吸附在铁盐改性蒙脱土表面的双酚A可以通过PMS的氧化作用而被快速降解,铁盐改性蒙脱土表面的三价铁活性位点得以循环再生。
|
图 2 双酚A吸附与催化氧化行为之间的平衡关系 Fig. 2 Balance between adsorption and catalytic oxidation of BPA |
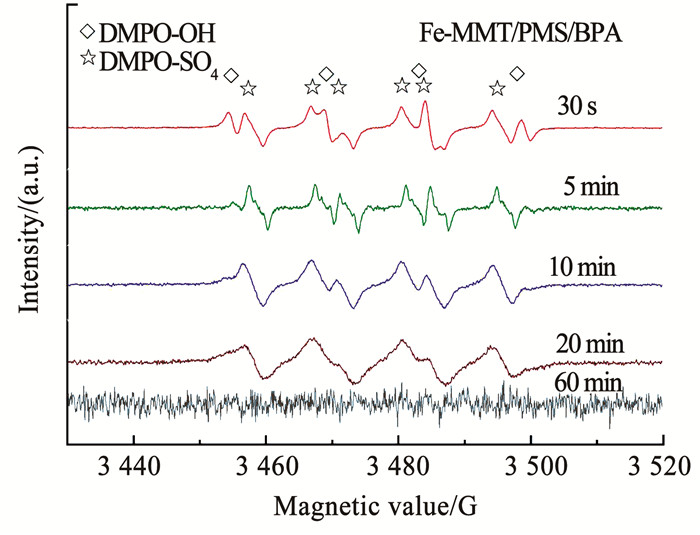
通过电子自旋共振(ESR)光谱技术,可以表征铁盐改性蒙脱土活化过一硫酸盐降解双酚A体系中自由基的物种及强度。根据前期的研究基础,可以利用DMPO作为典型的自由基捕获剂,显著识别1:2:2:1型DMPO-OH配合物的四重峰和DMPO-SO4的六重峰,从而检测系统中的自由基种类[13]。如图 3所示,在较短的反应时间内,铁盐改性蒙脱土活化过一硫酸盐降解双酚A体系中同时发现了HO·和SO4·-自由基的特征信号峰。随着反应时间的延长,HO·自由基的特征信号峰强度逐渐降低;在反应进行5 min后,HO·自由基的特征信号峰消失。充分说明,随着反应的进行,氢氧根加成物向硫酸根加成物的转化开始进行,直到氢氧根加成物的逐渐消失;硫酸根自由基逐步发展成为主导的活性物种。与典型的芬顿反应相比较,铁盐改性蒙脱土活化过一硫酸盐体系产生的HO·自由基与之类似。同时,研究也发现,三价铁盐活化过一硫酸盐体系和蒙脱土活化过一硫酸盐体系均不能产生HO·和SO4·-自由基。ESR的表征结果说明,铁盐改性蒙脱土对过一硫酸盐氧化具有很好的催化活性。
|
图 3 铁盐改性蒙脱土活化过一硫酸盐降解双酚A体系的电子自旋共振(ESR)光谱 Fig. 3 ESR spectroscopy of BPA system degradation through PMS activation by Fe-MMT |
为进一步验证铁盐改性蒙脱土活化过一硫酸盐降解双酚A(Fe-MMT/PMS/BPA)反应体系中的自由基种类,利用甲醇(Methanol)和叔丁醇(tert-Butanol, TBA)开展了自由基淬灭实验,其结果见图 4。甲醇常用作HO·和SO4·-自由基的淬灭指示剂。当向反应体系中投加10 mmol/L和100 mmol/L甲醇时,双酚A的去除率均由96.4%降到47.2%。与前期研究相比较,向单纯的Fe-MMT/BPA体系中投加甲醇,并不能明显抑制该体系对双酚A的去除率;这是因为Fe-MMT/BPA体系只有单纯的吸附作用,淬灭效应并不能体现出来。甲醇的自由基淬灭实验结果表明,在Fe-MMT/PMS/BPA反应体系中至少有HO·和SO4·-自由基的其中一种。

|
图 4 铁改性蒙脱土活化过硫酸盐降解双酚A体系中自由基的淬灭实验 Fig. 4 Radical quenching experiments of BPA system through PMS activation by Fe-MMT |
当向反应体系中投加10 mmol/L叔丁醇(TBA)时,双酚A的去除率由96.4%降至75.9%。相较于甲醇的淬灭作用而言,叔丁醇对Fe-MMT/PMS/BPA反应体系的抑制作用明显减弱。考虑到叔丁醇与HO·自由基的反应速率非常高,首先可以进一步确定Fe-MMT/PMS/BPA反应体系中存在HO·自由基。当向反应体系中投加100 mmol/L叔丁醇(TBA)时,双酚A的去除率进一步由75.9%降到54.6%。这主要是由过量叔丁醇抑制SO4·-自由基的氧化效能所致。叔丁醇的自由基淬灭实验结果表明,在Fe-MMT/PMS/BPA反应体系中共存有HO·和SO4·-两种自由基。
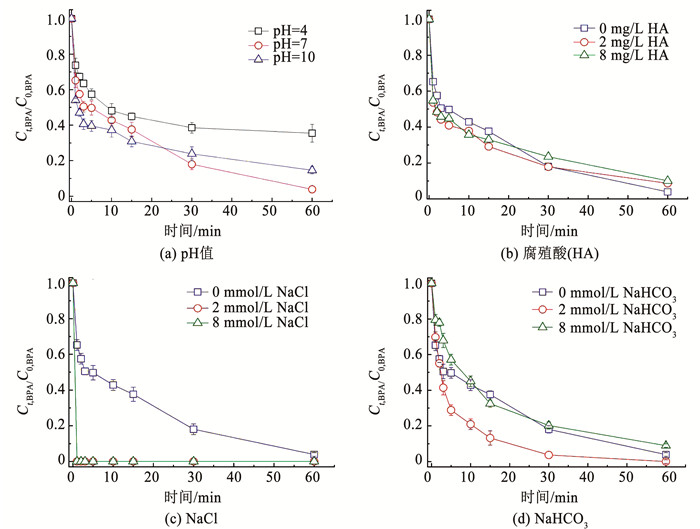
2.2 水中背景成分的影响 2.2.1 不同水质背景的影响系统考察了pH值、腐殖酸、碳酸氢根、氯离子等水质背景成分对Fe-MMT/PMS/BPA反应体系的影响。水中pH值对双酚A形态、铁盐水解、PMS分解程度都具有重要影响。如图 5(a)所示,当pH为7时,中性的反应体系在1 h内对BPA的去除率高达96.4%。当pH为4时,弱酸性的反应体系在1 h内对BPA的去除率下降到64.7%,这主要是由于酸性条件下大量的质子能够快速消耗反应体系中的HO·和SO4·-自由基。当pH为9时,碱性的反应体系在1 h内对BPA的去除率为85.4%。一方面,碱性条件有利于PMS通过碱活化路径额外生成单线态氧等活性物种; 另一方面,碱性条件下改性蒙脱土层间的三价铁盐可部分水解,生成的铁氧化物会占据一定量的吸附位点,降低BPA的吸附量。基于两方面因素的共同作用,碱性反应体系(pH=9)中BPA的去除率仍略低于中性反应体系。
|
图 5 背景成分对铁盐改性蒙脱土活化过硫酸盐降解双酚A的影响规律 Fig. 5 Effects of backgrounds on BPA degradation through PMS activation by Fe-MMT |
由图 5(b)可知,水中腐殖酸成分对Fe-MMT/PMS/BPA反应体系中双酚A的降解效率无明显抑制作用。一方面,水中腐殖酸与SO4·-自由基的反应活性比较低,不会与双酚A形成很强的竞争关系; 另一方面,铁盐改性的蒙脱土具有纳米级别的层间距,可以有效阻止水中腐殖酸成分进入片层间与铁盐反应,保证了层间微环境的过硫酸盐活性。
水中氯离子对Fe-MMT/PMS/BPA反应体系中双酚A的降解影响见图 5(c)。由图可知, 无论Cl-离子的投加量为2 mmol/L或8 mmol/L,双酚A都能在极短的时间(1 min)内被快速降解,去除率接近100%。已有报道认为,SO4·-自由基能够氧化氯离子产生氯自由基和自由氯活性物种。在SO4·-自由基和氯活性物种的共同作用下,双酚A能够被快速降解。水中HCO3-对Fe-MMT/PMS/BPA反应体系中双酚A的降解影响见图 5(d)。当NaHCO3的投加量为2 mmol/L时,双酚A在30 min内的去除率接近100%,这主要是因为此条件下易形成具有催化活性的铁氧化物水解产物。然而,当NaHCO3的投加量继续增加到8 mmol/L时,高浓度NaHCO3与HO·和SO4·-自由基的二级反应速率常数高达106~108 (mol/L)-1·s-1,导致HO·和SO4·-自由基易于被淬灭[14]。同时,在此过程中产生的CO3·-自由基具有较低的反应活性,也进一步降低了双酚A的去除率。以上研究发现,除了低浓度的腐殖酸外,pH值、氯离子、碳酸氢根对Fe-MMT活化过硫酸盐降解双酚A均具有较大的影响。
2.2.2 实际水体的影响通过实际水体加标的方式,考察了Fe-MMT活化过硫酸盐去除松花江江水中双酚A的情况,其结果见图 6。当向加标松花江水中添加2.5 g/L的Fe-MMT时,双酚A的去除率仅为7.2%,这主要是由Fe-MMT的吸附作用造成的。通过离子交换和吸附作用,松花江水中的无机离子或小分子有机物进入Fe-MMT层间而占据了双酚A的吸附活性位点,导致双酚A的吸附去除量很小。当向加标松花江水中添加PMS后,双酚A的去除率可以高达91%,这是水中pH、腐殖质、Cl-离子、HCO3-离子等复杂背景成分共同作用的结果。Fe-MMT活化过硫酸盐是降解去除松花江水中双酚A的主要作用机理。

|
图 6 铁盐改性蒙脱土活化过硫酸盐降解实际水体中双酚A的效能 Fig. 6 Efficiency of BPA degradation in real water through PMS activation by Fe-MMT |
催化性能稳定性和铁盐释放量是过硫酸盐高级氧化饮用水净化技术的重要指标。图 7所示为PMS投加量对于双酚A去除率和Fe(III)盐释放量的影响规律。在没有添加PMS的条件下,Fe-MMT在5 μmol/L双酚A溶液中的Fe(III)盐释放量仅为0.037 mg/L;而在Fe-MMT吸附作用下,双酚A的去除率为36.8%。当PMS的投加量由0.2 mmol/L增加到1 mmol/L时,反应初期的Fe(III)盐释放量增加,最大值达到0.583 mg/L。Fe(III)盐释放量依赖于PMS投加量,这主要归因于PMS中K+离子的阳离子交换效应。当PMS的投加量大于0.4 mmol/L时,双酚A的去除率保持在93.8%以上;同时,Fe(III) 盐释放量为0.283 mg/L,低于国家饮用水标准值(0.3 mg/L)。由此可见,Fe-MMT的稳定性和催化特性可以通过优化PMS的投加量来调节。
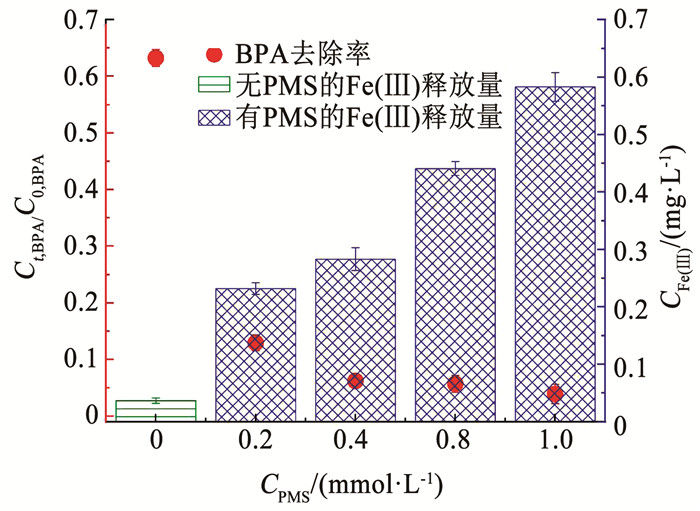
|
图 7 铁盐改性蒙脱土在活化过硫酸盐过程中的稳定性 Fig. 7 Stability of Fe-MMT in the process of PMS activation |
基于上述结果和分析,提出了Fe-MMT活化PMS降解双酚A的机制。在Fe(II)/PMS体系中,属于快速反应过程;该过程发生O—O键的断裂生成SO4·-。在Fe(III)/PMS体系中,电子由PMS向Fe(II)转移,属于缓慢反应过程,也是Fe(III)活化PMS的限速步骤。据报导,在蒙脱土层间,矿物表面化学可以促进氧化还原反应过程。
通过X射线衍射光谱(XRD)的分析可知,经过三价铁盐改性后,蒙脱土片层的层间距由0.13 nm增加到0.28 nm。由式(1)~(4),在Fe-MMT层间的纳米空间,Fe(III)可以与PMS形成络合物而发生电子转移,进而引发PMS的分解与活化,产生HO·和SO4·自由基;同时,Fe(III)与Fe(II)之间的相互转化可以实现Fe-MMT层间微区域≡Fe(III)/≡Fe(II)的循环催化[15]。此外,Fe-MMT制备过程中产生的铁氧化物也具有络合PMS的能力而产生SO5·-自由基,随后该络合物逐步释放出SO4·-自由基,见式(5)、(6)。SO4·-自由基在水中进一步产生HO·自由基,见式(7)。最后,生成的SO4·-和HO·自由基与BPA反应完成降解过程,见式(8)。由此可见,在蒙脱土层间的纳米空间,Fe(III)与PMS间的电子转移效率可以得到提高,加速生成了Fe(II),从而增强了PMS活化降解污染物的效果。
| $ \equiv {\rm{Fe}}\left( {{\rm{III}}} \right){\rm{ + HSO}}_5^ - \to \equiv {\rm{Fe}}\left( {{\rm{II}}} \right){\rm{ + S}}{{\rm{O}}_{\rm{5}}}{{\rm{\cdot}}^ - }{\rm{ + }}{{\rm{H}}^{\rm{ + }}} $ | (1) |
| $ \equiv {\rm{Fe}}\left( {{\rm{II}}} \right){\rm{ + HSO}}_5^ - \to \equiv {\rm{Fe}}\left( {{\rm{III}}} \right){\rm{ + S}}{{\rm{O}}_{\rm{4}}}{{\rm{\cdot}}^ - } + {\rm{O}}{{\rm{H}}^ - } $ | (2) |
| $ \equiv {\rm{Fe}}\left( {{\rm{II}}} \right){\rm{ + HSO}}_5^ - \to \equiv {\rm{Fe}}\left( {{\rm{III}}} \right){\rm{ + SO}}_4^{2 - } + {\rm{\cdot OH}} $ | (3) |
| $ \begin{array}{l} \equiv {\rm{Fe}}\left( {{\rm{III}}} \right) - {\rm{OH + HSO}}_5^ - \to \equiv {\rm{Fe}}\left( {{\rm{III}}} \right) - \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\left( {{\rm{OH}}} \right){\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + O}}{{\rm{H}}^ - } \end{array} $ | (4) |
| $ \begin{array}{l} {\rm{Fe}}\left( {{\rm{III}}} \right) - \left( {{\rm{OH}}} \right){\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + HSO}}_5^ - \to \equiv {\rm{Fe}}\left( {{\rm{II}}} \right) - \\ \;\;\;\;\;\;\;\;\;\;\;\;{\rm{\cdot OOSO}}_3^ - + {\rm{S}}{{\rm{O}}_{\rm{5}}}{\cdot ^ - } + {{\rm{H}}^ + } \end{array} $ | (5) |
| $ \begin{array}{l} \equiv {\rm{Fe}}\left( {{\rm{II}}} \right) - {\rm{\cdot OOSO}}_3^ - + {{\rm{H}}_{\rm{2}}}{\rm{O}} \to \equiv {\rm{Fe}}\left( {{\rm{III}}} \right) - \\ \;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{OH + S}}{{\rm{O}}_{\rm{4}}}{{\rm{\cdot}}^ - }{\rm{ + O}}{{\rm{H}}^ - } \end{array} $ | (6) |
| $ {\rm{S}}{{\rm{O}}_{\rm{4}}}{{\rm{\cdot}}^ - }{\rm{ + O}}{{\rm{H}}^ - } \to \cdot{\rm{OH + SO}}_4^{2 - } $ | (7) |
| $ {\rm{S}}{{\rm{O}}_{\rm{4}}}{{\rm{\cdot}}^ - } + {\rm{\cdot OH + BPA}} \to {\rm{byproducts + C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (8) |
天然MMT对PMS没有活化效果,而Fe-MMT能够有效活化PMS降解BPA。作为催化剂,Fe-MMT有良好的稳定性,且其铁盐释放量能够满足国家饮用水安全标准。Fe-MMT活化PMS体系几乎不受腐殖酸背景成分的影响,受无机阴离子影响较大,Cl-离子可以加快BPA的降解,低浓度的HCO3-可以增强Fe-MMT活化PMS体系的氧化能力,高浓度的HCO3-则会抑制体系的氧化能力。Fe-MMT/PMS体系适应性强,在实际水体背景条件下能有效降解BPA。自由基猝灭及自由基捕获实验表明,SO4·-和HO·自由基是主要活性物种,蒙脱土层间的纳米空间可以促进Fe(III)与Fe(II) 的循环,增强了PMS活化降解污染物的效果。
| [1] |
LI Juan, PANG Suyan, ZHOU Yang, et al. Transformation of bisphenol AF and bisphenol S by manganese dioxide and effect of iodide[J]. Water Research, 2018, 143: 47. DOI:10.1016/j.watres.2018.06.029 |
| [2] |
YANG Tao, WANG Lu, LIU Yulei, et al. Comparative study on ferrate oxidation of BPS and BPAF: Kinetics, reaction mechanism, and the improvement on their biodegradability[J]. Water Research, 2019, 148: 115. DOI:10.1016/j.watres.2018.10.018 |
| [3] |
MOREMAN J, LEE O, TRZNADEL M, et al. Acute toxicity, teratogenic, and estrogenic effects of bisphenol A and its alternative replacements bisphenol S, bisphenol F, and bisphenol AF in zebrafish embryo-larvae[J]. Environmental Science & Technology, 2017, 51(21): 12796. DOI:10.1021/acs.est.7b03283 |
| [4] |
ZOU Jing, MA Jun, CHEN Liwei, et al. Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(Ⅲ)/Fe(Ⅱ) cycle with hydroxylamine[J]. Environmental Science & Technology, 2013, 47(20): 11685. DOI:10.1021/es4019145 |
| [5] |
RASTOGI A, AL-ABED S R, DIONYSIOU D D. Effect of inorganic, synthetic and naturally occurring chelating agents on Fe(Ⅱ) mediated advanced oxidation of chlorophenols[J]. Water Research, 2009, 43(3): 684. DOI:10.1016/j.watres.2008.10.045 |
| [6] |
WANG Panpan, MA Jun, WANG Zhenghui, et al. Enhanced separation performance of PVDF/PVP-g-MMT nanocomposite ultrafiltration membrane based on the NVP-grafted polymerization modification of montmorillonite (MMT)[J]. Langmuir, 2012, 28(10): 4776. DOI:10.1021/la203494z |
| [7] |
WANG Panpan, MA Jun, SHI Fengmei, et al. Behaviors and effects of differing dimensional nanomaterials in water filtration membranes through the classical phase inversion process: A review[J]. Industrial & Engineering Chemistry Research, 2013, 52(31): 10355. DOI:10.1021/ie303289k |
| [8] |
CHEN Jianxin, ZHU Lizhong. Heterogeneous UV-fenton catalytic degradation of dyestuff in water with hydroxyl-Fe pillared bentonite[J]. Catalysis Today, 2007, 126(3/4): 463. DOI:10.1016/j.cattod.2007.06.022 |
| [9] |
FENG Jiyun, HU Xijun, YUE P L. Novel bentonite clay-based Fe-nanocomposite as a heterogeneous catalyst for photo-fenton discoloration and mineralization of orange Ⅱ[J]. Environmental Science & Technology, 2004, 38(1): 269. DOI:10.1021/es034515c |
| [10] |
WU Junxue, CAGNETTA G, WANG Bin, et al. Efficient degradation of carbamazepine by organo-montmorillonite supported nCoFe2O4-activated peroxymonosulfate process[J]. Chemical Engineering Journal, 2019, 368: 824. DOI:10.1016/j.cej.2019.02.137 |
| [11] |
CHEN Qiuqiang, WU Pingxiao, LI Yuanyuan, et al. Heterogeneous photo-Fenton photodegradation of reactive brilliant orange X-GN over iron-pillared montmorillonite under visible irradiation[J]. Journal of Hazardous Materials, 2009, 168(2/3): 901. DOI:10.1016/j.jhazmat.2009.02.107 |
| [12] |
JIA Hanzhong, ZHAO Song, SHI Yafang, et al. Mechanisms for light-driven evolution of environmentally persistent free radicals and photolytic degradation of PAHs on Fe(Ⅲ)-montmorillonite surface[J]. Journal of Hazardous Materials, 2019, 362: 92. DOI:10.1016/j.jhazmat.2018.09.019 |
| [13] |
XU Haodan, WANG Da, MA Jun, et al. A superior active and stable spinel sulfide for catalytic peroxymonosulfate oxidation of bisphenol S[J]. Applied Catalysis B: Environmental, 2018, 238: 557. DOI:10.1016/j.apcatb.2018.07.058 |
| [14] |
GHAUCH A, BAALBAKI A, AMASHA M, et al. Contribution of persulfate in UV-254nm activated systems for complete degradation of chloramphenicol antibiotic in water[J]. Chemical Engineering Journal, 2017, 317: 1012. DOI:10.1016/j.cej.2017.02.133 |
| [15] |
WANG Panpan, LIU Xiaolin, QIU Wei, et al. Catalytic degradation of micropollutant by peroxymonosulfate activation through Fe(Ⅲ)/Fe(Ⅱ) cycle confined in the nanoscale interlayer of Fe(Ⅲ)-saturated montmorillonite[J]. Water Research, 2020, 182: 116030. DOI:10.1016/j.watres.2020.116030 |
 2022, Vol. 54
2022, Vol. 54


