多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是具有两个或两个以上苯环的一类有机化合物的总称,是城市地表径流中的主要有毒污染物之一。已有研究表明,水体生态系统中14%~36%的PAHs负荷来自城市地表径流[1],上述结果对自然环境和人类健康均造成很大的威胁。干植草沟作为一种常用的低影响开发(LID)设施,对道路径流中污染物具有良好的水文、水质控制效果[2]。相比营养物质和悬浮物,迄今为止对植草沟控制道路径流中PAHs污染的研究仍然少见,已有的研究通常以生物滞留设施为评价对象[3]。生物滞留设施对于PAHs具有很好的去除能力,径流经生物滞留系统处理后出水PAHs总浓度可降低31%~99%,年平均污染负荷去除率高达87%[4]。Lefevre等[5]采用模拟柱研究了生物滞留对萘(NaP)的去除机制与影响因素,考察了基质吸附、植物吸收、微生物矿化、挥发等作用对NaP的去除效果。生物滞留设施的基质层厚度明显大于植草沟,因短流造成穿透的可能小,这有利于PAHs的稳定去除,因此,干植草沟对PAHs的实际控制效果值得关注。此外,迄今对LID设施去除高分子质量(HMW)PAHs的机制研究仍不够深入,已有的关于PAHs降解的研究多集中于污染土壤的修复领域[6-7]。
在干植草沟系统中,基质层是影响净化效果的决定因素。Huang等[8]发现,锯末能够提高土壤中细菌、真菌和PAHs降解菌的丰度,进而提高土壤中PAHs的去除率。添加堆肥也可以提高土壤中PAHs的降解效果,降解率可达53.65%[9]。在基质中引入合适的外源有机质,能强化对难降解污染物的吸附,还有利于提高相关微生物的活性与降解能力,因此,选择合适的外源有机质以提高植草沟对道路径流中的PAHs的去除效果具有现实意义。
本研究搭建植草沟模拟柱,以代表性PAHs配制的人工径流作为进水,考察外源有机质的存在及类型对PAHs去除效果及其归宿的影响;对各模拟柱进行PAHs质量平衡核算,评价PAHs在典型基质中的降解情况,探讨不同分子质量PAHs的去除机制,以期为植草沟设施的优化设计提供技术支撑。
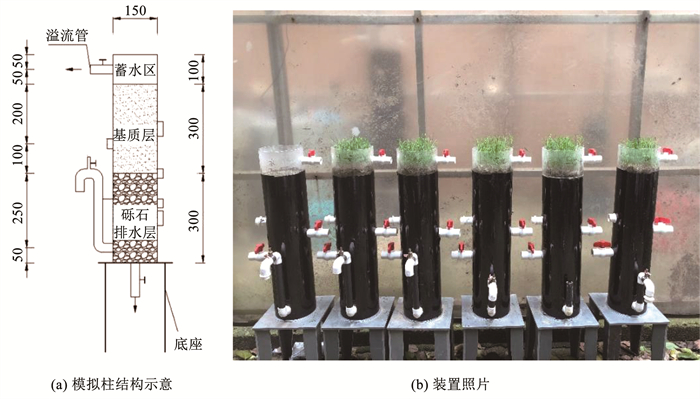
1 实验 1.1 实验装置6个干植草沟模拟柱置于透明阳光棚下,避免天然降雨影响的同时保持与当地气候、光照、温度一致的环境条件。模拟柱由有机玻璃制成,内径为150 mm、高度为700 mm,固定于高300 mm的底座上,自上而下依次为蓄水层、植物、基质层和砾石排水层。除上端100 mm蓄水区外,柱外壁贴黑色遮光膜以防止藻类滋生。模拟柱底端设置出水采样口,实验装置见图 1。由于实验期间底部出水口常开,上弯出水管在本实验中未使用。
|
图 1 模拟柱结构示意和装置实物(mm) Fig. 1 Schematic diagram and photograph of dry grass swale columns (mm) |
除添加的有机质类型不同外,各模拟柱的基质层基本成分完全一致(表 1),使用给水厂污泥意在强化植草沟的除磷效果,外源有机质类型的选择主要参照生物滞留池及污染土壤修复相关研究中常用的有机组分[8, 10-11]。其中,模拟柱CW(column-woodchips)添加经发酵处理的榉木屑,以降低木屑中易降解组分的质量分数,减少运行过程中有机物的淋出。模拟柱CWNG(column-woodchips-no grass)同样使用榉木屑而未种植植物,以分析比较植物对植草沟去除PAHs的作用。CV柱(column-vermiculite)选择无机材料蛭石作为介质,使其和CW有相近的渗透速率及持水能力,通过CV和CW比较基质中外源有机质的存在对PAHs去除效果的影响。模拟柱CN(column-newspaper)、CB(column-biochar)和CC(column-coir)分别选用纤维素含量高的报纸、500 ℃下炭化的玉米秸秆生物炭以及木质素含量较高的椰棕丝作为有机质,通过与CW的对比,考察不同类型的外源有机质对PAHs的去除和归宿的影响。
| 表 1 各模拟柱的基质组成 Tab. 1 Substrate components of each dry grass swale |
根据对上海市内环高架路面径流水质的前期监测结果[12],同时考虑不同分子质量PAHs的类型,选择径流中质量浓度较高的2环的萘(NaP)、3环的菲(PhA)和4环的荧蒽(FlA)作为植草沟去除PAHs机制考察的对象。根据3种PAHs的溶解度,取萘0.06 g、菲0.008 g和荧蒽0.001 6 g一起溶于10 mL甲醇中,配置成PAHs储备液,再将10 mL储备液加水定容至1 L,搅拌至完全溶解,配置成PAHs工作液存储于4 ℃冰箱中。
进水为人工配制的模拟径流。每次进水前,首先称取一定量的KH2PO4、NH4Cl、NaNO3溶于自来水中,加入适量的PAHs工作液,在暗处充分搅拌1 d后作为模拟柱的进水。确保模拟径流中水质指标大致如表 2所示。其中,NaP、PhA、FlA的进水质量浓度比实际径流中高很多,目的是减少后续质量平衡核算中的测定误差,有助于进行去除机制的研究。NaP、PhA、FlA的准确浓度经测定确定,进水中甲醇质量浓度约为190 mg/L,折算成COD约为285 mg/L,略高于上海市路面径流中实际COD。
| 表 2 人工模拟径流水质 Tab. 2 Characteristics of artificial simulated runoff |
为促进模拟柱内微生物群落形成以保证实验进度,在实验开始前用蠕动泵向各模拟柱内接种2 L污水厂二沉池出水进行微生物培养驯化。进水采用蠕动泵,参考上海市年径流总量控制率80%所对应的次降雨量26.7 mm与干植草沟服务面积比10%(径流系数0.9)设定模拟柱的运行条件:进水流速约为1 L/h(5.56 cm/h),每次进水4.5 h,单次实验进水量为4.5 L。上述运行参数对应的降雨条件对于植草沟的实际运行为不利条件。以7 d为1个进水周期,在每周期开始时进水4.5 h(进水期),之后均处于闲置状态(落干期),以此模式连续运行约5个月。
1.3 样品采集与分析取模拟径流1 L置于棕色玻璃瓶中作为进水样品。每次进水收集各模拟柱的全部出水并混合均匀,记录出水体积,取1 L置于棕色玻璃瓶中作为出水样品。全部水样避光保存在4 ℃冰箱中,并于48 h内完成水质分析。PAHs分析方法参照HJ478—2009《水质多环芳烃的测定液液萃取和固相萃取高效液相色谱法》[13]。
定期对狗牙根草皮进行修剪,收集修剪下来的植物样品备用。进水实验完成后,将各模拟柱中的草皮连同根系挖出,与之前收集的植物样品混匀。分别对0~10 cm、10~20 cm和20~30 cm基质层进行分层取样,用于测定模拟柱基质中残留的PAHs质量分数。植物和基质样品采集后冷冻干燥,研磨后过0.25 mm筛,参照HJ784—2016《土壤和沉积物多环芳烃的测定高效液相色谱法》进行PAHs的测定和分析[14]。
基质的饱和渗透速率使用恒水头法测定[15]。有机质材料的纤维素、半纤维素、木质素含量采用范式法[16]进行测定。比表面积的计算采用Brunauer-Emmett-Teller(BET)方法,使用ASAP 2460比表面积分析仪(Micromeritics仪器公司,美国)测定。
1.4 质量控制PAHs分析的质量控制采用加标回收分析和平行样分析,3种PAHs混合标准品由美国o2si公司提供。在样品萃取前加入十氟联苯(Decafluorobiphenyl,质量分数99%),用于跟踪样品前处理的回收率(50%~130%)。以蒸馏水进行空白试验,3种目标PAHs均未检出,分析过程无污染。样品中3种PAHs的平均加标回收率分别为60.9%、77.8%、87.2%,空白加标回收率分别为70.4%、82.3%、89.6%,满足HJ478—2009[13]、HJ784—2016[14]中规定的痕量PAHs分析要求。同一水样的平行样品(n=3)中3种PAHs具有较好的重现性,相对标准偏差小于20%,满足质量控制标准。
1.5 数据处理与分析植草沟模拟柱中PAHs的去除量由式(1)和(2)计算:
| $ \begin{aligned} \Delta m=& m_{\text {in }}-m_{\text {out }}=\sum\limits_{i=1}^{n}\left(\rho_{i(\text { in })} \times V_{i(\text { in })}-\right.\\ &\left.\rho_{i(\text { out })} \times V_{i(\text { out })}\right) \end{aligned} $ | (1) |
| $ \Delta m=m_{\mathrm{b}}+m_{\mathrm{v}}+m_{\mathrm{s}}+m_{\mathrm{p}} $ | (2) |
式中:Δm为模拟柱对PAHs去除量,mg;min为进水中PAHs总质量,mg;mout为出水中PAHs总质量,mg;n为总进水次数,n=20;ρi(in)、ρi(out)为第i次进出水中PAHs质量浓度,mg/L;Vi(in)、Vi(out)为第i次进出水体积,L;mb为模拟柱中PAHs的微生物降解量,mg;mv为模拟柱中PAHs的挥发量,mg;ms为模拟柱中PAHs的吸附量,mg;mp为模拟柱中PAHs的植物吸收量,mg。
由于所选3种PAHs拥有相对较低的空气- 水分配系数(log Kaw)和较高的正辛醇- 水分配系数(log Kow),进入模拟柱中的PAHs更倾向于吸附在基质中,使得PAHs的挥发量极小,因此,在进行质量平衡时PAHs的挥发量可以忽略[5],模拟柱中PAHs的微生物降解量可由式(3)计算得到。
| $ m_{\mathrm{b}}=\Delta m-m_{\mathrm{s}}-m_{\mathrm{p}} $ | (3) |
实验数据采用IBM SPSS 20和Origin 8.0进行统计处理,在显著性分析前先对相关数据进行正态分布和方差齐性检验。在0.05水平下,所有数据符合正态分布,但部分数据方差不齐,故采用单因素方差分析中的Games-Howell方法进行显著性分析。
2 结果与讨论 2.1 基质重要成分理化性质表征各模拟柱中有机质材料和蛭石的理化性质表征结果见表 3。
| 表 3 基质重要成分的理化性质 Tab. 3 Physicochemical properties of important components of substrates |
各模拟柱出水中PAHs质量浓度监测结果见图 2和表 4。由图 2可知,各模拟柱出水NaP、PhA、FlA的质量浓度均极显著低于进水值(P<0.01)。在整个运行周期内,同一模拟柱在同样的进水条件下出水水质波动不大,去除效果较稳定。

|
注:标有不同小写字母表示组间差异显著(P < 0.05);标有相同小写字母表示组间差异不显著(P>0.05);1/2、1/10进水分别表示将进水质量浓度除以2、10后作图。 图 2 各模拟柱进出水PAHs的质量浓度分布 Fig. 2 Concentrations of PAHs in influent and effluent of each column |
| 表 4 各模拟柱进出水PAHs的去除率 Tab. 4 Removal rates of PAHs in influent of each |
各模拟柱对FlA的去除效果最好,平均去除率均高于90%(表 4),组间差异不明显,对NaP、PhA的去除率分别为69%~88%和34%~73%,这可能与PAHs自身的理化性质有关。FlA为含有4个苯环结构的高分子质量(HMW)PAHs,HMW PAHs的正辛醇- 水分配系数大,疏水性强,容易吸附于颗粒物表面[17],在流经干植草沟基质层时可得到有效过滤和拦截,因此,HMW PAHs的去除效率普遍高于低分子质量(LMW)PAHs[17]。与NaP相比,PhA具有更多的苯环,可通过形成π—π络合物表现出更高的吸附亲和力[18],但本研究中PhA的去除效果不如NaP,可能是因为NaP的进水质量浓度约为PhA的7.5倍,NaP在进水期更有可能与基质材料中有限的活性吸附位点发生有效碰撞。由于各组分进水质量浓度比例与实际道路径流差别较大,需结合浅基质层植草沟对于道路径流的实际控制效果进行进一步探讨。
添加蛭石的模拟柱CV出水中除FlA外,NaP、PhA和∑3PAHs的平均质量浓度均显著高于模拟柱CW(P<0.05),说明在植草沟基质中添加外源有机质有利于进水期PAHs的去除。添加生物炭的模拟柱CB出水水质显著优于其他模拟柱(P<0.05),这是因为高温条件下(500 ℃)烧制而成的生物炭具有大量的芳香结构,而且比表面积大、孔隙度高,可以提供更多的吸附位点,对PAHs具有强吸附能力[19-21]。由于椰棕丝易盘绕成团,在基质中形成了大孔隙容易发生短流,模拟柱CC的基质饱和渗透速率(表 3)高于其他模拟柱,在同样的进水条件下,CC柱总是首先产生出流,PAHs与基质接触时间短、作用不充分,因而CC柱出水质量浓度最高,去除效果相应最差。
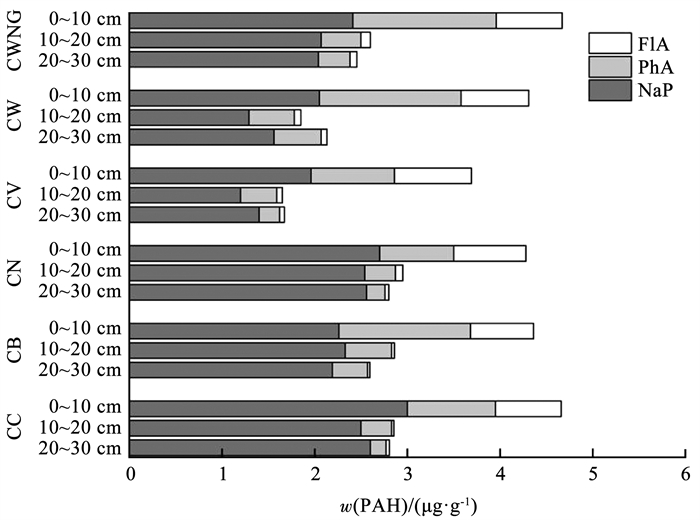
2.3 各模拟柱中PAHs质量平衡为考察PAHs在模拟柱中的积累和最终归宿,基于整个运行周期对各模拟柱进行PAHs质量平衡核算。实验开始前采集了各种基质样品,测定其中PAHs的本底浓度,NaP、PhA和FlA的浓度均低于检出限,因此, 本底浓度不计。实验结束后对各模拟柱不同深度采集的基质样品进行检测发现(图 3),∑3PAHs主要被截留于基质层上部0~10 cm,质量分数随着基质层深度的增加而降低,这与国外报道的现场规模的研究结果一致[4, 22]。NaP在各模拟柱基质层不同位置的质量分数相对比较均匀,PhA和FlA则更多地留存于基质层表层,原因是低环数的NaP溶解度高、渗滤势大,且进水质量浓度较高,更容易从表层向下迁移[23]。上述结果说明浅基质层相对不利于以溶解态为主的LMW PAHs的去除。而实际道路径流中PAHs以4~6环的HMW PAHs为主[12],因此,从PAHs去除的角度而言,基质层厚度较浅的常规设计并不影响干植草沟的实际运行效果。
|
图 3 各模拟柱基质中PAHs残留量 Fig. 3 Residues of PAHs in substrates of each column |
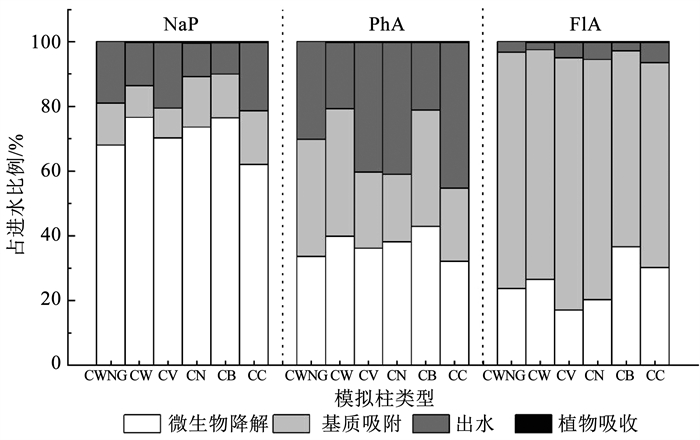
整个运行周期内共完成了20次进水操作,根据模拟柱进、出水PAHs质量,基质和植物中PAHs吸收量,以及由式(3)计算而得的PAHs微生物降解量,得到运行周期内各模拟柱PAHs质量平衡结果如图 4所示。可以看出,植物直接吸收PAHs的量很少,均低于0.5%,表明草皮的吸收不是PAHs去除的重要途径。在所有模拟柱中,随着分子质量的增加,PAHs在基质中的积累越明显,生物降解的程度也相应降低,NaP、PhA和FlA的微生物降解率分别为62.1%~76.6%、32.2%~42.9%和17.1%~36.6%,这是因为2环的NaP化学性质相对活泼,更容易发生典型的芳香亲电取代和氧化等反应,主要通过微生物的降解作用得到去除[24],而高环组分化学性质相对稳定,对土壤微生物的抵抗力较强[7]。
|
图 4 各模拟柱PAHs质量平衡 Fig. 4 Mass balance of PAHs in each column |
对比模拟柱CW和CWNG可知,在植物存在的情况下,基质中微生物降解PAHs的能力提高了2.8%~8.6%,说明植物的存在对PAHs的矿化有积极作用。Siciliano[25]和Lefevre等[5]的研究均发现,种植植物的生物滞留设施对PAHs生物降解效率远高于没有种植植物的系统。植物根部可以在落干期增加土壤的含氧量[26],并提供微生物生长附着的载体,植物释放的分泌物可作为污染物类似物诱导污染物生物降解,刺激细菌种群发育[27],从而增强微生物对PAHs的好氧降解过程。由于植草沟草皮根系的生物量小,相关植草设施对促进PAHs降解的效果一般。
在基质中外源有机质质量分数相同的情况下,模拟柱CB对强化PAHs的生物降解效果最为显著,NaP、PhA和FlA的微生物降解率分别为76.4%、42.9%和36.6%,说明生物炭的施用是一种有效的提高PAHs分解转化效果的措施。生物炭因其结构特性可以为PAHs降解菌的生长和繁殖提供更多的附着位点和较大的生存空间,并为附着在生物炭上的微生物提供营养物质[28]。
本研究中椰棕丝、木屑、报纸的木质素质量分数分别为33.7%、18.9%和13.12%(表 3),模拟柱CC、CW、CN对FlA的微生物降解率相应降低,分别为30.2%、26.6%和20.3%,上述结果可能与外源有机质材料中木质素的质量分数有关。具有木质素降解能力的白腐真菌等可以向胞外分泌木质素降解酶[29],这些胞外酶可通过开环作用把PAHs代谢成为水溶性较强的醌类中间产物,再由其他微生物进一步降解这些中间产物直至完全矿化[30]。Han等[31]在土壤修复研究中发现,添加农业废弃物(小麦秸秆、蘑菇渣和牛粪)能够改变土壤中多环芳烃降解菌的丰度和群落结构,这些农业废弃物中木质素质量分数较高,可作为共代谢基质以刺激土壤中的白腐真菌生长,进而促进了HMW PAHs的矿化率[32]。而模拟柱CC对NaP和PhA的降解程度不如CW和CN,可能是CC柱不利的布水条件导致基质中存在短流,使较多的以溶解态为主的NaP和PhA随出水流失,还影响了被吸附截留的PAHs在基质中的分布,因而PAHs降解菌的作用没有得到充分发挥。
2.4 外源有机质类型评价本研究的目的是考察、筛选有利于提高PAHs的降解率,保证植草沟类LID设施长期运行效果的外源有机质成分。综合比较4种外源有机质成分对强化PAHs去除转化的效果可知,椰棕丝在实际应用中易形成不利的布水条件,影响植草沟对PAHs的净化效果和微生物降解程度。生物炭对PAHs的去除率和微生物降解率均最高,作为一种优良的土壤改良剂,生物炭目前已应用于海绵城市建设中,不同生物质材料与不同热解温度所制得的生物炭的性质与价格存在差异[33],实际应用还需要积累经验。经稳定化处理后的硬木屑比报纸更能促进PAHs的降解,其降解效率与生物炭相当(图 4)。发酵木屑制作简单、成本低廉,还能作为反硝化碳源[34]提高植草沟类设施的除氮能力,是生态型径流源头控制设施基质的常用成分。因此,在实际工程应用中,生物炭和发酵木屑均可作为合适的外源有机质材料强化植草沟类设施对PAHs的控制效果,发酵木屑更具经济性。
3 结论1) 对于进水,各种有机成分植草沟模拟柱对NaP、PhA和FlA的去除率分别为69.0%~87.5%、33.7%~72.9%和90.8%~96.8%,在植草沟基质中添加外源有机质有利于提高对径流中PAHs的去除效果。NaP在各模拟柱基质层不同位置的质量分数相对比较均匀,PhA和FlA主要被截留于基质层上部0~10 cm内,基质层较浅不利于以溶解态为主的LMW PAHs的去除。
2) 随着PAHs分子质量的增加,PAHs在基质中的积累越明显,生物降解的程度也相应降低,NaP、PhA和FlA的微生物降解率分别为62.1%~76.6%、32.2%~42.9%和17.1%~36.6%。草皮的存在可使微生物降解PAHs的总量提高2.8%~8.6%。
3) 椰棕丝在实际应用中易形成不利的进水条件,影响PAHs的去除效果。木屑对促进PAHs的生物降解效率与生物炭相当,二者均可作为良好的外源有机质材料在LID设施的实际应用中发挥作用,木屑更具经济性。
| [1] |
HOFFMAN E J, MILLS G L, LATIMER J S, et al. Urban runoff as a source of polycyclic aromatic hydrocarbons to coastal waters[J]. Environmental Science & Technology, 1984, 18(8): 580. DOI:10.1021/es00126a003 |
| [2] |
GONG Yongwei, YIN Dingkun, LIU Chao, et al. The influence of external conditions on runoff quality control of grass swale in Beijing and Shenzhen, China[J]. Water Practice & Technology, 2019, 14(2): 482. DOI:10.2166/wpt.2019.031 |
| [3] |
LEROY M C, LEGRAS M, MARCOTTE S, et al. Assessment of PAH dissipation processes in large-scale outdoor mesocosms simulating vegetated road-side swales[J]. Science of the Total Environment, 2015, 520: 146. DOI:10.1016/j.scitotenv.2015.03.020 |
| [4] |
DIBLASI C J, LI H, DAVIS A P, et al. Removal and fate of polycyclic aromatic hydrocarbon pollutants in an urban stormwater bioretention facility[J]. Environmental Science & Technology, 2009, 43(2): 494. DOI:10.1021/es802090g |
| [5] |
LEFEVRE G H, NOVAK P J, HOZALSKIR M. Fate of naphthalene in laboratory-scale bioretention cells: implications for sustainable stormwater management[J]. Environmental Science & Technology, 2012, 46(2): 995. DOI:10.1021/es202266z |
| [6] |
GAN S, LAU E V, NG H K. Remediation of soils contaminated with polycyclic aromatic hydrocarbons (PAHs)[J]. Journal of Hazardous Materials, 2009, 172(2/3): 532. DOI:10.1016/j.jhazmat.2009.07.118 |
| [7] |
HARITASH A K, KAUSHIKC P. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review[J]. Journal of Hazardous Materials, 2009, 169((1/2/3)): 1. DOI:10.1016/j.jhazmat.2009.03.137 |
| [8] |
HUANG Yongjie, PAN Huan, WANG Qingling, et al. Enrichment of the soil microbial community in the bioremediation of a petroleum-contaminated soil amended with rice straw or sawdust[J]. Chemosphere, 2019, 224: 265. DOI:10.1016/j.chemosphere.2019.02.148 |
| [9] |
FENG Lijuan, ZHANG Liqiu, FENG Li. Dissipation of polycyclic aromatic hydrocarbons in soil amended with sewage sludge compost[J]. International Biodeterioration & Biodegradation, 2014, 95: 200. DOI:10.1016/j.ibiod.2014.04.012 |
| [10] |
LI Xiaona, SONG Yang, WANG Fang, et al. Combined effects of maize straw biochar and oxalic acid on the dissipation of polycyclic aromatic hydrocarbons and microbial community structures in soil: a mechanistic study[J]. Journal of Hazardous Materials, 2019, 364: 325. DOI:10.1016/j.jhazmat.2018.10.041 |
| [11] |
RAHMAN K S M, BANAT I M, THAHIRA J, et al. Bioremediation of gasoline contaminated soil by a bacterial consortium amended with poultry litter, coir pith and rhamnolipid biosurfactant[J]. Bioresource Technology, 2002, 81(1): 25. DOI:10.1016/S0960-8524(01)00105-5 |
| [12] |
边璐, 李田, 侯娟. PMF和PCA/MLR法解析上海市高架道路地表径流中多环芳烃的来源[J]. 环境科学, 2013, 34(10): 3840. BIAN Lu, LI Tian, HOU Juan. Source apportionment of polycyclic aromatic hydrocarbons using two mathematical models for runoff of the Shanghai elevated inner highway, China[J]. Environmental Science, 2013, 34(10): 3840. DOI:10.13227/j.hjkx.2013.10.027 |
| [13] |
中华人民共和国环境保护部. 水质多环芳烃的测定液液萃取和固相萃取高效液相色谱法: HJ478—2009[S]. 北京: 中国环境科学出版社, 2009
|
| [14] |
中华人民共和国环境保护部. 土壤和沉积物多环芳烃的测定高效液相色谱法: HJ784—2016[S]. 北京: 中国环境科学出版社, 2016
|
| [15] |
雷志栋, 杨诗秀, 谢森传. 土壤水动力学[M]. 北京: 清华大学出版社, 1988: 25. LEI Zhidong, YANG Shixiu, XIE Senchuan. Soil hydrodynamics[M]. Beijing: Tsinghua University Press, 1988: 25. |
| [16] |
陈贤情, 商晋, 宋慧芳, 等. 秸秆中纤维素/半纤维素和木质素的几种测定方法对比[C]//中国农业工程学会2011年学术年会论文集. 重庆: 中国农业工程学会, 2011: 1 CHEN Xianqing, SHANG Jin, SONG Huifang, et al. Comparison of several determination methods of cellulose/hemicellulose and lignin in straw[C]//Proceedings of 2011 Annual Conference of Chinese Society of Agricultural Engineering. Chongqing: Chinese Society of Agricultural Engineering, 2011: 1 |
| [17] |
SCHWARZENBACH R P, GSCHWEND P M, IMBODEN D M. Environmental organic chemistry[M]. Hoboken: Wiley, 2016: 34.
|
| [18] |
BOVING T B, NEARY K. Attenuation of polycyclic aromatic hydrocarbons from urban stormwater runoff by wood filters[J]. Journal of Contaminant Hydrology, 2007, 91(1/2): 43. DOI:10.1016/j.jconhyd.2006.08.009 |
| [19] |
PARK J H, OK Y S, KIM S H, et al. Competitive adsorption of heavy metals onto sesame straw biochar in aqueous solutions[J]. Chemosphere, 2016, 142: 77. DOI:10.1016/j.chemosphere.2015.05.093 |
| [20] |
黄华, 王雅雄, 唐景春, 等. 不同烧制温度下玉米秸秆生物炭的性质及对萘的吸附性能[J]. 环境科学, 2014, 35(5): 1884. HUANG Hua, WANG Yaxiong, TANG Jingchun, et al. Properties of maize stalk biochar produced under different pyrolysis temperatures and its sorption capability to naphthalene[J]. Environmental Science, 2014, 35(5): 1884. DOI:10.13227/j.hjkx.2014.05.036 |
| [21] |
肖凯丽. 不同热解温度小麦秸秆生物炭对土壤中多环芳烃环境行为的影响[D]. 天津: 天津大学, 2018 XIAO Kaili. Effects of biochars derived from different pyrolysis temperatures on environmental behaviors of polycyclic aromatic hydrocarbons in soils[D]. Tianjin: Tianjin University, 2018 |
| [22] |
DIERKES C, GEIGER W F. Pollution retention capabilities of roadside soils[J]. Water Science and Technology, 1999, 39(2): 201. DOI:10.1016/S0273-1223(99)00024-4 |
| [23] |
鲁垠涛, 向鑫鑫, 张士超, 等. 不同土地利用类型的土壤中多环芳烃的纵向迁移特征[J]. 环境科学, 2019, 40(7): 3369. LU Gentao, XIANG Xinxin, ZHANG Shichao, et al. Vertical distribution characteristics of PAHs in soils with different land use types during rapid urbanization[J]. Environmental Science, 2019, 40(7): 3369. DOI:10.13227/j.hjkx.201809094 |
| [24] |
DAVIES J I, EVANS W C. Oxidative metabolism of naphthalene by soil pseudomonad: the ring-fission mechanism[J]. Biochemical Journal, 1964, 91(2): 251. DOI:10.1042/bj0910251 |
| [25] |
SICILIANO S D, GERMIDA J J, BANKS K, et al. Changes in microbial community composition and function during a polyaromatic hydrocarbon phytoremediation field trial[J]. Applied & Environmental Microbiology, 2003, 69(1): 483. DOI:10.1128/AEM.69.1.483-489.2003 |
| [26] |
WEISHAAR J A, TSAO D, BURKEN J G. Phytoremediation of BTEX hydrocarbons: potential impacts of diurnal groundwater fluctuation on microbial degradation[J]. International Journal of Phytoremediation, 2009, 11(5): 509. DOI:10.1080/15226510802656326 |
| [27] |
LEIGH M B, FLETCHER J S, FU X, et al. Root turnover: an important source of microbial substrates in rhizosphere remediation of recalcitrant contaminants[J]. Environmental Science & Technology, 2002, 36(7): 1579. DOI:10.1021/es015702i |
| [28] |
李力, 刘娅, 陆宇超, 等. 生物炭的环境效应及其应用的研究进展[J]. 环境化学, 2011, 30(8): 1411. LI Li, LIU Ya, LU Yuchao, et al. Review on environmental effects and applications of biochar[J]. Environmental Chemistry, 2011, 30(8): 1411. |
| [29] |
杨晔. 木质素降解酶研究进展[J]. 农业工程, 2014, 4(4): 48. YANG Ye. Review on lignin degradation enzyme[J]. Agricultural Engineering, 2014, 4(4): 48. DOI:10.3969/j.issn.2095-1795.2014.04.016 |
| [30] |
HARAYAMA S, KOK M, NEIDLE E L. Functional and evolutionary relationship among diverse oxygenases[J]. Annual Review of Microbiology, 1992(46): 565. DOI:10.1146/annurev.mi.46.100192.003025 |
| [31] |
HAN Xuemei, HU Hangwei, SHI Xiuzhen, et al. Effects of different agricultural wastes on the dissipation of PAHs and the PAH-degrading genes in a PAH-contaminated soil[J]. Chemosphere, 2017, 172: 286. DOI:10.1016/j.chemosphere.2017.01.012 |
| [32] |
CAJTHAML T, ERBANOVA P, KOLLMANN A, et al. Degradation of PAHs by ligninolytic enzymes of Irpex lacteus[J]. Folia Microbiologic, 2008, 53(4): 289. DOI:10.1007/s12223-008-0045-7 |
| [33] |
CHI Jie, LIU Hongyan. Effects of biochars derived from different pyrolysis temperatures on growth of Vallisneria spiralis and dissipation of polycyclic aromatic hydrocarbons in sediments[J]. Ecological Engineering, 2016(93): 199. DOI:10.1016/j.ecoleng.2016.05.036 |
| [34] |
张佳炜, 李田, 张庭秀. 浅基质层干植草沟运行效果的现场实验[J]. 环境科学, 2020, 41(9): 4105. ZHANG Jiawei, LI Tian, ZHANG Tingxiu. Performance assessment of field-scale dry grass swale with shallow substrate layer[J]. Environmental Science, 2020, 41(9): 4105. DOI:10.13227/j.hjkx.202002005 |
 2022, Vol. 54
2022, Vol. 54


