工业园区废水具有浓度高、毒性大和成分复杂等特点,经二级生化处理后,仍存在一些毒性较大的有机物[1],如苯系物[2-3]等,直接排放至自然水体会对生态环境造成严重威胁。因此,必须对工业园区二级出水进行深度处理,以降低其环境风险。
臭氧高级氧化技术被广泛应用于水中难降解、有毒污染物的降解去除,其中,O3/H2O2工艺能够产生氧化性极强且选择性较低的羟基自由基(·OH)[4],在水处理领域得到广泛关注[5-6]。魏祥甲等[7]采用O3/H2O2技术处理石化废水时发现,H2O2能够加快臭氧分解速率及·OH的产生速率,促进污染物的降解,反应时间为40 min时COD去除率提高至90%以上。Gu等[8]采用O3/H2O2工艺处理二硝基二氮酚(DDNP)工业废水时发现,在O3投加量为18.9 mg/min、H2O2初始投加量为18 mmol/L、初始pH为10条件下,COD和色度去除率分别为93.8%和90.1%。然而,臭氧高级氧化技术在实际应用中存在运行成本较高等问题。提高水中臭氧传质效率,减小臭氧投量,是降低臭氧工艺运行成本的有效手段。
微纳米气泡技术能够通过压力作用使气体快速、高效地溶于水中,产生一种直径在0.1~50.0 μm的微小气泡[9]。相比传统曝气方式,微气泡曝气方式具有传质效率高、比表面积大等优点[10],与臭氧高级氧化技术联用能够有效提高臭氧传质效率[11]。张静等[12]采用臭氧微气泡处理酸性大红3R废水,在微气泡曝气条件下,臭氧传质系数为传统曝气方式的3.6倍,TOC去除率约为传统曝气的2倍;Zheng等[13]对比了微气泡臭氧化与普通气泡臭氧化处理腈纶废水的效果,发现相同臭氧剂量下,微气泡臭氧化比普通气泡臭氧化CODCr和UV254去除率分别高25%和35%,同时,臭氧总传质系数和平均臭氧利用效率分别是普通气泡臭氧化的2.2和1.5倍。
本研究建立了微气泡O3/H2O2深度处理工艺,研究了该工艺对某工业园区二级出水的处理效果,探究了污染物降解机制及DOM变化特征,并对出水进行了急性毒性评价,以期为工业园区深度处理工艺的选择提供一定理论依据。
1 实验 1.1 实验试剂双氧水(30%)购于哈尔滨新达化工厂,重铬酸钾(K2Cr2O7)购于天津基准化学试剂有限公司,硝酸银(AgNO3)购于上海试剂一厂,草酸钛钾(C4H2K2O10Ti)、无水亚硫酸钠(Na2SO3)、氢氧化钠(NaOH)、硫酸银(AgSO4)、硫酸汞(HgSO4)购于上海市阿拉丁化学试剂有限公司, 甲醇、正己烷购于上海麦克林生化科技有限公司。上述试剂除双氧水、甲醇、正己烷外均为分析纯。
1.2 实验用水水质本研究所用二级出水取自安庆市某工业园区二级生化处理出水,该工业园区内以纺织印染类企业和化工新材料类企业为主。该二级出水BOD/COD低、可生化性差,具体水质指标如表 1所示。
| 表 1 二级出水水质特征 Tab. 1 Characteristics of secondary effluent water quality |
实验仪器包括臭氧发生器(COM-AD-01,ANSEROS,Germany)、臭氧气相浓度分析仪(GM-6000-OEM,ANSEROS,Germany)、微纳米气泡机(MF-5000,上海行恒科技,中国)、TOC/TN测定仪(Multi N/C 3100,Analytikjena,Germany)、高效液相色谱仪(2695,Water,USA)、荧光光谱仪(FP-6500,JASCO,Japan)、傅里叶红外光谱仪(Spectrum One,Perkin-Elme,USA)、电子自旋共振波谱仪(A200S-95/12,BRUKER,Germany)。
1.4 分析测试方法UV254采用紫外可见光分光光度计测定;COD采用重铬酸钾回流滴定法;TOC采用TOC分析仪(德国MultiN/C);气相臭氧质量浓度采用臭氧在线检测仪;液相臭氧质量浓度采用碘量法测定;生物毒性采用青海弧菌Q67作为指示生物,以发光抑制率评价毒性大小;采用电子自旋共振波谱仪(A200S-95/12,BRUKER公司)对深度处理过程中·OH的产生情况进行检测分析;废水中DOM组分采用XAD-8、XAD-4大孔吸附树脂进行分级,将DOM分为亲水中性(HPI)、疏水酸性(HPO-A)、半亲水酸性(TPI-A)、疏水中性(HPO-N)、半亲水中性(TPI-N)组分。臭氧转移率及臭氧利用率计算公式如下:
| $ R_1=\left(\rho_0-\rho\right) / \rho_0 $ | (1) |
| $ R_2=\left(\rho_0-\rho_1-\rho\right) / \rho_0 $ | (2) |
式中: R1、R2分别为臭氧转移率、臭氧利用率, %; ρ0为反应体系臭氧输入量, mg/L; ρ为尾气臭氧质量浓度, mg/L; ρ1为液相中臭氧溶解量, mg/L。
1.5 实验装置实验装置如图 1所示。反应器为内径50 mm的圆柱体有机玻璃容器,高1.0 m,有效容积为1.8 L。臭氧发生器以氧气为气源。普通O3曝气是通过曝气头将臭氧直接通入反应器底部,将臭氧与实验用水通入微气泡机产生微气泡O3,然后进入反应器;微气泡机运行过程产热较大,需在微气泡机出水端添加冷却装置,将水温控制在20~25 ℃;尾气通过碘化钾溶液吸收。样品经N2充分吹脱臭氧后,用0.22 μm滤膜过滤,密封于4 ℃保存待测。普通曝气方式采用微孔曝气头,所产气泡直径1~3 mm;微气泡机所制气泡直径为0.1~1.0 μm,一般气泡发生直径低于50 μm时称为微纳米气泡。
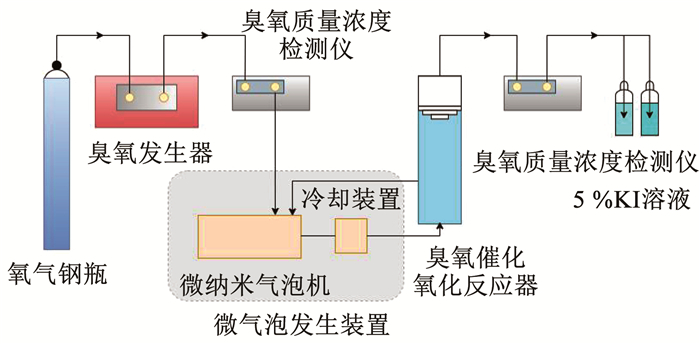
|
图 1 实验装置示意 Fig. 1 Experimental device |
对比普通气泡O3、普通气泡O3/H2O2、微气泡O3、微气泡O3/H2O2及H2O25种工艺对该工业园区二级出水的处理效果,结果如图 2所示。在反应时间为15 min时,微气泡O3/H2O2工艺对有机污染物的去除效果达到稳定,COD去除率不再随反应时间的延长而升高,此时COD和TOC去除率分别为47.44%、46.61%。微气泡O3工艺15 min时的COD去除率(47.41%)与普通气泡O3工艺45 min时的COD去除率(46.42%)相当,表明微气泡曝气能够使反应时间缩短2/3,显著加快污染物降解速率。

|
图 2 不同体系对二级出水COD和TOC的去除效率 Fig. 2 Removal efficiency of COD and TOC of secondary effluent |
反应时间为15 min时,微气泡O3/H2O2工艺对二级出水的TOC去除率为46.61%,与普通气泡O3/H2O2工艺相比,TOC去除率提高约15%,表明微气泡曝气对O3/H2O2具有一定的强化作用,该现象在反应时间为60 min时仍然存在,该强化作用并非简单地加快反应速率,可能是微气泡曝气方式加速了O3与H2O2的反应,产生了更多的·OH[14],促进污染物的进一步矿化;与微气泡O3工艺相比,TOC去除率提高9.05%,而单独H2O2工艺TOC去除率不足1%,表明H2O2与O3之间存在一定的协同作用,其机制如式(3)~(6)[15]所示:
| $ \mathrm{H}_2 \mathrm{O}_2 \rightarrow \mathrm{HO}_2^{-}+\mathrm{H}^{+} $ | (3) |
| $ \mathrm{O}_3+\mathrm{HO}_2^{-} \rightarrow \cdot \mathrm{HO}+\mathrm{O}_2^{-}+\mathrm{O}_2 $ | (4) |
| $ \mathrm{O}_3+\mathrm{O}_2^{-} \rightarrow \mathrm{O}_3^{-}+\mathrm{O}_2 $ | (5) |
| $ \mathrm{O}_3^{-}+\mathrm{H}_2 \mathrm{O} \rightarrow \cdot \mathrm{OH}+\mathrm{HO}^{-}+\mathrm{O}_2 $ | (6) |
考察了臭氧投加量对该工业园区二级出水处理效果的影响,结果如图 3(a)所示。当臭氧投加量小于60 mg/L时,废水的COD去除率随臭氧投加量的增加而增大,此时速率限制条件是臭氧质量浓度;臭氧投加量为60 mg/L时,COD去除率为49.33%;当臭氧投加量继续增大时,COD去除率变化不明显。因此,后续选择60 mg/L臭氧投加量进行研究。

|
图 3 臭氧投加量、H2O2初始投加量、初始pH对COD去除的影响及pH变化 Fig. 3 Effect of ozone dosage, initial H2O2 dosage, initial pH on COD removal and pH change trend |
考察了H2O2初始投加量对该工业园区二级出水处理效果的影响,结果如图 3(b)所示。随着H2O2初始投加量由0 mg/L增大到114 mg/L,COD去除率不断增大;当初始投加量大于114 mg/L时,COD去除率逐渐降低。H2O2初始投加量为170 mg/L时的COD去除率低于0 mg/L时的COD去除率,出现明显抑制现象。这是因为水中臭氧质量浓度一定时,适量的H2O2能够与O3产生·OH[16],从而强化臭氧去除污染物;当H2O2过量时,H2O2作为弱酸,产生的共轭碱HO2-或自身都会与·OH产生反应,导致污染物去除效率的降低[17-18]。
2.2.3 初始pH的影响考察了初始pH对该园区二级出水处理效果的影响,结果如图 3(c)所示。当初始pH为5.0 ~ 9.0时,COD去除率达到50%以上;当初始pH为3.0或11.0时,COD去除率较低。这是因为pH会影响臭氧/H2O2体系产生·OH的效率,在酸性条件下,臭氧分子的选择性氧化占主导地位[19-20];在碱性条件下,由于H2O2不稳定会发生解离,进一步与臭氧分子反应产生氧化能力更强的·OH[6],但是在强碱条件下,大量存在的OH-会淬灭已经产生的·OH[21],从而导致污染物去除率的降低。研究了反应过程中的pH变化情况,发现在反应过程中整个反应体系pH向弱碱性方向(pH为8.0 ~ 9.0)变化(图 3(d)),因此,初始pH为5.0、7.3、9.0时的COD去除率变化不大。原水pH为7.0 ~ 8.0,处于中性范围,考虑经济效益选择7.3为最佳初始pH进行后续研究。
2.3 污染物降解动力学与机制分析 2.3.1 降解动力学对H2O2、普通气泡O3、普通气泡O3/H2O2、微气泡O3、微气泡O3/H2O2工艺深度处理二级出水时的有机物降解过程进行动力学拟合,结果如表 2和图 4所示。根据二级出水TOC去除率-时间曲线将拟合曲线分为两段(0~15 min、>15~60 min): 第一阶段表征污染物快速矿化阶段,随着反应持续进行,污染物的矿化进程被搁置; 进入第二阶段,反应速率大大降低,后续的研究中仅针对第一阶段的反应动力学进行详细分析。
| 表 2 不同工艺条件下有机物降解动力学模拟参数结果 Tab. 2 Results of kinetics fitting of organic degradation under different processes |

|
图 4 不同工艺条件下有机物降解动力学拟合图 Fig. 4 Kinetics fitting of organic degradation under different processes |
普通气泡O3、微气泡O3工艺处理二级出水时,有机污染物的降解过程可以用表观一级反应动力学方程描述,一级反应速率常数分别为1.31×10-2、3.19×10-2 min-1;普通气泡O3/H2O2、微气泡O3/H2O2工艺处理二级出水时,有机污染物的降解过程可以用表观二级反应动力学方程描述,二级反应速率常数分别为1.82×10-3、2.92×10-3 mg-1·L·min-1。由于单独使用H2O2对二级出水TOC去除率几乎可以忽略不计,其动力学拟合结果不具有参考意义。上述结果表明,微气泡曝气使得普通气泡O3工艺和普通气泡O3/H2O2工艺对污染物的降解速率分别提高了243.5%和60.4%,能够显著提高污染物去除速率。
2.3.2 羟基自由基理论以DMPO为捕获剂,利用电子顺磁共振技术(EPR)测定有机物降解过程中·OH与DMPO加成化合物的响应信号,测定结果如图 5所示。普通气泡O3及微气泡O3工艺深度处理二级出水过程中并未发现明显的DMPO-·OH信号峰;在微气泡O3/H2O2与普通气泡O3/H2O2工艺深度处理过程中,出现明显的1∶ 2∶ 2∶ 1的DMPO-·OH信号峰。根据前人的研究[22-23],仅仅通过H2O2自分解产生·OH一般不会发生, 表明添加H2O2后,臭氧/H2O2体系(普通气泡O3/H2O2、微气泡O3/H2O2工艺)深度处理过程中有机污染物的降解遵循·OH机制。此外,微气泡O3/H2O2的信号峰强度明显高于普通气泡O3/H2O2,表明微气泡O3/H2O2工艺处理二级出水过程中产生了更多的·OH,证实了微气泡曝气对O3/H2O2的强化作用是通过加快O3与H2O2的反应进而产生更多的·OH。
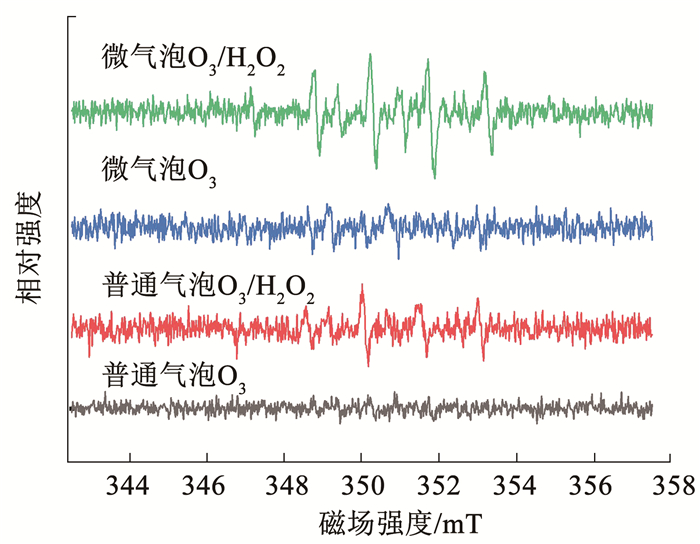
|
图 5 不同工艺处理过程中的EPR谱图 Fig. 5 EPR spectra under different processes |
研究了普通气泡O3、普通气泡O3/H2O2、微气泡O3、微气泡O3/H2O2工艺深度处理二级出水过程中的臭氧利用率及臭氧转移率,结果如图 6所示。

|
图 6 不同工艺深度处理过程中臭氧转移率和臭氧利用率 Fig. 6 Ozone transfer rate and ozone utilization rate in advanced treatment processes |
反应时间为15 min时,微气泡O3工艺深度处理过程中臭氧转移率与臭氧利用率分别为0.99、0.91,比普通气泡O3工艺提升约13%、9%;微气泡O3/H2O2工艺深度处理过程中臭氧转移率与臭氧利用率分别为0.99、0.95,比普通气泡O3/H2O2工艺提升约10%、4%。这是因为微气泡曝气能够增大气液传质界面面积,从而增大臭氧利用率和臭氧转移率[24];H2O2能够消耗臭氧产生·OH,臭氧利用率和转移率得到提升。
2.4 深度处理过程中DOM变化特征 2.4.1 DOM分子质量分布变化特征研究了原水中DOM分子质量(MW)分布情况,结果如图 7所示。原水中小分子物质(MW < 3×103u)占主体地位,占比为80.7%;大分子有机物(MW>100×103u)占比为13.4%;MW在(3~5)×103u、(>5~10)×103u、(>10~100)×103u的有机物总占比小于6% (分别为2.5%、1.2%、2.2%),后续研究不予讨论。

|
图 7 不同工艺处理出水分子质量分布及TOC占比 Fig. 7 Molecular weight distribution of effluent from different processes TOC content proportion |
微气泡O3/H2O2工艺深度处理15 min后,MW> 100×103u和 < 3×103u的溶解性有机物质量浓度由进水时的2.60、15.70 mg/L降低至0.17、9.86 mg/L,去除率分别达到93.46%、37.20%,比普通气泡O3工艺去除率提高了15.76%、30.10%。表明微气泡O3/H2O2深度处理工艺对该分子质量区间的溶解性有机物具有更佳的去除效果。
此外,经不同深度处理工艺处理后,MW>100×103u和 < 3×103u的溶解性有机物均得到不同程度的去除效果。其中,MW>100×103u的溶解性有机物质量浓度及占比减小,MW < 3×103u的溶解性有机物质量浓度减少但是占比大幅度提高。表明单独臭氧化、臭氧/H2O2体系可提高出水中小分子有机物的比例,溶解性有机物存在由大分子质量向较小分子质量转化的趋势。
2.4.2 DOM组分变化特征研究了该工业园区二级出水经普通气泡O3、微气泡O3、普通气泡O3/H2O2、微气泡O3/H2O2工艺深度处理前后DOM各组分TOC质量浓度及UV254,结果如图 8所示。原水DOM疏水组分(HPO-N及HPO-A)TOC质量浓度整体高于非疏水组分(亲水及半亲水组分),UV254占比达到总UV254的61.6%,但其SUVA值(UV254/DOC)为非疏水组分的0.62倍,表明原水中疏水性物质含量高,且为UV254的主要来源,但其不饱和度较低。

|
图 8 各DOM组分TOC质量浓度及去除率、UV254及去除率和SUVA值 Fig. 8 TOC and TOC removal rate, UV254 and UV254 removal rate, SUVA value of each DOM component |
深度处理15 min后,普通气泡O3、微气泡O3、普通气泡O3/H2O2、微气泡O3/H2O2工艺对疏水性物质的TOC去除率分别为49.65%、51.20%、73.67%、64.76%,其中,单独臭氧化体系(普通气泡O3、微气泡O3工艺)对HPO-N组分的TOC去除效果明显低于臭氧/H2O2体系,表明H2O2的加入增强了单独臭氧化体系对HPO-N组分的去除能力。
普通气泡O3、微气泡O3、普通气泡O3/H2O2、微气泡O3/H2O2 4种工艺对疏水组分的UV254的去除率分别为3.81%、70.53%、29.80%、73.83%。其中,HPO-N经过普通气泡O3、普通气泡O3/H2O2工艺处理后UV254升高,表明HPO-N的去除过程中生成了不饱和度更高的产物;经普通气泡O3、普通气泡O3/H2O2工艺处理后,HPO-N组分的SUVA值由原来的0.067 cm-1·L·mg-1分别升高至0.16、0.25 cm-1·L·mg-1,表明HPO-N组分不饱和度显著增强也是导致其UV254升高的原因之一。
微气泡O3比普通气泡O3工艺对HPI、TPI-N、TPI-A组分的TOC去除率分别提高39.52%、34.72%、51.78%;微气泡O3/H2O2比普通气泡O3/H2O2工艺对HPI、TPI-N、TPI-A组分的TOC去除率分别高95.68%、39.93%、10.46%,表明微气泡曝气明显增强了单独臭氧化体系及臭氧/H2O2体系对HPI、TPI-N、TPI-A组分的去除效率,可能原因是微气泡曝气强化了臭氧气液传质效率,加快了污染物的降解速率,从而提高了污染物的去除效果[11]。
2.4.3 DOM三维荧光特征图 9为原水及不同工艺深度处理出水的三维荧光谱图,根据激发波长和发射波长范围将整个荧光区域分为芳香类蛋白Ⅰ区、芳香类蛋白Ⅱ区、富里酸区、类溶解性微生物产物(SMP)区和类腐殖酸区5部分:芳香类蛋白Ⅰ(Ⅰ区220 nm < Ex < 250 nm,280 nm < Em < 330 nm)、芳香类蛋白Ⅱ(Ⅱ区220 nm < Ex < 250 nm,330 nm < Em < 380 nm)、富里酸区(Ⅲ区220 nm < Ex < 250 nm,Em>380 nm)、类微生物代谢产物区(Ⅳ区Ex>250 nm,280 nm < Em < 380 nm)、类腐殖酸(Ⅴ区Ex>250 nm,Em>380 nm),并根据分区进行区域积分(FRI)计算[25],结果如图 9(f)所示。

|
图 9 原水、深度处理出水三维荧光谱图及各分区荧光强度标准积分体积变化 Fig. 9 3D-EEM of raw water and effluent and fluorescence intensity standard volume of each partition |
由图 9可知,原水三维荧光谱图中分别在Ⅰ、Ⅱ、Ⅳ、Ⅴ区出现明显的特征峰,表明原水中含有类芳香族蛋白、类微生物溶解性代谢产物及类腐殖酸物质。经普通气泡O3、微气泡O3、普通气泡O3/H2O2、微气泡O3/H2O24种工艺深度处理后,各分区特征峰强度明显减小。根据FRI计算结果,经普通气泡O3、微气泡O3、普通气泡O3/H2O2、微气泡O3/H2O24种工艺处理后,出水Ⅰ、Ⅱ区标准积分体积之和比为8.35∶ 1.70∶ 5.44∶ 1.00,Ⅴ区标准积分体积比为0.92∶ 1.48∶ 0.70∶ 1.00。经单独臭氧化体系处理后,在Ⅴ区吸收强度明显弱于臭氧/H2O2体系,而在Ⅰ、Ⅱ及Ⅳ区吸收强度明显强于臭氧/H2O2体系。表明臭氧氧化对类腐殖酸类物质具有良好的降解效果,对类芳香族蛋白、类微生物溶解性代谢产物有一定的去除效果,但其中仍然存在一部分物质不易与臭氧直接发生反应,而H2O2加入后强化了臭氧对类芳香族蛋白及类微生物溶解性代谢产物的降解,可能是由于H2O2加入后产生了一定量的·OH[4],改变了污染物的降解路径。臭氧/H2O2体系深度处理过程中,类芳香族蛋白及类微生物溶解性代谢产物有向类腐殖酸类物质转化的趋势。
如图 9(f)所示,普通气泡O3、微气泡O3、普通气泡O3/H2O2、微气泡O3/H2O24种工艺深度处理出水FRI标准积分体积分别为61.20×105、18.21×105、41.68×105、11.42×105 a.u.·nm2,其中, 微气泡O3/H2O2工艺处理出水FRI积分体积最小,对各类型污染物的去除效果最佳。
2.5 毒性评价研究了不同工艺深度处理过程水质急性毒性变化情况,结果如图 10所示。原水急性毒性不高,对发光菌的发光抑制率仅为14.89%。但是经普通气泡O3、微气泡O3工艺处理后,发光抑制率在5 min内急剧升高至100%;采用普通气泡O3/H2O2、微气泡O3/H2O2体系处理后,水质急性毒性未出现急剧升高现象,发光抑制率始终稳定在20%以下。此现象的原因可能是:单独臭氧化体系对有机物产生的降解效果主要来源于臭氧直接氧化,臭氧直接氧化具有一定选择性,母体化合物被选择性降解,产生的中间产物不能被臭氧直接氧化而导致中间产物不断累积,由于某些中间产物毒性会高于母体化合物[26],出现毒性升高的现象;在添加H2O2后,反应体系内产生的·OH无选择性攻击中间产物,使得中间产物含量降低,从而表现为整个反应体系毒性的降低。结果表明,H2O2的加入能够明显抑制单独臭氧化体系深度处理过程中急性毒性的升高。这与前述H2O2的加入改变了污染物降解途径相一致。

|
图 10 深度处理出水水质急性毒性变化 Fig. 10 Acute toxicity change of effluent water quality |
1) 建立了微气泡O3/H2O2深度处理工艺,在pH为7.3、O3投加量为60 mg/L、H2O2初始投加量为114 mg/L、反应时间为15 min条件下,COD、TOC去除率分别达到47.41%、46.61%。
2) 微气泡技术在本研究中显著提高了臭氧利用率,使反应时间缩短2/3,并且强化O3/H2O2产生更多的·OH;此外,H2O2的加入促进了单独臭氧化体系产生·OH,并显著提高了TOC去除率,抑制了单独臭氧化体系处理过程中水质急性毒性的升高,并将其稳定在较低毒性水平。
3) 该二级出水中DOM在深度处理过程中存在大分子物质向小分子物质转化的趋势;疏水性组分为UV254的主要来源,H2O2能够增强臭氧对HPO-N组分的去除能力;H2O2的加入能够改变臭氧对污染物的降解途径,在臭氧/H2O2体系下,类芳香族蛋白及类微生物溶解性代谢产物有向类腐殖酸类物质转化的趋势。
| [1] |
刘旭, 崔康平, 汪翠萍, 等. 高级氧化-生化深度处理工业园区生化尾水[J]. 环境工程学报, 2016, 10(8): 3993. LIU Xu, CUI Kangping, WANG Cuiping, et al. High efficiently advanced treatment of secondary effluent from wastewater treatment plant in industrial park by advanced oxidation-biochemical process[J]. Chinese Journal of Environmental Engineering, 2016, 10(8): 3993. DOI:10.12030/j.cjee.201503017 |
| [2] |
戴鸿军, 李红丽, 周国旺, 等. GC-MS分析印染废水处理中有机污染物的降解特性[J]. 浙江大学学报(理学版), 2014, 41(1): 72. DAI Hongjun, LI Hongli, ZHOU Guowang, et al. Analysis on the degradation of organic pollutants in textile wastewater treatment process by GC-MS[J]. Journal of Zhejiang University (Science Edition), 2014, 41(1): 72. DOI:10.3785/j.issn.1008-9497.2014.01.017 |
| [3] |
HIDAYAH E N, CAHYONUGROHO O H. Tracking of dissolved effluent organic matter (dEfOM) in wastewater treatment plant by using fluorescence method[J]. International Conference Research Collaboration of Environmental Science, 2019, 245(1): 012018. DOI:10.1088/1755-1315/245/1/012018 |
| [4] |
CUERDA C, MANUEL E, FRANCO A, et al. Advanced oxidation processes for the removal of antibiotics from water: an overview[J]. Water, 2020, 12(1021). DOI:10.3390/W12010102 |
| [5] |
YANG Yongyuan, DEMEESTERE K, VAN HULLE S. Ozone-based advanced oxidation of biologically treated landfill leachate: oxidation efficiency, mechanisms, and surrogate-based monitoring for bulk organics[J]. Journal of Environmental Chemical Engineering, 2021, 9(6). DOI:10.1016/j.jece.2021.106459 |
| [6] |
CHEN Hai, WANG Jianlong. Degradation and mineralization of ofloxacin by ozonation and peroxone (O3/H2O2) process[J]. Chemosphere, 2021, 269: 128775. DOI:10.1016/j.chemosphere.2020.128775 |
| [7] |
魏祥甲, 王兰, 乔瑞平, 等. O3/H2O2深度氧化处理石化废水的研究[J]. 工业用水与废水, 2014, 45(6): 23. WEI Xiangjia, WANG Lan, QIAO Ruiping, et al. Study on advanced treatment of petrochemical wastewater by O3-H2O2 combined oxidation[J]. Industrial Water & Wastewater, 2014, 45(6): 23. DOI:10.3969/j.issn.1009-2455.2014.06.007 |
| [8] |
GU Zhepei, WANG Ying, FENG Ke, et al. A comparative study of dinitrodiazophenol industrial wastewater treatment: ozone/hydrogen peroxide versus microwave/persulfate[J]. Process Safety and Environmental Protection, 2019, 130: 39. DOI:10.1016/j.psep.2019.07.019 |
| [9] |
王永磊, 王文浩, 代莎莎, 等. 微纳米气泡发生机制及其应用研究进展[J]. 山东建筑大学学报, 2017, 32(5): 474. WANG Yonglei, WANG Wenhao, DAI Shasha, et al. Research progress of mechanism and application of micro and nano bubble[J]. Journal of Shandong Jianzhu University, 2017, 32(5): 474. DOI:10.12077/sdjz.2017.05.011 |
| [10] |
熊永磊, 杨小丽, 宋海亮. 微纳米气泡在水处理中的应用及其发生装置研究[J]. 环境工程, 2016, 34(6): 23. XIONG Yonglei, YANG Xiaoli, SONG Hailiang. Review on application of micro-nano bubble in water treatment and its generator[J]. Environmental Engineering, 2016, 34(6): 23. DOI:10.13205/j.hjgc.201606006 |
| [11] |
ZHANG Jing, HUANG Guoqing, LIU Chun, et al. Synergistic effect of microbubbles and activated carbon on the ozonation treatment of synthetic dyeing wastewater[J]. Separation and Purification Technology, 2018, 201: 10. DOI:10.1016/j.seppur.2018.02.003 |
| [12] |
张静, 杜亚威, 刘晓静, 等. 臭氧微气泡处理酸性大红3R废水特性研究[J]. 环境科学, 2015, 36(2): 584. ZHANG Jing, DU Yawei, LIU Xiaojing, et al. Characteristics of acid red 3R wastewater treatment by ozone microbubbles[J]. Environmental Science, 2015, 36(2): 584. DOI:10.13227/j.hjkX.2015.02.028 |
| [13] |
ZHENG Tianlong, WANG Qunhui, ZHANG Tao, et al. Microbubble enhanced ozonation process for advanced treatment of wastewater produced in acrylic fiber manufacturing industry[J]. Journal of Hazardous Materials, 2015, 287: 412. DOI:10.1016/j.jhazmat.2015.01.069 |
| [14] |
YASUI F, SEKIGUCHI K, YOSHIDA T, et al. Complete decomposition of 2-Propanolusing TiO2 immobilized on a nonwoven fabric under UV light irradiation by adding H2O2 and O3 microbubbles[J]. Water Air and Soil Pollution, 2021, 232(5): 175. DOI:10.1007/s11270-021-05106-2 |
| [15] |
OH B, SEO Y, SUDHAKAR D, et al. Oxidative degradation of endotoxin by advanced oxidation process (O3/H2O2 & UV/H2O2)[J]. Journal of Hazardous Materials, 2014, 279: 105. DOI:10.1016/j.jhazmat.2014.06.065 |
| [16] |
LANAO M, ORMAD M P, IBARZ C, et al. Bactericidal effectiveness of O3, O3/H2O2 and O3/TiO2 on clostridium perfringens[J]. Ozone-Science & Engineering, 2008, 30(6): 431. DOI:10.1080/01919510802488003 |
| [17] |
程莹, 臧纪, 宋骏杰, 等. 基于臭氧微纳米气泡的O3-H2O2体系降解有机污染物的效能与影响因素[J]. 环境工程技术学报, 2022, 12(4): 1317. CHENG Ying, ZANG Ji, SONG Junjie, et al. Degradation efficiency and influencing factors of organic contaminants in O3-H2O2 system based on ozone micro-nanobubbles[J]. Journal of Environmental Engineering Technology, 2022, 12(4): 1317. |
| [18] |
CHEN Hai, ZHANG Zhonglei, YANG Zhilin, et al. Heterogeneous fenton-like catalytic degradation of 2, 4-dichlorophenoxyacetic acid in water with FeS[J]. Chemical Engineering Journal, 2015, 273: 481. DOI:10.1016/j.cej.2015.03.079 |
| [19] |
BHAD R M, DAS A, KODAPE S M. Ozonation of procion blue reactive dye and its kinetics study[J]. Pollution, 2022, 8(2): 529. DOI:10.22059/POLL.2021.330871.1191 |
| [20] |
TAK H, CHUNG Y, KIM G, et al. Catalytic ozonation with vanadium oxide-doped TiO2 nanoparticles for the removal of di-2-ethylhexyl phthalate[J]. Chemosphere, 2022, 306: 135646. DOI:10.1016/j.chemosphere.2022.135646 |
| [21] |
SUH J H, MOHSENI M. A study on the relationship between biodegradability enhancement and oxidation of 1, 4-dioxane using ozone and hydrogen peroxide[J]. Water Research, 2004, 38(10): 2596. DOI:10.1016/j.watres.2004.03.002 |
| [22] |
MAEZONO T, TOKUMURA M, SEKINE M, et al. Hydroxyl radical concentration profile in photo-Fenton oxidation process: generation and consumption of hydroxyl radicals during the discoloration of azo-dye orange Ⅱ[J]. Chemosphere, 2011, 82(10): 1422. DOI:10.1016/j.chemosphere.2010.11.052 |
| [23] |
LI Qing, HU Baoshan, YANG Qian, et al. Interaction mechanism between multi-layered MoS2 and H2O2 for self-generation of reactive oxygen species[J]. Environmental Research, 2020, 191: 110227. DOI:10.1016/j.envres.2020.110227 |
| [24] |
曾尚升, 杨宇成, 张娜, 等. 旋转微气泡反应器强化臭氧降解水中对硝基苯酚[J]. 化工进展, 2021, 40(7): 4091. ZENG Shangsheng, YANG Yucheng, ZHANG Na, et al. Enhanced ozone degradation of the p-nitrophenol wastewater by rotating-microbubble reactor[J]. Chemical Industry and Engineering Progress, 2021, 40(7): 4091. DOI:10.16085/j.issn.1000-6613.2020-1704 |
| [25] |
HE Xiaosong, XI Beidou, WEI Zimin, et al. Fluorescence excitation-emission matrix spectroscopy with regional integration analysis for characterizing composition and transformation of dissolved organic matter in landfill leachates[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 293. DOI:10.1016/j.jhazmat.2011.03.047 |
| [26] |
ZHANG Jiali, XIONG Zhaokun, WEI Jian, et al. Catalytic ozonation of penicillin G using cerium-loaded natural zeolite(CZ): efficacy, mechanisms, pathways and toxicity assessment[J]. Chemical Engineering Journal, 2020, 383: 123144. DOI:10.1016/j.cej.2019.123144 |
 2024, Vol. 56
2024, Vol. 56


