硫铝酸盐水泥在中国的应用已有30多年的历史,与传统的硅酸盐水泥系列相比具有以下优点[1-4]:水泥熟料烧成温度低,降低了能耗;生产过程中CO2排放量低,减缓了温室效应;早期强度高、后期强度不倒缩等.硫铝酸盐水泥在我国已成为一种非常重要的特种水泥,基于该水泥可以开发出如用于防渗堵漏、快速修补、防腐抗蚀等特种工程的材料,但是前提是要搞清楚其水化反应机理.
关于硫铝酸盐水泥水化方面的研究已有很多[1, 4-7],但由于水泥熟料中含有无水硫铝酸钙(C4A3Š)、硅酸二钙(C2S)等多种矿物,水化反应复杂,需对各单矿物进行研究,再研究水泥的水化硬化过程.C4A3Š作为硫铝酸盐水泥中的主要矿物,对硫铝酸盐水泥性能的发挥起着决定性作用.目前关于C4A3Š的单矿物水化研究较少且存在较大分歧.王燕谋等[2]认为,单矿物的水化产物中同时存在钙矾石(AFt)和单硫型水化硫铝酸钙(AFm),水化初期生成的水化产物AFt逐渐减少,AFm逐渐增多,最终水化产物以AFm和铝凝胶为主,水灰比较小时会含少量AFt.一些学者认为[8-11],单矿物的水化产物中同时存在AFt和AFm-12,但关于水化过程的表述如水化产物生成的时间等不尽相同,而其他研究人员[12-14]没有发现水化产物中有AFt生成.Martin等[9]认为,单矿物的水化反应与水灰比密切相关,在较小水灰比时水化反应依式(1)进行,在大水灰比条件下会倾向于发生式(2)的水化反应生成AFt,最终AFt会转化为AFm.
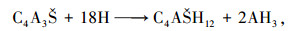
|
(1) |

|
(2) |
目前对单矿物的水化没有明确的结论,因此本文采用人工合成的C4A3Š研究了单矿物在较低水灰比下的水化反应机理,上述2个水化反应式计量的水灰比分别为0.53和0.59,因此选择mw/ms=0.3、0.5、0.7作为本文试验的水灰比.
1 试验 1.1 C4A3Š合成和水化采用分析纯化学试剂CaCO3、Al2O3、CaSO4按物质的量比3:3:1准确称量后放入ND7型行星式球磨机中粉磨并混合均匀,加少许水压制成φ50 mm×10 mm圆柱试样,在110 ℃下烘干1 h,再放入刚玉坩埚中置于DK200型高温电炉内升温至1 350 ℃保温2 h,取出急冷至室温[10].熟料通过球磨机磨细至全部通过80 μm方孔筛备用.
单矿物合成后进行水化试验,按照不同水灰比称取相应质量的水和C4A3Š并搅拌均匀,在水化实验中为了隔绝外部环境对实验结果的影响,将试样装入密封袋中置于标准养护箱中养护.在水化后3 h、6 h、9 h、12 h、1 d、3 d、7 d、28 d分别选取水化样,将所取水化样破碎研细后浸泡在无水乙醇中停止水化,然后在真空干燥箱中以40 ℃烘干备用.
1.2 表征用德国Bruker公司D8 ADVANCE型X射线衍射仪分析烧成矿物和各水化时间产物的组成,管电压和管电流分别为40 kV、40 mA,扫描范围为5°~60°.用Mettler-Toledo TG/DSC1综合热分析仪对不同时间的水化样品进行热分析,测量温度范围为40~400 ℃,升温速率为10 ℃/min.用FEI Quanta 450型扫描电子显微镜对水化样品进行微观形貌观察.
2 结果与分析 2.1 XRD分析 2.1.1 C4A3Š熟料图 1为所烧熟料的X射线衍射(XRD)谱图.通过定性分析可知,熟料的主要成分是C4A3Š,此外还含有少量的C3A和C5A3.利用德国Bruker公司的全谱分析软件Total Pattern Solution (TOPAS4.2)中的全谱结构拟合法(Rietveld法衍射谱分析)对熟料XRD谱进行定量分析,拟合结果显示,C4A3Š质量分数为94.3%,C5A3质量分数为3.9%,C3A质量分数为1.8%.
|
图 1 C4A3Š的XRD谱图 |
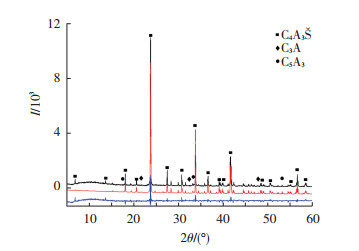
图 2列出了不同水灰比下12 h和28 d水化样的XRD谱图,可以看到C4A3Š的特征衍射峰(d值为0.374、0.265、0.217 nm)在28 d的XRD谱图中依然存在,说明水化样中C4A3Š有残留,未完全水化.水化过程中均有含12 mol结晶水的单硫型水化硫铝酸钙(AFm-12,d值为0.893、0.446、0.400 nm)和含14 mol结晶水的单硫型水化硫铝酸钙(AFm-14,d值为0.955、0.478、0.248 nm)生成.此外,在各XRD谱图中均未发现AFt的特征衍射峰,可以确定在水化过程中没有AFt生成,这是因为水化体系中SO42-离子的浓度过低,只能生成含SO42-离子较少的AFm [9].结果表明,在试验水灰比下单矿物的水化过程中没有AFt晶体生成,只生成了2种AFm晶体,明确了单矿物在较低水灰比下的水化反应机理.
|
图 2 不同水灰比下12 h和28 d C4A3Š水化样的XRD谱图 |
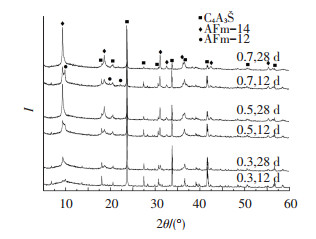
C4A3Š在不同水灰比下发生相同的水化反应,并且各XRD谱图是在相同测试条件下由同一台X射线衍射仪测得,因此可以依据其主要衍射峰强度的变化反映其含量的相对变化.图 3为不同水灰比下C4A3Š的特征衍射峰最强峰(d值为0.374 nm)强度随水化时间的变化曲线.
|
图 3 不同水灰比和水化时间下C4A3Š的特征衍射峰最强峰强度 |
由图 3可知:当mw/ms=0.3时,水化的前3 h内特征衍射峰强度只降低了1.9%,说明只有少量C4A3Š发生反应,水化进行缓慢;随着水化时间的延长,衍射峰的下降呈先加速后减速的趋势,在1 d时下降率达到44.7%,1 d之后的下降率虽有增加但变化很小,说明水化反应在加速进行一段时间后逐渐变缓直至最终停止,这可能是由于C4A3Š与水发生反应,使得自由水不断消耗,导致水化逐渐停止进行;mw/ms=0.5时,水化前3 h内衍射峰强度下降幅度为3.7%,之后C4A3Š的特征衍射峰强度下降速度加快,在9~12 h时间段内衍射峰强度下降率达31.4%,12 h内总下降率为58.9%,超过12 h后下降骤然减缓,可知C4A3Š的水化主要发生在前12 h内,此阶段内水化速度逐渐加快,并在9~12 h时间段内达到顶峰,12 h后水化速度大幅减缓;mw/ms=0.7时,衍射峰强度的下降速度进一步加快,但变化趋势基本一致,水化12 h时强度下降率达到68.5%,水化12 h后衍射峰强度变化较小,说明剩余的C4A3Š的量基本保持不变,水化反应即接近于终止.
比较不同水灰比下相同水化时间的衍射峰强度可知,水灰比越大,同一水化时间的衍射峰强度越低,说明随着水灰比的增大,水化反应速度加快,在相同水化时间内有更多的C4A3Š参与反应.
图 4是AFm-14和AFm-12的XRD特征衍射峰最强峰所在位置(d值分别为0.955和0.893 nm)的局部放大图.
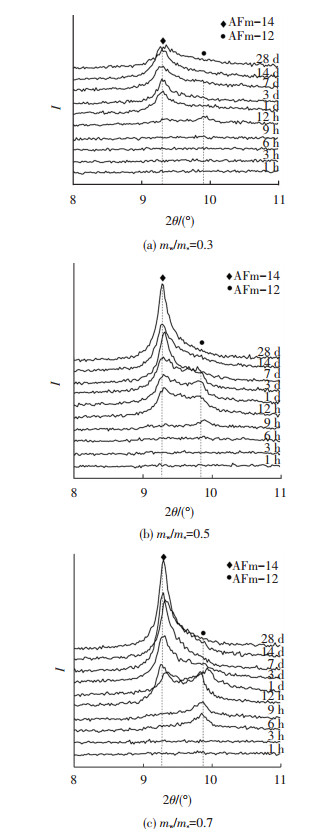
|
图 4 C4A3Š水化样XRD谱局部图(2θ=8°~11°) |
由图 4可知:mw/ms=0.3时,水化12 h的XRD谱图中出现了强度很低的AFm-12和AFm-14的衍射峰,说明水化产物中有2种不同的AFm生成,水化1 d时AFm-14的峰略有上升,而AFm-12的峰却消失了,之后无显著变化;mw/ms=0.5时,9 h的XRD谱图中出现AFm-12的特征衍射峰,水化12 h的产物中除了AFm-12还有AFm-14生成,1 d、3 d的水化产物XRD谱各特征峰强度没有变化,3 d后的XRD谱中呈现出AFm-12的特征衍射峰下降而AFm-14的特征衍射峰上升的趋势,由于水化反应在12 h后大幅减缓,后期参与水化反应的C4A3Š的量很少,但AFm-12和AFm-14相对含量变化较大,因此说明水化产物中存在AFm-12向AFm-14转化的现象,即初期生成的AFm-12在水化过程中吸收未参与水化反应的水变成AFm-14,到28 d时水化产物中只有AFm-14存在;当mw/ms=0.7时,水化6 h即出现了产物AFm-12,12 h的水化产物中也同时存在着AFm-12和AFm-14,由于自由水的增多,AFm-12向AFm-14的转化也相应提前,在水化1 d后即开始转化,在7 d的水化产物XRD谱图中已经找不到AFm-12的特征衍射峰了,说明转化过程已经结束.
2.2 热分析利用TG-DSC分析方法分析水化产物的组成,可以辨别XRD方法无法分析的非晶态物质.图 5为不同水灰比下28 d水化产物的DSC曲线,可以看到在220和290 ℃左右有2个大的吸热谷,其他位置包括130和170 ℃存在有较小的吸热谷.AFm在180 ℃左右有一个大的吸热谷及其他几个小的吸热谷,AH3在280~300 ℃有吸热谷,随结晶度的不同吸热谷温度会有所偏移[8, 14].从XRD分析结果可知水化产物中无AFt产生,因此可确定290 ℃处吸热谷对应的水化产物为AH3,其余位置吸热谷对应的为AFm.结合XRD定性分析的结果,可以得出单矿物在低水灰比下发生如式(3)的水化反应,并且水化过程中同时伴随着式(4)的转化.
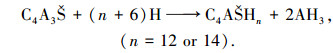
|
(3) |
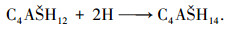
|
(4) |
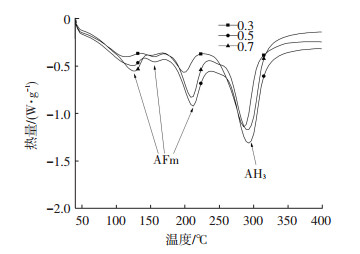
|
图 5 C4A3Š水化样DSC曲线 |
图 6是根据各水灰比不同水化时间水化产物的TG曲线得到的失重率随水化时间的变化曲线.就同一个水灰比而言,随着反应时间的延长,C4A3Š水化生成的AFm和AH3的量越来越多, 使得水化样的失重率不断提高.各水灰比3 h的水化样失重率均较小,说明水化反应在前3 h内进行缓慢.当mw/ms=0.5、0.7时水化3~12 h的水化样失重率增长较快,12 h后的变化再次变小,也进一步说明了水化反应主要在3~12 h间进行,12 h后反应大幅减缓.当mw/ms=0.3时水化反应速度会慢一些,在1 d后反应物失重率基本停止增长.通过比较不同水灰比下相同水化时间水化样的失重率,会发现随着水灰比的增大,各时期的水化样的失重率也会相应增加,同样说明随着反应中水的增多,更多的C4A3Š参与到水化反应当中.
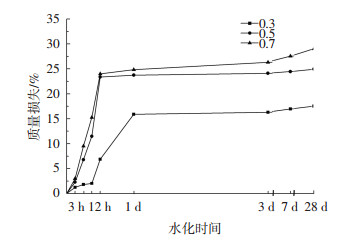
|
图 6 C4A3Š水化样失重率曲线 |
图 7为mw/ms=0.7时不同时间水化产物的SEM照片.在水化12 h的照片中可以观察到熟料颗粒被表面生成的水化产物包裹严密,很难找到具有规则形貌的物质.根据XRD谱图和热分析的结果,水化反应在12 h后大幅减缓,原因是由于水化初期生成的水化产物包裹在C4A3Š颗粒的表面,阻止了反应的进一步进行.水化3 d的照片中除了凝胶状物质及被凝胶包裹的C4A3Š颗粒还有少量片状的AFm出现,而根据XRD图谱已知3 d及以后的水化产物中的AFm晶体大部分为AFm-14,因此可以认定其中具有片状形貌的是AFm-14.7 d、28 d照片中可观察到堆积紧密呈层状的AFm-14,说明水化后期晶体不断长大.此外,各电镜照片中未找到具有针棒状形貌的AFt晶体,也证明了水化反应未生成AFt.

|
图 7 C4A3Š水化样SEM照片 |
1) 单矿物C4A3Š在较低水灰比下的水化过程中生成AFm-12、AFm-14和AH3三种水化产物,没有AFt生成.随着水化的进行,前期生成的AFm-12会向AFm-14转化,AFm-14晶体不断长大,因此最终的水化产物为AFm-14和AH3.
2) 当mw/ms=0.3时,C4A3Š的水化反应主要集中于3 h~1 d的时间段内.随着水量的增多,在mw/ms=0.5、0.7下反应主要发生在3~12 h,在9~12 h达到顶峰,而12 h后水化反应速度大幅下降,反应减缓.随着水灰比的增加,C4A3Š反应率也有提高.
3) 在mw/ms=0.3、0.5下单矿物在28 d的水化时间后有较多残余,即使超过计量水灰比,在mw/ms=0.7下28 d的水化产物中仍有未水化的C4A3Š.
| [1] |
建筑材料科学研究院水泥研究所. 硫铝酸盐水泥水化、硬化及其特性[J]. 硅酸盐学报, 1978(3): 123–140.
Cement Research Division, Research Institute of Building Materials. Hydration and hardening of sulfoaluminate cement and its properties[J]. J Chin Ceram Soc (in Chinese), 1978(3): 123–140. |
| [2] | 王燕谋, 苏慕珍, 张量. 硫铝酸盐水泥[M]. 北京: 北京工业大学出版社, 1999: 154-155. |
| [3] | HERRMANN P. Investigation of fresh and hardened properties of Calcium sulfoaluminate (CSA) cement blends[J]. Magazine of Civil Engineering, 2014, 47: 63–70. DOI: 10.5862/MCE |
| [4] | DESBOIS T, LE ROY R, PAVOINE A, et al. Effect of gypsum content on sulfoaluminate mortars stability[J]. European Journal of Environmental and Civil Engineering, 2010, 14(5): 579–597. DOI: 10.1080/19648189.2010.9693248 |
| [5] |
韩建国, 阎培渝. 锂化合物对硫铝酸盐水泥水化历程的影响[J]. 硅酸盐学报, 2010, 38(4): 608–614.
HAN J G, YAN P Y. Influence of lithium compound on sulphoaluminate cement hydration process[J]. J Chin Ceram Soc (in Chinese), 2010, 38(4): 608–614. |
| [6] | KASSELOURI V, TSAKIRIDIS P, MALAMI C, et al. A study on the hydration products of a non-expansive sulfoaluminate cement[J]. Cement and Concrete Research, 1995, 25(8): 1726–1736. DOI: 10.1016/0008-8846(95)00168-9 |
| [7] | BERETKA J, MARROCCOLI M, SHERMAN N, et al. The influence of C4A3Š content and W/S ratio on the performance of calcium sulfoaluminate-based cements[J]. Cement and Concrete Research, 1996, 26(11): 1673–1681. DOI: 10.1016/S0008-8846(96)00164-0 |
| [8] | WINNEFELD F, BARLAG S. Calorimetric and thermogravimetric study on the influence of calcium sulfate on the hydration of ye'elimite[J]. Journal of Thermal Analysis and Calorimetry, 2010, 101(3): 949–957. DOI: 10.1007/s10973-009-0582-6 |
| [9] | MARTIN D, MARTIN P, VLADIMIR K. Heat evolution and mechanism of hydration in CaO-Al2O3-SO3 system[J]. Ceramics, 2005, 49(2): 104–108. |
| [10] | SÁNCHEZ-HERRERO M J, FERNÁNDEZ-JIMÉNEZ A, PALOMO A. C4A3Š hydration in different alkaline media[J]. Cement and Concrete Research, 2013, 46: 41–49. DOI: 10.1016/j.cemconres.2013.01.008 |
| [11] | EL-DIDAMONY H. Hydration mechanisms of calcium sulphoaluminate C4A3Š, C4A3Š phase and active β-C2S[J]. Ceramics-Silikáty, 2012, 56(4): 389–395. |
| [12] | HANIC F, KAPRÁLIK I, GABRISOVÁ A. Mechanism of hydration reactions in the system C4A3Š-CŠ-CaO-H2O referred to hydration of sulphoaluminate cements[J]. Cement and Concrete Research, 1989, 19(5): 671–682. DOI: 10.1016/0008-8846(89)90038-0 |
| [13] | KAPRÁLIK I, HANIC F. Phase relations in the subsystem C4A3Š-CŠH2-CH-H2O of the system CaO-Al2O3-CŠ-H2O referred to hydration of sulphoaluminate cement[J]. Cement and Concrete Research, 1989, 19(1): 89–102. DOI: 10.1016/0008-8846(89)90069-0 |
| [14] | SONG J, YOUNG J F. Direct synthesis and hydration of calcium aluminosulfate (Ca4Al6O16S)[J]. Journal of the American Ceramic Society, 2002, 85(3): 535–539. |
 2016, Vol. 24
2016, Vol. 24


