2. 河北省无机非金属重点实验室,河北 唐山 063000
2. Key Laboratory of Inorganic Nonmetal of Hebei Province, Tangshan 063000, China
钛(Ti)及其合金因其优异的耐腐蚀性、生物相容性和力学性能,被广泛用于承载植入材料[1].但是,钛及其合金属于惰性材料,本身不具备骨诱导能力,无法与周围组织直接形成良好的早期骨结合[2],需要对其进行表面改性来赋予生物活性.而骨组织结合和细胞存活的关键因素是具有纳米结构的表面形貌和生物材料的粗糙度[3].纳米TiO2作为一种生物材料,不仅与钛基体有良好的附着力,而且可与骨组织之间形成良好的骨结合[4].纳米TiO2具有不同的结构,如纳米点[5]、纳米线[6]、纳米管[7]和纳米棒[8-9],其中,纳米棒由于其可控的直径和密度而被广泛研究.另外,纳米棒之间的间隙具有较好的亲水性,有利于营养物质的流动[10].
目前,钛种植体制备TiO2纳米棒的方法主要有阳极氧化法[11]、溶胶-凝胶法[12].阳极氧化法的工艺简单,但制备成本高,不适合大规模的工业化生产.溶胶-凝胶法的成本低,设备简单,适用性广,但工艺较为复杂,费时且所用的化学药品毒性大.而水热法的条件比较温和,操作简单,不至于破坏到钛基体的形状和结构,并且钛金属在水热溶液中的反应属于界面反应,能保证生成产物在钛基底表面均匀分散,是近年发展起来的一种制备TiO2纳米棒阵列的新方法[13].另外,研究发现,酸处理可以提高钛表面的粗糙度并获得较大的表面积,增加表面的附着力[14].因此,本文采用酸-水热两步法对钛表面进行TiO2纳米棒的制备,提高钛的生物活性,扩大钛在人体植入领域方面的应用.
基于以上分析,先用硝酸和氢氟酸混合液对钛表面进行酸处理,提高钛表面的粗糙度,再采用水热法,在酸处理后的钛片表面制备TiO2纳米棒,并探讨不同水热温度对纳米TiO2形貌的影响,对表面改性后的钛片进行模拟体液(simulated body fluid, SBF)生物活性实验,分析其表面生物活性.
1 实验 1.1 材料与试剂实验材料如下:NaOH,分析纯;氢氟酸,分析纯;浓硝酸,分析纯;草酸,分析纯;无水乙醇,分析纯;丙酮,分析纯.
实验基体材料选用医用纯钛片(纯度≥99.7%),用电火花数控线切割机(DK7725,苏州中航长风数控科技有限公司)加工成尺寸为10 mm×10 mm×1 mm的试样.
1.2 实验过程 1.2.1 试样预处理将切割好的医用纯钛片依次用丙酮、无水乙醇和去离子水超声清洗10 min,然后将清洗后的钛片放入表面皿中,倒入质量分数5%的草酸溶液使其能够完全地覆盖钛片,放入100 ℃的鼓风干燥箱中恒温2 h,再用去离子水超声清洗,直到钛片表面呈亮银色为止,然后烘干备用.将预处理后的试样组标记为51 574 109.
1.2.2 酸处理钛试样配制体积比1:1的0.29 mol/L HNO3和0.53 mol/L的HF混合酸液中,并放入25 ℃的电热磁力加热搅拌器中,将1#组试样浸渍于此混合酸液中,磁力搅拌10 min后迅速取出试样,用去离子水超声清洗5 min,晾干备用.将此酸处理后的试样组记为2#.
1.2.3 酸-水热法处理试样将2#组样品分为4组,放入容积50 mL的以聚四氟乙烯为内衬的反应釜中(NaOH填充量为35 mL),然后将配制的5 mol/L的NaOH溶液倒入反应釜内,分别于70、100、130、160 ℃的烘箱中反应12 h.取出反应后的钛片,在0.3 mol/L的HCl水溶液中浸泡5 h,用去离子水冲洗3次.70 ℃烘干后放入马弗炉中于450 ℃下热处理1 h,随炉冷却到室温.取出样品清洗待用,将酸-水热处理后的试样组记为3#(其中,70、100、130、160 ℃反应温度的样品分别标记为3#-1、3#-2、3#-3、3#-4).
1.2.4 试样检测1) 微观结构检测
采用场发射扫描电子显微镜(FESEM, 型号FEI: S-480, 日本)分析钛表面纳米结构的微观形貌;利用X射线衍射仪(XRD, 型号: D/MAX2500PC, 日本)分析钛表面纳米结构的物相组成,扫面范围为20°~80°,掠射角为0.5°,步长为0.02°.
2) 生物活性检测
配制与人体体液相似的模拟体液,利用SBF模拟人体温度环境条件,对1#、2#和3#组试样进行模拟体液生物活性实验.由于羟基磷灰石(HA)是脊椎动物骨骼和牙齿的主要无机组成成分,而Ca、P是羟基磷灰石(HA)的组成元素,因此可以通过检测生物活性实验后样品的Ca、P的含量,结合HA的生成状况来评价材料在人体条件下的生物活性.
3) 模拟体液配制
可参考文献[15],模拟体液根据表 1的组成配制.将分析纯NaCl、NaHCO3、KCl、K2HPO4·3H2O、MgCl2·6H2O、CaCl2、Na2SO4按一定顺序溶于去离子水中,然后用盐酸(1 mol/L-HCl)和三羟甲基氨基甲烷((CH2OH)3CNH2)将其缓冲至pH=7.4,最后加入蒸馏水定容至1 L.
| 表 1 模拟体液离子组成(pH=7.4) Table 1 Composition of simulated body fluid (pH=7.4) |
将1#、2#和3#组样品浸泡于定量SBF液中,温度保持在36.5 ℃.浸泡过程中,每2 d更换一次SBF,经过7 d后取出,用去离子水冲洗,在空气中晾干,利用SEM结合EDS评价实验后样品的Ca、P的含量,利用XRD评价实验后样品的HA的生成状况.
2 结果 2.1 钛表面纳米薄膜的组成结构表征 2.1.1 涂层的表面形貌图 1为1#、2#和3#组中3#-1、3#-2、3#-3、3#-4样品的SEM照片.由图 1可以看出,随着水热温度的升高,产物形貌经历了纳米片(70 ℃)到纳米棒(100、130、160 ℃)的变化.
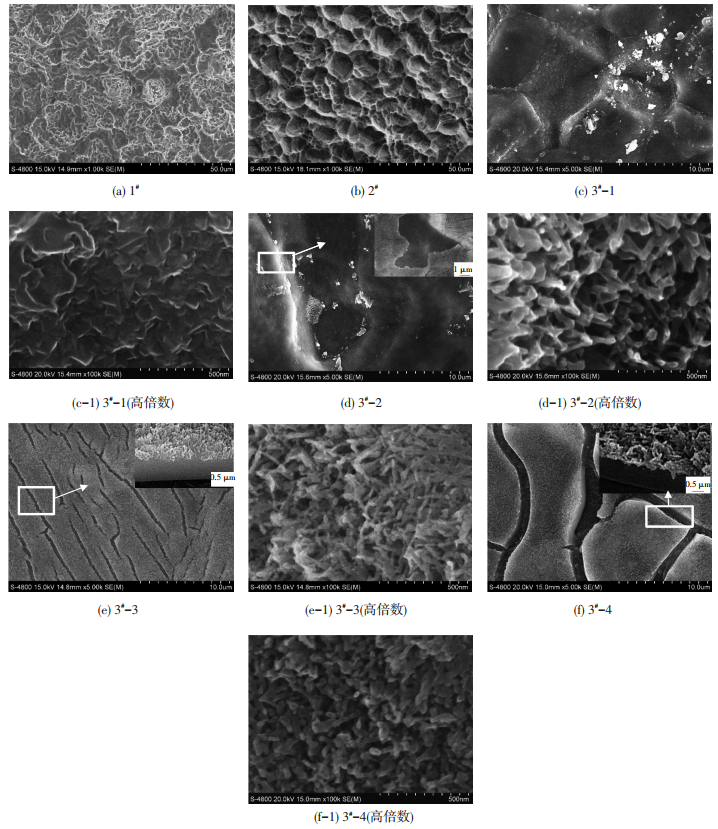
|
图 1 1#、2#、3#组试样的SEM照片 Figure 1 SEM image of 1#, 2#, 3# groups samples: (a) 1#; (b) 2#; (c) 3#-1; (c-1) 3#-1(high-multiple); (d) 3#-2; (d-1)3#-2(high-multiple); (e) 3#-3; (e-1)3#-3(high-multiple); (f) 3#-4; (f-1)3#-4(high-multiple) |
如图 1所示,未经过酸处理的1#试样,其表面出现的微粗糙形貌是由于预处理时草酸对钛表面的微腐蚀,见图 1(a).经HF和HNO3混合液腐蚀后的2#试样表面粗糙度增加,出现较深的沟壑形貌,见图 1(b).因此,由图 1可知,1#和2#仅仅改变了钛表面的粗糙度,没有改变其表面形貌,但3#组试样的钛表面形貌发生了变化.
3#组试样中3#-1试样表面的沟壑依然存在,其表面没有形成涂层,只附着很少的具有微细粗糙结构的小颗粒(图 1(c)),对应的图 1(c-1)中可以看出放大的小颗粒是片状结构;从图 1(d)中可以看出3#-2的试样表面的沟壑不太明显,插图为所对应位置的俯视图,可以看出钛表面形成涂层厚度很薄,从图 1(d-1)中看到形成的钛表面是棒状结构;3#-3的试样样品(图 1(e))表面沟壑消失,代之附着一层具有微裂纹的涂层,插图为所对应位置的截面图,可以看到形成的膜层厚度约为2.5 μm.其对应的图 1(e-1)显示钛表面是纳米棒结构,形成的纳米棒尺寸大小均一,长度为150 nm左右,直径为10 nm左右;而3#-4试样(图 1(f))的表面产生了较大的裂隙,插图为所对应位置的截面图,可以看到形成的膜层厚度约2 μm,与3#-3的试样很相近,但对应的图 1(f-1)显示钛表面形成的纳米棒之间发生了团聚,可能是因为水热反应过程中,水热温度越高,晶体生长越快,晶体发育越完整,但温度过高会导致临界晶核尺寸增大,使得晶体发生二次再结晶,导致晶体之间的团聚.结果表明,在NaOH浓度和热处理条件相同的情况下,不同的水热温度会影响钛表面氧化层的厚度.因此,在合适的水热温度下才有可能生成优异的纳米棒.由以上实验结果分析可知,当NaOH浓度为5 mol/L、水热温度为130 ℃、热处理温度为450 ℃(3#-3)时形成的纳米棒结构最好.
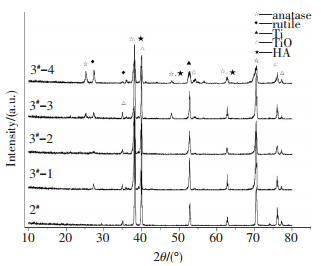
2.1.2 涂层的XRD分析为研究改性的2#和3#组中3#-1、3#-2、3#-3、3#-4试样的化学成分,对其进行XRD分析.图 2为2#组与3#组样品的XRD谱图.

|
图 2 2#、3#组试样的XRD谱图 Figure 2 XRD patterns of 2#, 3# groups samples |
由图 2可见,仅经过酸腐蚀的2#样品表面只有钛的衍射峰,说明酸腐蚀未改变钛表面的化学成分,但水热处理后的3#组试样表面的物质发生了变化,其物质为锐钛矿型TiO2和金红石型TiO2的混合相,且随水热温度的增加,形成的锐钛矿和金红石晶体也越来越多,结晶化程度越来越高,晶体发育越完整,生成的薄膜越厚,但太厚可能会使薄膜发生开裂,这与图 1的结果一致.
结合图 1、图 2的分析结果知,酸处理后的样品仅增加了粗糙度,未改变其化学成分,而酸-水热处理后样品表面的形貌和化学成分均发生了改变,当水热温度为130 ℃时,钛片表面形成的产物为具有较好结晶度的纳米棒,其化学成分为锐钛矿型TiO2和金红石型TiO2的混合相,且制备的纳米棒分布和尺寸均匀,排列整齐有序,长度也基本一致,单根纳米棒的长度为100~200 nm,直径约10 nm.
2.2 SBF浸泡后样品表面的观察结果为考察钛表面2#和3#组试样的生物活性,实验研究了模拟体液内HA的生成情况.将酸处理试样2#与酸-水热处理试样3#组中3#-1、3#-2、3#-3、3#-4一同浸泡于定量SBF溶液中.表 2是2#、3#组样品浸泡在SBF7 d表面的EDS化学元素分析,图 3和图 4分别是2#和3#组样品浸泡在SBF7 d后的SEM照片和XRD谱图.

|
图 3 #和3#组样品浸泡在SBF 7d后的SEM照片 Figure 3 SEM images of 2#, 3# groups samples soaked in SBF after 7 d |
|
图 4 #和3#组样品浸泡在SBF 7 d后的XRD谱图 Figure 4 XRD patterns of 2#, 3# groups samples soaked in SBF after 7 d |
从图 3可以看出,2#组的钛片表面没有新物质的形成,结合表 2中EDS分析可知样品表面主要是钛原子.图 4结果也显示2#样品只能观察到钛的衍射峰, 而经过水热处理后的钛片,模拟体液中浸泡7 d后,其表面均有新的物质生成.但3#-1、3#-2和3#-4试样表面仅有少量颗粒状的沉积物,而3#-3组表面附着的沉积物布满整个表面.XRD结果(图 4)显示在2θ=39°、48°等处都出现了羟基磷灰石HA的衍射峰,结合表 2的EDS可知,新物质为富含Ca、P的羟基磷灰石HA,与其他水热处理样品相比,3#-3试样表面沉积的HA的量最多.
| 表 2 2#、3#组钛片表面的EDS化学元素分析(质量分数/%) Table 2 EDS chemical element analysis of titanium surface of 2#, 3# groups(wt.%) |
另外,通过计算得知3#-3组的钙/磷比值为1.71,接近正常骨组织中的钙/磷比(1.79),表明水热温度为130 ℃形成的TiO2纳米棒可有效引导骨组织的再生.
3 讨论酸处理是通过酸溶液中的H+酸蚀钛表面氧化层,并与钛形成Ti-X离子键,同时使钛表面具有较高的表面能,便于进行化学反应.另外, 酸腐蚀能够增大钛表面的粗糙度,为接下来TiO2纳米结构的制备提供保证[16],但酸腐蚀未在钛表面形成新的物质(见图 1(a)、图 2).
在钛金属表面,水热法生长TiO2纳米棒的可能历程如下:浸入NaOH溶液后,钛基体不断被腐蚀,其表面自发形成的氧化膜TiO2溶解到碱液中和OH-反应,形成Ti(OH)3; 同时, 钛片表层以Ti4+的形式溶解到溶液中发生水合作用,生成水合二氧化钛(TiO2·nH2O)[17],TiO2·nH2O进一步与OH-反应形成水合物HTiO3·nH2O,随着水热反应的进行,水合物HTiO3·nH2O发生溶解,生成层状的Na2Ti3O7.钛片浸入稀盐酸后,Na2Ti3O7发生置换反应生成具有片状结构的H2Ti3O7[18],热处理后,钛表面纳米结构的钛酸相转化为片状的TiO2结构,同时这种热力学不稳定的TiO2纳米片会发生卷曲以降低表面能,在二维受限表面形成定向排列的致密纳米棒结构.水热表面化学反应过程为
Ti+3OH-→Ti(OH)3++4e-,
2Ti(OH)3++2e-→2TiO2·H2O+H2,
TiO2·H2O+OH-→HTiO3-·nH2O,
3HTiO3-·nH2O+2Na+→
Na2Ti3O7, +(n+1)H2O+OH-,
Na2Ti3O7+2H+
H2Ti3O7→TiO2+H2O.
在溶液浓度和热处理温度保持不变时,水热温度主要依靠TiO2晶体生长速度的快慢而改变其表面形貌.一方面, 升高水热温度会加快钛溶解的速率,也会提高溶液中物质的扩散速度,增加反应物碰撞几率,使得晶体生长速率变大,促进TiO2纳米棒的形核和加快生长过程;另一方面,成核过程是一个放热过程,温度的升高将不利于水解反应向成核方向进行,使体系中晶核数量相对较少,而且温度的升高还会导致能稳定存在的临界晶核尺寸增大[19],使得晶体有可能发生二次再结晶,导致晶体之间的团聚(见图 1(f-1)).
当基体浸在模拟体液中,2#试样表面没有HA的沉积,而3#组试样均有HA的沉积(图 3、图 4),其原因可能是酸腐蚀仅改变其粗糙度,而诱导HA沉积主要以羟基作用为主,粗糙度为次要因素.钛表面形成的TiO2·H2O在SBF中解离出表面带负电荷的Ti-OH,Ti-OH可通过库仑力吸引Ca2+,Ca2+又通过库仑力吸附PO33+,这个过程提高了基体表面钙、磷离子的过饱和度.另外,纯钛经酸-水热处理后表面形成了纳米结构,增加了比表面积和表面能,从而增加了表面形核位点,为磷灰石的异质成核提供了优先位置,这样能诱导磷灰石从模拟体液中快速沉积出来.因此, 酸-水热处理后的表面均有HA的沉积,但3#组中3#-3试样表面沉积的HA的量优于其他水热处理样品,其原因是较小的尺寸更易诱导HA沉积[20],而3#-3样品呈现的纳米棒直径较小,尺寸小于3#-2样品表面的纳米片和3#-4样品表面团聚的纳米棒.另外,钛表面氧化层的厚度也有可能会影响HA的生成,膜层越厚越有利于HA的生成,与其他样品相比.3#-3样品和3#-4样品形成的膜层厚度很相近,但由图 1(f-1)可知3#-4样品形成的纳米棒发生了团聚,因此3#-3样品(水热温度为130 ℃)时诱导HA沉积的量最多.与由图 3、表 2的HA生成结果一致.
由图 1、图 2可知,当碱液的浓度为5 mol/L、热处理温度为450 ℃,水热温度130 ℃时生成的TiO2纳米棒尺寸大小较为均匀.再结合图 3、图 4可知,此条件下表面沉积的HA含量最多.
4 结论1) 先采用酸处理增加钛表面的附着性,再利用水热法制备TiO2纳米结构.结果可知,随水热温度的增加,TiO2的形貌发生了变化,较低温度(70 ℃)时,TiO2为纳米片结构,温度升高后,产物形貌由纳米片变成了纳米棒.
2) NaOH浓度为5 mol/L,热处理温度为450 ℃,水热温度为130 ℃时,获得了尺寸均匀、长度基本一致的纳米棒,长度和直径分别为150和10 nm,且纳米棒是由锐钛矿型TiO2和金红石型TiO2的混合相组成的.
3) 酸-水热处理的钛基体经SBF浸泡7 d后可知,2#试样表面没有钙磷的生成,而3#试样组表面均形成了钙磷沉积层,其主要成分是HA,但3#-3试样表面HA的生成量最多,其表面钙磷比1.71,与骨的接近,表面出良好的生物活性,其主要原因是此条件下钛表面形成的纳米棒对其生物活性做出了大的贡献.另外,钛表面氧化层的厚度也有可能会影响HA的生成,膜层越厚越有利于HA的生成.证明水热温度为130 ℃制备的纳米棒最有利于骨细胞与机体之间产生化学键合,提高生物活性.
4) 水热温度通过影响TiO2晶体的生长速度来影响TiO2纳米棒的形核和生长过程,但温度过高,晶体则有可能发生二次再结晶,使晶体之间发生团聚.
| [1] | BUTEN E, ESEN Z, BOR S. In vitro bioactivity investigation of alkali treated Ti6Al7Nb alloy foams[J]. Applied Surface Science, 2015, 327(4): 437–443. |
| [2] |
王运锋, 何蕾, 郭薇. 医用钛合金的研究及应用现状[J]. 钛工业进展, 2015(1): 1–6.
WANG Yunfeng, HE Lei, GUO Wei. Research and application status of medical titanium alloys[J]. Titanium Industry Progress, 2015(1): 1–6. DOI: 10.13567/j.cnki.issn1009-9964.2015.01.001 |
| [3] | PARK J, BAUER S, VOND M K, et al. Nanosize and vitality: TiO2 nanotube diameter directs cell fate[J]. Nano Letters, 2007, 7(6): 1686. DOI: 10.1021/nl070678d |
| [4] | CHENG K, WANG T, WENG W, et al. Two step synthesis of CaP/TiO2, nanorod composite coatings with improved protein adsorption[J]. Thin Solid Films, 2013, 544: 206–211. DOI: 10.1016/j.tsf.2013.03.120 |
| [5] | CHENG K, WANG X, WENG W, et al. In vitro characterization of TiO2 nanodots films on Ti substrates[J]. Journal of Nanoscience & Nanotechnology, 2016, 16(6): 5804–5809. |
| [6] | TAN A W, ISMAIL R, CHUA K H, et al. Osteogenic potential of in situ TiO2 nanowire surfaces formed by thermal oxidation of titanium alloy substrate[J]. Applied Surface Science, 2014, 320: 161–170. DOI: 10.1016/j.apsusc.2014.08.160 |
| [7] | TIAN T. Preparation and antibacterial bioactivity of Ti-Base titania nanotube arrays[J]. Key Engineering Materials, 2014, 609-610: 435–441. DOI: 10.4028/www.scientific.net/KEM.609-610 |
| [8] | DONG L, CHENG K, WENG W, et al. Hydrothermal growth of rutile TiO2 nanorod films on titanium substrates[J]. Thin Solid Films, 2011, 519(15): 4634–4640. DOI: 10.1016/j.tsf.2011.01.008 |
| [9] | SHRESTHA S, MAO Z, FEDUTIK Y, et al. Influence of titanium dioxide nanorods with different surface chemistry on the differentiation of rat bone marrow mesenchymal stem cells[J]. Journal of Materials Chemistry B, 2016, 4(43): 6955–6966. DOI: 10.1039/C6TB02149B |
| [10] | DONG L, CHENG K, WENG W, et al. Hydrothermal growth of rutile TiO2 nanorod films on titanium substrates[J]. Thin Solid Films, 2011, 519(15): 4634–4640. DOI: 10.1016/j.tsf.2011.01.008 |
| [11] |
钟梅玲, 谭帼馨, 尹兆益, 等. 密度可控钛纳米棒阵列的制备及其矿化性能研究[J]. 稀有金属材料与工程, 2015, 44(8): 2053–2057.
ZHONG Meiling, TAN Guoxin, YIN Zhaoyi, et al. Preparation and mineralization properties of titanium nanorod arrays with controllable density[J]. Rare Metal Materials and Engineering, 2015, 44(8): 2053–2057. |
| [12] | MAHENDIRAN R, PANDIYARAJ K N, KANDAVELU K, et al. Investigation of physico-chemical properties of TiO2 nanorod by direct sol filling and heating sol-gel template method[J]. Journal of Nanoscience & Nanotechnology, 2014, 2(1): 79–82. |
| [13] | 董祥. 纯钛水热法制备低维纳米结构TiO2及其光电化学性能研究[D]. 南京: 南京航空航天大学, 2009. |
| [14] | AMR S F, MOHAMMED A A. An invitro and invivo evaluation of bioactive titanium plants following sodium removal treatment[J]. Dental Materials, 2009, 25(1): 48–57. DOI: 10.1016/j.dental.2008.05.007 |
| [15] | NOURI A, CASTRO R, SANTOS J L, et al. Calcium phosphate-mediated gene delivery using simulated body fluid (SBF)[J]. International Journal of Pharmaceutics, 2012, 434(1/2): 199–208. |
| [16] |
王立军, 郭志君, 胡盼, 等. 不同碱热处理方法对钛表面理化性能及细胞响应特性的影响[J]. 生物骨科材料与临床研究, 2014, 11(2): 5–9.
WANG Lijun, GUO Zhijun, HU Pan, et al. Effects of different alkali heat treatment methods on physical and chemical properties and cell response of titanium surface[J]. Materials and Clinical Research of Biological Department of Orthopedics, 2014, 11(2): 5–9. |
| [17] | LU Xiong, ZHAO Zhanfeng, LENG Yang. Biomimetic calcium phosphate coatings on nitric-acid-treated titanium surfaces[J]. Materials Science and Engineering C, 2007, 27(4): 700–708. DOI: 10.1016/j.msec.2006.06.030 |
| [18] | NAKAHIRA A, KUBO T, NUMAKO C. Formation mechanism of TiO2-derived titanate nanotubes prepared by the hydrothermal process[J]. Journal of Physical Chemistry C, 2010, 49(13): 5845–5852. |
| [19] |
冉凡勇, 曹文斌, 李艳红, 等. 水热合成法制备锐钦矿型纳米TiO2粉体的研究[J]. 无机材料学报, 2006, 21(3): 553–557.
ZHAN Fanyong, CAO Wenbin, LI Yanhong, et al. Study on preparation of anatase TiO2 nano powder by hydrothermal synthesis[J]. Journal of Inorganic Materials, 2006, 21(3): 553–557. |
| [20] |
王小红, 许楚峰, 贺嘉诚, 等. 碱和酸碱处理对钛生物活性的影响[J]. 化学研究与应用, 2016, 28(8): 1129–1135.
WANG Xiaohong, XU Chufeng, HE Jiacheng, et al. Effect of alkali and acid alkali treatment on bioactivity of titanium[J]. Chemical Research and Application, 2016, 28(8): 1129–1135. |
 2018, Vol. 26
2018, Vol. 26


