2. 重庆医科大学 实验教学中心,重庆 400016
2. Experimental Teaching Center, Chongqing Medical University, Chongqing 400016, China
腱骨组织的损伤作为一个全球性的健康问题,每年影响数百万人的正常生活与工作[1]。肌腱-骨界面作为软组织向骨转化的特殊移行区域,呈现渐变的组织学构成,其具体表现为:从肌腱组织到未矿化纤维软骨组织,再到矿化纤维软骨组织,最后到骨组织,各组织在区域之间无明显边界[2-3]。因此,腱骨组织损伤比一般组织损伤更为复杂,其特殊的结构和功能给组织修复和再生带来巨大的挑战。
组织工程的相关研究为腱骨损伤修复带来了希望,与传统手术方式不同的是,它通过制备天然组织替代物,使损伤的肌腱组织可以原位再生,且再生组织能够模仿原有健康组织的天然结构和功能,并具有长期活性。目前应用于腱骨组织工程修复的支架构建技术有冷冻干燥、3D打印、热处理溶出等,虽然这些技术都能提供适宜细胞生长的结构,但对于模仿肌腱组织的细胞生长环境仍然有所欠缺[1-4]。从解剖学上讲,肌腱由整齐排列的胶原纤维束组成,在组织工程支架中,相比于其它方法所制备的腱骨仿生支架,静电纺丝纤维结构与肌腱组织在显微结构和力学性能方面的相似性最大[5-6]。有利于肌腱再生的纤维结构按照直径可分为3类:微米纤维结构、纳米纤维结构和微/纳米纤维结构。在微米及纳米纤维结构中,较大的纤维尺寸可以更好地符合肌腱机械强度,而纳米纤维结构的纳米特性可以促进调节细胞生长形态、排列及表型表达[7]。因此,利用静电纺丝技术得到的微/纳米纤维结构相比于其它方法所制备的支架更有利于肌腱组织再生。
静电纺丝技术有许多应用,如组织工程、药物/基因输送、传感器、高效过滤器等[8]。静电纺丝技术因其简单方便、多功能性和价格低廉的特点已成为制备纤维结构的最常见方法。静电纺丝设备主要通过聚合物溶液的表面张力和由足够高的电场提供的拉伸力形成纺丝。因而,影响这两种作用力的工艺参数会极大地影响纤维的生成和结构[9-10]。其中,通过调整静电纺丝中接收装置类型及纺丝过程中的工艺参数,可以获得排列方向高度一致的纤维支架。这种静电纺丝取向纳米纤维支架区别于传统随机排列纳米纤维支架,显示出较高的机械强力。同时,定向纤维支架与天然肌腱组织细胞外基质结构相似并保持材料本身的固有特性,从支架的定向结构方面可以用于促进细胞黏附、迁移,而与细胞或生长因子的结合可进一步诱导细胞定向生长、分化,最终实现腱骨组织的再生修复[11-12]。另外,静电纺丝中选择具有与天然组织的机械性能相匹配的可电纺材料是模仿肌腱组织天然细胞外基质的基础。左旋聚乳酸(PLLA)是一种具有良好生物相容性的聚合物。最终的降解产物是对环境无害的二氧化碳和水[13]。由于PLLA良好的机械稳定性和生物相容性,大量研究已将其用于电纺纤维的生产。
综上,本研究从静电纺丝制备工艺参数方面优化腱骨仿生PLLA微/纳米纤维支架,并且考察了纤维支架的仿生力学特性与体外生物相容性,使所制备的纤维能够更好地模拟天然肌腱组织的结构和性能,以诱导肌腱组织的再生修复。
1 实验 1.1 试剂左旋聚乳酸(Poly(L-lactic acid),PLLA)(分子量:9.1万,岱罡生物);氯仿(成都市科龙化工试剂厂);小鼠肌腱细胞(购买自中国科学院典型培养物保藏委员会细胞库);α-MEM培养基(MA0216,大连美仑生物技术有限公司);胎牛血清(GIBCO);青霉素/链霉素溶液(MA0110,大连美仑生物技术有限公司);微丝绿色荧光探针(Actin-Tracker Green,C1033,上海碧云天生物技术有限公司);4′, 6-二脒基-2-苯基吲哚(DAPI)溶液(北京雷根生物技术有限公司);钙黄绿素-AM(Calcein-AM)和碘化丙啶(PI)活细胞/死细胞双染试剂盒(北京索莱宝科技有限公司);细胞计数(Cell Counting Kit-8,CCK-8)试剂盒(K1018,APEXBIO)。
1.2 仪器与设备分析电子天平(LS220A SCS,上海天美天平仪器有限公司);正置光学显微镜(ECLIPSE Ci,NIS-Elements成像软件,NIKON);力学拉伸仪(UniVert,CellScale);激光共聚焦显微镜(LEICA TCS SP8 SR);台式场发射扫描电镜(Phenom Pharos G1);台式电纺设备(FM1101,北京富友马有限公司)。
本研究中使用的静电纺丝设备由高压直流电源、微量注射泵、喷丝头、收集装置以及温度控制器几部分组成。其中接收装置的选择对于制备取向纤维膜十分重要。滚筒收集器是最简单有效获得纤维膜的装置之一,只需通过调整静电纺丝工艺参数,即可获得取向良好、分布均匀的纳米纤维膜[14-15]。同时,使用滚筒装置接收,纤维的沉积面积较大,可以获得更高的纤维产出率。因此,本研究选用的静电纺丝接收装置为滚筒收集器。
1.3 PLLA纺丝溶液的配制以PLLA为溶质,氯仿为溶剂制备纺丝溶液,常温下搅拌12 h,充分溶解后得到PLLA-氯仿纺丝溶液。使用一次性注射器吸取5 mL纺丝溶液,安装型号为22G的纺丝针头,将注射器夹于注射泵上,待实验操作温度到达(37±5) ℃后开始纺丝。
1.4 制备工艺参数对PLLA纤维形貌的影响对PLLA静电纺丝过程中参数影响进行研究,每个考察因素对应3个水平进行研究,具体参数设置如表 1。
| 表 1 PLLA静电纺丝过程参数考察表 Table 1 Process parameters of electrospinning PLLA |
通过扫描式电子显微镜(SEM)观察静电纺丝法所制备的PLLA纤维的形貌与排列。为了量化研究因素对纤维直径的影响,使用Photoshop软件对显微镜下PLLA纤维照片中随机选出的10根纤维进行测量,计算平均直径,从而为优化制备过程和工艺参数提供依据。
1.5 PLLA纤维力学性能表征将静电纺丝最优制备工艺条件下制备的PLLA定向纤维膜随机取出3份样品,使用游标卡尺测量其厚度后统一切割成30 mm长度。参照GB6529/T规定[16],将纤维膜试样在标准大气要求的环境条件下进行调温和调湿,设置力学拉伸仪参数,夹持长度22 mm,拉伸速度13.2 mm/min。随机取出样品,固定于力学拉伸仪的夹具中,使样品纵轴与上下夹具中心连线重合,以确保纤维沿着轴向伸长。通过力学拉伸仪进行拉伸测试,得到纤维膜的载荷位移曲线及应力-应变曲线,最终计算获得PLLA纤维膜的拉伸强度、平均杨氏模量、最大拉伸应变。
1.6 纤维支架的细胞相容性实验将静电纺丝随机取向纤维膜和定向纤维膜裁剪成边长为1 cm的正方形薄片。将样品于超净台下紫外灭菌3 h后置于24孔板底部,加入培养基浸泡过夜。使用完全培养基(100 mL完全培养基配比为:89 mL α-MEM培养基、10 mL胎牛血清以及1 mL青霉素/链霉素溶液)培养小鼠肌腱细胞至对数生长期后将随机取向纤维膜和定向纤维膜分别与生长状态良好的第三代小鼠肌腱细胞共培养,进行细胞相容性相关实验。
1.6.1 细胞形貌将随机取向纤维膜(RF)和定向纤维膜(AF)分别与生长状态良好的第三代小鼠肌腱细胞共培养4、7天后使用微丝绿色荧光探针(Actin-Tracker Green)和4', 6-二脒基-2-苯基吲哚(DAPI)染色工作液分别对细胞骨架和细胞核进行染色,封片后于激光共聚焦显微镜下观察细胞形貌。
1.6.2 细胞活力将随机取向纤维膜和定向纤维膜分别与生长状态良好的第三代小鼠肌腱细胞共培养4、7 d后使用钙黄绿素-AM(Calcein-AM)和碘化丙啶(PI)活细胞/死细胞双染试剂盒检测细胞活性,封片后于激光共聚焦显微镜下对活细胞与死细胞进行观察,并通过Image J软件估计活细胞与死细胞染色比例。
1.6.3 细胞增殖将随机取向纤维膜和定向纤维膜分别与生长状态良好的第三代小鼠肌腱细胞共培养1、4、7 d后用CCK-8细胞增殖-毒性检测试剂盒检测TT-D6细胞增殖能力,使用酶标仪测定各样品于450 nm处吸光度OD值。通过各个取样时间点细胞增长率评价纤维膜上的细胞增殖情况。
1.6.4 细胞迁移通过Actin-Tracker Green染色细胞内肌动蛋白,从激光共聚焦图像重建3D图像来观察细胞在纤维膜上的迁移情况。
2 结果与讨论 2.1 工艺参数对纤维形貌的影响 2.1.1 纺丝溶液聚合物浓度对纤维形貌的影响为保证静电纺丝过程的稳定,设置PLLA-氯仿溶液聚合物质量浓度为30、80、130 mg/mL,其他条件不变。研究发现,纺丝溶液聚合物的浓度是影响纤维直径大小的主要因素之一。当纺丝溶液浓度为30 mg/mL时,不能拉伸成纤维。这可能是由于溶液黏度较低时聚合物的分子链缠结不充分,射流稳定性差,在电场力的作用下,导致分子链之间相互分离。由图 1(a)、(b)可见随着纺丝液聚合物浓度增大,纤维直径随之增大,当浓度由80 mg/mL提高到130 mg/mL时,纤维直径从(0.94±0.21) μm增加到(3.55±1.00) μm。这一方面是由于聚合物溶液的表面张力随浓度的增大而增大,在离开注射器针口时液滴形成纤维的能力便随之减弱;另一方面,纺丝液浓度增大,所含溶剂量就会变少,喷口处聚合物易凝结,溶剂完全挥发所需时间变短,纤维受拉伸的时间也减短,致使纤维直径随纺丝液浓度呈正相关关系。综合考虑,在PLLA-氯仿溶液聚合物浓度为80 mg/mL下制备的纤维更适合模拟肌腱组织。

|
图 1 不同纺丝溶液聚合物浓度下纤维的SEM形貌 Fig.1 SEM morphology of fibers under different polymer solution concentrations: (a) 80 mg/mL; (b) 130 mg/mL |
设置的环境相对湿度分别为40%、50%、60%。纺丝环境湿度是影响纤维形貌的主要环境因素。静电纺丝过程中的环境湿度主要影响纺丝溶液中溶剂的挥发速率,从而影响例如形态、机械性能、相组成等系列特性。环境湿度降低时,空气中的水蒸气含量减少,纺丝溶液中溶剂的挥发速率加快,如图 2(a),此时较低的相对湿度有利于形成表面更干燥的纤维。然而,如果相对湿度太低,溶剂挥发快,阻碍了射流的延伸,容易造成纤维的不连续沉积[17]。另一方面,当相对湿度达到足够高的水平时,纺丝溶液中溶剂的挥发速率降低,从而影响射流的凝固速率,如图 2(c)所示,纺丝过程中溶剂不能在到达接收板前挥发完全。同时,相对湿度较高时,空气中的水蒸气可能渗透到射流中[17],水蒸气冷凝成液珠并附着于纤维表面,导致多孔纤维的形成。由图 2可知,在环境相对湿度为40%的条件下,可以保证纺丝过程中纤维的连续沉积并保持良好的形貌特征。

|
图 2 不同湿度下纤维的SEM形貌 Fig.2 SEM morphology of fibers under different humidity: (a) 40%; (b) 50%; (c) 60% |
已有文献指出,接收器的接收转速对纤维的取向程度以及直径有影响[18-19]。接收器旋转时产生的机械力有拉伸纤维的作用,在达到一定的转速时即可使纤维以对齐的方式沉积。如图 3(a)所示,接收器的转速为500 r/min时,纤维无明显取向,多数纤维呈螺旋状分布,不能满足模拟肌腱组织天然细胞外基质定向排列要求。尽管高旋转对取向纤维产生机械拉伸效应,在转速提升到1 000 r/min时,纤维定向性得到提高,但直径(1.79±0.46) μm略高于在500 r/min条件下所产生的纤维直径(1.45±0.35) μm。这种现象可能是由于纤维沉积时接收器的高速运动导致了更快的溶剂蒸发速率,从而降低了溶液电导率,使纤维直径在一定程度下随着收集器速度的增加而小幅增加。当转速提升到1 500 r/min时,机械拉伸作用显著增加,并显著高于溶剂蒸发对纤维直径的影响,使得纤维直径明显下降(0.94±0.21) μm,同时具有良好的取向性。由实验结果可知,接收器1 500 r/min的高速运动下接收到的纤维具明显取向性,可以满足模拟肌腱组织天然细胞细胞外基质的定向排列特征目的。

|
图 3 不同接收转速下纤维的SEM形貌 Fig.3 SEM morphology of fibers under different receiving speeds: (a) 500 r/min; (b) 1 000 r/min; (c) 1 500 r/min |
保持纺丝过程中其他因素不变,设置注射泵针头尖端到接收器距离分别为10、20、30 cm。比较图 4(a)、(b)给出的接收距离分别为10和20 cm时的纤维形貌,可见,接收距离为10 cm的纤维直径明显较大,这是由于较短的接收距离造成了纤维沉积时间的减少,溶剂挥发不完全导致大直径片状纤维的产生。纺丝溶液从针头喷出后,在一定的空间间隔内沿直线运动,经历弯曲不稳定和鞭打运动,然后将纤维沉积在接收器上[20]。因此,在一定程度上接收距离越大,纤维拉长越多,则纤维越细。然而,由图 4(c)可知,当接收距离为30 cm时,纤维直径为(1.71±0.43) μm,大于接收距离为20 cm时的纤维直径(0.94±0.21) μm。这是因为纤维沉积过程的电场强度随着工作距离的增加而减小,当超过了一定距离后纺丝溶液所受到的静电力降低,使纤维变粗。可见,注射泵针头尖端到接收器距离短时,产生片状纤维;接收距离过大时,不仅增加纤维直径,而且导致纤维附着点重复性降低,减小纤维之间的取向性。

|
图 4 不同接收距离下纤维的SEM形貌 Fig.4 SEM morphology of fibers under different receiver distances: (a) 10 cm; (b) 20 cm; (c) 30 cm |
设置静电纺丝注射泵梯度推注速度分别为0.8、0.5、0.3 μL/s。研究表明[17],如果当注射泵推注速度过快时,纤维的产生速度小于溶液推出速度导致完整纤维的形成受阻。如图 5(a),当注射泵推注速度为0.8 μL/s时,流速过快,导致针口液滴不稳定,溶剂量随之增大,挥发速率低,不能使纤维在飞行过程中完全干燥,沉积到接收器时纤维发生融合,呈片状分布。注射泵推注速度由0.8 μL/s降低到0.5 μL/s时,从图 5(b)中仍然能观察到片状纤维,但相比于0.8 μL/s已大幅减少。当注射泵推注速度降至0.3 μL/s时(图 5(c)),静电场内的电场力能够充分作用于液滴,纤维已经完整成形。由此可见,注射泵推注速度主要影响纤维的产生速度,进而决定了静电纺丝的生产效率,纤维产出率随推注速度的增大而得到提高。推注速度也同时决定着纤维的直径大小,在一定范围内,纤维的直径随着注射泵推注速度的增大而增大。由实验结果可知,静电纺丝注射泵梯度推注速度为0.3μL/s时,静电场内的电场力能够充分作用于液滴,纤维形貌优良。

|
图 5 不同注射泵推注速度下纤维的SEM形貌 Fig.5 SEM morphology of fibers under different injection pump pushing speeds: (a) 0.8 μL/s; (b) 0.5 μL/s; (c) 0.3 μL/s |
实验设置的纺丝正电压分别为10、17.5和25 kV,比较在3个不同的电压下采集的纤维的SEM图像。如图 6(a)~(c)所示,在3种不同电压下,纤维都是光滑的,没有串珠状或片状纤维,并且在各个电压下的纤维直径分别为(1.73±0.38)、(1.49±0.38)、(0.94±0.21) μm。虽然直径呈梯度减小,但是大小无明显区别,并且在不同电压之下,纤维之间仍然保持定向排列,表明静电纺丝过程中的附加电压不是纤维结构的主要影响因素。

|
图 6 不同附加电压下纤维的SEM形貌 Fig.6 SEM morphology of fibers under different additional voltages: (a) 10 kV; (b) 17.5 kV; (c) 25 kV |
综上,本研究中静电纺丝最佳工艺参数为:使用聚合物质量浓度为80 mg/mL的PLLA-氯仿纺丝溶液在相对湿度梯度为40%、纺丝电压为25 kV、接收距离为20 cm、注射泵推注速度为0.3 μL/s以及接收转速装置为1 500 r/min的条件下制备定向纤维膜,以达到模拟肌腱组织天然细胞外基质结构的要求。
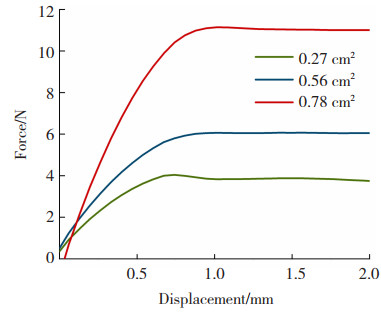
2.2 力学性能分析肌腱在肌腱-骨界面中是用于传递力学的结缔组织,力学相关表征是肌腱修复材料重要的指标之一。为了评估本研究中静电纺丝最优制备工艺下PLLA定向纤维膜的力学特性,随机取出3份样品,使用游标卡尺测量其厚度分别为0.027、0.057、0.078 mm后统一切割成300 mm长度。图 7给出了纤维膜的载荷-位移曲线。
|
图 7 定向纤维膜力学性能载荷-位移曲线 Fig.7 Force-displacement curve of mechanical properties of directional fiber membrane |
由图 7可知,所制备的PLLA纤维平均拉伸强度约为(14.80±0.32) MPa,杨氏模量为(807.02±45.09) MPa。成年哺乳动物的肢体肌腱,其拉伸强度的范围在10~70 MPa,最常见的大约为13 MPa[21],因此本研究所制备的PLLA定向纤维膜可基本满足成年哺乳动物的肢体肌腱的力学特性要求。同时,也可观察到在横截面积0.27 cm2至0.78 cm2的范围内,其最大载荷为(4.33±0.32)N至(11.31±0.48) N,可推断如要求所制备纤维应满足不同的载荷,通过改变纤维膜纺织厚度即可达到目的。
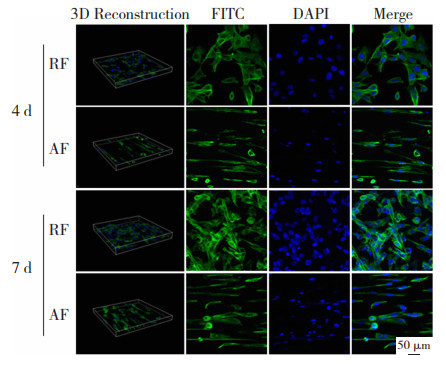
2.3 细胞相容性实验 2.3.1 细胞形貌将随机取向纤维膜(RF)和定向纤维膜(AF)分别与生长状态良好的第三代小鼠肌腱细胞共培养4、7 d后,通过激光共聚焦显微镜(如图 8所示)均可观察到两种纤维膜上各自黏附的肌腱细胞生长方向与纤维取向高度一致,且细胞骨架显著沿纤维定向伸长,但由于非定向纤维膜上纤维分布随机性较高而导致细胞散落分布,与普通平板上培养的细胞分布程度较为相似,然而其细胞取向排列程度远不如定向纤维。因此,还需选择定向纤维膜来满足模拟肌腱细胞天然细胞外基质定向特征要求。
|
图 8 激光共聚焦显微镜下细胞形貌图 Fig.8 Cell morphology under CLSM |
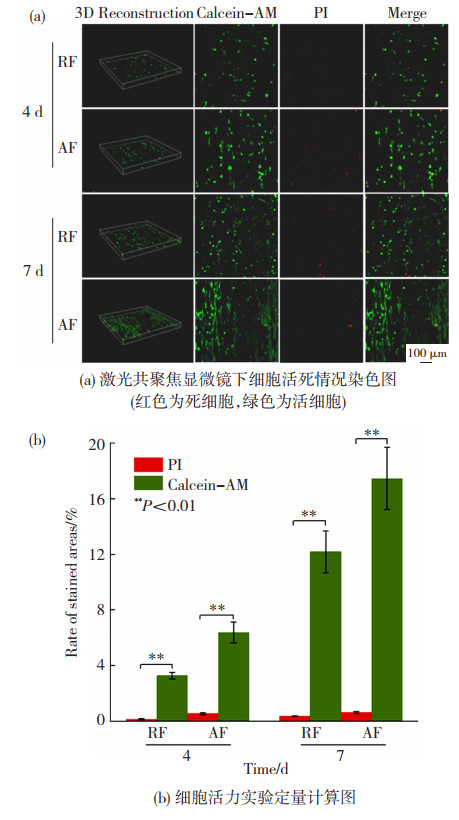
使用Calcein-AM/PI活细胞/死细胞双染试剂盒检测细胞活性,封片后在共聚焦荧光显微镜下观察到大量的活细胞和罕见的死亡细胞(如图 9所示),表明无论是随机取向纤维膜还是定向纤维膜上黏附的TT-D6都具有良好的活性。同时通过Image J软件计算4、7 d的存活细胞占比也显著高于死亡细胞。
|
图 9 纤维支架对细胞活力的影响 Fig.9 Effect of fiber scaffolds on cell viability: (a) staining of cell alive (green) and dead (red) under CLSM; (b) quantitative calculation diagram of cell viability experiment |
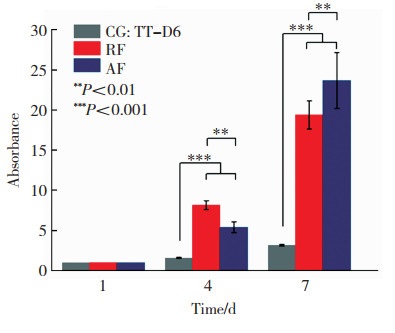
如图 10所示,根据CCK-8结果,发现无论是随机取向纤维膜或者定向纤维膜对小鼠肌腱细胞的增殖均无明显不良影响,同时在定向纤维支架上种植的细胞增殖速度显著高于空白对照组(普通培养环境下的肌腱细胞,CG)。
|
图 10 纤维支架对细胞增殖的影响 Fig.10 Effect of fiber scaffold on cell proliferation |
将定向与非定向纤维膜的激光共聚焦显微镜图像进行3D重建,从纤维膜3D重建图截面观察细胞的迁移状态。由图 11可观察到,细胞在定向和非定向膜上都具有一定的细胞迁移效应,但是非定向膜纤维上黏附与迁移的细胞数目远远小于定向纤维膜。其原因可能是PLLA作为酯类物质,其本身亲水性差,由于非定向膜纤维之间的孔隙率会随着纺丝时间的延长而减小,这种孔隙率的减小极其不利于细胞的黏附与生长。对于定向纤维膜来说,在经过长时间的纺丝操作后纤维之间仍然会平行排列,这种结构有利于保持高孔隙率,细胞便于在纤维间生长、迁移、养分流动。

|
图 11 纤维支架对细胞迁移的影响 Fig.11 Effect of fiber scaffolds on cell migration |
1) 单因素实验结果表明,接收转速是影响纤维定向排列的最主要因素,纺丝液聚合物浓度是影响纤维直径的最主要因素,其次是接收距离、环境湿度、推注速度。当PLLA-氯仿纺丝液聚合物质量浓度为80 mg/mL、接收转速为1500 r/min、接收距离为20 cm、注射泵推注速度为0.3 μL/s以及纺丝电压为25 kV时,制备的PLLA纤维成型性良好,平均直径为(0.94±0.21) μm,纤维之间平行分布,可达到模拟肌腱组织的天然细胞外基质结构的要求。
2) PLLA定向纤维膜平均拉伸强度约为(14.80±0.32) MPa,与成年哺乳动物的肢体肌腱常见拉伸强度相近,可基本满足成年哺乳动物的肢体肌腱的力学特性要求。
3) 制备的纤维膜细胞相容性良好,并且细胞沿纤维定向生长,定向纤维结构上的细胞排列规则,非定向结构上的细胞呈随机分布。定向性排列纤维膜具有改变细胞结构的作用,有利于符合模拟天然细胞外基质的结构要求。
本研究所制备的纤维膜能够满足肌腱组织修复的需要,但该PLLA纤维在肌腱组织的再生修复中的应用还需要通过动物实验进一步研究。
| [1] |
WANG Dan, ZHANG Xu, HUANG Shuting, et al. Engineering multi-tissue units for regenerative medicine: bone-tendon-muscle units of the rotator cuff[J]. Biomaterials, 2021, 272: 120789. DOI:10.1016/j.biomaterials.2021.120789 |
| [2] |
WEINREB J H, SHETH C, APOSTOLAKOS J, et al. Tendon structure, disease, and imaging[J]. Muscles, 2014, 4(1): 66-73. DOI:10.11138/mltj/2014.4.1.066 |
| [3] |
BENJAMIN M, KAISER E, MILZ S. Structure-function relationships in tendons: a review[J]. Journal of Anatomy, 2010, 212(3): 211-228. DOI:10.1111/j.1469-7580.2008.00864.x |
| [4] |
KILLIAN M L, BIOLOGY D. Growth and mechanobiology of the tendon-bone enthesis[J]. Seminars in Cell & Developmental Biology, 2021, 123: 64-73. DOI:10.1016/j.semcdb.2021.07.015 |
| [5] |
BÖLGEN N. Electrospun materials for bone and tendon/ligament tissue engineering[M]. Editor(s): Tamer Uyar, Erich Kny, Electrospun Materials for Tissue Engineering and Biomedical Applications, Woodhead Publishing, 2017: 234-256.
|
| [6] |
BOSWORTH L, DOWNES S. Biocompatible three-dimensional scaffolds for tendon tissue engineering using electrospinning[M]. Cellular Response to Biomaterials, 2009: 3-27.
|
| [7] |
高仓健, 杨振, 刘舒云, 等. 静电纺丝技术在肩袖损伤修复中的应用[J]. 中国组织工程研究, 2021, 26(4): 637-642. GAO Cangjian, YANG Zhen, LIU Shuyun, et al. Application of electrospinning in rotator cuff repair[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2021, 26(4): 637-642. DOI:10.12307/2022.104 |
| [8] |
WANG Xiaoxiong, YU Guifeng, ZHANG Jun, et al. Conductive polymer ultrafine fibers via electrospinning: preparation, physical properties and applications[J]. Progress in Materials Science, 2021, 115: 100704. DOI:10.1016/j.pmatsci.2020.100704 |
| [9] |
TAYLOR G. Electrically driven jets[J]. Proceedings of the Royal Society of London A Mathematical, physical & Engineering Sciences, 1969, 313(1515): 453-475. DOI:10.2307/2416488 |
| [10] |
LIANG M, HéBRAUD A, SCHLATTER G. Modeling and on-line measurement of the surface potential of electrospun membranes for the control of the fiber diameter and the pore size[J]. Polymer, 2020, 200: 122576. DOI:10.1016/j.polymer.2020.122576 |
| [11] |
XIE Jian, SHEN Hangqi, YUAN Guangyin, et al. The effects of alignment and diameter of electrospun fibers on the cellular behaviors and osteogenesis of BMSCs[J]. Materials Science and Engineering C, 2021, 120(3-4): 111787. DOI:10.1016/j.msec.2020.111787 |
| [12] |
JIANG T, CARBONE E J, LO K W H, et al. Electrospinning of polymer nanofibers for tissue regeneration[J]. Progress in Polymer Science, 2015, 46: 1-24. DOI:10.1016/j.progpolymsci.2014.12.001 |
| [13] |
NAMPOOTHIRI K M, NAIR N R, JOHN R P. An overview of the recent developments in polylactide (PLA) research[J]. Bioresour Technol, 2010, 101(22): 8493-8501. DOI:10.1016/j.biortech.2010.05.092 |
| [14] |
LIPOL L S, RAHMAN M M. Electrospinning and electrospun nanofibers[J]. World Journal of Nano Science & Engineering, 2016, 6(2): 45-50. DOI:10.4236/wjnse.2016.62005 |
| [15] |
MATTHEWS J A, WNEK G E, SIMPSON D G, et al. Electrospinning of collagen nanofibers[J]. Biomacromolecules, 2002, 3(2): 232-238. DOI:10.1021/bm015533u |
| [16] |
国家市场监督管理总局. 纺织品调湿和试验用标准大气法: GB/T 6529-2008[S]. 中国: 中国标准出版社, 2008.
|
| [17] |
LONG Yunze, YAN Xu, WANG Xiaoxiong, et al. Electrospinning[M]. Electrospinning: Nanofabrication and Applications, 2019: 21-51.
|
| [18] |
ROUBA G, ASADIAN M, VERCRUYSSE C, et al. Wide-ranging diameter scale of random and highly aligned PCL fibers electrospun using controlled working parameters[J]. Polymer, 2018, 157: 19-31. DOI:10.1016/j.polymer.2018.10.022 |
| [19] |
EDWARDS M D, MITCHELL G R, MOHAN S D, et al. Development of orientation during electrospinning of fibres of poly(ε-caprolactone)[J]. European Polymer Journal, 2010, 46(6): 1175-1183. DOI:10.1016/j.eurpolymj.2010.03.017 |
| [20] |
ZULKEFLE M, PUAD M, RAHMAN R A, et al. Fabrication and physical characterization of electrospun PVA-ZnO fibers with different deposition distance[J]. Journal of Physics Conference Series, 2020, 1535: 012048. DOI:10.1088/1742-6596/1535/1/012048 |
| [21] |
KER R F, WANG X T, PIKE A J J O E B. Fatigue quality of mammalian tendons[J]. Journal of Experimental Biology, 2000, 203(8): 1317-1327. DOI:10.1242/jeb.203.8.1317 |
 2022, Vol. 30
2022, Vol. 30


