摘要
生物材料是生物医学工程研究的关键要素之一,多聚脱氧核糖核苷酸(PDRN)是一类DNA衍生物,由于其具有组织修复、抗炎、促进伤口愈合、刺激血管生成、抗缺血损伤等多种药理活性,被广泛用于新的疗法和技术,以及开发人工生物替代系统等,用于支持、修复或替换受损的细胞、组织和器官等方面。本文综述了PDRN及其类似物的制备、生物医学应用、分子作用机制、载药体系等内容,且对PDRN在生物医学工程领域中存在的问题及未来发展潜能进行了探讨,为研究者们开发基于PDRN的新型技术与产品提供参考。
关键词
Abstract
Biomaterials are one of the key elements in biomedical engineering research. Polydeoxyribonucleotide (PDRN) is a type of DNA derivatives that have various pharmacological activities such as tissue repair, anti-inflammation, wound healing, stimulation of angiogenesis, and anti-ischemia properties. It is widely used in new therapies and technologies to develop artificial biological replacement systems to support, repair or replace damaged cells, tissues and organs. This article reviews the preparation, analogs, biomedical applications, molecular mechanism of action, drug loading system of PDRN and discusses the existing challenges and research trends of PDRN in the field of biomedical engineering. It provides a reference for researchers exploring novel technologies and products based on PDRN.
Keywords
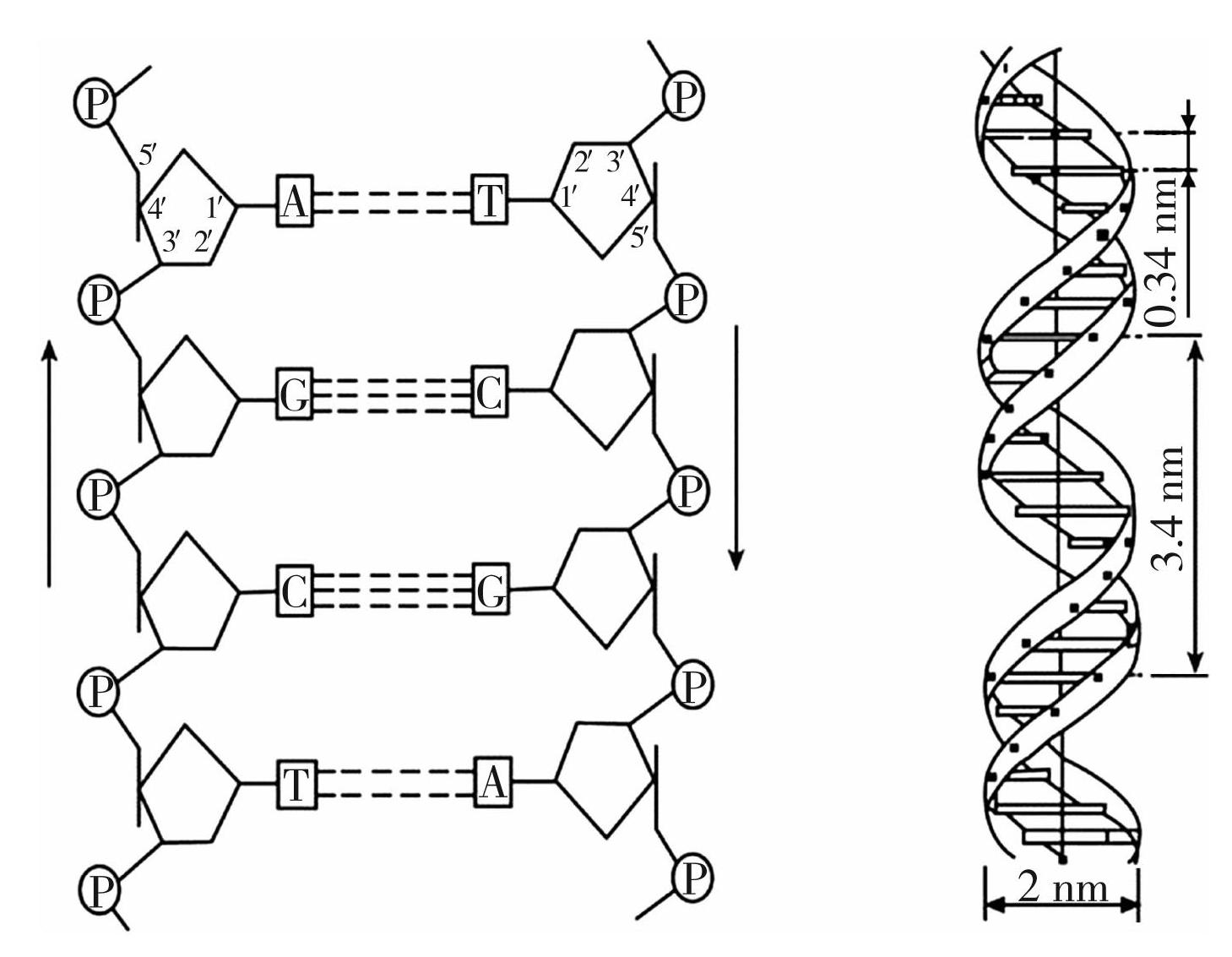
多聚脱氧核糖核苷酸(Polydeoxyribonucleotide,PDRN)是一种天然来源的低分子量DNA衍生物,分子量介于50~1 500 kDa,PDRN最具代表性的分子量是80~200 kDa,高斯分布的峰值在132 kDa。PDRN的碱基长度在50~2 000 bp,是一种带有磷酸二酯键的脱氧核糖核苷酸的线性聚合物,PDRN中包含50%双链脱氧核糖核苷酸,两条聚脱氧核糖核苷酸通过碱基对之间的氢键相连(腺嘌呤(A)=胸腺嘧啶(T);鸟嘌呤(G)=胞嘧啶(C)),最终形成双螺旋结构(如图1)[1]。
PDRN主要从大马哈鱼(Oncorhynchus keta)或虹鳟鱼(Oncorhynchus mykiss)的精子细胞中提取和纯化制备。PDRN通过提纯和高温杀菌工艺制备,确保了较高的DNA含量,制备的PDRN活性成分纯度为95%,且不含药理活性蛋白和多肽,保证了产品的安全性,并且不会产生免疫副作用[2]。商业化生产的PDRN是制造商通过蛋白水解酶和其他强化变性处理获得的。
PDRN的碱基组成与人类DNA相似度高达98%,基于这一生物学效应,其在临床的应用范围逐渐拓展,在组织修复、伤口愈合、抗缺血、抗炎等方面均显示出了明显的效果。体外和体内的实验表明,PDRN最相关的作用机制是作为腺苷A2A受体的激动剂,激活A2A受体,产生多种生理性效应。除了激活腺苷A2A受体,PDRN还为所谓的“挽救途径”提供核苷和核苷酸。
本文拟对PDRN的化学、医学/药学、工程技术与应用潜能等方面的内容进行全面的总结,为研究者们开发基于PDRN的新型技术与产品提供参考。
1 PDRN的制备
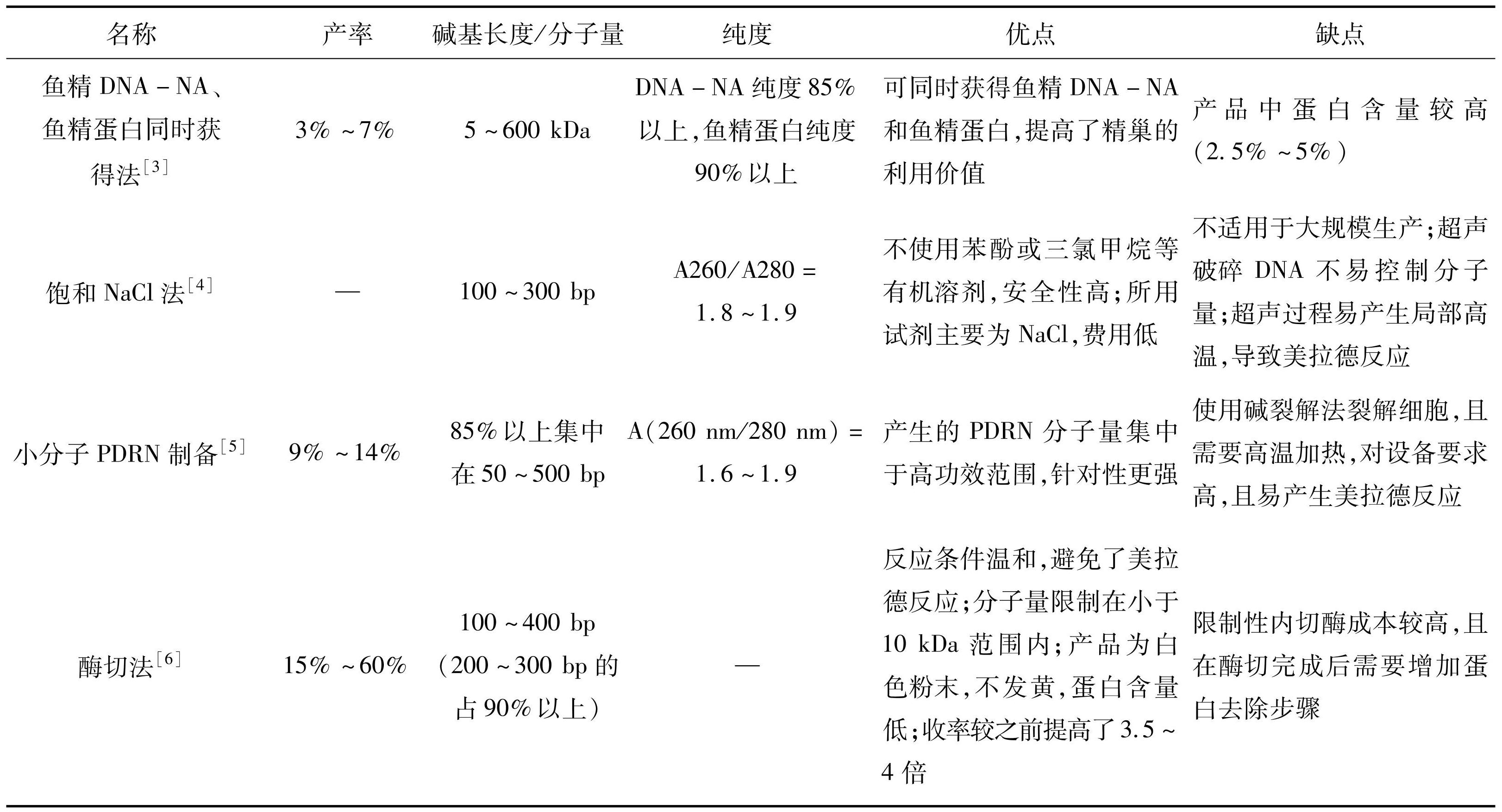
PDRN主要是大分子DNA降解后的小片段的产物。PDRN来自于大马哈鱼或虹鳟鱼的精子细胞。传统提取纯化DNA的方法,常会使用对人体有危害的苯酚和三氯甲烷,且提取步骤繁琐,耗时长。为了提高工艺的安全性以及提取效率,增加获得PDRN分子量的可控度,科学家们在不断探索更加高效、温和、安全的制备方法(如表1)。
如表1所示,现有的提取方式各具优缺点,所以PDRN提取的产率,提取物的安全性和稳定性,提取过程的温和性,提取所用仪器设备试剂的成本控制,精巢组织利用的充分性以及活性PDRN分子量控制等多方面综合因素是之后研究的重点,开发更高效的PDRN提取工艺亟不可待。
表1PDRN不同制备方式的比较
Table1Comparison of different preparations of PDRN
提取并优化不同分子量的PDRN,将其应用到各类领域中,发挥它强大抗炎修复再生的功效:700 kDa以上用于皮肤再生、关节软骨再生及促进骨骼形成;350~500 kDa用于医药品治疗以达到组织再生、角膜再生及治疗肌肉骨骼疾病;40~60 kDa用于化妆品及食品达到修复屏障、改善皱纹及皮肤美容的作用等。基于此,在PDRN制备的过程中,根据不同的应用,制备不同分子量的PDRN,具有重要的意义,所谓“一源多用”。
2 PDRN在生物医学中的应用及分子调控机制
最初对PDRN的描述是一种从人胎盘中提取的组织修复刺激剂,随着研究的深入,人们对于PDRN的关注越来越多,PDRN在生物医学中的应用潜能也被挖掘。本小节拟在PDRN的作用机制的基础上,对PDRN的生物医学应用及相应的分子调控机制进行综述。
2.1 PDRN的作用机制
细胞外腺苷(Adenosine)可作为局部调节剂,在体内具有细胞保护功能。目前有4种已知的腺苷受体(Adenosine Receptor,AR)亚型,包括A1,A2A,A2B和A3,这4种受体都属于G蛋白偶联受体超家族,具有7个疏水性跨膜片段。它们在大多数组织中广泛表达,并参与调节循环、肾血流量、免疫系统、葡萄糖稳态、高脂血症、动脉粥样硬化、血管生成、炎症和缺血再灌注的过程[7]。在机体出现组织损伤、缺血缺氧的条件下,释放大量腺苷,以对抗细胞能量失衡,进而激活A1,A2A,A2B和A3受体产生多种生理性效应。腺苷通过与细胞内G蛋白的不同耦合发挥不同的药理作用,A1AR和A3AR优先激活Gi/Gβγ蛋白以抑制腺苷酸环化酶(AC)的活性和环磷酸腺苷(cAMP)的产生。而A2AAR和A2BAR优先刺激Gs蛋白以激活AC的活性和增加cAMP积累,从而激活下游信号通路,促进基因表达。其他途径,如激活磷脂酶C(PLC)、促进蛋白激酶C(PKC)的表达,从而促进基因表达,也与之相关(腺苷受体信号通路如图2所示[8])。

体外和体内的实验表明,PDRN最相关的作用机制是参与腺苷A2AAR途径(如图3)[9]。除了与A2AAR的结合之外,PDRN还为“补救途径(Salvage Pathway)”提供核苷和核苷酸。受损或缺氧的组织通常无法进行DNA“从头”合成,在这种情况下,“补救途径”可以回收DNA和RNA分解产生的碱基和核苷,然后将回收的碱基转化为核苷酸并重新整合到DNA中,从而重新激活正常的细胞增殖。

Fig.3Schematic representation of the mechanism of action of PDRN: activation of A2 receptors and the "Salvage Pathway"[9]
2.2 PDRN的药代动力学
药代动力学(Pharmacokinetics,PK),即药物代谢动力学,主要研究体内药物浓度随时间变化的规律,涉及药物在体内的吸收(Absorption)、分布(Distribution)、代谢(Metabolism)、和排泄(Excretion)过程。药代动力学已成为临床前研究和临床研究的重要组成部分。
在大鼠中单次腹腔注射8 mg/kg PDRN后,对其药代动力学进行评价。注射后15 min观察到PDRN的可测量值,给药后1 h达到峰值,生物有效性可达90%。随后药物水平逐渐下降,注射6 h后仍可检测到PDRN(0.137 μg/mL)。PDRN的半衰期为3 h,不受用量的影响。PDRN不经肝脏代谢,主要是通过非特异性的血浆DNA核酸酶降解,或通过与细胞膜结合的核酸酶降解,从而形成单核苷酸和寡核苷酸。从药物动力学的角度来看,PDRN的降解导致了核苷和核苷酸的形成,可主要用于与腺苷A2AAR结合。PDRN片段随后在尿液中排出(约65%),在粪便中排出的程度较小。
给健康志愿者肌肉注射PDRN(5.625 mg)后,同样研究了其药代动力学,研究的结果与在实验动物中观察到的药代动力学曲线重叠:更具体地说,在~1 h达到峰值;半衰期~3.5 h,生物有效性为80%~90%[2]。
2.3 PDRN在骨再生中的应用及分子机制
骨再生是骨组织损伤或缺损后,重新形成形态与功能相同的骨组织的过程,是目前骨科研究领域的重点和难点问题之一。由于在临床上的巨大应用价值,近几年骨再生成为科研热点领域。在再植手术中,PDRN促进骨再生的能力得到验证[10-12]。2017年,一位进行左耳完全切除手术的76岁男性接受再植治疗并进行PDRN注射,耳朵几乎完全修复[13]。另外PDRN也被用于创伤性神经损伤的再生[14],一位创伤性颈椎骨折左C5神经根阻滞的患者接受PDRN治疗后,其运动无力和神经病性疼痛等均得到减轻。
PDRN对于骨再生的促进作用基于对成骨细胞(Osteoblast)的促生长机制(如图3)[9]。 Guizzardi等[10]研究了PDRN对体外培养的人成骨细胞的增殖和碱性磷酸酶活性的影响,结果表明,经PDRN(100 μg/mL)处理6天后,成骨细胞生长显著增加(+21%),在这个过程中伴随着碱性磷酸酶活性的增加。
最近的研究表明,血管生成在骨再生中发挥着重要作用。在这个问题中,PDRN发挥非常重要的作用,它能在骨形成过程中增强血管生成。Baek等[15]研究发现PDRN对血管生成有很好的促进能力,并作为腺苷A2AAR的激动剂发挥作用。随后,它加速了急性炎症的下调,并上调了血管生成因子(如血管内皮生长因子,VEGF)的产生,促进血管生成。PDRN被认为是成功再生血管化骨组织的合适的生物活性分子。
2.4 PDRN在伤口愈合和组织修复中的应用及分子机制
伤口愈合过程,是复杂和高度整合的过程,需要许多细胞类型的相互作用,包括炎症细胞、成纤维细胞、角质细胞和内皮细胞,以及生长因子和酶的参与。PDRN在伤口愈合和组织修复中发挥了积极作用[16],其基础研究成果在临床治疗中得到进一步验证[10,17-19]。
正常的伤口愈合通过4个重叠但不同的阶段进行:止血、炎症、增殖、成熟或重塑[20]。止血阶段是激活身体的紧急修复系统、血液凝固系统,有效阻止出血。炎症阶段是在趋化因子的作用下,中性粒细胞、单核巨噬细胞、淋巴细胞进入组织损伤区域清理坏死的细胞碎片、吞噬细菌,同时分泌细胞因子促进组织修复[21]。体内和体外研究表明,腺苷A2AAR激动剂可与Toll样受体激动剂通过共刺激诱导M2d型巨噬细胞释放血管内皮生长因子(VEGF)[22]。一旦伤口被清除,伤口进入阶段三,即增殖阶段。血管生成对组织的生长作用重大,VEGF是一种高度特异性的促血管内皮细胞生长因子,可以促进伤口愈合和组织修复。在糖尿病小鼠模型中,PDRN通过与A2AAR相互作用发挥其功能,PDRN(8 mg/kg(i.p),12 d)注射显著增强了VEGF及血管生成素-1(angiopoietin-1)的表达,从而促进伤口愈合。成熟阶段,胶原纤维重新组织,组织成熟或重塑。PDRN通过激活A2AAR来刺激Wnt/β-catenin信号转导,促进表皮生长因子(EGF)、胰岛素样生长因子-1(IGF-1)、转化生长因子-β(TGF-β)、血小板衍生生长因子(PDGF)和血管内皮生长因子(VEGF)的产生和分泌(如图3)[9],增加成纤维细胞的线粒体活性,参与组织重塑[23]。EGF和VEGF可通过调节细胞迁移促进组织修复[24];IGF-1和TGF-β在组织修复过程中的巨噬细胞-成纤维细胞串扰环节发挥作用[25];PDGF和IGF信号之间的协同作用可共同促进成纤维细胞的增殖,加速伤口愈合。
然而,一些疾病,如糖尿病、烧伤和缺血可能导致伤口愈合过程受损,其特点是伤口缺氧、氧自由基含量高、血管生成减少、胶原蛋白合成和组织减少(如图4)[26]。
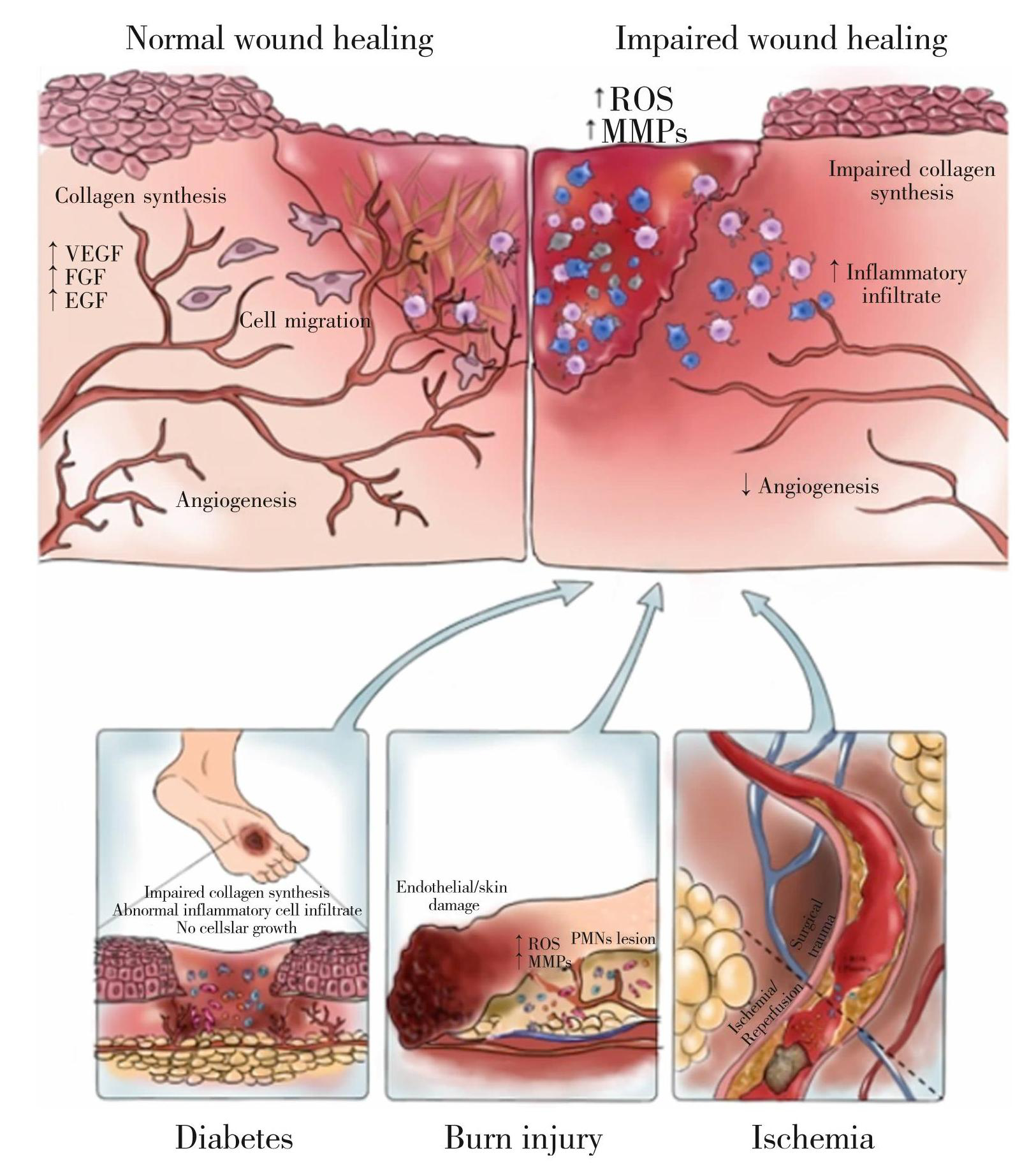
伤口愈合受损是糖尿病患者的主要临床问题,是所谓“糖尿病足溃疡”中下肢截肢的主要原因[27],糖尿病损害伤口愈合的确切机制尚不完全清楚,但可能包括炎症细胞反应异常、新生血管受损、胶原蛋白合成减少和蛋白酶水平增加(如图4)[26]。在细胞水平上,Ferguson团队证明了急性炎症细胞的增加、细胞生长的缺失以及伤口上表皮的迁移,同时伤口边缘的血管变窄或闭塞[28]。糖尿病患者的白细胞功能受损,糖尿病的代谢异常导致中性粒细胞和巨噬细胞向伤口的迁移失调,同时白细胞的趋化性降低,伤口感染的风险增加。多项研究探讨了PDRN在不同创面损伤中的作用,在糖尿病足溃疡[29-30]、压疮创面[31]、负压伤口[32]等治疗中,PDRN均可有效改善创口闭合,缩短愈合时间,并促进再上皮化。
烧伤是另一种与伤口愈合受损有关的疾病[33]。烧伤后,多形核中性白细胞立即侵入病灶,激起大量的氧自由基和蛋白酶的释放,将导致内皮细胞和皮肤损伤。自由基和蛋白酶的过度产生损害了一氧化氮(NO)的可用性以及生长因子的产生和释放。NO在皮肤伤口愈合过程中也拥有多种生物学作用,包括调节血管扩张、抗菌活性、细胞增殖、VEGF诱导的新血管生成、基质沉积和重塑。PDRN用于深层二度烧伤小鼠的治疗中,该药物的系统性给药增强了烧伤伤口的再上皮化,减少了最终伤口闭合的时间。PDRN通过减少炎症浸润和烧伤水肿,并通过刺激真皮和表皮再生、成纤维细胞增殖和新血管生成来改善烧伤伤口的愈合。PDRN还显示出明显的系统效应,它降低了多发性细胞因子肿瘤坏死因子(TNF-α)的血清水平,并增强了伤口VEGF、内皮型一氧化氮合酶(eNOS)、一氧化氮合成酶(iNOS)的表达和伤口NO的含量[34]。
另一种可能导致伤口愈合受损的疾病是缺血再灌注损伤,即血管出现堵塞造成血流的中断或部分中断,这部分的血管恢复到正常的血流后,导致这一部分供血区域的细胞或者组织出现损伤加重或新的损伤等现象。PDRN由于能够促进细胞迁移、生长和血管生成,并在受损的伤口愈合模型上减少炎症,已被广泛用于通过局部和全身给药来改善伤口愈合(包括体外、体内和临床研究)。目前,PDRN已经上市,它的耐受性良好,并在一些临床试验中显示出非常好的安全性。PDRN的抗缺血保护作用在脑缺血、急性缺血性肾损伤的动物模型中得到验证[35],但需要进一步开展临床研究。A2AAR已被指定为调节缺血损伤的治疗靶标,A2AAR在冠状组织中高度表达,促进平滑肌细胞中环磷酸腺苷cAMP的产生,进而促进平滑肌细胞肌松弛以及血管舒张,增加冠状动脉血流量[35-36]。在缺血再灌注诱导的小鼠急性肾损伤模型中,腹腔内注射PDRN(8 mg/kg)显著降低了肾小管损伤,在分子水平上,PDRN通过激活A2A受体显著增加了VEGF的水平,VEGF作为主要的血管生成因子,对缺血性损伤后的血管维持起重要作用[37]。
2.5 PDRN在再生医美中的应用及分子机制
再生医美,是一种通过再生医学技术,修复、替代或再生人体细胞与组织,同时应用医疗美容术方法来实现人体容貌、形态与机能的修复、再塑与提升的医美手段。在这场席卷全球的医美技术更迭浪潮中,PDRN是其中的佼佼者。2019年,一款称之为医美产品的“三文鱼针”(婴儿针)在医美界迅速走红,其主要成分就是PDRN。PDRN因成分与人体的DNA碱基组成几乎是一致的,因而没有免疫原性,用于人体无毒无副作用。目前,以PDRN为主要成分的医美产品在我国、韩国及意大利大量应用,主要用于皮肤再生、修复、抗老等医美护肤领域。
胶原蛋白在皮肤中发挥着非常重要的支撑作用,能够维持皮肤的紧致度和弹性,尤其是I型胶原蛋白,它是皮肤中含量最高的胶原蛋白,约占总胶原含量的90%。而随着年龄增长,人体胶原蛋白的合成量逐步降低,胶原蛋白流失的速度却维持不变甚至更快,自然胶原蛋白的总含量越来越少。研究显示,PDRN可促进胶原蛋白合成,抑制金属蛋白酶和弹性蛋白酶生成,发挥重塑细胞外基质,对抗皮肤老化的作用[38]。PDRN作为腺苷A2AAR激动剂,对A2AAR的刺激激活了Gs蛋白,通过腺苷酸环化酶导致cAMP上升,并激活了下游目标。MAPK-p38、PKA和CTGF都被证明能直接促进典型的β-catenin信号,而Fli1能抑制典型的β-catenin信号。Akt通过非经典通路激活β-catenin,也促进其转录活性。这些途径可以共同刺激细胞I型胶原和III型胶原合成(如图5)[39-40]。
皮肤衰老与氧化应激和紫外线慢性照射密切相关。研究表明,PDRN还有抗氧化和光保护作用。培养的人类皮肤成纤维细胞暴露在紫外线B(UVB)的辐射下会导致有害的光产物的积累,如环丁烷嘧啶二聚体(CPDS)。辐照后立即在细胞培养中加入PDRN,可降低CPDS的水平,激活p53蛋白,并增强DNA修复,这可能是由于触发了“补救途径”[41]。
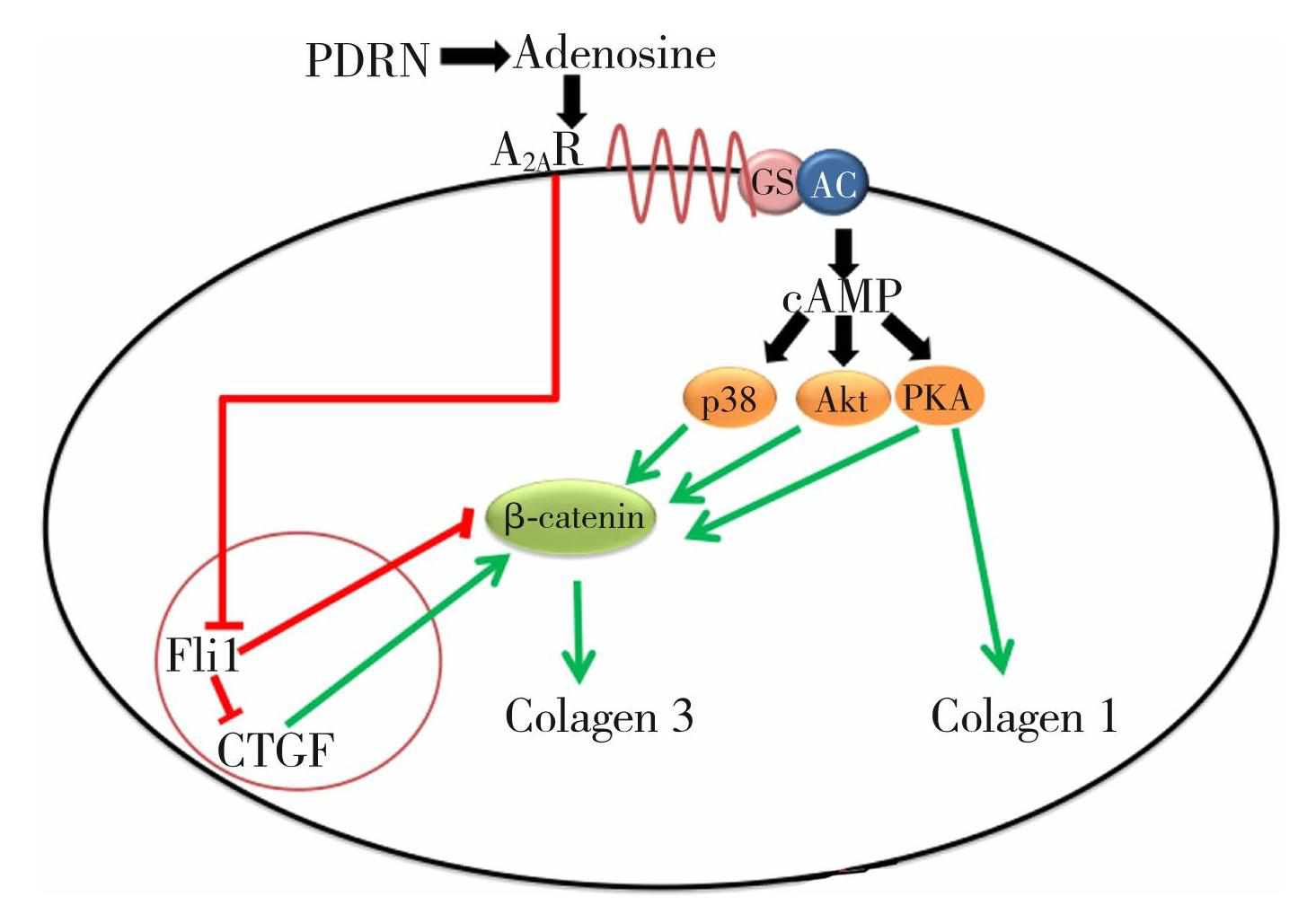
Fig.5Crosstalk between A2A receptors and Wnt/β-catenin signalling pathways in human dermal fibroblasts[39-40]
黑色素是肤色的决定因素,并可保护皮肤免受紫外线辐射引起的损害。然而,由于长期暴露在紫外线照射下,黑色素的过度生产和积累会导致各种色素沉着的皮肤病,如黄褐斑、斑点状色素沉着、雀斑、老年性色斑和炎症后色素沉着。黑色素生成受多个生化步骤的调节,主要由限速酶酪氨酸酶(Tyrosinases)的活性和表达来调节,酪氨酸酶相关蛋白TRP-1和TRP-2是另外两个主要的黑色素生成酶,而MITF作为黑色素合成调控网络的中心枢纽,调节黑色素细胞的生存、增殖和分化(如图6)[42]。
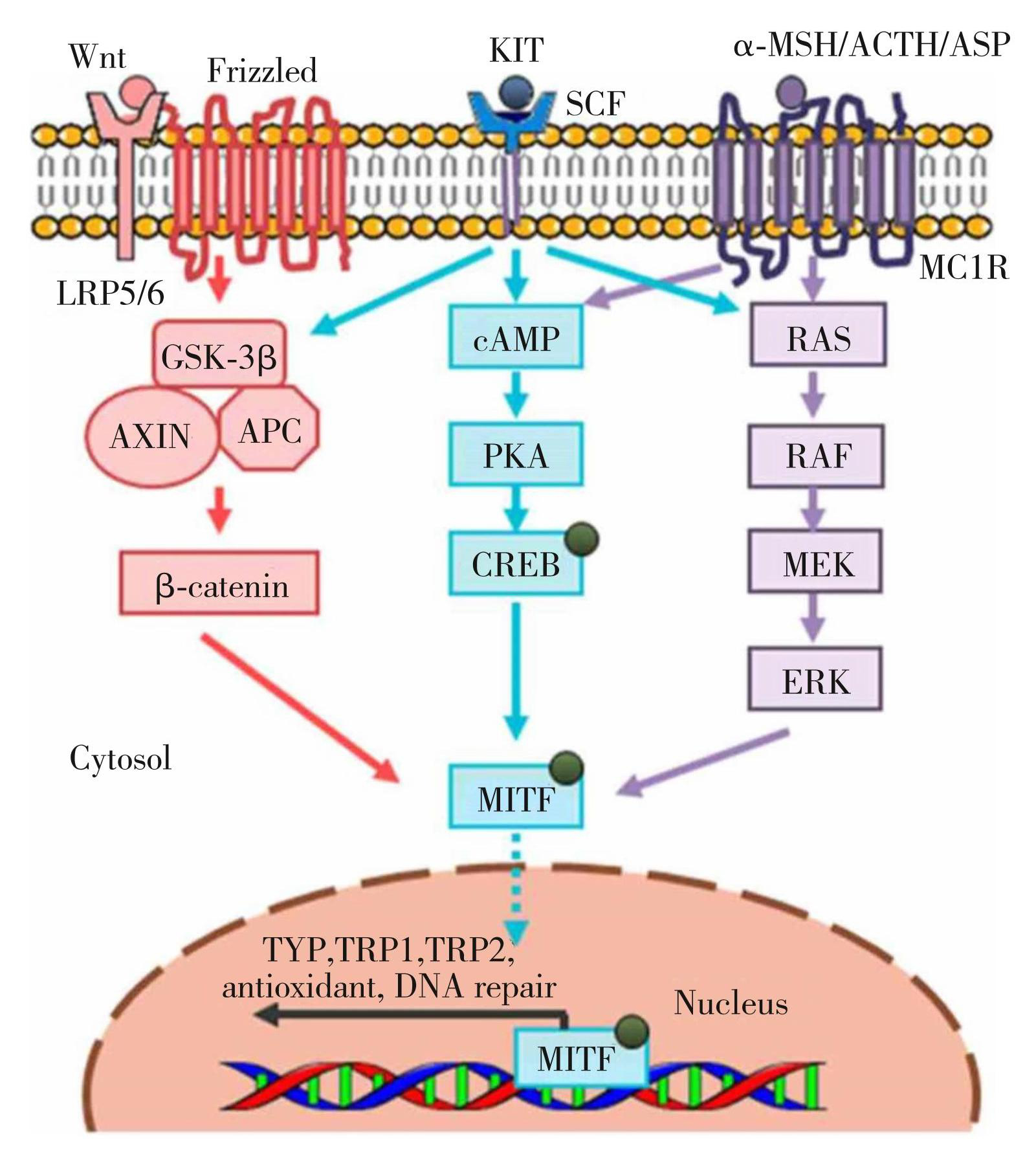
黑色素生成可由包括MAP激酶途径在内的多种信号途径调节,ERK信号的上调被证明可以下调黑色素的合成[43]。研究表明,PDRN在体外对黑色素生成具有调控作用,PDRN通过激活A2AAR,激活黑色素细胞中的MAP激酶途径来发挥其作用,导致了酪氨酸酶、TRP-1和MITF蛋白水平的下降,从而减少了黑色素的产生[44],起到美白淡斑的作用。
由于PDRN具有抗炎及改善组织微循环的作用,有研究证明有助于毛发的生长,改善雄激素性脱发[45],其具体机制还需要更深入的研究。PDRN强大的抗炎及修复作用,也可辅助治疗炎症性皮肤病。PDRN可以增强伤口修复,并加强成纤维细胞的增殖,修复皮肤屏障增强皮肤厚度,同时具有抗炎修复的作用,缓解肌肤炎症,因此PDRN在医学领域将有着巨大的潜能。
3 PDRN载药体系的研究进展
在大多数研究中,PDRN的给药模式仅限于皮内/肌内注射。由于PDRN半衰期短,患者必须每日注射,注射过程痛苦,给患者带来了不必要的负担。此外一般的给药方式,提供给患者的药物浓度不稳定,低于有效剂量或者超过最高耐受剂量,都不利于患者的治疗。因此如何将PDRN释放到伤口中也直接影响到治疗效果。
药物释放体系是将药物以预期的方式、一定的给药速度作用于患者的药物制剂,具有能在较长时间内保持稳定的给药速度、药物利用率高、减少给药次数、降低药物毒性等优点。药物的释放需要合适的药物负载载体。随着生物医学工程的发展,一些生物医学高分子材料被广泛应用于PDRN载体中。水凝胶、纳米材料及生物活性支架等的研究,改变了PDRN的给药策略,增强了PDRN的药理活性(如表2所示)。设计智能载体实现PDRN的时空可控输送,对临床应用具有重要意义。
3.1 水凝胶负载PDRN的研究
水凝胶是由水和交联聚合物组成的三维高分子复合体系,具有良好的亲水性、生物相容性、生物粘附性及可降解性等。水凝胶可作为一种优秀的药物缓释材料和可降解的细胞移植载体,近来广泛应用于药物释放和组织工程领域。
在组织工程领域,水凝胶因其独有的三维网络结构发挥独特的作用,其可以有效地促进创面的气体和液体交换,保持湿润环境,从而为创面的愈合提供良好的条件。此外,水凝胶含水量在70%~90%,作为伤口敷料既能促进伤口愈合,又减少了伤口感染的风险。这些特性使水凝胶成为伤口敷料的热门材料。已有多种天然聚合物制备成水凝胶,如藻酸盐、壳聚糖、透明质酸、纤维素、淀粉和明胶等。研究者们已成功将PDRN负载到不同的水凝胶中,如海藻酸盐、壳聚糖基及纳米纤维等水凝胶,实现了PDRN的可控性释放、逐步释放,提高了PDRN的生物有效性,从而避免了生物活性物质的浪费,并保证了后续治疗中的持续作用效果。
表2PDRN载药体系总结
Table2Summary of PDRN drug delivery system
目前,有两种水凝胶负载PDRN的方式。第一种是直接将裸露的PDRN包含在水凝胶中,这种方法主要依赖于核酸和水凝胶网络之间的物理化学相互作用,如静电相互作用、氢键和范德华力等。2016年,陈熹等[46]开发了封装PDRN的自组装sNAG纳米纤维水凝胶,用于治疗慢性软组织溃疡,通过释放防御素,抑制感染;释放生长因子,促进细胞增生和迁移,促进新生血管生成,从而治疗组织溃疡。然而,这种方法存在释放速率不可控等缺点。
第二种是通过封装纳米材料来将PDRN加载到水凝胶中,即纳米复合水凝胶。由于纳米颗粒自身具有独特的物理化学性质,引入了纳米材料的水凝胶可以增强自身机械性能,更利于药物释放,或者被赋予诸如外源刺激响应等功能来进一步实现药物的可控释放。有研究受基因载体的启发[47],合成了负载PDRN的CaCO3纳米颗粒(PCNP),并制备了含有PCNPs的均匀多糖基水凝胶(Gel@PCNPs)。在Gel@PCNPs应用于伤口治疗时,多糖基水凝胶发挥其固有的有效性,为创面愈合提供一个合适的环境,适用于各种不规则伤口(如图7(a))[47]。

图7水凝胶负载PDRN的示意图
Fig.7Schematic diagram of hydrogel loaded PDRN: (a) preparation and application of Gel@PCNPs[47]; (b) preparation and application of nanocomposite hydrogel PDRN@Gel[48]
在最新研究中,研究者提出了一种利用外源刺激从水凝胶中时空可控地释放PDRN的方法。利用改性的短链壳聚糖(SCS)作为大分子交联剂,与二硫化钼纳米片(MoS2)和N-异丙基丙烯酰胺(NIPAAm)共聚形成复合水凝胶。其中,甲基丙烯酸甲酯(GMA)修饰的SCS可通过与NIPAAm(称为p(NIPAAm-co-GMA/SCS))共聚而集成到聚合物链中(如图7(b))[48]。SCS成分在伤口敷料中充当止血剂和抗菌剂。该纳米复合水凝胶,在近红外光的远程刺激下,可实现PDRN的“时空可控”释放,打破了以药物投递容易降解和难以递送的困境。纳米复合水凝胶具有使用方便、黏附性好、抗菌性能增强等优点,提高了创面愈合效率。
3.2 生物活性支架负载PDRN的研究
支架材料在组织工程与再生医学中扮演着至关重要的角色,基于生物支架方法的主要挑战是需要加入支架植入物调节炎症反应以及促进移植后的血管形成,因此,将支架与活细胞或生物活性分子结合,形成“组织工程结构”,在有充足的血液供应的情况下可以促进组织修复或再生。基于PDRN的药理特性以及支架材料的性质,研究者们将PDRN整合到支架中,以促进组织修复和再生。
2021年,Ko等[49]研发了一种多孔气动微挤压复合支架(PME),它是由聚乳酸-乙醇酸共聚物(PLGA,P)、氢氧化镁(MH,M)和猪肾源性脱细胞细胞外基质(kECM,E)组成,并用PDRN、肿瘤坏死因子-α(TNF-α)/干扰素-γ(IFN-γ)诱导的间充质干细胞(MSCs)来源的细胞外囊泡(TI-EVs)对其进行功能化修饰,以促进功能性肾组织的再生和维持其功能(如图8(a))。支架中携带的PDRN,可以准确地控制释放动力学实现适当的管理。PDRN和TI-EV的组合在细胞增殖、血管生成、纤维化和炎症等再生过程中表现出明显的协同作用。此外,与现有的PME支架相比,PME/PDRN/TI-EV支架在部分肾切除小鼠模型中诱导了有效的肾小球再生并恢复了肾脏功能。因此,这种结合了PDRN和TI-EV的生化线索和含有MH和kECM的多孔PLGA支架的生物物理线索的综合生物活性支架可以作为一个先进的组织工程平台用于肾脏组织再生。
研究者们将PDRN应用于骨再生支架中。众所周知,骨修复通常比其他组织需要更长的时间,理想的生物医学工程支架应该具有成骨诱导特性。研究者用氢氧化镁(MH)和骨细胞外基质与PLGA支架(PME)结合,以提高抗炎性、机械性、骨传导性,将PDRN和骨形态发生蛋白2(BMP2)一起形成的生物活性纳米复合物(Nanocomplex,NC)固定在PME支架,形成骨再生支架(如图8(b))[50]。PDRN和BMP2在血管生成和骨再生中提供了协同能力。这种PME/NC混合支架在抗炎,血管生成和成骨方面获得了出色的性能。这种先进的PME/NC支架表明了一种骨再生的综合骨移植替代品。
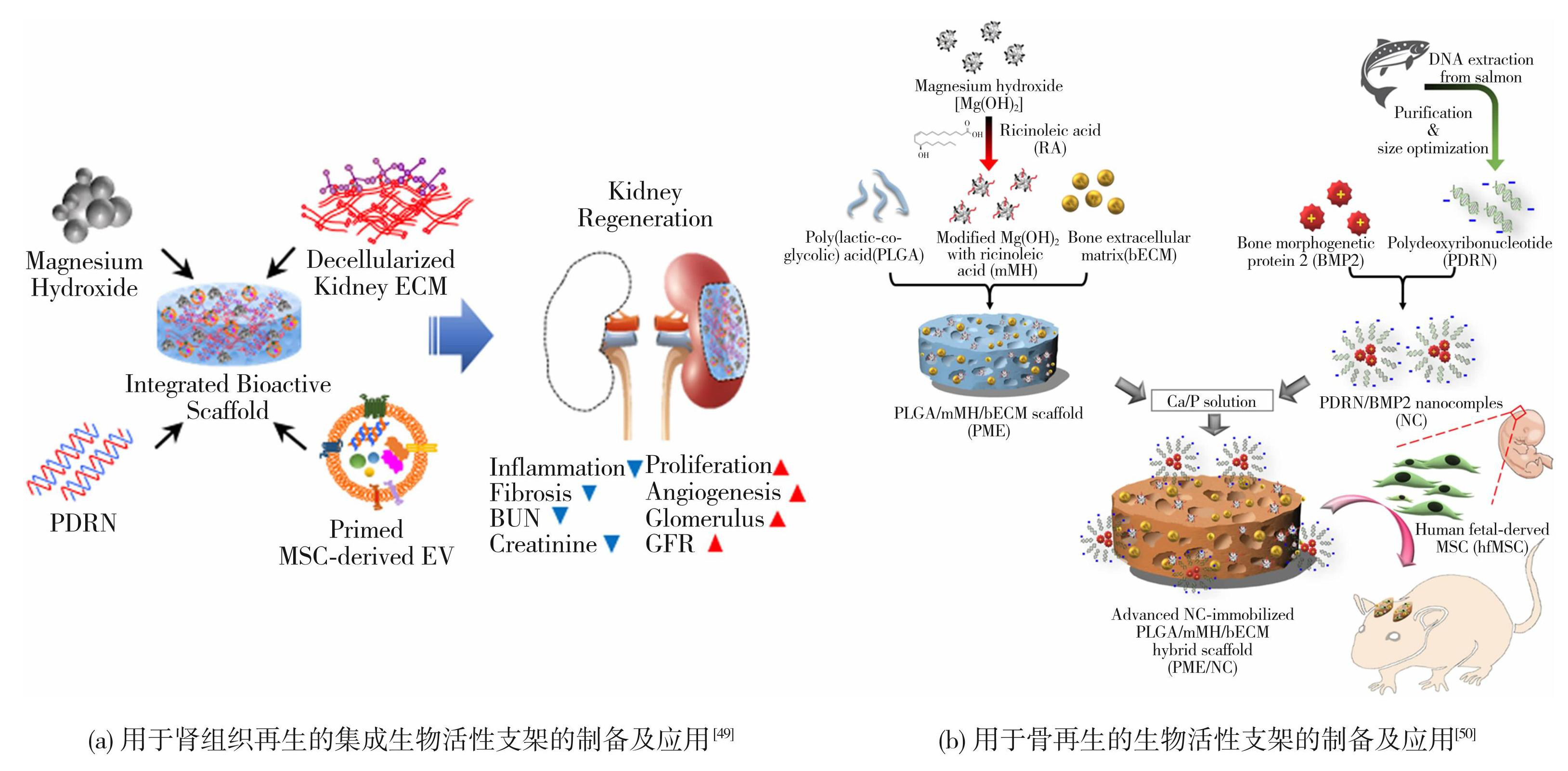
图8生物支架负载PDRN的示意图
Fig.8Schematic diagram of bioprosthesis loaded PDRN: (a) preparation and application of an integrated bioactive scaffold for renal tissue regeneration[49]; (b) preparation and application of bioactive scaffolds for bone regeneration[50]
4 PDRN/PN及其类似物
基于PDRN在生物医学与药物可控释放领域的应用潜能,PDRN的升级产品也得到了快速的发展。多核苷酸(Polynucleotide,PN)是在PDRN基础上继续优化的结构,PN是PDRN的二次精制,与PDRN一样都是国际认可的细胞与组织再生促进剂。PDRN/PN的类似物(PDRN/PN analogues,PNAs)主要是以人工合成,目前PNAs的相关医疗产品作为III类医疗器械,其耐受性和使用安全性已通过医疗器械CE认证MDD指令(93/42/EEC)要求的体外和体内生物相容性测试确认。对PDRN的升级产品PN及其类似物进一步深入研究,有利于PDRN突破性应用潜能的挖掘。
4.1 PN及其与PDRN区别
PN是由相同的碱基(嘌呤/嘧啶碱)-糖(核糖/脱氧核糖)-磷酸亚基组成的高分子量聚合物链,亦有解释是由核苷酸单体通过共价键相互连接的组合物,一般一个多核苷酸分子由14个或14个以上的核苷酸单体组成。而PDRN是脱氧核糖核苷酸,长度范围为50~2 000 bp。PN也是从天然来源鱼精中提取的,对比PDRN,PN是由更高阶聚合分子组成的,相当于PDRN的二次精制,拥有更加稳定的长链分子结构,属于大分子结构。因此PDRN属于PN的一种(有研究称之为DNA PN[51]),两者在组成上的异同点如表3所示。
表3PN和PDRN的异同点
Table3Similarities and differences of PN and PDRN

4.2 PN的功能研究
PN的酶解衍生物(简单核苷酸、核苷、含氮碱基)在细胞外环境中存在,是有利于细胞再生和代谢活动的有益营养底物[52]。Giarratana和Vanelli等[53-54]研究发现,PN通过定向和配位水分子形成三维凝胶,经过酶裂解,逐步释放水分子和较小的寡核苷酸,能够保持较长时间的保湿和粘弹性特性。Baek等[55]研究表明,在处理体外骨关节炎模型中,PDRN和PN均可通过降低促炎细胞因子和趋化因子的表达,表现出抗炎特性。具体地,PN处理比PDRN处理表现出更强的抗炎反应,具体机制有待进一步研究。Bitto等[51]研究发现,0.75%的PDRN/PN凝胶处理牙周炎模型大鼠后,改善了严重的炎症浸润现象并降低了炎症和凋亡蛋白的表达水平。Guizzardi等[56]发现PDRN/PN凝胶(20 mg/mL,溶于生理盐水)处理大鼠胫骨创伤,组织学上观察到损伤明显改善。通过动物研究和临床试验的数据,验证来自Pharmaresearch公司研制的一款名为Rejuran ®的产品(由纯化的PN制成的新型填料产品,20 mg/mL)对鱼尾纹的持久性、有效性和安全性,结果表明Rejuran ®作为一种新的再生填充剂,可以有效地减少皱纹[57]。
4.3 PN的类似物研究
由于PDRN属于PN的一种,我们以PN的类似物来描述。PN的类似物(PNAs)主要是以人工合成为主,具有修饰的聚合物主干(磷酸基和糖基)和/或修饰的核酸碱基,已被用作天然核酸的模型聚合物。
PNAs最显著的特点是能够识别特定结构的分子。已经观察到PNAs通过氢键与天然核酸或其他互补碱基的PNAs特异性结合。通过最近的合成研究,PNAs的结合模式变得更加精细,使其更接近于自然核酸。相应的PNAs的应用也广泛发展。
4.3.1 液相色谱法
在许多合成的PNAs中都观察到特定的碱基通过氢键与互补碱基配对,PNAs的这种互补碱基识别能力可应用于高效液相色谱分离寡核苷酸。已有的研究中,成功地分离出了含有核酸碱基的低聚乙亚胺衍生物[58]
4.3.2 基因治疗
因PNAs较高的亲和力、较强的结合特异性以及在细胞内无毒性,PNAs成为基因治疗药物的设计和开发的强有力的候选。可通过抑制复制/转录/翻译、人工启动转录、特异性激活基因的分离来设计基因治疗策略。Kolevzo团队首次证明了使用PNAs技术通过下调恶性疟原虫基因表达可治疗疟疾感染[59]。
4.3.3 纳米技术
PNAs纳米颗粒是一种很有前途的自组装系统,它们被用作DNA纳米结构组装的连接器。利用PNAs连接器控制组装,合理设计蛋白质和多肽工程的纳米支架也可以将蛋白质和氨基酸复合物组装成3D DNA纳米笼。PNAs探针也可以纳入纳米通道,构建检测和鉴定DNA分子的传感平台[60-61]。
4.3.4 疾病诊断
PNAs已被广泛用于各种疾病的检测。Rahman等[62]开发了使用PNAs探针检测登革热病毒的无标记比色法。Guo等[63]展示了一种电化学方法,利用PNAs检测与阿尔茨海默病相关的载脂蛋白中的单核苷酸错配。
4.3.5 食品分析
PNAs通过检测转基因生物和评估隐藏的过敏原成分和微生物病原体的存在来确定食品成分。使用PNAs微阵列技术检测转基因大豆,以确保其作为食品的安全性[64]。PNAs通过检测革兰氏阳性李斯特菌用于李斯特菌的检测和食品生产环境的常规监测[65]。
4.3.6 荧光原位杂交技术(FISH)
采用多肽核酸探针FISH法快速检测呼吸道常见细菌中的嗜麦芽窄养单胞菌、血液和腹膜液体标本中的念珠菌。PNAs-FISH方法与传统细菌学方法相比,至少节省2 d的检测时间。第二代PNAs-FISH方法通过新的探针设计和内置控制被称为QuickFISH,它可以根据细胞的荧光颜色在20~25 min内识别物种,而不需要清洗或安装载玻片。可以利用肠球菌QuickFISH法直接从血液培养瓶中快速检测肠球菌[66]。
4.3.7 微阵列
PNAs的序列特异性和选择性杂交特性在PNAs微阵列的发展中具有巨大的潜力。PNAs被广泛应用于多种基于核酸的生物传感器中,具有较高的检测灵敏度。PNAs芯片技术在病原检测、单核苷酸多态性(SNP)检测、疾病相关miRNA表达监测等方面都有应用[67]。
5 总结与展望
生物材料是生物医学工程研究的关键要素之一,PDRN是有效和安全的生物材料,被越来越多地用于新的疗法和技术,开发人工生物替代系统,支持、修复或替换受损的细胞、组织和器官。本文对PDRN及其类似物的化学、医学/药学、工程技术与应用潜能等方面的内容进行全面的总结(如图9)。但是,要挖掘PDRN更加突破性的应用潜能,在以下几个方面还有待进一步的深入研究。

图9PDRN的生物医学研究内容示意图
Fig.9Advances in biomedical research on PDRN
1)目前PDRN的提取来源主要是大马哈鱼或虹鳟鱼的精子细胞,但其只在繁殖季节产卵,限制了来源。除此之外,人类、植物也被用做PDRN的提取原料。韩国有几家公司正试图从草莓、西兰花和芦荟等植物中提取PDRN。但是当从植物中提取PDRN时,需要额外的过程来分解植物的细胞壁,效率远低于动物来源。考虑到伦理问题和成本效益,海洋生物是PDRN的最好来源,这就需要确定更具成本效益的提取源,如海星、藻类和未经研究的海洋生物。在后续的研究中,用更优异的原料,更简易的提取工艺,提取纯度更高的PDRN将是亟需解决的难题。
2)在药物可控缓释方面,目前已有研究开展水凝胶、纳米纤维及生物活性支架等形式的给药方式,在动物模型中得到验证,并表现出独特的优势,但仍存在难以临床应用的难题。进一步开展利于PDRN缓释、有助于伤口愈合、且具有良好的生物相容性的PDRN缓释载体,应用于临床,将是生物医学与生物工程领域的研究重点。
3)PDRN具有组织修复、抗炎、促进伤口愈合、刺激血管生成、抗缺血损伤等多种药理活性。PDRN的药理特性给药物设计提供了的新的方向,用于治疗由不同病理状况引起的伤口愈合不良。PDRN药物上市5年后,销售超过300 000份,证实了该药物的出色的安全性,代表了药物治疗的新进展。此外,目前商业化生产的PDRN产品提供的质量浓度为1.875 mg/mL,但实验浓度一直小于此浓度,高于此浓度的研究瓶颈还没有突破,还需进一步的研究,为后续的临床应用浓度探索做铺垫。
4)PDRN的结构基础是两千万种复杂的DNA序列组合,而有效片段需要采用当今国际最前沿的生物提取技术和基因芯片筛选技术才能够完成,同时,在提取过程中,针对不同的生物反应要做出及时、科学的处理。因此,解锁PDRN有效片段在生物医学与生物传感等研究领域显示出巨大的应用前景,突破PDRN有效片段的壁垒,也成为PDRN未来研究探索的重中之重。
