摘要
为探究团簇MMoS4内部的催化析氢机理及性能,本研究以密度泛函理论为基础,在B3LYP/def2tzvp水平下运用Gaussian09软件分别在1、2、3、4重态下对团簇MMoS4的初始构型进行优化计算,得到8种稳定构型,其中的5种稳定构型在吸附氢原子后能够稳定存在。对团簇MMoS4的HOMO轨道图与水分子的LUMO轨道图、构型的前线轨道能级差以及结合能等进行了分析比较,结果表明:第1步析氢反应时,构型2(2)、2(4)、3(3)表现出更好的催化活性,表明其在与水分子发生反应时易于吸附氢原子,电子能够更好地完成转移;在第2步解吸反应时,水中氢原子均吸附在团簇的Mo原子上,表明Mo原子是团簇析氢反应过程中的潜在活性位点,构型2(2)、3(2)在第2步解吸反应时展现出优异的析氢性能并更快地将氢气析出;综合分析认为,在团簇MMoS4中构型2(2)的催化析氢能力最佳。
Abstract
To investigate the catalytic hydrogen evolution mechanism and performance within the MMoS4 clusters, this study is based on density functional theory. Using the Gaussian09 software at the B3LYP/def2tzvp level, optimization calculations were performed on the initial configurations of MMoS4 clusters in their singlet, doublet, triplet, and quartet states, resulting in eight stable configurations, of which five remained stable after hydrogen adsorption. The HOMO orbital maps of the MMoS4 clusters were compared with the LUMO orbital maps of water molecules, as well as the frontier orbital energy level differences and binding energies of different configurations.The results indicated that in the first hydrogen evolution step, configurations 2(2), 2(4), and 3(3) exhibited superior catalytic activity, suggesting their enhanced ability to adsorb hydrogen atoms and facilitate electron transfer during interactions with water molecules. In the second desorption step, hydrogen atoms were found to be adsorbed on the Mo atoms of the clusters, indicating that Mo atoms are potential active sites during the hydrogen evolution process. Configurations 2(2) and 3(2) demonstrated excellent hydrogen evolution performance and a faster release of hydrogen in the second desorption step.Collectively, the analysis suggests that configuration 2(2) exhibits the best catalytic hydrogen evolution capability within the MMoS4 clusters.
目前,世界各国对能源[1-3]、环境保护高度重视,研究人员迫切希望找到环境友好的清洁能源来代替化石能源。氢[4-5]具有的可再生、高能量、清洁的特点受到学者们广泛的关注。Yang等[6]在Ti网格上合理设计并制备出晶态Ni(OH)2-非晶态NiMoS界面的新型Ti@Ni(OH)2-NiMoS异质结构,通过酸性条件实验发现,非晶态NiMoS提供了丰富的活性位点,并允许快速的电子转移速率。Huang等[7]研究证实,在长方体阵列(N-NiMoS)中,N的掺杂促进了电子输运,提高了电子导电性,其中分层N-NiMoS性能更加优异,从而使催化剂具备更为优异的催化析氢活性。Ni-Mo基材料因其在环境中具有良好的耐腐蚀性,故在析氢电催化领域被作为Pt/C贵金属催化剂的潜在替代品。Yuan等[8]制备了NiMo非晶镀层,Ni-Mo非晶材料在NiMo(pH10)表现出最高的催化活性,是一种高效且具有成本效益的HER催化剂。Ma等[9]制备了Mo-NiMo/NF材料,其在Pη10=71 mV下表现出优异的电催化性能,且在碱性水电解质中具有出色的稳定性。Zhou等[10]利用水热法,在乙二醇溶剂中合成了Co-Mo-S纳米结构,其具有优异的电催化活性,该电催化剂的优异HER(析氢反应)性能可归因于Co-S和Mo-S的电子相互作用、良好的电导率以及高的比表面。Wang等[11]提出在MoS2中加入 Co、L-半胱氨酸、磷钼酸,研究发现CoS2与MoS2具有协同催化作用,促进Co-Mo-S催化剂的HER活性。Ren等[12]在碳纤维上制作了高性能无定形的CoMoS纳米片,当作为HER电极时,其在磷酸盐缓冲盐水中表现出显著的活性。Aslan等[13]用简单的热注射方法合成了Mo基三元难熔金属硫化物(MMoSx;M=Fe, Co, Ni和Mn),利用紫外光谱法测试了其析氢动力学,发现Mo基三元难熔金属硫化物表现出优异的催化析氢活性。Huang等[14]制备了双金属Co-Mo硫化物复合材料,热解后在整个非均相复合材料中产生更均匀分散的活性位点,同时,由于复合材料中Co-Mo-S纳米粒子活性位点和N,S的掺杂协同效应,使得优化的双金属复合材料CoMoS在HER方面表现出显著的性能。Morozan等[15]利用热处理方法获得了铁钼硫化铁材料,并将其与碳纳米管(CNTs)结合,研究发现,在酸性环境下其表现出优异的析氢反应活性。Wang等[16]合成了负载在FeMoSx纳米片的介孔g-C3N4(FeMoSx/mpg-C3N4)材料,其具有大量的多孔通道,促进了电子的转移,增加了活性位点,且光催化析氢速率显著提高,为设计高效的光催化系统提供了一种新的思路。Chang等[17]基于第一性原理,利用局域密度近似下的平面波赝势法研究了高压下单氮化钽(TaN)的结构和力学性能,结果表明,TaN在3个阶段的弹性性能与压力密切相关。而六边形的h-TaN是所有考虑相中最不可压缩的,这表明TaN的h相是超不可压缩硬材料的潜在候选结构之一。Chang等[18]采用第一性原理密度泛函理论(DFT)在广义梯度近似(GGA)和局部密度近似(LDA)下研究了固体硝基甲烷在压力下的结构、电子和弹性性质,且所得的基态结构性质与已有的实验和理论结果一致,此外,该研究还预测了固体纳米材料的弹性常数及其与压力的关系。Qiu等[19]基于密度泛函理论对混锌Cr∶AlAs的空间分布和伴生磁性进行了广泛的研究,结果表明,在取代Al和间隙位置上形成的嵌入Cr团簇会导致Cr∶AlAs的局部结构和磁性发生很大的变化。Zhao等[20]研究了铁磁半导体合金Al1-xCrxAs的结构稳定性和半金属铁磁性,计算表明,当Cr含量低于30%时,半导体合金相更稳定。
目前,由于学者对Co-Mo-S体系、Ni-Mo-S体系及Fe-Mo-S体系的研究大多停留在宏观实验角度,微观理论方面的研究较少,因此本文将通过微观理论研究,以期为宏观实验提供理论指导和依据。
1 计算方法与析氢机理
1.1 理论和计算方法
以密度泛函理论[21]为基础,利用Gaussian09程序以B3LYP泛函和def2tzvp基组同时在1、2、3、4重态下[22]对依据拓扑学原理设计出的团簇[23-26]36种初始构型进行优化,并对S原子加极化函数。对所得到优化后的构型,排除相同构型和因虚频而不能稳定存在的构型后,确定8种构型。相关运行以及计算均在计算机上完成。
1.2 析氢反应机理
本文以团簇MMoS4(团簇MMoS4用N来表示,N-Hads为吸附氢原子的团簇)为对象模拟催化水解时的析氢反应机理,该团簇的析氢反应机理主要分以下2个步骤:
第1步,
第2步,该反应步骤存在两种反应途径,具体如下:
2 结果与讨论
2.1 团簇MMoS4稳定构型
最初设计团簇NiMoS4、CoMoS4、FeMoS4初始构型主要为平面型、四角双锥型以及五棱锥型,而后通过改变不同原子的相对位置,最终确定了36种有可能存在的构型。对所得到的稳定构型排除相同构型和因虚频而不能稳定存在的构型后,最终得到8种平面型和类平面型,其中四重态1种、三重态3种,一、二重态各2种。以能量最低的构型1(3)作为基准,依据相对能量的高低,将这3种体系的稳定构型从小到大进行排序。上角标括号里的数字代表重态,构型后括号里的数字表示能量。由图1可以看到,只有3(2)为类平面型,构型2(4)、4(3)为平面六边形,构型1(3)、1(1)、2(2)、3(3)、4(1)为中心带一个原子的平面五边形;构型3(2)以S5原子为锥顶,Co1、Mo2、S3、S4、S6 5个原子为基准面构成;构型2(4)、4(3)分别是以Co1、Mo2、S3、S4、S5、S6 6个原子和Fe1、Mo2、S3、S4、S5、S6 6个原子为基准面所构成的平面六边形;构型1(3)、1(1)以Ni1原子为中心,Mo2、S3、S4、S5、S6 5个原子为基准面构成平面五边形;构型2(2)以Co1原子为中心,Mo2、S3、S4、S5、S6 5个原子为基准面构成平面五边形;构型3(3)、4(1)均以Fe1原子为中心,Mo2、S3、S4、S5、S6 5个原子为基准面构成平面五边形。平面型占据主要态,并且较大一部分构型优化后都以平面型存在,说明平面型更为稳定。

图1团簇MMoS4的稳定构型图
Fig.1Stable configuration diagram of cluster MMoS4
2.2 热力学稳定性
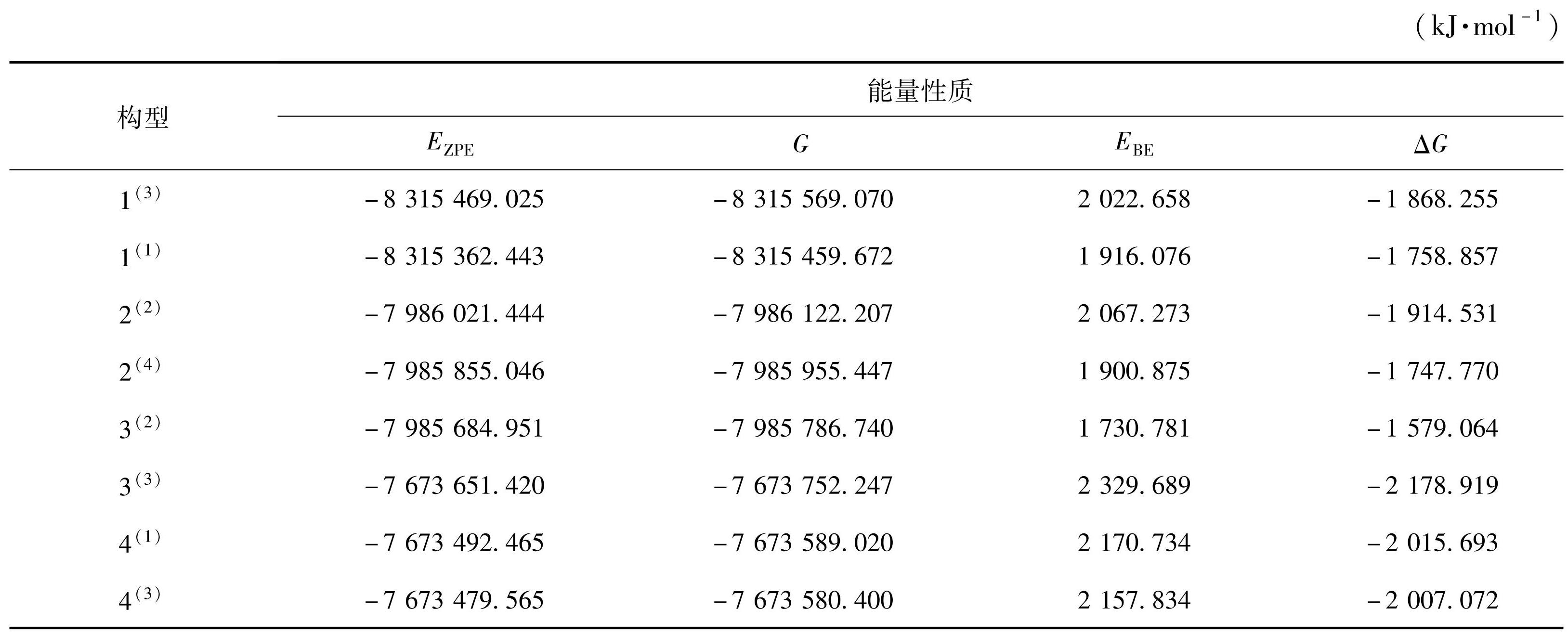
热力学稳定性在一定程度上会影响团簇MMoS4催化水解析氢反应,因此本文将对这8个稳定构型的热力学稳定性进行研究。表1为团簇MMoS4的4个能量参数,其中校正能(EZPE)以及吉布斯自由能(G)的数据在优化后可直接得到,而结合能(EBE)和吉布斯自由能变(ΔG)通过以下公式计算得出。
(1)
(2)
其中: EZPE(Ni)=-3 957 097.758 kJ/mol,
EZPE (Co) =-3 627 605.561 kJ/mol,
EZPE (Fe) =-3 314 973.122 kJ/mol,
EZPE (Mo) =-178 347.1828 kJ/mol,
EZPE (S) =-1 044 500.357 kJ/mol,
G (Ni) =-3 957 141.767 kJ/mol,
G (Co) =-3 627 648.628 kJ/mol,
G (Fe) =-3 315 014.279 kJ/mol,
G (Mo) =-178 390.4207 kJ/mol,
G (S) =-1 044 542.157 kJ/mol。
在团簇NiMoS4(构型1(3)、1(1))、CoMoS4(构型2(2)、2(4)、3(2))、FeMoS4(构型3(3)、4(1)、4(3))3个体系中,各自体系的吉布斯自由能变和结合能表现出相反的变化趋势,而后,这些构型的稳定性变化就会不同。此外吉布斯自由能变均为负值,容易自发形成,且吉布斯自由能变和结合能总体变化波动不大,稳定性变化也不大。通过能量最低原理可知,校正能越低则代表该构型越稳定,在图1所示的8个稳定构型中,构型1(3)的稳定性最好,构型4(3)的稳定性最差。吉布斯自由能变越小,说明构型越容易自发形成。由此可见,在团簇NiMoS4中,构型1(3)最容易自发形成,且校正能最小,稳定性最好;在团簇CoMoS4中,2(2)最容易自发形成;在团簇FeMoS4中,3(3)最容易自发形成。结合能越高,说明热力学稳定性越好。在团簇NiMoS4、CoMoS4、FeMoS4中,构型1(3)、2(2)、3(3)为其体系中热力学稳定性最好的构型。将这3种体系8种稳定构型的热力学稳定性进行排序,团簇NiMoS4中:1(3)>1(1);团簇CoMoS4中:2(2)>2(4)>3(2);团簇FeMoS4中:3(3)>4(1)>4(3)。现阶段来看,从热力学角度出发,团簇NiMoS4热力学稳定性较好,团簇CoMoS4的热力学稳定性次之。
表1团簇MMoS4优化构型的能量性质
Table1Energy properties of cluster MMoS4 optimized configuration
3 团簇MMoS4析氢性能分析
3.1 团簇MMoS4吸附氢原子性能的研究
3.1.1 团簇MMoS4-HOMO与水分子-LUMO图研究
上世纪50年代日本化学家福井谦一提出了前线轨道理论[27],指出一个化学反应能否发生取决于能量最高的占据轨道HOMO和能量最低的未占据轨道LUMO。团簇MMoS4析氢反应的第一步是要形成N-Hads模型,即电子从每个稳定构型的 HOMO轨道转移至水分子的LUMO轨道的过程,导出团簇MMoS4及水分子的前线轨道图如图2所示,其中,因为单重态构型无未成对电子,故不必分开作图。图2中各原子附近均存在阴影区域,黑色(深色)区域所形成的面积代表轨道波函数负相位,白色(浅色)区域面积代表轨道波函数的正相位。当电子在阴影区域出现时,其波函数形成离域空间,为析氢反应最为活跃的部分,离域空间中电子出现的概率越大,则电子的流动越剧烈。
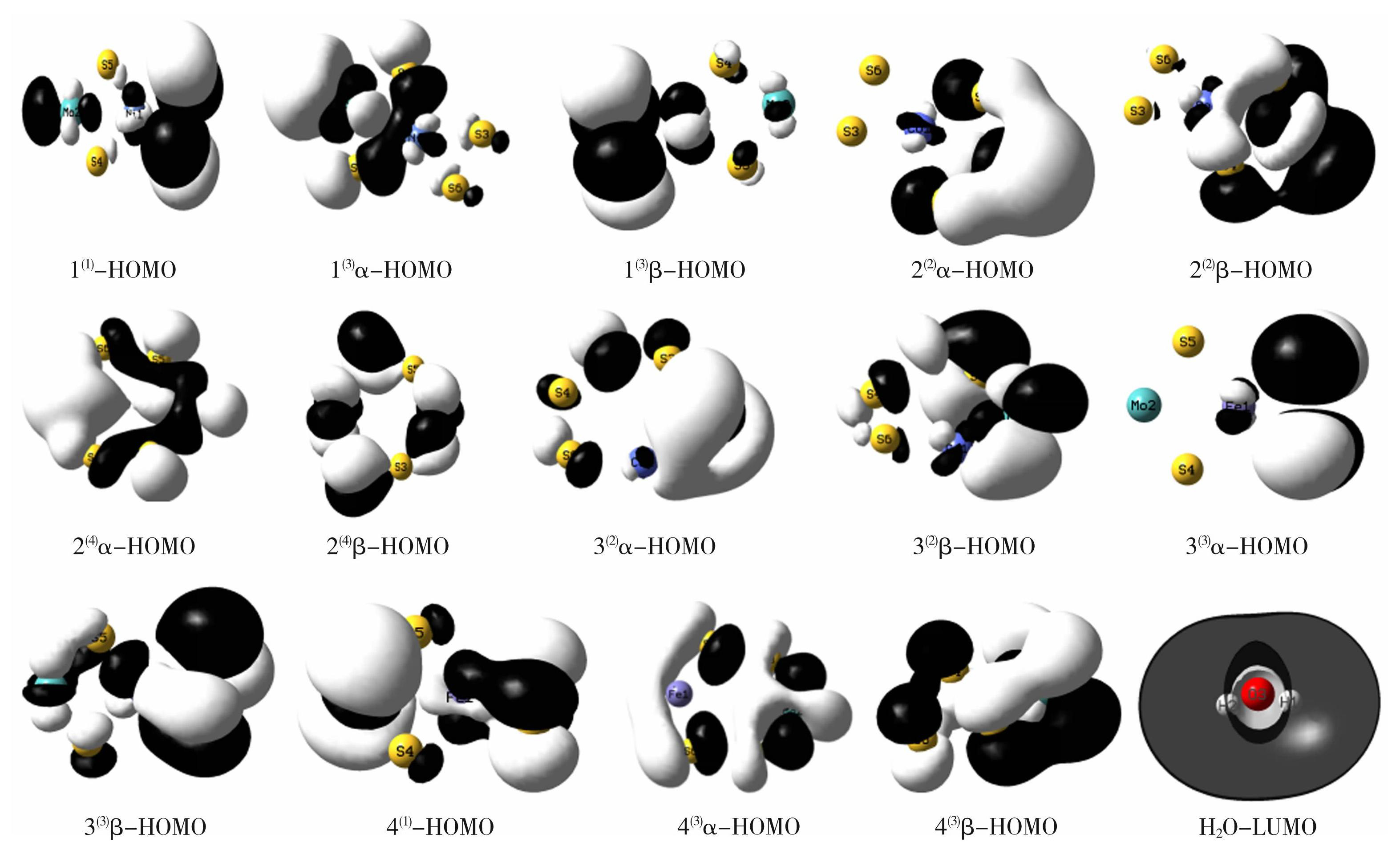
图2团簇 MMoS4-HOMO与水分子-LUMO轨道图
Fig.2Cluster MMoS4-HOMO and water molecule-LUMO orbital diagram
由水分子的LUMO轨道图可以看出,其几乎均被波函数为负相位的深色区域所包围,且水分子深色区域面积要远大于浅色区域面积,这说明水分子LUMO与团簇MMoS4中各稳定构型HOMO轨道深色区域的负相位更容易发生反应,形成稳定的过渡态,更易于水分子与团簇之间进行电子转移,达到吸附H原子的目的。观察分析图2中MMoS4的HOMO轨道图发现,每个稳定构型的α-HOMO、β-HOMO轨道图深色以及浅色面积大小、形状互不相同、重叠重度各异,说明这些优化后的构型与H2O之间作用的难易程度也不同。在团簇NiMoS4中,构型1(1)-HOMO和1(3)β-HOMO轨道图的深色区域面积和浅色区域面积相近、重叠性较好,均对析氢反应有所贡献,因此,与LUMO 轨道波函数正相位或负相位的物质都能进行较好的反应。构型1(3)α-HOMO轨道图的深色区域面积小于浅色区域面积,说明其不易与水分子LUMO轨道进行重叠,在反应时活化能高、活性低,因而不易吸附H原子。在团簇CoMoS4中,构型2(2)β-HOMO轨道图的深色区域部分要明显大于其浅色区域部分,说明其反应时活化能较低,更容易与水分子发生反应;构型2(2)α-HOMO、2(4)α-HOMO、2(4)β-HOMO、3(2)β-HOMO轨道图的深色区域部分和浅色区域部分相近、重叠性较好,均可与水分子发生反应;构型3(2)α-HOMO轨道图的深色区域部分小于浅色区域部分,说明其不易与水分子反应,不易吸附H原子。在团簇FeMoS4中,构型3(3)α-HOMO、3(3)β-HOMO、4(3)β-HOMO图的正相位和负相位较接近,且重叠性好,负相的组分在析氢过程中所起的作用也非常接近;构型4(1)-HOMO、4(3)α-HOMO图中深色区域部分小于浅色区域部分,与水分子反应时活化能较大,不易与水分子反应。说明在此阶段,构型2(2)β-HOMO更容易与水分子发生反应。
3.1.2 团簇MMoS4与水分子间的轨道能级差
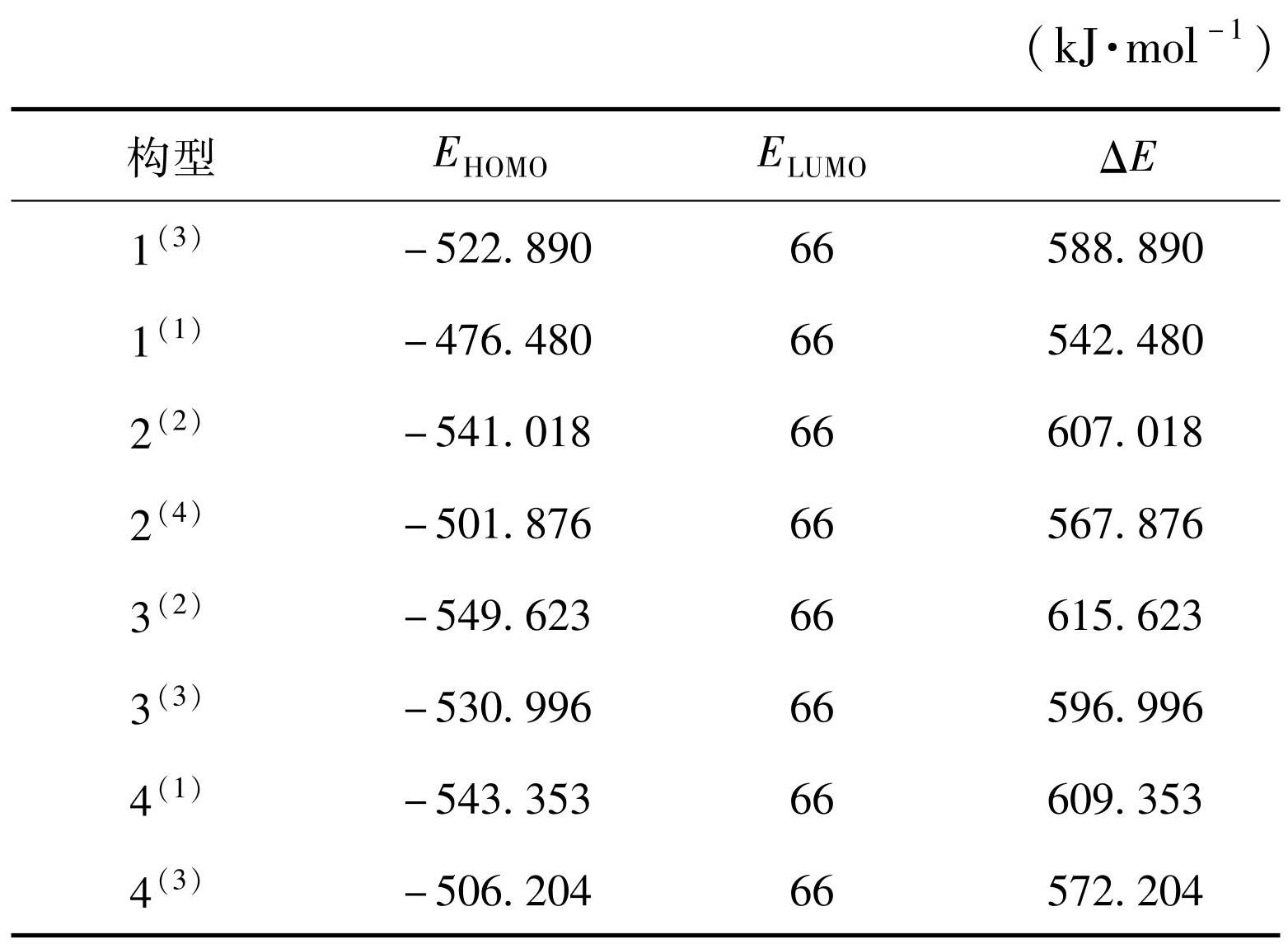
仅通过团簇MMoS4的HOMO轨道图与水分子的LUMO轨道图进行分析存在局限性,只能说明在吸附反应过程中的难易程度,缺少定量分析,因此,本文引入能级差定量分析团簇MMoS4与水分子之间的关系。根据前线轨道理论,当反应物之间具有较小的能级差时,电子易跃迁,反应易发生,即水分子与团簇 MMoS4之间的电子更易转移发生反应。表2为团簇MMoS4的能级数值,利用式(3)计算能级差。
(3)
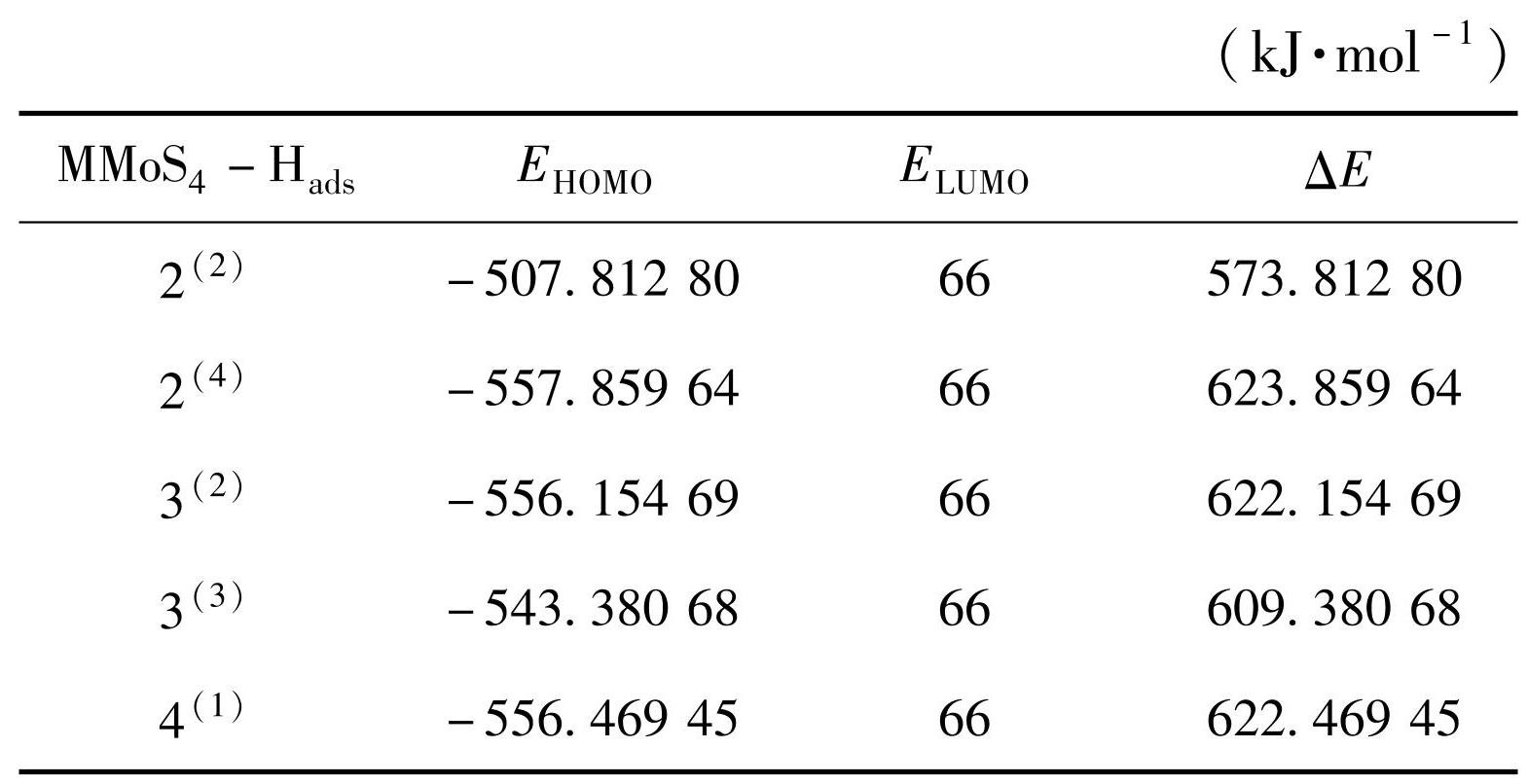
由表2可以看出,构型1(1)、2(4)、4(3)的轨道能级差(542.48、567.876、572.204 kJ/mol)在其对应体系内最低,表明在与H2O发生反应时易于吸附H原子,有利于析氢反应的第一步;构型1(3)、3(2)、4(1)的轨道能级差(588.89、615.623、609.353 kJ/mol)在其对应体系内最大,表明这3种稳定构型不易与水分子发生反应,吸附H原子过程较难,电子转移时,能量消耗较大。由团簇 MMoS4的HOMO轨道图与水分子的LUMO轨道图来看,各稳定构型均能与水分子反应,只是反应过程中难易程度不同。综合分析认为,团簇MMoS4的稳定构型活性大小排序为:1(1)>2(4)>4(3)>1(3)>3(3)>2(2)>4(1)>3(2)。
表2团簇MMoS4-HOMO与H2O-LUMO的能级差
Table2Energy level difference between MMoS4-HOMO and H2O-LUMO
3.2 MMoS4-H解吸过程的研究
在本文前述实验中已经完成了对团簇MMoS4各稳定构型与水分子间的第1步析氢反应,反应完成后,该团簇与水分子反应吸附H原子进而得到MMoS4-Hads结构。图3所示为团簇MMoS4各构型的MMoS4-Hads构型图,构型2(2)-Hads以Co1原子为中心,Mo2、S3、S4、S5、S65个原子为基准面,H7为锥顶构成;构型2(4)-Hads以Co1、Mo2、S3、S4、S5、S6 6个原子为基准面,H7为锥顶构成;构型3(2)-Hads以S5原子为顶,Co1、Mo2、S3、S4、S6 5个原子为基准面,H7为单帽构成;构型3(3)-Hads、4(1)-Hads均以Fe1原子为中心,Mo2、S3、S4、S5、S6 5个原子为基准面,H7为锥顶构成。其中构型1(3)、1(1)、4(3)在与H原子结合后形成N-Hads结构,经Gaussian09软件运行分析认为其不能稳定存在,因此,不对这3种构型进行分析研究,也可看出,构型在解吸过程中的稳定性与热力学稳定性没有一定的关系。又可由图3发现,团簇N-Hads中的Mo与H原子结合在一起,表明Mo原子是团簇N-Hads析氢反应中的催化活性位点。
3.2.1 MMoS4-H与水继续反应析出氢气的分析
当团簇与水分子完成第1步后生成了N-Hads结构,后续N-Hads结构又与水分子进行反应产出H2,且电子完成了由N-Hads结构转移到水分子结构的过程。表3为N-Hads构型HOMO轨道能级以及与水分子LUMO轨道的能级差(ΔE)。由表3数据可以看出,构型2(4)-Hads、3(2)-Hads、3(3)-Hads、4(1)-Hads结构的能级差均有一定幅度的增大,因此,这4种构型在与H原子结合后,催化性能在一定程度上减弱;而构型2(2)-Hads结构的能级差却减小,所以其催化性能提高,且在这5种N-Hads构型中,2(2)-Hads的能级差(573.812 8 kJ/mol)最低,由此得出,2(2)-Hads在与水分子反应时活性最好,最容易产出H2,综合认为,在解吸过程中N-Hads构型与水反应活性大小排序为:2(2)-Hads>3(3)-Hads>3(2)-Hads>4(1)-Hads>2(4)-Hads。
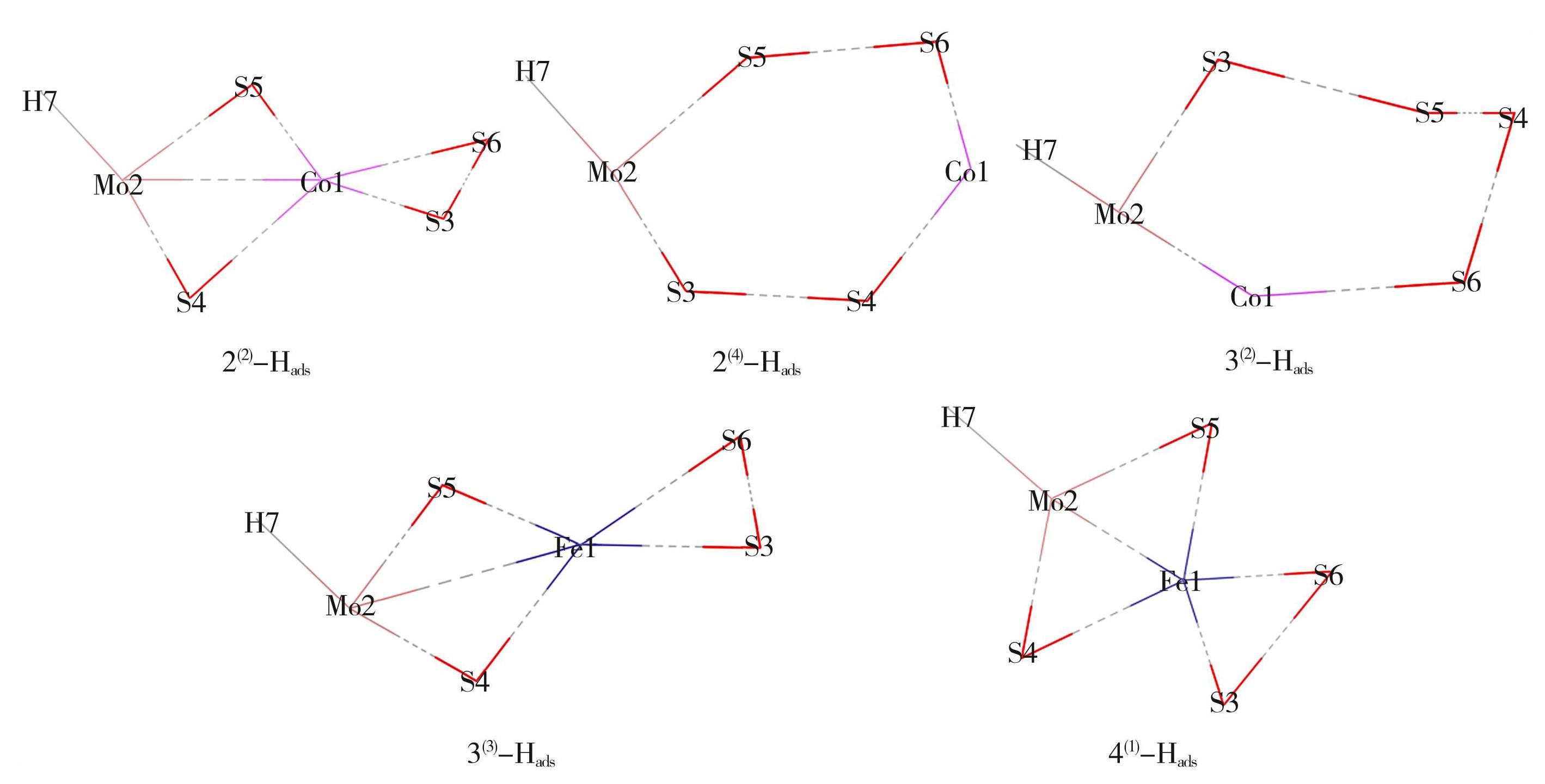
图3团簇MMoS4各构型的MMoS4-Hads构型图
Fig.3MMoS4-Hads configuration diagrams of clusters of MMoS4
表3团簇MMoS4-Hads-HOMO与水分子-LUMO间的轨道能级差
Table3Difference in orbital energy levels between cluster MMoS4-Hads-HOMO and water molecule-LUMO
3.2.2 MMoS4-H结构校正能和结合能分析
表4列出了团簇MMoS4-Hads各构型的校正能,与反应前MMoS4各构型校正能相比,反应后的MMoS4-Hads校正能均有一定程度的减小,表明析氢反应后的热力学稳定性均有提高,因此N-Hads比N更加稳定。综上分析,在这5种构型中,2(2)-Hads的校正能(-7 987 526.215 kJ/mol)最低,热力学稳定性最好。将5种构型的校正能进行排序,得到热力学稳定性大小顺序为:2(2)-Hads>2(4)-Hads>3(2)-Hads>4(1)-Hads>3(3)-Hads。
结合能越小,N-Hads结构的解吸过程越容易进行,有利于H2的析出。将表4中的结合能与表1中得到的结合能进行对比发现,N-Hads各构型的结合能有一定程度的提高,综合来看,3(2)-Hads的结合能(1 912.353 kJ/mol)最低,也就是说构型3(2)-Hads最容易发生解吸反应,进而使H原子顺利从N-Hads结构分离,快速产出H2;4(1)-Hads的结合能(2 652.930 kJ/mol)最大,不利于解吸反应,H原子最不易分离下来,将N-Hads结构的解吸能力大小进行排序:3(2)-Hads>2(4)-Hads>2(2)-Hads>3(3)-Hads>4(1)-Hads。说明3(2)-Hads解吸能力最强,4(1)-Hads解吸能力最弱。
表4MMoS4-Hads的校正能和结合能分析
Table4Calibration and binding energy analysis of MMoS4-Hads
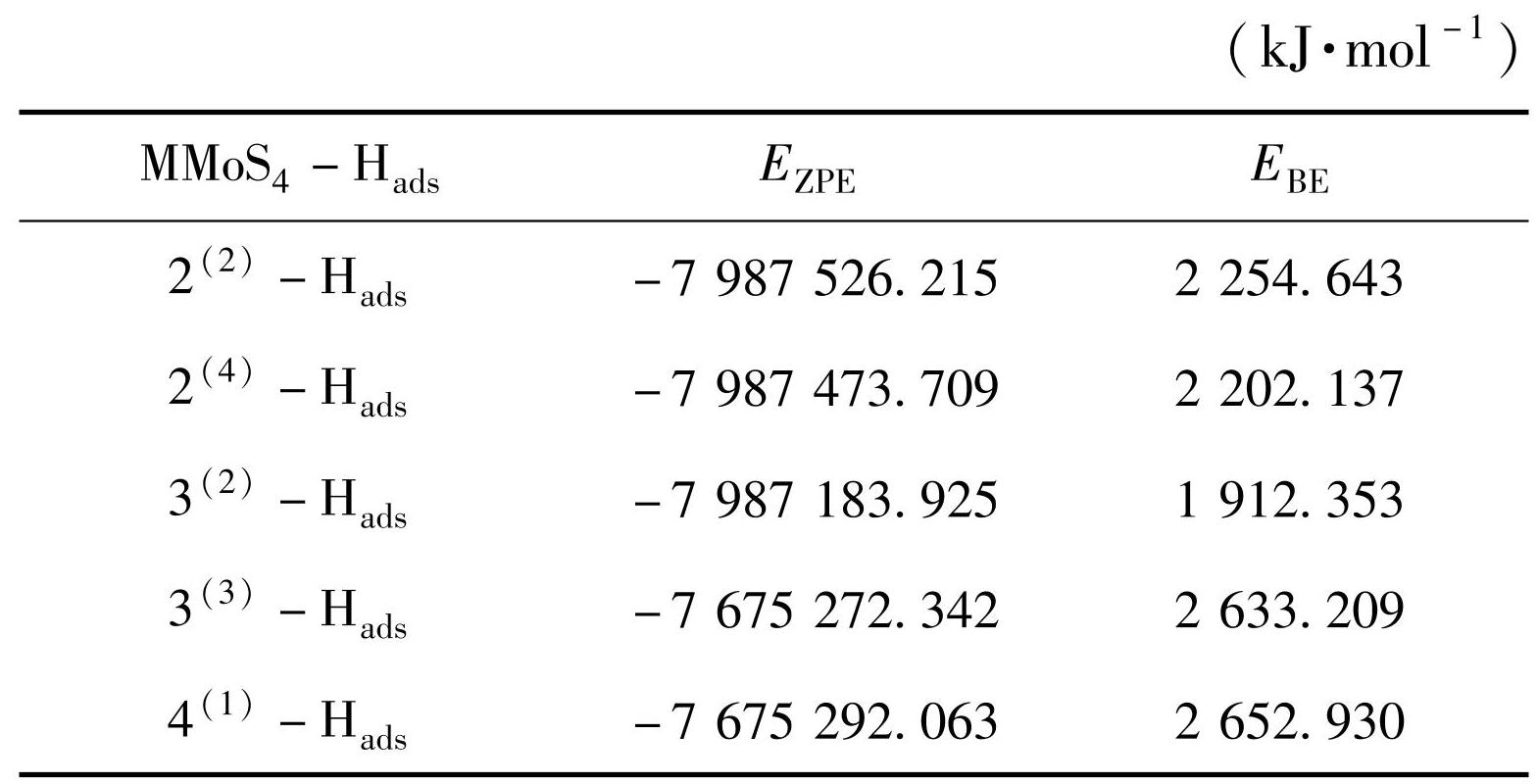
为了获得具有最佳解吸性能的构型,需要考虑N-Hads结构的能级差和结合能两个因素,以选择出具有最优综合性能的构型。由3.2.1节与3.2.2节讨论可知,3(3)-Hads在能级差分析析氢活性中排序第2,展现出较高的活性,但在结合能分析稳定性中排序第4,表现较差,取二者之和在稳定构型中排名第4,综合分析其解吸性能不是很好。2(4)-Hads在结合能分析中表现较好,在稳定构型中排序第2,但在能级差分析中,其析氢活性最差,所以排序第5。4(1)-Hads在能级差、结合能分析比较中都表现的很差,分别排在了第4和第5。总体而言,2(2)-Hads和3(2)-Hads在能级差、结合能中分别排在了第1和第2位、第3和第1位。通过综合排序来看,其性能好于其他构型,在解吸过程中,其综合表现要优于其他构型。此外,将N-Hads结构能级差和结合能的排名相加,数值越小其解吸能力越好。因此,N-Hads解吸能力综合排序为:2(2)-Hads(能1+结3=总4)≈3(2)-Hads(能3+结1=总4)>3(3)-Hads(能2+结4=总6)>2(4)-Hads(能5+结2=总7)>4(1)-Hads(能4+结5=总9)。
催化剂的性能需结合吸氢和解吸能力共同分析。在第1步吸氢反应中,由于解吸过程构型1(3)、1(1)、4(3)不能稳定存在,故将其3种构型排除,不做分析,而构型2(2)、2(4)、3(3)的吸氢活性较好;由第2步解吸反应分析可知,构型2(2)具有最优的解吸能力,2(4)、3(3)解吸能力一般。综合上述分析,构型2(2)是团簇MMoS4在析氢反应中表现最好的构型,并且构型稳定性好,析氢反应活性也相对较好。
4 结论
1)优化后构型有平面型和类平面型,平面型占据主要态,构型1(3)的热力学稳定性最好,构型4(3)的热力学稳定性最差。
2)在析氢反应第1步,通过分析前线轨道图,大部分构型的HOMO轨道与水分子LUMO轨道之间的反应均可顺利进行,只有2(2)构型由β-HOMO作主要贡献;通过分析能级差,2(2)、2(4)、3(3)的吸氢活性较好,故在当前阶段,构型2(2)、2(4)、3(3)较易与水分子反应生成N-Hads。
3)析氢反应第2步,在得到MMoS4-Hads(N-Hads)结构后,H全吸附在Mo原子上,表明Mo原子是团簇N-Hads析氢反应过程中的潜在活性位点。进一步分析N-Hads的能级差,在解吸过程中N-Hads构型与水反应活性大小排序为:2(2)-Hads>3(3)-Hads>3(2)-Hads>4(1)-Hads>2(4)-Hads,构型2(2)-Hads、3(3)-Hads、3(2)-Hads的能级差小于其他构型,且具有较强的活性能力,可以更快地与水完成反应;分析结合能,对团簇N-Hads解吸能力大小进行排序:3(2)-Hads>2(4)-Hads>2(2)-Hads>3(3)-Hads>4(1)-Hads,构型2(2)-Hads、2(4)-Hads、3(2)-Hads的结合能较小,优于其他稳定构型的解吸效果;综合分析,2(2)-Hads、3(2)-Hads的解吸能力最强,容易使H原子发生脱离,从而析出H2。综合分析前线轨道图、能级差以及结合能可以得出,构型2(2)-Hads的催化水解析氢性能最好。
