邻苯二甲酸酯(phthalate esters,PAEs)是一类人工合成的化学物质,广泛应用于塑料制品、食品包装、建筑材料、医疗用品、清洁剂以及个人护理用品,易挥发进入环境介质中,是普遍存在的环境激素类污染物[1].PAEs可通过呼吸、饮食和皮肤接触等途径进入人体[2],低相对分子质量PAEs进入人体后可转化为相应的水解单酯[3],高相对分子质量PAEs进入人体后首先转化为其对应的水解单酯,进而在酶的作用下转化为更高级的代谢产物[4].PAEs代谢物在人体内可与相应的激素受体相结合,影响人体的发育和健康.环境中很少存在PAEs的代谢物,因此,其是一种较合适的反映PAEs暴露的生物标志物[5-6],人体内PAEs代谢物的含量可间接地反映PAEs的暴露水平.研究表明,PAEs代谢物在人的尿液、乳汁、血液和精液中均有检出[6-11],其中,由于尿液样本采集方便,是最为广泛采用的样本,用以评估PAEs的暴露水平.
PAEs作为增塑剂已广泛应用于不同行业,PAEs职业暴露人群的健康问题也逐渐受到关注.近年来,职业暴露人群体内PAEs代谢物的质量分数水平在国内外已有报道[12-16],但主要集中在与聚氯乙烯生产相关的行业,关于油漆涂料等环境中从业者的报道较少.PAEs作为增塑剂添加于油漆涂料中可以增强油漆涂料的延伸性[17],但是,PAEs并不与涂料中的高分子基质形成稳定的化学键,容易挥发到环境中并经呼吸或食物进入人体,因此,装修工人等特殊人群有可能受到PAEs的高质量分数暴露.为了了解长期暴露于油漆涂料等环境中的从业者体内PAEs代谢物的污染水平,2013年1月至4月,在黑龙江省哈尔滨市采集了10个油漆工人的尿液样品,同时采集10个普通人群的尿液样品作为对照,分析样品中14种PAEs代谢物的质量分数水平和污染特征,并对人体内PAEs的暴露风险进行评估,研究成果对于减少和控制PAEs对于特殊暴露人群的危害提供了重要参考依据.
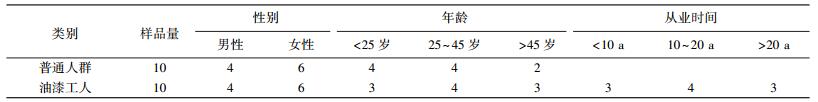
1 实验 1.1 尿液样品的采集与保存2013年1月至4月,在黑龙江省哈尔滨市采集10个油漆工人尿液样品,同时采集10个普通人群尿液样品作为对照,采样人群的年龄为13~60岁,油漆工人从业年限为5~25 a,尿液样品详细信息见表 1.每个尿液样品采集8~10 mL,-20 ℃避光保存于10 mL离心管中.
| 表 1 普通人群和油漆工人尿液样品信息 |
结合国内外的研究现状,共选择14种PAEs代谢物作为目标物,分别为邻苯二甲酸单甲酯(mMP)、邻苯二甲酸单乙酯(mEP)、邻苯二甲酸单丁酯(mBP)、邻苯二甲酸单异丁酯(miBP)、邻苯二甲酸单苄酯(mBzP)、邻苯二甲酸单环已酯(mCHP)、邻苯二甲酸单(3-羧基丙基)酯(mCPP)、邻苯二甲酸(2-乙基-5-羧基戊基)单酯(mECPP)、邻苯二甲酸(2 -羧基甲基己基)单酯(mCMHP)、邻苯二甲酸(2-乙基-5羟基己基)单酯(mEHHP)、邻苯二甲酸(2-乙基-5-氧己基)单酯(mEOHP)、邻苯二甲酸(2-乙基己基)单酯(mEHP)、邻苯二甲酸单正辛酯(mOP)和邻苯二甲酸单正壬酯(mNP)(详细信息见表 2).
| 表 2 PAEs名称、相对分子质量及其对应的代谢物名称 |
尿液样品的前处理方法见文献[18-19].概述如下:冻存尿液在室温下缓慢解冻,涡旋混合30 s,取0.5 mL尿液样品于15 mL玻璃离心管中,加入100 μL质量浓度为250 μg/L的13C和D4标记的混和内标(13C4-mMP,13C4-mEP,13C4-mBP,13C4-mECPP,13C4-mBzP,13C4-mEHP和D4-miBP),200 μL醋酸氨缓冲溶液,50 μL 200 u/mL的β-葡萄糖醛酸酶,37 ℃水浴过夜.水浴后向离心管中加入1 mL磷酸二氢钠缓冲溶液(pH = 2.0),混合均匀.加入3 mL乙酸乙酯,震荡萃取60 min,4 500g离心10 min,取上清液,此过程重复两次,混合上清液.向收集的上清液中加入1 mL超纯水,4 500g离心10 min,取上清液,上清液用高纯氮气缓慢浓缩至几乎干燥,加入0.5 mL乙腈和超纯水的混合溶液(体积比1:9),涡旋混匀,移入棕色样品瓶中,密封,低温保存,待仪器分析.采用安捷伦1100高效液相色谱串联AB SCIEX API 2000三重四极杆质谱仪对PAEs代谢物进行检测,具体仪器参数见文献[18].
1.3 质量控制和质量保证在样品处理过程中,同时进行2个空白实验和2个基质加标实验,处理方法与尿液样品相同,用以检测方法回收率和基质干扰.空白实验中各种PAEs代谢物的检出结果如下(μg/L):mMP(0.99)、mEP(0.06)、mBP(0.09)、miBP(0.08)、mBzP(0.03)、mCPP(0.43)、mEHP(2.06)、mECPP(0.23)、mCMHP(0.76)、mEHHP(0.14),mCHP、mOP、mNP和mEOHP均未检出.空白样品中PAEs代谢物的质量分数远低于其在真实样品中的质量分数,数据均已扣除空白值.空白样品和基质加标样品中14种PAEs代谢物的平均回收率分别为(102±15)%和(98±23)%.为了检测样品处理过程中的基质影响和回收率,所有样品在处理前均加入7种PAEs代谢物的内标,其回收率为(72±15)%,所有数据均经过回收率校正.14种PAEs代谢物的最低定量限(LOQ)范围为0.1~0.5 μg/L.
2 结果与讨论 2.1 PAEs代谢物的总质量分数水平14种PAEs代谢物的检出率和经肌酐校正后的质量分数水平见表 3及图 1.所有油漆工人和普通人群尿液样品中均有PAEs代谢物检出,说明PAEs普遍存在于哈尔滨市居民的日常生活中.mMP、mBP、miBP、mEP、mECPP、mCMHP、mEHHP和mEOHP在所有尿液样品中均有检出,说明其母体DMP、DBP、DIBP、DEP和DEHP是哈尔滨市居民日常生活中所能接触的主要PAEs.其他6种PAEs代谢物的检出率相对较少或仅在个别样品中检出.
| 表 3 油漆工人和普通人群尿液样品中14种PAEs代谢物的质量分数水平 |
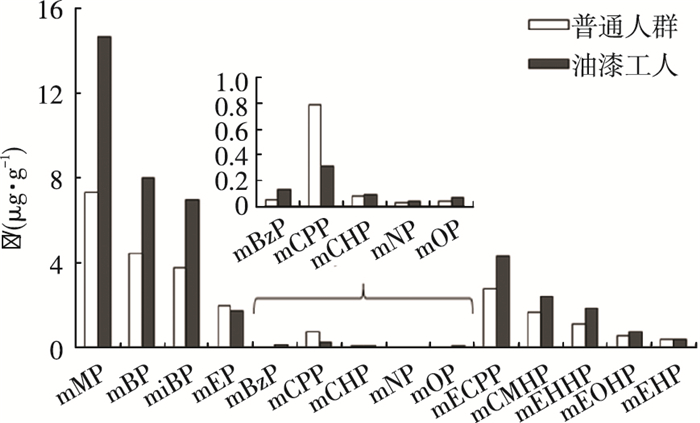
|
图 1 油漆工人和普通人群尿液样品中14种PAEs代谢物的质量分数水平(几何平均) |
油漆工人尿液中PAEs代谢物的总质量分数(∑14Phthalates)范围为21.03~182.56 μg/g,普通人群尿液中PAEs代谢物的总质量分数(∑14Phthalate)范围为16.16~57.27 μg/g.油漆工人尿液中PAEs代谢物的最高质量分数(182.56 μg/g)是普通人群尿液样品中(57.27 μg/g)的3倍,平均质量分数(53.62 μg/g)是普通人群尿液样品中(27.28 μg/g)的2倍.此外,由表 3和图 1可以看出,油漆工人尿液中14种PAEs代谢物的质量分数均大于普通人群(mCPP除外),说明油漆工人体内PAEs的质量分数高于普通人群.有研究表明[17, 20],油漆涂料添加PAEs以增加其延展性,因此,在使用过程中,油漆涂料中含有的PAEs可挥发迁移到环境中,经呼吸、皮肤接触或饮食摄入等途径进入人体.油漆工人长期从事油漆涂料的粉刷工作,其工作环境中PAEs的污染质量分数较高,进而导致其体内PAEs的质量分数水平较高.
2.2 不同PAEs代谢物的质量分数特征在14种PAEs代谢物中,mMP在哈尔滨市油漆工人和普通人群尿液样品中的质量分数最高,mMP是DMP的主要代谢物,说明DMP的暴露水平较高.油漆工人尿液中mMP的质量分数范围为3.65~154.05 μg/g,普通人群尿液中为3.25~15.39 μg/g,油漆工人尿液中mMP的平均质量分数(14.67 μg/g)是普通人群的2倍(7.33 μg/g),这一结果与已有研究结果不同.Guo等[21]分析了183个中国普通人群尿液样品中PAEs代谢物的质量分数水平,结果显示mBP(64.6 μg/L)和miBP(48.6 μg/L)为中国普通人群尿液中主要的PAEs代谢物,质量分数显著高于mMP(15.5 μg/L).Wang等[22]分析了259个中国中学生尿液样品,结果显示mBP(47.5 μg/L)为主要的PAEs代谢物.油漆工人尿液中,mBP和miBP的质量分数范围分别为2.99~16.17和1.29~21.8 μg/g,平均质量分数分别为8.00和7.00 μg/g.普通人群尿液中,mBP和miBP的质量分数范围分别为1.88~13.19和2.30~13.85 μg/g,平均质量分数分别为4.44和3.76 μg/g.油漆工人尿液中mBP和miBP的平均质量分数是普通人群的2倍.油漆工人体内mMP、mBP和miBP的质量分数均高于普通人群,表明油漆工人摄入了更多的DMP、DBP和DIBP.研究表明,PAEs广泛应用于油漆涂料中,且DMP和DBP为墙体涂料中的主要增塑剂[17].mMP、mBP和miBP均为低相对分子质量PAEs的代谢物,低相对分子质量PAEs的挥发性相对较高,容易从油漆涂料中释放到环境中,所以,油漆工人体内这3种PAEs代谢物的质量分数水平较高.
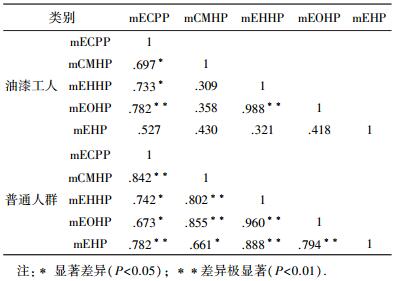
mECPP、mCMHP、mEHHP、mEOHP和mEHP为DEHP的主要代谢产物[23].DEHP进入人体后,首先代谢为其水解代谢物mEHP,进而代谢为氧化代谢产物mECPP、mCMHP、mEHHP和mEOHP.油漆工人尿液中DEHP代谢物的总质量分数(∑mEHP)范围为2.71~87.49 μg/g,其最高质量分数是普通人群的5倍,mECPP、mCMHP、mEHHP和mEOHP的质量分数略高于普通人群,但差异不显著.同时,与mCMHP和mEHP相比,mECPP、mCMHP和mEHHP质量分数相对较高,是DEHP的主要代谢物.通过对DEHP的5种代谢物的相关性分析可知(表 4),普通人群尿液样品中5种代谢物之间具有显著相关性(P<0.05),油漆工人尿液样品中5种代谢物之间的相关性相对较差.普通人群尿液样品中mEHP与其他4种DEHP代谢物均具有显著相关性(P<0.05),而油漆工人体内mEHP与其他4种DEHP代谢物均无相关性.这一结果表明, 普通人群体内mECPP、mCMHP、mEHHP、mEOHP和mEHP是由单一母体(DEHP)代谢而来,而油漆工人体内mEHP可能不是由单一的DEHP代谢而来.研究表明,mEHP不仅可由DEHP代谢产生,也可单独存在于环境中[24].由此可知,油漆工人的工作环境中存在mEHP的其他污染源.
| 表 4 油漆工人和普通人群尿液样品中DEHP代谢物的相关性分析 |
mBzP、mCPP、mCHP、mNP和mOP在油漆工人和普通人群尿液样品中的质量分数均不高,且无显著差异.mBzP、mCPP和mCHP为低相对分子质量PAEs的代谢产物,其在油漆工人体内质量分数较低,说明其母体BBzP和DCHP不是油漆涂料中主要的PAEs添加物.mNP和mOP在油漆工人体内质量分数较低,可能由于mNP和mOP是高相对分子质量PAEs的代谢产物,挥发性较低,不易从油漆涂料中释放到环境中,或者mNP和mOP也不是油漆涂料中主要的PAEs添加物.
2.3 不同相对分子质量PAEs代谢物的分布特征PAEs按其相对分子质量大小可分为高相对分子质量PAEs和低相对分子质量PAEs,在14种目标PAEs代谢物中,mMP、mEP、mBP、miBP、mBzP、mCHP和mCPP属于低相对分子质量PAEs的代谢产物,mEHP、mECPP、mCMHP、mEHHP、mEOHP、mOP和mNP属于高相对分子质量PAEs的代谢产物.分别对比油漆工人和普通人群尿液样品中低相对分子质量和高相对分子质量PAEs代谢物的质量分数,结果如图 2所示.油漆工人和普通人群尿液样品中低相对分子质量PAEs代谢物的质量分数分别为39.72、20.10 μg/g, 高相对分子质量PAEs代谢物的质量分数分别为11.07、6.97 μg/g.油漆工人体内低相对分子质量PAEs代谢物的质量分数显著高于普通人群(P<0.05),高相对分子质量PAEs代谢物的质量分数在两类人群中无显著差异(P>0.05).研究显示,高相对分子质量PAEs主要应用于建筑材料、服装和家具中,低相对分子质量PAEs主要应用于油漆、清漆、涂料和个人护理品中[25].油漆、清漆、涂料等经粉刷后,其中添加的低相对分子质量PAEs会释放到环境中,油漆工人因其工作性质长期暴露于此类环境中,通过呼吸和皮肤接触等途径会摄入PAEs.此外,如果油漆工人在工作场所用餐,食物也可能被释放到环境中的PAEs污染,进而经消化系统进入人体.

|
图 2 油漆工人和普通人群尿液样品中低相对分子质量和高相对分子质量PAEs代谢物的质量分数比较 |
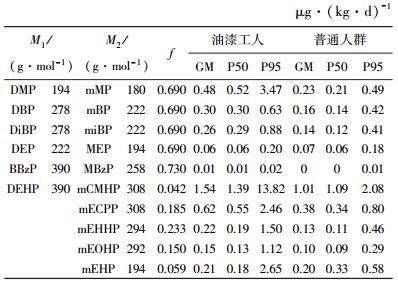
哈尔滨市油漆工人和普通人群尿液中PAEs的日暴露量(IED)由下式计算[26],
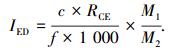
|
式中:c为尿液中PAEs代谢物的质量分数(μg/g); RCE为经体重矫正过的肌酐排泄率(mg/(kg·d)),男性为23 mg/(kg·d),女性为18 mg/(kg·d); f为人体摄入PAEs 24 h后尿液中其相应代谢物的摩尔分数,不同PAEs代谢物所对应的f值见表 5 [24, 27-31];M1和M2分别为PAEs及其相应代谢物的相对分子质量(表 5),1 000为单位矫正系数.
| 表 5 哈尔滨市油漆工人和普通人群尿液中PAEs的日暴露量 |
哈尔滨市油漆工人和普通人群尿液中PAEs代谢物暴露水平见表 5.油漆工人体内DMP、DBP和DiBP的平均日暴露量分别为0.48、0.30和0.26 μg/(kg·d),普通人群体内DMP、DBP和DiBP的平均日暴露量分别为0.23、0.16和0.14 μg/(kg·d),油漆工人体内DMP、DBP和DiBP的平均日暴露量是普通人群的2倍,DBP在两类人群中的日暴露量差异显著(P<0.05),DMP和DiBP差异不显著(P=0.089和P=0.069).油漆工人体内DEHP的日暴露量范围为0.15~154 μg/(kg·d),普通人群为0.10~1.01 μg/(kg·d),无显著差异(P>0.05).DEP和BBzP在油漆工人和普通人群体内平均日暴露量相对较少,二者无显著差异(P>0.05).美国环境保护署给出的人体内DEP、DBP、BBzP和DEHP的最大参考暴露剂量分别为800、100、200和20 μg/(kg·d),哈尔滨市油漆工人和普通人群对PAEs的日暴露量远低于该参考值,说明哈尔滨市油漆工人和普通人群对PAEs的暴露剂量处于安全水平[32].
3 结论1) 通过对哈尔滨市油漆工人和普通人群尿液样品中14种PAEs代谢物的研究发现,哈尔滨市油漆工人和普通人群对于PAEs的暴露非常普遍,mMP、mBP和miBP是主要的PAEs代谢物.
2) 油漆工人尿液中PAEs代谢物的质量分数水平高于普通人群.低相对分子质量PAEs是油漆涂料中主要添加的PAEs类物质,哈尔滨市油漆工人体内低相对分子质量PAEs代谢物的质量分数显著高于普通人群,说明油漆工人可暴露于油漆涂料中释放出来的PAEs.
3) 哈尔滨市油漆工人体内DBP的日暴露量显著高于普通人群,但油漆工人和普通人群对PAEs的日暴露量均低于美国EPA给出的最大参考暴露剂量,说明其暴露风险均处于安全水平.
| [1] |
HAUSER R, CALAFAT A M. Phthalates and human health[J]. Occupational and Environmental Medicine, 2005, 62(11): 806-818. DOI:10.1136/oem.2004.017590 |
| [2] |
WORMUTH M, SCHERINGER M, VOLLENWEIDER M, et al. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans?[J]. Risk Analysis, 2006, 26(3): 803-824. DOI:10.1111/risk.2006.26.issue-3 |
| [3] |
ALBRO P W, MOORE B. Identification of the metabolites of simple phthalate diesters in rat urine[J]. Journal of Chromatography A, 1974, 94: 209-218. DOI:10.1016/S0021-9673(01)92368-4 |
| [4] |
MCKEE R H, EL-HAWARI M, STOLTA M, et al. Absorption, disposition and metabolism of di-isononyl phthalate (DINP) in F-344 rats[J]. Journal of Applied Toxicology:JAT, 2002, 22(5): 293-302. DOI:10.1002/(ISSN)1099-1263 |
| [5] |
DUTY S M, CALAFAT A M, SILVA M J, et al. The relationship between environmental exposure to phthalates and computer-aided sperm analysis motion parameters[J]. Journal of Andrology, 2004, 25(2): 293-302. DOI:10.1002/j.1939-4640.2004.tb02790.x |
| [6] |
SILVA M J, BARRR D B, REIDY J A, et al. Urinary levels of seven phthalate metabolites in the US population from the National Health and Nutrition Examination Survey (NHANES) 1999-2000[J]. Environmental Health Perspectives, 2004, 112(3): 331. |
| [7] |
FREDERIKSEN H, NIELSEN J K S, MORCK T A, et al. Urinary excretion of phthalate metabolites, phenols and parabens in rural and urban Danish mother-child pairs[J]. International Journal of Hygiene and Environmental Health, 2013, 216(6): 772-783. DOI:10.1016/j.ijheh.2013.02.006 |
| [8] |
SARAVANABHAVAN G, GUAY M, LANGLOIS E, et al. Biomonitoring of phthalate metabolites in the Canadian population through the Canadian Health Measures Survey (2007-2009)[J]. International Journal of Hygiene and Environmental Health, 2013, 216(6): 652-661. DOI:10.1016/j.ijheh.2012.12.009 |
| [9] |
MORTENSEN G K, MAIN K M, ANDERSSON A M, et al. Determination of phthalate monoesters in human milk, consumer milk, and infant formula by tandem mass spectrometry (LC-MS-MS)[J]. Analytical and Bioanalytical Chemistry, 2005, 382(4): 1084-1092. DOI:10.1007/s00216-005-3218-0 |
| [10] |
SILVA M J, SAMANDAR E, PREAU J L, et al. Automated solid-phase extraction and quantitative analysis of 14 phthalate metabolites in human serum using isotope dilution-high-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Toxicology, 2005, 29(8): 819-824. DOI:10.1093/jat/29.8.819 |
| [11] |
KATO K, SILVA M J, NEEDHAM L L, et al. Quantifying phthalate metabolites in human meconium and semen using automated off-line solid-phase extraction coupled with on-line SPE and isotope-dilution high-performance liquid chromatography-tandem mass spectrometry[J]. Analytical Chemistry, 2006, 78(18): 6651-6655. DOI:10.1021/ac0608220 |
| [12] |
GAUDIN R, MARSAN P, ROBERT A, et al. Biological monitoring of occupational exposure to di (2-ethylhexyl) phthalate:survey of workers exposed to plastisols[J]. International Archives of Occupational and Environmental Health, 2008, 81(8): 959-966. DOI:10.1007/s00420-007-0289-6 |
| [13] |
GAUDIN R, MARSAN P, NDAW S, et al. Biological monitoring of exposure to di (2-ethylhexyl) phthalate in six French fa ctories:a field study[J]. International Archives of Occupational and Environmental Health, 2011, 84(5): 523-531. DOI:10.1007/s00420-010-0566-7 |
| [14] |
HINES C J, HOPF N B, DEDDENS J A, et al. Occupational exposure to diisononyl phthalate (DiNP) in polyvinyl chloride processing operations[J]. International Archives of Occupational and Environmental Health, 2012, 85(3): 317-325. DOI:10.1007/s00420-011-0674-z |
| [15] |
FONG J P, LEE F J, LU I, et al. Estimating the contribution of inhalation exposure to di-2-ethylhexyl phthalate (DEHP) for PVC production workers, using personal air sampling and urinary metabolite monitoring[J]. International Journal of Hygiene and Environmental Health, 2014, 217(1): 102-109. DOI:10.1016/j.ijheh.2013.04.002 |
| [16] |
LU J, ZHANG J, WANG Z T, et al. An estimation of the daily intake of di (2-ethlhexyl) phthalate (DEHP) among workers in flavoring factories[J]. Biomedical and Environmental Sciences:BES, 2014(6): 419-425. |
| [17] |
刘付建, 冼燕萍, 郭新东, 等. 气相色谱-质谱联用法检测水性墙体涂料中20种邻苯二甲酸酯[J]. 分析测试学报, 2014, 33(4): 437-441. |
| [18] |
GUO Y, ALOMIRAH H, CHO H S, et al. Occurrence of phthalate metabolites in human urine from several Asian countries[J]. Environmental Science & Technology, 2011, 45(7): 3138-3144. |
| [19] |
ASIMAKOPOULOS A G, WANG L, THOMAIDIS N S, et al. A multi-class bioanalytical methodology for the determination of bisphenol a diglycidyl ethers, p-hydroxybenzoic acid esters, benzophenone-type ultraviolet filters, triclosan, and triclocarban in human urine by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2014, 1324: 141-148. DOI:10.1016/j.chroma.2013.11.031 |
| [20] |
WORMUTH M, SCHERINGER M, VOLLENWEIDER M, et al. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans?[J]. Risk Analysis, 2006, 26: 803-824. DOI:10.1111/risk.2006.26.issue-3 |
| [21] |
GUO Y, WU Q, KANNAN K. Phthalate metabolites in urine from China, and implications for human exposures[J]. Environment International, 2011, 37(5): 893-898. DOI:10.1016/j.envint.2011.03.005 |
| [22] |
WANG H X, ZHOU Y, TANG C X, et al. Urinary phthalate metabolites are associated with body mass index and waist circumference in Chinese school children[J]. PloS One, 2013, 8(2): e56800. DOI:10.1371/journal.pone.0056800 |
| [23] |
SILVA M J, REIDY J A, PREAU J L, et al. Measurement of eight urinary metabolites of di (2-ethylhexyl) phthalate as biomarkers for human exposure assessment[J]. Biomarkers, 2006, 11(1): 1-13. DOI:10.1080/13547500500382868 |
| [24] |
KOCH H M, BOLT H M, ANGERER J. Di (2-ethylhexyl) phthalate (DEHP) metabolites in human urine and serum after a single oral dose of deuterium-labelled DEHP[J]. Archives of Toxicology, 2004, 78(3): 123-130. DOI:10.1007/s00204-003-0522-3 |
| [25] |
SCHETTLER T. Human exposure to phthalates via consumer products[J]. International Journal of Andrology, 2006, 29(1): 134-139. DOI:10.1111/ija.2006.29.issue-1 |
| [26] |
KOHN M C, PARHAM F, MASTEN S A, et al. Human exposure estimates for phthalates[J]. Environmental Health Perspectives, 2000, 108(10): A440-A442. |
| [27] |
ITOH H, YOSHIDA K, MASUNAGA S. Quantitative identification of unknown exposure pathways of phthalates based on measuring their metabolites in human urine[J]. Environmental Science & Technology, 2007, 41(13): 4542-4547. |
| [28] |
KOCH H M, BOLT H M, PREUSS R, et al. New metabolites of di (2-ethylhexyl) phthalate (DEHP) in human urine and serum after single oral doses of deuterium-labelled DEHP[J]. Archives of Toxicology, 2005, 79(7): 367-376. DOI:10.1007/s00204-004-0642-4 |
| [29] |
ANDERSON W A C, CASTLE L, SCOTTER M J, et al. A biomarker approach to measuring human dietary exposure to certain phthalate diesters[J]. Food Additives & Contaminants, 2001, 18(12): 1068-1074. |
| [30] |
FROMME H, GRUBER L, SCHLUMMER M, et al. Intake of phthalates and di (2-ethylhexyl) adipate:results of the integrated exposure assessment survey based on duplicate diet samples and biomonitoring data[J]. Environment International, 2007, 33(8): 1012-1020. DOI:10.1016/j.envint.2007.05.006 |
| [31] |
KOCH H M, DREXLER H, ANGERER J. An estimation of the daily intake of di (2-ethylhexyl) phthalate (DEHP) and other phthalates in the general population[J]. International Journal of Hygiene and Environmental Health, 2003, 206(2): 77-83. DOI:10.1078/1438-4639-00205 |
| [32] |
Office of Research, National Center for Environmental Assessment, Environmental Protection Agency. Exposure factors handbook[M]. United States: DIANE Publishing, 1996.
|
 2016, Vol. 48
2016, Vol. 48